动脉导管未闭(patent ductal arteriosus,PDA)是早产儿常见的潜在严重并发症之一。尽管对早产儿PDA的研究已长达数十年,但最佳的临床管理方案仍是学者们的争论焦点。早产儿胎龄越小,PDA发生率越高。研究表明,胎龄大于30周的早产儿动脉导管未闭发生率约10%,而胎龄小于28周的早产儿PDA发生率则高达80%~90%[1-2]。早产儿一旦发生血流动力学紊乱的PDA(hemodynamic significant patent ductal arteriosus,hsPDA)可导致一系列并发症,如呼吸衰竭或心力衰竭、颅内出血(intraventricular hemorrhage,IVH)、坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)和支气管肺发育不良(bronchopulmonary dysplasia,BPD)等,甚至危及生命[3-4]。新生儿包括早产儿血小板减少的定义相对统一,即血小板计数<150×109/L,轻度减少为(100~149)×109/L,中度减少为(50~99)×109/L,重度减少为<50×109/L[5-6]。近年来研究发现血小板在动脉导管内的聚集黏附可能是早产儿动脉导管解剖性闭合的主要机理之一[7]。血小板减少可能导致早产儿PDA发生率增加[8]。然而目前很少有研究明确表明治疗前血小板减少可影响布洛芬治疗早产儿hsPDA的疗效和相关并发症的发生率。本研究旨在探讨胎龄小于34周的hsPDA早产儿在布洛芬治疗前发生血小板减少对药物疗效和后期并发症的影响。
对象与方法
一、对象
回顾性选取2016年5月—2019年4月本院新生儿科收治的hsPDA早产儿为研究对象,并符合下列纳入、排除标准。
1.纳入标准:(1)胎龄<34周;生后24 h内入住新生儿科;(2)所有入选患儿均于生后第一周内完成超声心动图检查,符合hsPDA诊断,且给予布洛芬口服治疗(生后2周内);(3)所有入选患儿均于布洛芬治疗前3天内完善血常规检查;(4)临床资料完整。
2.排除标准:(1)存在以下布洛芬用药禁忌征[9]:血小板计数<50×109/L、出血性疾病、少尿症(每8 h尿量<8 mL/kg)、NEC、肠穿孔或血肌酐升高(>1.8 mg/dL);(2)生后早期(1周内)发生败血症或死亡;(3)存在严重消化道或泌尿系畸形、遗传代谢性疾病、染色体异常;(4)合并需维持动脉导管持续开放的严重先天性心脏病如肺动脉狭窄、完全性大动脉转位等。
二、方法
1.hsPDA诊断标准[10]:首先符合如下超声心动图诊断标准(1)动脉导管直径>1.5 mm;(2)左心房内径/主动脉根部内径>1.3;(3)存在左向右分流(或双向双期分流)。而且存在下述临床表现之一,包括心脏杂音、水冲脉、心动过速、心前区搏动增强、脉压差增大、呼吸情况恶化。
2.分组:根据治疗前血小板计数(PLT)的情况将入选早产儿分为50~99×109/L(中度减少组)、100~150×109/L(轻度减少组)和≥150×109/L(正常组)三组。
3.治疗:三组早产儿均于生后第一周内完成超声心动图检查,结合临床表现,诊断符合hsPDA的患儿均给予布洛芬口服(上海强生制药有限公司,布洛芬混悬滴剂15 mL;0.6 g;首剂10 mg/kg,第二、三剂5 mg/kg,每日1次,共3日)一个疗程,布洛芬治疗时间均在生后2周内。治疗前3天内均采血进行血小板计数分析。疗程结束3天后复查超声心动图,评估PDA的关闭情况。
4.临床资料收集:收集患儿一般资料包括胎龄、出生体重、分娩方式、性别、小于胎龄儿、窒息、胎膜早破、妊娠期糖尿病、妊娠期高血压、产前激素应用等和PDA相关并发症如IVH、喂养不耐受、NEC及肾损伤等的发生情况。并发症诊断标准参照《实用新生儿学》第5版诊断标准[11]。
5.统计学方法:采用SPSS 23.0统计软件进行统计分析。计量资料进行正态性检验,不符从正态分布,采用中位数M(Q1,Q3)进行统计描述,三组组间比较采用多个独立样本非参数检验Kruskal-Wallis法。计数资料采用百分数(%)进行统计描述,三组组间比较采用χ2检验。P<0.05表示差异有统计学意义。
结 果
一、一般情况比较
本研究共纳入早产儿203例,其中中度减少组、轻度减少组和正常组分别为14例、38例和151例。三组患儿胎龄、出生体重、分娩方式、性别、是否小于胎龄儿、窒息、胎膜早破、母亲妊娠期高血压、妊娠期糖尿病、产前激素使用情况组间差异无统计学意义(P>0.05)。见表1。
表1 三组早产儿一般资料比较[例(%)]
Table 1 Comparison of general characteristics among the three groups [n (%)]
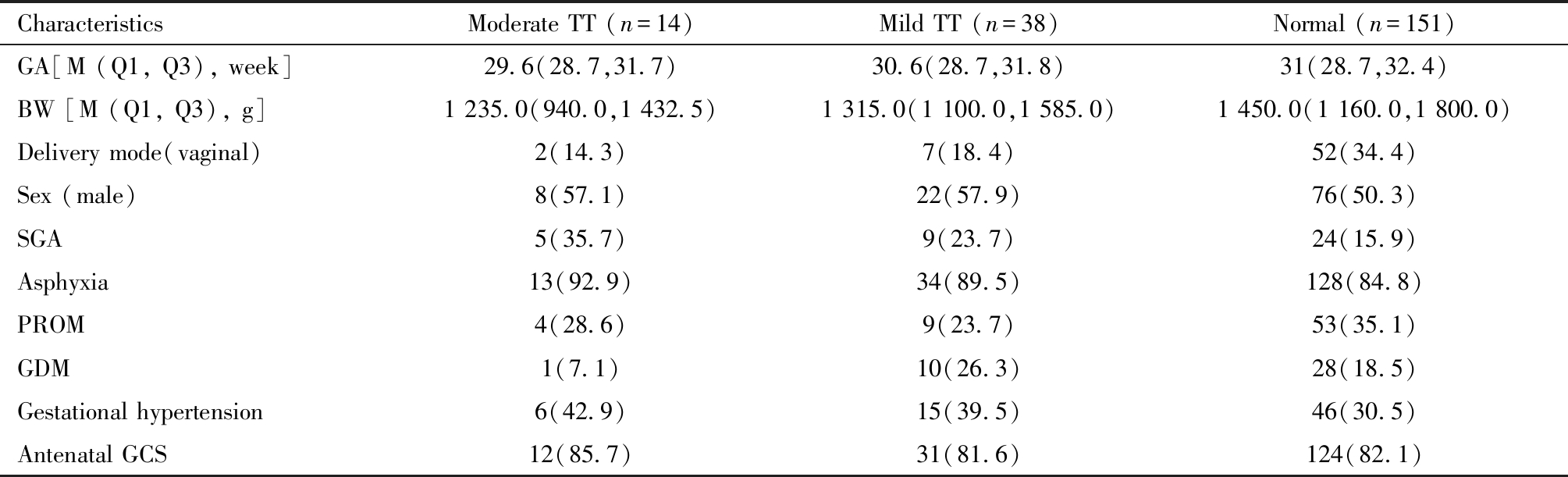
CharacteristicsModerate TT (n=14)Mild TT (n=38)Normal (n=151)GA[M (Q1, Q3), week]29.6(28.7,31.7)30.6(28.7,31.8)31(28.7,32.4)BW [M (Q1, Q3), g]1 235.0(940.0,1 432.5)1 315.0(1 100.0,1 585.0)1 450.0(1 160.0,1 800.0)Delivery mode(vaginal)2(14.3)7(18.4)52(34.4)Sex (male)8(57.1)22(57.9)76(50.3)SGA5(35.7)9(23.7)24(15.9)Asphyxia13(92.9)34(89.5)128(84.8)PROM4(28.6)9(23.7)53(35.1)GDM1(7.1)10(26.3)28(18.5)Gestational hypertension6(42.9)15(39.5)46(30.5)Antenatal GCS12(85.7)31(81.6)124(82.1)
*TT:Thrombocytopenia; GA:Gestational age; BW:Birth weight; SGA:Small for gestational age; PROM:Premature rupture of membrane; GDM:Gestational diabetes mellitus; GCS:Glucocorticoid
二、三组患儿动脉导管关闭率比较
口服布洛芬疗程结束后,中度减少组、轻度减少组和正常组分别有5例、23例和103例患儿动脉导管关闭,关闭率分别为35.7%、60.5%和68.2%;三组组间比较差异有统计学意义(P<0.05);两两比较中度减少组PDA关闭率显著低于正常组(P<0.05),而轻度减少组和其他两组间PDA关闭率无统计学差异(P>0.05),见表2。
表2 三组患儿PDA关闭情况[例(%)]
Table 2 Comparison of PDA closure rate among the three groups [n(%)]

GroupNPDA closedPDA opened Moderate TT∗145(35.7)9(64.3)Mild TT3823(60.5)15(39.5)Normal151103(68.2)48(31.8)
Compared with normal group,*P<0.05; TT:Thrombocytopenia
三、药物治疗后hsPDA相关并发症的发生情况
口服布洛芬疗程结束后,三组早产儿喂养不耐受、NEC、IVH及肾损伤并发症发生率之间的差异无统计学意义(P>0.05)。见表3。
表3 药物治疗后hsPDA相关并发症的发生率比较[例(%)]
Table 3 Comparison of hsPDA-related complications among the three groups [n(%)]

CharacteristicsModerate TT(n=14)Mild TT(n=38)Normal(n=151)Feeding intolerance8(57.1)22(57.9)73(48.3)NEC1(7.1) 5(13.2)11(7.3) IVH None3(21.4)11(28.9)55(36.4) ≤Lever Ⅱ5(35.7)12(31.6)46(30.5) >Lever Ⅱ6(42.9)15(42.9)50(33.1)Kidney injury7(50.0)17(44.7)74(49.0)
*TT:Thrombocytopenia; NEC:Neonatal necrotizing enterocolitis; IVH:Intraventricular hemorrhage
讨 论
与足月儿不同,早产儿动脉导管管壁薄且缺乏血管滋养管,其收缩不能引起管壁缺氧。而生后动脉导管管壁缺氧是其重塑和永久性解剖性关闭的关键。目前研究发现,血小板在动脉导管内的黏附聚集是早产儿PDA解剖性关闭的主要机理之一[7]。大量研究证实,生后血小板减少可影响早产儿PDA的发生率。Dani等[12]的研究纳入163例胎龄小于30周早产儿,分为hsPDA组143例和自然闭合PDA组28例,研究结果显示,出生时PLT<100×109/L是早产儿发生hsPDA的独立危险因素(OR=4.50),血小板减少增加了hsPDA的危险性。Alyamac等[13]的回顾性研究也指出血小板计数<150×109/L及血小板分布宽度>17%是hsPDA发生的危险因素。因此,早产儿血小板数量减少和黏附聚集功能不良均可影响PDA的发生情况[7]。
早产儿PDA常用的治疗药物包括布洛芬、吲哚美辛和对乙酰氨基酚[14],布洛芬和吲哚美辛均为非选择性环氧化酶抑制剂,通过抑制前列腺素的合成促进动脉导管关闭,为治疗PDA的临床一线药物[15]。不少研究表明布洛芬和吲哚美辛在治疗早产儿PDA方面的有效性相似,但布洛芬不良反应更少[16-17]。本研究选用目前临床上较为常用的布洛芬作为早产儿PDA的治疗药物,结果指出药物治疗前发生血小板减少可影响布洛芬治疗成功率,尤其是中度减少组患儿PDA关闭率显著低于正常组。一项回顾性研究纳入119例hsPDA早产儿,分为吲哚美辛治疗成功组83例和失败组36例,研究结果显示吲哚美辛治疗前PLT计数水平是影响吲哚美辛治疗成功率的独立危险因素(OR=1.29)[18]。然而Dani等[12]和Alyamac等[13]的研究则认为PLT水平与布洛芬治疗成功率无关。Murphy等[19]的多中心研究纳入311例极低出生体重儿,均诊断PDA且予药物治疗,将入选患儿根据治疗前PLT计数分为0~119×109/L,120~199×109/L,200~299×109/L,>300×109/L四组,研究结果显示治疗前PLT水平不影响极低出生体重儿PDA药物治疗成功率,PLT计数水平也不是接受药物治疗的PDA早产儿发生IVH和NEC等并发症的危险因素。Murphy等的研究选择极低出生体重儿,PDA关闭率波动于33%~45%之间;而本研究选择胎龄小于34周的早产儿,胎龄和出生体重更大,且PDA关闭率更高,因此可能导致研究结果不一致。
此外,与Murphy等的研究结果类似,本研究三组早产儿喂养不耐受、NEC、IVH及肾损伤等并发症发生率之间的差异无统计学意义。由于环氧化酶抑制剂可抑制血小板活性,延长出血时间,部分研究者认为血小板相对性减少可导致药物治疗PDA的相关并发症发生率增加。Brunner等[20]的回顾性研究指出血小板减少可增加环氧化酶抑制剂存在时的出血风险,治疗前血小板减少(50~99×109/L)与IVH的发生有关。而本研究三组患儿IVH发生率之间无统计学差异,可能与回顾性研究所致的局限性有关,以及相关并发症的定义方面可能存在差异。本研究在IVH的统计分组方面进行调整,以区分轻度和中重度IVH之间的差异。此外,在大多数NICU病房,严重的血小板减少被认为是PDA药物治疗的禁忌症,但各中心血小板数值规定不同[21]。本研究剔除治疗前血小板计数<50×109/L的患儿,因此缺乏血小板重度减低的患儿纳入研究,可能使结果出现一定偏倚。
本研究的局限在于中度血小板减少组患儿病例数偏少,且缺乏重度血小板减少患儿,可能使结果存在偏倚,未来需要进一步扩大样本量。
综上,本研究认为早产儿hsPDA治疗前合并血小板减少症降低了口服布洛芬的疗效,但不影响hsPDA相关并发症如喂养不耐受、NEC、IVH及肾损伤的发生率。提示临床治疗早产儿hsPDA前需密切监测患儿血小板的水平,以提高口服布洛芬的疗效。
1 Clyman RI,Couto J,Murphy GM.Patent ductus arteriosus:are current neonatal treatment options better or worse than no treatment at all?.Semin Perinatol,2012,36:123-129.
2 Rolland A,Shankar-Aguilera S,Diomandé D,et al.Natural evolution of patent ductus arteriosus in the extremely preterm infant.Arch Dis Child Fetal Neonatal Ed,2015,100:F55-F58.
3 Sellmer A,Bjerre JV,Schmidt MR,et al.Morbidity and mortality in preterm neonates with patent ductus arteriosus on day 3. Arch Dis Child Fetal Neonatal Ed,2013,98:F505-510.
4 Zonnenberg I,De Waal K.The definition of a haemodynamic significant duct in randomized controlled trials:a systematic literature review.Acta Paediatr,2012,101:247-251.
5 Bas-Suárez MP,González-Luis GE,Saavedra P,et al.Platelet counts in the first seven days of life and patent ductus arteriosus in preterm very low-birth-weight Infants.Neonatology,2014,106:188-194.
6 Sallmon H,Gutti RK,Ferrer-Marin F,et al.Increasing platelets without transfusion:is it time to introduce novel thrombopoietic agents in neonatal care?.J Perinatol,2010,30:765-769.
7 Echtler K,Stark K,Lorenz M,et al.Platelets contribute to postnatal occlusion of the ductus arteriosus.Nat Med,2010,16:75-82.
8 Clyman R,Cassady G,Kirklin JK,et al.The role of patent ductus arteriosus ligation in bronchopulmonary dysplasia:reexamining a randomized controlled trial.J Pediatr,2009,154:873-876.
9 李娜,富建华.早产儿动脉导管未闭药物治疗现状及进展.中华新生儿科杂志,2018,33:72-76.
10 Gokmen T,Erdeve O,Altug N,et al.Efficacy and safety of oral versus intravenous ibuprofen in very low birth weight preterm infants with patent ductus arteriosus.J Pediatr,2011,158:549-554.
11 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学.5版.北京:人民卫生出版社,2019:856-857,633-634,831.
12 Dani C,Poggi C,Fontanelli G.Relationship between platelet count and volume and spontaneous and pharmacological closure of ductus arteriosus in preterm infants.Am J Perinatol,2013,30:359-64.
13 Alyamac DE,Ozdemir R,Sari FN,et al.Low platelet count is associated with ductus arteriosus patency in preterm newborns.Early Hum Dev,2012,88:813-816.
14 Le J,Gales MA,Gales BJ.Acetaminophen for patent ductus arteriosus.Ann Pharmacother,2015,49:241-246.
15 Dang D,Wang D,Zhang C,et al.Comparison of oral paracetamol versus ibuprofen in premature infants with patent ductus arteriosus:a randomized controlled trial.PLoS One,2013,8:e77888.
16 Irmesi R,Marcialis MA,Anker JVD,et al.Non-steroidal anti-inflammatory drugs (NSAIDs) in the management of patent ductus arteriosus (PDA) in preterm infants and variations in attitude in clinical practice:a flight around the world.Curr Med Chem,2014,21:3132-3152.
17 Khuwuthyakorn V,Jatuwattana C,Silvilairat S,et al.Oral indomethacin versus oral ibuprofen for treatment of patent ductus arteriosus:a randomised controlled study in very low-birthweight infants.Paediatr Int Child Health,2018,38:187-192.
18 Ahamed MF,Verma P,Lee S,et al.Predictors of successful closure of patent ductus arteriosus with indomethacin.J Perinatol,2015,35:729-734.
19 Murphy DP,Lee HC,Payton KS,et al.Platelet count and associated morbidities in VLBW infants with pharmacologically treated patent ductus arteriosus.J Matern Fetal Neonatal Med,2016,29:2045-2048.
20 Brunner B,Hoeck M,Schermer E,et al.Patent ductus arteriosus,low platelets,cyclooxygenase inhibitors,and intraventricular hemorrhage in very low birth weight preterm infants.J Pediatr,2013,163:23-28.
21 Brissaud O,Guichoux J.Patent ductus arteriosus in the preterm infant:a survey of clinical practices in French neonatal intensive care units.Pediatr Cardiol,2011,32:607-614.