辅助生殖技术(assisted reproductive technology,ART)的出现和发展为不孕不育症患者带来了孕育新生命的希望。然而,在过去近40年里,尽管试管婴儿技术取得了长足地发展,其成功率却达到了一个瓶颈,徘徊在40%~50%左右。如何判断胚胎的植入能力一直是胚胎学家们努力攻克的难题,近年来,评估、挑选胚胎的方法不断发展,用无创性方法评估胚胎备受关注。胚胎的无创评估是指不影响胚胎的正常发育环境,不会对胚胎产生负面影响,不直接损伤胚胎的评估方法[1]。蛋白质组学作为其中一种,能降低形态学评估来自不同人的主观差异而前景可期。其研究发育中的胚胎产生和分泌的蛋白质,以反映胚胎发育状态,揭示蛋白质功能与细胞生命活动的规律。目前可通过质谱法,酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)及其他电离方法等,精确、快速、简便地测定微量样品产生和分泌的蛋白质含量。近年来,对于人类白细胞抗原G (human leukocyte antigen G,HLA-G)的研究较多,HLA-G作为一种免疫抑制因子而调节母胎界面和母体的免疫反应,从而防止母胎免疫排斥的发生[2]。研究表明,HLA-G是评估胚胎质量的重要标志物[3]。胚胎培养液中可溶性HLA-G(soluble human leukocyte antigen G,sHLA-G)的存在有利于较高的胚胎植入率和妊娠率[4]。本文回顾性分析了胚胎培养液中sHLA-G与胚胎植入和妊娠的相关性,为胚胎质量的评判提供依据。
对象与方法
一、研究对象
选择2017年5月—2018年5月在江苏省苏北人民医院生殖医学中心接受体外受精或卵胞浆内单精子注射胚胎移植(in vitro fertilization/intracytoplasmic sperm injection-embryo transfer,IVF/ICSI)的86例不孕患者,共计100个周期为研究对象。纳入标准:女性年龄20~44岁、不孕年限≥1年、获卵数≥1个。排除标准:子宫异常(肌瘤、子宫腺肌症、子宫纵膈、其它先天或后天子宫畸形)、子宫内膜异位症III或Ⅳ期、患者或其丈夫染色体异常及有内科合并症如甲状腺功能异常、高泌乳素血症和糖尿病等内分泌疾病、供卵/冻卵周期、补救ICSI、移植两个胚胎后获得单胚胎植入的。获取胚胎受精后第3日行胚胎冷冻的单个胚胎培养液共计146份。按妊娠结局分为妊娠组和未妊娠组;另按移植胚胎中sHLA-G阳性情况分为2组:sHLA-G阳性组和sHLA-G阴性组,比较组间差异。本研究遵循的程序符合江苏省苏北人民医院伦理委员会制定的伦理学标准,得到该委员会批准。
二、方法
1.胚胎及培养液的选择:卵子取出后培养3~6 h加入处理后的精液,授精后20~21 h观察受精情况,并将每个受精卵分别移入30 ulG1(Vitrolife,瑞典)培养液滴中盖油,在37 ℃、6%CO2条件下孵育至移植前。胚胎分级标准:根据第三天胚胎形态和碎片多少,将胚胎分为4级:Ⅰ级:卵裂球大小均匀,胞质无异常,碎片<5%;Ⅱ级:卵裂球大小均匀或不均匀,碎片<20%;Ⅲ级:碎片 20%~50%;Ⅳ级:碎片>50%;可移植胚胎包括Ⅰ级、Ⅱ级和Ⅲ级胚胎。
2.胚胎培养液的收集和保存:将每个胚胎对应的培养液25 ul吸入0.5 mL Eppendrof管中,存放入-80 ℃冰箱以备检测。
3.sHLA-G的检测:采用双抗体夹心法ELISA(enzyme-linked immunosorbent assay)试剂盒,定量检测单个胚胎培养液sHLA-G浓度。sHLA-G试剂盒由捷克BioVendor Laboratory Medicine公司提供,试剂盒最低检测限为1 ng/ml。一抗为鼠抗sHLA-G单克隆抗体,二抗为酶标的鼠源抗人微球蛋白单克隆抗体。按说明书操作。实验所需设备有:Bio Tek Instruments(HIGHLAND PARK,BOX 998.WINOOSKI,VT 05404-0998,USA)光谱仪、微量振荡器、水浴箱等。
4.胚胎的冻融移植:胚胎解冻后观察,至少有6个细胞且细胞内碎片少于20%的胚胎被认为是可移植的,培养2 h后移植至宫腔内,最多移植2个胚胎。移植后常规给予黄体酮40~80 mg肌内注射,或阴道放置黄体酮阴道缓释凝胶90 mg/d予以黄体支持。
5.确认妊娠:胚胎移植后14天,若患者血清β-人绒毛膜促性腺激素(β-HCG)阳性,定义为生化妊娠;移植4~5周后,超声检查见孕囊或临床证实为异位妊娠及宫内外同时妊娠,则定义为临床妊娠。
6.统计学分析:采用SPSS16.0软件对数据进行处理,作图软件使用Graphpad prism 7,采用受试者工作特征(receiver operating characteristics,ROC)曲线分析sHLA-G对妊娠结局的影响。用 Kolmogorow-Smirnov检验数据是否符合正态分布,若符合则采用t检验,若不符合则运用Mann-Whitney U检验;计量资料用![]() 表示;定性资料采用例数(百分比)表示,组间比较采用卡方检验。资料中促性腺激素给药总量(Gn总量)、成熟卵数符合正态分布,患者的年龄、体质量指数(body mass index,BMI)、促性腺激素给药天数(Gn天数)、基础FSH(basal follicle-stimulating hormone)、基础LH(basal luteinizing hormone)、基础E2(basal estradiol)、HCG日子宫内膜厚度及窦卵泡数、获卵数数据不符合正态分布。以胚胎植入结局为因变量,窦卵泡数、获卵数、成熟卵数及胚胎培养液中sHLA-G含量为自变量,应用二元Logistic回归分析变量对胚胎植入结局的影响。P<0.05为差异有统计学意义。
表示;定性资料采用例数(百分比)表示,组间比较采用卡方检验。资料中促性腺激素给药总量(Gn总量)、成熟卵数符合正态分布,患者的年龄、体质量指数(body mass index,BMI)、促性腺激素给药天数(Gn天数)、基础FSH(basal follicle-stimulating hormone)、基础LH(basal luteinizing hormone)、基础E2(basal estradiol)、HCG日子宫内膜厚度及窦卵泡数、获卵数数据不符合正态分布。以胚胎植入结局为因变量,窦卵泡数、获卵数、成熟卵数及胚胎培养液中sHLA-G含量为自变量,应用二元Logistic回归分析变量对胚胎植入结局的影响。P<0.05为差异有统计学意义。
结 果
一、研究对象的一般资料
妊娠组与未妊娠组患者的年龄、不孕年限、不孕类型、BMI、授精方式、Gn天数、Gn总量、基础性激素水平、HCG日子宫内膜厚度比较差异均无统计学意义(均P>0.05);妊娠组的窦卵泡数、获卵数及成熟卵数均较未妊娠组高(均P<0.05),见表1。
表1 妊娠组与未妊娠组基本信息比较![]()
Table 1 Comparison of general characteristics of the pregnant group and non-pregnant ![]()
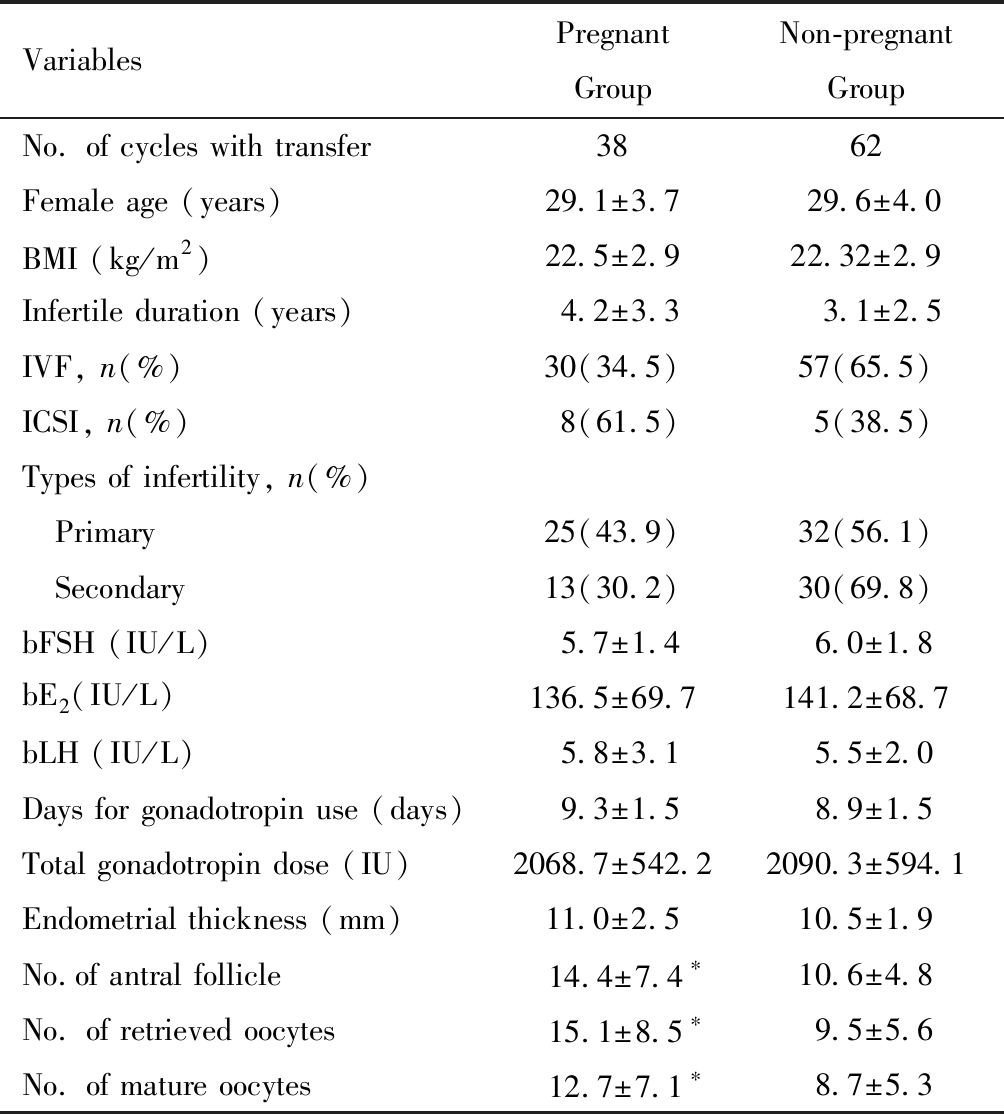
VariablesPregnant GroupNon-pregnant GroupNo. of cycles with transfer3862Female age (years)29.1±3.729.6±4.0BMI (kg/m2)22.5±2.922.32±2.9Infertile duration (years)4.2±3.33.1±2.5IVF, n(%)30(34.5)57(65.5)ICSI, n(%)8(61.5)5(38.5)Types of infertility, n(%) Primary25(43.9)32(56.1) Secondary13(30.2)30(69.8)bFSH (IU/L)5.7±1.46.0±1.8bE2 (IU/L)136.5±69.7141.2±68.7bLH (IU/L)5.8±3.15.5±2.0Days for gonadotropin use (days)9.3±1.58.9±1.5Total gonadotropin dose (IU)2068.7±542.22090.3±594.1Endometrial thickness (mm)11.0±2.510.5±1.9No.of antral follicle 14.4±7.4∗10.6±4.8No. of retrieved oocytes 15.1±8.5∗9.5±5.6No. of mature oocytes 12.7±7.1∗8.7±5.3
*P<0.05, compared with non-pregnant group.
二、检测标准判读
根据sHLA-G标准品稀释倍数做标准曲线,求得sHLA-G浓度与吸光度(optical density,OD,450 nm)之间的线性回归方程,由OD值推算各培养液中sHLA-G的含量,依据其妊娠结局做ROC曲线,曲线下面积(area under the curve,AUC)为0.746(95% CI:0.661-0.831)(见图1)。计算截断值a=1.253(灵敏度为69.2%,特异性为84.0%),≥a则为 sHLA-G阳性, 图1 培养液中sHLA-G预测胚胎植入的ROC曲线 行FET的86例患者, 共100个周期,146个胚胎成功移植。其中获得临床妊娠的有38个周期,65个胚胎成功植入,81个胚胎未植入。临床妊娠率为38.0%(38/100),妊娠组与未妊娠组之间sHLA-G含量平均值的差异(1.8 U/mLvs 0.8 U/mL)有统计学意义(P<0.05),见表2;sHLA-G阳性组植入率(77.6%,45/58)高于sHLA-G阴性组(22.7%,20/88),组间差异有统计学意义(P<0.05); sHLA-G阳性组平均sHLA-G浓度(2.4 U/mL)明显高于sHLA-G阴性组(0.3 U/mL),差异有统计学意义(P<0.05), 见表3;二元Logistic回归分析结果显示,胚胎培养液中sHLA-G含量为影响胚胎植入的独立危险因素(P<0.05),见表4。以植入与未植入胚胎的sHLA-G含量做散点图,组间sHLA-G含量差异有统计学意义(P<0.05),见图2。 表2 妊娠组与未妊娠组sHLA-G含量和植入率对比 GroupNo. of transferred embryos (n)Mean value ofsHLA-G(x±s)(U/mL)Implantation rate (%)Pregnant Group481.8±1.2∗63.2∗Non-pregnant Group980.8±1.122.6 *P<0.05, compared with non-pregnant group. 表3 sHLA-G阳性组与sHLA-G阴性组含量及植入率对比 No. of transferred embryos(n)No. of implantation embryos(n)Mean value of sHLA-G(x±s)(U/mL)Implantation rate(%)sHLA-G positive group58452.4±0.8∗77.6∗sHLA-G negative group88200.3±0.422.7 *P<0.05, compared with sHLA-G negative group. 表4 二元Logistic回归分析变量对胚胎植入的影响 VariablesβSEOdds ratio (95% CI)No.of antral follicle 0.0050.0641.005(0.886-1.138)No. of retrieved oocytes 0.1570.1041.170(0.954-1.434)No. of mature oocytes-0.0830.1100.921(0.742-1.142)sHLA-G levels 0.7130.1772.041(1.442-2.888) 图2 植入组与未植入组sHLA-G含量分布图 自1978年第一例试管婴儿诞生以来,通过技术的革新,问题的突破及不断的研究探索,辅助生殖技术在胚胎学家们的努力下持续发展,为人类造福。但仍存在一些亟需解决的问题,最主要是“一低一高”问题,即活产率低和多胎妊娠率高,为解决这个问题,更准确的评估胚胎发育潜能,挑选单个最优胚胎进行移植很重要。为了寻求无创,简便,准确的评估方法,本研究通过分析植入与未植入胚胎的胚胎培养液中的sHLA-G含量,探讨其是否可作为妊娠预测指标。首先从理论上来说:1996年Jurisicova等第一次研究证明了sHLA-G阳性胚胎的卵裂率更高,且sHLA-G的表达与胚胎植入存在正相关[4],从此以后,许多研究者发表了关于胚胎培养液中sHLA-G的表达与胚胎妊娠结局关系的研究。Sher等的一项前瞻性队列研究表明,胚胎在ICSI后46小时能产生sHLA-G预示着较好的妊娠结局[5]。德国的一项多中心研究表明,随着胚胎发育阶段的推进,sHLA-G阳性胚胎的比例随之升高,且sHLA-G阳性胚胎发育至囊胚的可能性更大,sHLA-G水平可能是继胚胎的形态学评分系统之后的第二个重要评判参考[6]。2017年发表的一篇荟萃分析表明胚胎培养液中sHLA-G的存在有利于较高的胚胎植入率和妊娠率[7]。其次从标本的检测方面来讲:一方面,胚胎生长发育的直接环境是胚胎培养液,胚胎从中汲取养分并分泌代谢产物。在基因——蛋白——代谢终产物这样一个生物信息传递链中,蛋白质及代谢物是细胞生命活动的体现者,能反映胚胎的活力。另一方面,在一般情况下,第三天胚胎行移植或培养囊胚或冷冻保存后,卵裂期胚胎培养液均被遗弃,对其的收集及检测既节约资源又对胚胎无任何损伤。 研究表明,HLA-G是人类主要组织相容性复合体,特异性表达于绒毛膜外细胞滋养层的母-胎界面,它除了能抑制NK细胞的自然杀伤和T淋巴细胞及抗原提呈细胞的免疫应答作用,使绒毛细胞滋养层细胞逃避杀伤,也可通过MEK1/2信号传导通路促进HCG的表达,促进血管重塑及早期胚胎的着床和发育[8-9]。sHLA-G主要存在于早期胚胎的胚胎培养液中,羊水、母体血清、血浆和卵泡液中也可检测到,已有多数研究结果提示,胚胎培养液中sHLA-G的存在与较高的胚胎植入率和妊娠率有关[7]。有研究称妊娠早期胚胎培养液中sHLA-G与不明原因复发性流产及子痫前期相关[10-11],但它们之间的关系尚无定论,由此可见,探究sHLA-G与胚胎植入及妊娠并发症之间的关系对于挑选优质胚胎,改善妊娠结局很有意义。 sHLA-G在胚胎培养液中的表达多为定量研究,以往的多数研究中,由于测定sHLA-G的方法不尽相同,使用的试剂盒及操作步骤有所区别,所以使用不同的判定方法来界定sHLA-G阳性截断值[6,12,13]。部分研究将可检测到sHLA-G定为阳性,还有研究中直接给出阳性的浓度范围,但并未解释范围的来源,故这些方法降低了不同研究之间可比性。还有一部分研究用Stoller的非参数判别分析确定阳性截断值,即待测胚胎培养液中sHLA-G的平均荧光强度(mean fluorescent intensity,MFI)高于阴性对照MFI的10%即为sHLA-G阳性。由于实验环境及试剂的不同,操作方法的差异使得不同研究之间的sHLA-G阳性/阴性的标准不同,这大大降低了不同研究之间可比性,偏倚较大。本研究依据标准曲线和培养液的sHLA-G的实际测定值来确定阴阳,由ROC曲线来确定截断值,相比其他研究方法,其敏感性及特异性均较高,更加客观地判定了sHLA-G阳性的界限。截断值是错误最少的最好阈值,其假阳性和假阴性的总数最少。研究中ROC曲线下面积AUC为0.746,表明用胚胎培养液中sHLA-G含量评估胚胎的植入结局有中等度准确性。由于本研究样本量不高,且为回顾性研究,偏倚不可避免,故而需加大样本量进一步实验。 本研究中妊娠组sHLA-G含量均值高于非妊娠组;sHLA-G阳性组的sHLA-G含量均值高于sHLA-G阴性组,表明用ELISA法检测胚胎培养液中的sHLA-G是可行的。这与Noci等[12]的研究结果不同,他们认为移植胚胎中至少要有一个是sHLA-G阳性时才获得妊娠,但多数实验结果中妊娠组与非妊娠组胚胎均检测到sHLA-G阳性的表达[7]。究其原因,一方面是研究方法之间的差异,另一方面,有研究表明不同发育时间的胚胎产生sHLA-G的量不同,培养24h(52%)、培养48 h(87%)、培养72 h(90%)的胚胎有sHLA-G的表达[14]。虽然多数研究均检测的是第三天的胚胎培养液,但胚胎发育速度的不同必将导致sHLA-G含量的差异。 二元Logistic回归分析去除混杂因素后的结果表明,胚胎培养液中sHLA-G含量为影响胚胎植入的独立危险因素,证明了胚胎培养液中的sHLA-G与妊娠结局相关,它可能是预测胚胎质量的一个标志物,此结果与多数已发表的研究结果类似[7,15]。卵泡的发育将直接影响胚胎的质量及妊娠结局[16],本研究中,单因素分析中妊娠组的窦卵泡数、获卵数及成熟卵数均高于未妊娠组,差异有统计学意义,但二元Logistic回归分析表明窦卵泡数、获卵数及成熟卵数与妊娠结局的关系不大,进而证明sHLA-G含量为影响胚胎植入的独立危险因素。研究中收集并测定的是第三天的胚胎培养液中的sHLA-G含量,这些胚胎在第三天被冷冻,等待解冻后移植。这为评估胚胎质量提供了一种新思路,为复苏周期胚胎移植的质量评估提供了新方法,争取了时间。形态学评估法仍是临床应用最广的胚胎质量评估方法,因此,结合第三天胚胎的形态学评级及培养液中的sHLA-G含量挑选优质胚胎解冻移植,以提高胚胎植入率,是我们接下来的研究方向。 综上所述,本研究结果表明可将胚胎培养液中的sHLA-G 水平检测作为胚胎移植前无创性检测项目,促进临床中选择性单胚胎移植的进行。在形态学评估的基础上,将sHLA-G作为辅助生育中无创检测项目,帮助选择优质胚胎进行单胚胎移植,可以在提高胚胎着床率的同时降低多胎率。但本研究的局限是纳入研究的样本较少,需要更大规模的前瞻性研究来证明sHLA-G对于评估胚胎质量的可靠性。 1 Warner CM,Lampton PW,Newmark JA,et al.Symposium:innovative techniques in human embryo viability assessment.Soluble human leukocyte antigen-G and pregnancy success.Reprod BioMed Online,2008,17:470-485. 2 李静博,周美英,许惠惠,等.HLA-G与母胎免疫耐受.医学研究杂志,2017,46:12-14. 3 Hviid TV.Human leukocyte antigen-G within the male reproductive system:implications for reproduction.Adv Exp Med Biol,2015,868:171-190. 4 Jurisicova A,Casper RF,MacLusky NJ,et al.Embryonic human leukocyte antigen-G expression:possible implications for human preimplantation development.Fertil Steril,1996,65:997-1002. 5 Sher G,Keskintepe L,Fisch JD,et al.Soluble human leukocyte antigen G expression in phase I culture media at 46 hours after fertilization predicts pregnancy and implantation from day 3 embryo transfer.Fertil Steril,2005,83:1410-1413. 6 Rebmann V,Switala M,Eue I,et al.Soluble HLA-G is an independent factor for the prediction of pregnancy outcome after ART:a German multi-centre study.Hum Reprod,2010,25:1691-1698. 7 Niu Z,Wang L,Pang RT,et al.A meta-analysis of the impact of human leukocyte antigen-G on the outcomes of IVF/ICSI.Reprod BioMed Online,2017,34:611-618. 8 Le Bouteiller P.HLA-G in human early pregnancy:control of uterine immune cell activation and likely vascular remodeling.Biomed J,2015,38:32-38. 9 张晓莉,姚元庆.人类白细胞抗原-G与移植免疫.武警医学,2016,27:415-418. 10 朱明武,程瑞,李威.HLA-G非编码区单核苷酸多态性与不明原因反复流产的相关性.免疫学杂志,2017,3:239-244. 11 刘兴会,王晓东,何国琳.子痫前期发病机制的研究现状及展望.四川大学学报(医学版),2015,46:99-103. 12 Noci I,Fuzzi B,Rizzo R,et al.Embryonic soluble HLA-G as a marker of developmental potential in embryos.Hum Reprod,2005,20:138-146. 13 Dirk K,Thinus FK,Carl L,et al.The effect of the biochemical marker soluble human leukocyte antigen G on pregnancy outcome in assisted reproductive technology-a multicenter study.Fertil Steril,2013,100:1303-1309. 14 吕晶,周从容.可溶性人类白细胞抗原G与胚胎发育关系的初步研究.生殖与避孕,2014,34:706-713. 15 Yao YQ.The role of human leukocyte antigen G in early embryo development and implantation.J Reprod Immunol,2015,111:6-7. 16 Fadini R,Coticchio G,Brambillasca F,et al.Clinical outcomes from mature oocytes derived from preovulatory and antral follicles:reflections on follicle physiology and oocyte competence.J Assist Reprod Gen,2015,32:255-261.
Figure 1 ROC curve for estimating the predictive value of sHLA-G in embryo culture medium of embryo implantation三、第三日单胚胎培养液sHLA-G表达情况
Table 2 Comparison of the mean value of sHLA-G and implantation rate between Pregnant Group and Non-pregnant Group
Table 3 Comparison of thesHLA-G levels and implantation rate between sHLA-G positive group and sHLA-G negative group
Table 4 Binary logistic regression analysis of factors on the implantation of embryos
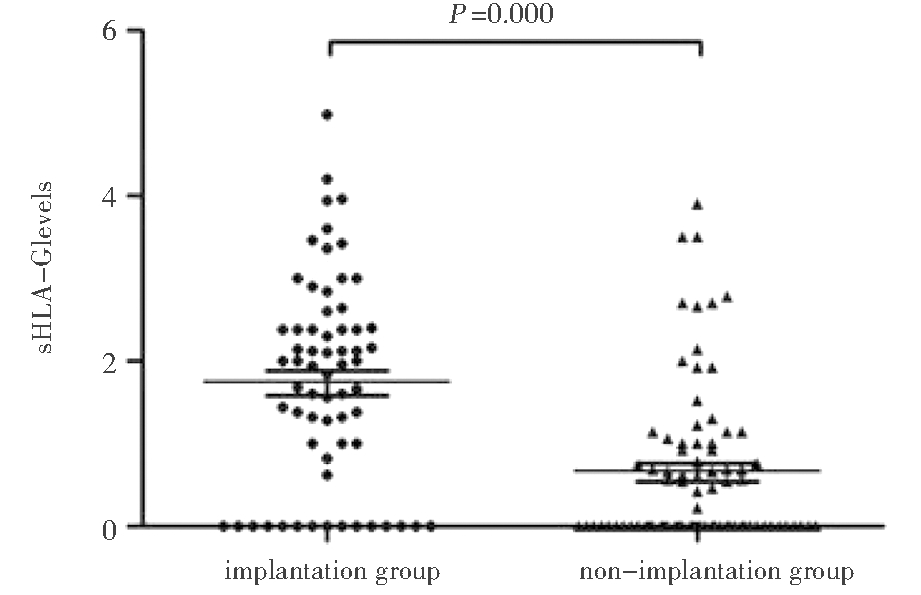
Figure 2 The scattergram of sHLA-G levels in implantation group and non-implantation group讨 论