近年来,由于工业化和城市化的快速发展,大量的重金属进入水体及其他环境系统中,长期存在于环境中,并通过食物、污水和空气等进入人体且不断蓄积,直接危害人体健康[1]。砷(As)、铅(Pb)、镉(Cd)、镍(Ni)是已知的有毒重金属,具有一定的生殖毒性,且能通过胎盘屏障[2, 3]。动物实验研究发现,砷、铅、镉、镍暴露会影响胚胎的正常发育及后代的生长[4, 5]。然而,其致畸作用的机制尚不清楚。
目前,越来越多的研究聚焦于环境暴露引起的表观遗传学改变[6]。表观遗传学是指在不改变DNA序列的前提下,基因表达发生的可遗传的变化,被认为是环境暴露和疾病发生发展之间的机制桥梁[7, 8]。其中,DNA甲基化是研究最广泛的机制之一,是指在DNA甲基转移酶(DNA Methyltransferase, DNMT)的催化下,将S-腺苷甲硫氨酸提供的甲基添加到DNA分子上[9]。流行病学研究发现,母亲砷、铅、镉、镍暴露会引起胎儿脐带血中整体[10]及特异基因甲基化水平的改变,包括砷甲基转移酶基因(As3MT)[11]、印迹基因(H19、HSD11B2、PEG10、MEG3)[12, 13]、DNMT3B基因[14]等。但大部分研究采集母亲外周血、尿、指甲等生物标本进行重金属暴露测量,鲜有研究使用脐带组织测量重金属含量。脐带作为胎儿身体的一部分,测量其污染物浓度,能更好地评估胎儿体内污染物的真实暴露水平。为探讨一般人群中重金属含量与DNA甲基化水平的关系,本研究纳入173例无重大体表出生缺陷胎儿,测量其脐带组织砷、铅、镉、镍金属含量,及脐带血中DNMT3B基因甲基化水平,探索胎儿重金属内暴露对DNA甲基化水平的影响,为重金属的致畸作用机制研究提供依据。
对象及方法
一、研究对象
本研究为横断面研究。研究对象来自北京大学生育健康研究所于2003年1月至2016年12月在山西省太谷县、平定县、昔阳县、寿阳县、泽州县、太原市和长治市开展的病例对照研究。研究对象纳入标准为:(1)无重大体表出生缺陷的正常胎儿或新生儿;(2)母亲为山西省常住居民(在本地居住2年以上),且本次妊娠期间在本地居住;(3)同意参加研究并签署书面知情同意书。本研究通过北京大学生物医学伦理委员会审批。
二、方法
1. 问卷调查及标本采集:对调查员进行统一规范的培训,在终止妊娠或分娩前后,采用结构式问卷对研究对象的母亲进行面对面调查。调查内容包括母亲基本人口学特征、生活方式、孕期饮食情况、环境污染物暴露情况等。胎儿娩出时,现场采集5~10 cm脐带组织、脐带血等标本,并用干冰转运至实验室。脐带组织保存在-20℃冰箱,脐带血以纸血片或血细胞方式分别保存于-20℃、-80℃冰箱。
2. 脐带组织重金属含量检测:分离2g左右的湿重脐带,用钛合金剪刀将脐带血管剪开,超纯水清洗后放入真空冷冻干燥机,冻干至约0.2g。在高压微波消解仪(Ultra WAVE, Milestone, Italy)中用3 mL硝酸溶液和0.5 mL双氧水消化冻干脐带。处理1h后,从石英消解管中取1ml样本加入到EP管中,超纯水稀释至2ml。使用电感耦合等离子体质谱(ICP-MS)检测并得到结果。每批次检测同时制备2份猪肝标准品(GBW 10051),对每20个脐带样品进行质控。砷、铅、镉、镍的检出限分别0.011 ng/mL、0.002 ng/mL、0.001 ng/mL、0.016 ng/mL。所有样本的重金属含量均高于检出限。
3. 脐带血DNA提取:用DNA提取试剂盒(QIAamp DNA Mini Kit),按照试剂盒说明书提取脐带血中的DNA,使用NanoDrop分光光度计对DNA样本的浓度及纯度进行测定,并置于-80°C冰箱保存。
4. 脐带血DNMT3B基因甲基化水平检测:选取DNMT3B基因甲基化岛区域为目标区域,使用EpiDesigner网站(http://www.epidesigner.com/),在线设计PCR引物,PCR引物共覆盖24个CpG位点,剔除3个位点不可分析,共21个可分析位点。正向引物为5′-aggaagagag-GGGTTTTTAGGGGTTTTTTTTG-3′,反向引物为5′-agtaatacgactcactatagggagaaggct-CCCCTCCCACAAAATATATACAATA-3′。取500ng DNA样本使用试剂盒(EZ DNA Methylation kit,Zymo公司)进行重亚硫酸盐转换。处理后的DNA使用Sequenom MassARRAY时间飞行质谱阵列基因分析平台进行定量分析。先配置5μL体系进行PCR扩增,反应条件为:95℃ 4min; 95℃ 20s,58℃ 30s,72℃ 1min(45个循环);72℃ 3min。之后使用虾碱性磷酸酶(SAP)纯化PCR产物,条件为37℃ 20min,85℃ 5min。使用T切割转录酶进行碱基特异性酶切反应(MassCLEAVE),条件为37℃ 3h。最终产物转移至384孔板,加入清洁树脂进行脱盐处理并上机检测。用EpiTYPER软件进行峰值检测及甲基化水平定量计算。甲基化数值用百分数表示,DNMT3B的甲基化水平为21个位点的平均值。实验中设置阳性对照和阴性对照进行质控。
5. 统计分析方法:砷、铅、镉、镍金属浓度用中位值及四分位间距表示,基因甲基化水平用![]() 表示。采用Spearman等级相关法进行相关分析。对四种金属含量进行log对数转换,并采用多重线性回归模型调整混杂,分析四种重金属对DNMT3B甲基化水平的影响。混杂因素包括母亲分娩年龄、孕前BMI、文化程度、职业、围孕期叶酸补充情况、主动或被动吸烟暴露、胎儿孕周及胎儿性别。使用Stata 14.0 软件进行数据分析。双侧P<0.05为差异有统计学意义。
表示。采用Spearman等级相关法进行相关分析。对四种金属含量进行log对数转换,并采用多重线性回归模型调整混杂,分析四种重金属对DNMT3B甲基化水平的影响。混杂因素包括母亲分娩年龄、孕前BMI、文化程度、职业、围孕期叶酸补充情况、主动或被动吸烟暴露、胎儿孕周及胎儿性别。使用Stata 14.0 软件进行数据分析。双侧P<0.05为差异有统计学意义。
结 果
本研究共纳入173例无重大体表出生缺陷胎儿,均为汉族,男性和女性的比例分别为44.7%、55.3%,平均孕周为(39.8±3.0)周。接受问卷调查的母亲平均分娩年龄为(27.0±4.7)岁,孕前BMI为(23.0±3.6)kg/m2。113(65.3%)人文化程度为初中及以下。大部分人(77.3%)的职业为农民,89(53.0%)人为初产妇。其余孕期环境因素暴露特征见表1。
表1 母亲、胎儿基本人口学及孕期环境暴露因素特征
Table 1 Basic demographic characteristics and prenatal environmental exposure among mothers and infants

Characteristics∗ n(%)Age at delivery (mean±SD)27.0±4.7BMI (mean±SD)23.0±3.6Education level Junior school and lower113(65.3) High school and above60(34.7)Occupation Famer133(77.3) Other39(22.7)Han ethnicity173(100.0)Parity 189(53.0) ≥279(47.0)Folic acid supplementation Yes86(52.4) No78(47.6)Active or passive smoking Yes70(40.7) No102(59.3)Alcohol drinking Yes15(8.8) No156(91.2)Infant gender Male76(44.7) Female94(55.3)Gestational week (mean±SD)39.8±3.0
*The number for some variables data may not equal to total number due to missing value.
脐带组织中,砷、铅、镉、镍浓度的中位值及四分位间距分别为7.66(5.24~10.30) ng/g、23.91(16.74~44.29) ng/g、0.95(0.47~2.71) ng/g、21.42(15.61~32.2) ng/g。脐带血中DNMT3B基因平均甲基化水平为(7.38±2.66)%。Spearman等级相关法结果显示,镉与DNMT3B甲基化水平存在相关性(r=0.19, P=0.01),其余金属与DNMT3B甲基化水平无相关性(P>0.05)。4种重金属的浓度均为偏态分布,进行log对数转换,分别绘制散点图。详见图1。

图1 脐带中砷、铅、镉、镍金属含量与DNMT3B甲基化水平散点图
Figure 1 Correlation between concentrations of As, Pb, Cd and Ni in umbilical cord and DNMT3B methylation level
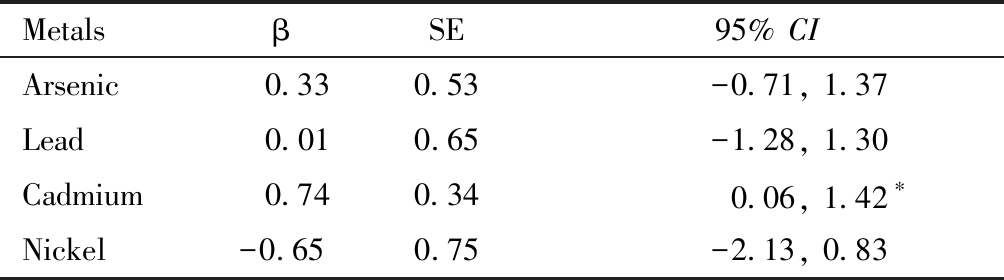
以DNMT3B甲基化水平为因变量,各金属浓度的log转换值为自变量,调整混杂因素,进行多重线性回归分析。回归结果显示,脐带组织中镉含量对DNMT3B甲基化水平的影响有统计学意义(β=0.74, P=0.03)。其余金属对DNMT3B甲基化水平无显著影响(P>0.05)。详见表2。
表2 脐带中砷、铅、镉、镍金属对DNMT3B甲基化水平的影响
Table 2 Effect of umbilical cord As, Pb, Cd and Ni on DNMT3B methylation level
MetalsβSE95% CIArsenic 0.330.53-0.71, 1.37Lead 0.010.65-1.28, 1.30Cadmium 0.740.34 0.06, 1.42∗Nickel-0.650.75-2.13, 0.83
*P<0.05
多重线性回归模型中分别加入镉与砷、铅、镍金属两两配对的交互项,结果显示镉与砷、铅、镍金属对DNMT3B甲基化的影响均无显著交互作用(P>0.05)。详见表3。
表3 脐带中重金属交互作用对DNMT3B甲基化水平的影响
Table 3 Interaction effect among umbilical cord As, Pb, Cd and Ni on DNMT3B methylation level

MetalsβSE95% CICadmium×Arsenic-1.220.94-3.08, 1.86Cadmium×Lead-2.031.10-4.21, 0.15Cadmium×Nickel 0.361.30-2.20, 2.93
讨 论
本研究为横断面研究,以无重大体表出生缺陷的胎儿为研究对象,分析一般人群中重金属暴露对胎儿DNA甲基化水平的影响。结果显示,控制混杂因素后,脐带组织镉含量增加,会引起脐带血中DNMT3B甲基化水平升高。未发现镉与砷、铅或镍对DNMT3B甲基化水平的交互作用。
砷、铅、镉、镍是生产生活环境中普遍存在的污染物,可以通过多种途径进入人体,如呼吸系统、消化系统等,对人类健康造成了很多不良影响[1]。有研究报道,砷、铅、镉、镍可以通过胎盘屏障,形成宫内暴露,引起不良妊娠结局[2,3]。本研究检测了173例胎儿脐带组织中砷、铅、镉、镍的含量,其中,铅、镉含量的中位值分别为23.91 ng/g、0.95 ng/g,略低于日本的一项人群研究报道的39.9 ng/g、1.16 ng/g[15]。既往研究多采用脐带血清样本检测砷含量,一项在中国人群开展的大型队列研究(N=3474)报道脐带血清砷含量中位值为1.87 μg/L[16]。与脐带血相比,脐带组织是胎儿组织的一部分,更能反映胎儿的暴露情况。本研究首次使用脐带组织检测砷的中位值为7.66 ng/g。本研究也首次报道了脐带组织中镍的含量,其中位值为21.42 ng/g。
已有研究发现,母亲孕期砷、铅、镉、镍暴露会影响胎儿的DNA甲基化水平。本研究以DNMT3B基因为目的基因,检测甲基化水平并分析与重金属的关系。DNMT3B基因是DNA甲基转移酶(DNMT)家族的成员之一,其编码的蛋白酶在合成甲基化(de novo methylation)过程中起重要作用[17]。对169例居住在镉暴露区和100例非暴露区的泰国居民的尿镉浓度检测发现随着尿镉浓度增加,外周血DNMT3B甲基化的水平越高[14]。另一项对202名阿根廷妇女的研究发现低水平的尿镉暴露(0.23 μg/L)与外周血DNMT3B基因表达呈负相关[18]。以上研究提示镉暴露会影响DNMT3B甲基化及表达水平,但暴露测量均使用妊娠妇女尿液标本,不能反映胎儿生长发育过程中的真实暴露情况。本研究中,多重线性回归分析发现,控制混杂因素后,DNMT3B甲基化与脐带镉含量呈正相关,随着镉暴露水平的增加,DNMT3B甲基化水平升高,提示表观遗传改变可能是重金属致病的重要途径之一。
本研究还探讨了镉与砷、铅和镍金属之间的交互作用。结果显示,镉与其他三种金属对DNMT3B甲基化水平的影响均无统计学交互作用。目前有关金属交互作用的研究较少,一项母亲镉、砷暴露与后代先天性心脏病发病风险关联研究中发现,镉和砷对先天性心脏病发病风险存在交互作用[19]。然而,其相互作用的生物机制尚不清楚。
本研究的优势在于,相比以往研究,使用脐带组织测量胎儿发育过程中的重金属内暴露。使用脐带血测量DNA甲基化水平,DNA甲基化能作为一种生物标志物,可运用临床上异常状态的早期识别和诊断。
综上所述,本研究发现胎儿脐带组织重金属暴露可能会影响DNMT3B基因甲基化水平,为今后进一步探究重金属与疾病关联的作用机制提供依据。此外,胎盘对重金属缺乏有效屏障作用,为减少胎儿的宫内暴露剂量,应采取有效防护措施、开展合理的孕期健康教育,避免孕妇暴露于环境重金属污染。
1 Wu X,Cobbina SJ,Mao G,et al.A review of toxicity and mechanisms of individual and mixtures of heavy metals in the environment.Environ Sci Pollut Res Int,2016,23:8244-8259.
2 Caserta D,Graziano A,Lo Monte G,et al.Heavy metals and placental fetal-maternal barrier:a mini-review on the major concerns.Eur Rev Med Pharmacol Sci,2013,17:2198-2206.
3 Punshon T,Davis MA,Marsit CJ,et al.Placental arsenic concentrations in relation to both maternal and infant biomarkers of exposure in a US cohort.J Expo Sci Environ Epidemiol,2015,25:599-603.
4 Thompson J,Bannigan J.Cadmium:toxic effects on the reproductive system and the embryo.Reprod Toxicol,2008,25:304-315.
5 Wang A,Holladay SD,Wolf DC,et al.Reproductive and developmental toxicity of arsenic in rodents:a review.Int J Toxicol,2006,25:319-331.
6 Martin EM,Fry RC.Environmental Influences on the epigenome:exposure- associated DNA methylation in human populations.Annu Rev Public Health,2018,39:309-333.
7 Marsit CJ.Influence of environmental exposure on human epigenetic regulation.J Exp Biol,2015,218:71-79.
8 朱江辉,任爱国.表观遗传流行病学.中国生育健康杂志,2009,20:378-382.
9 Maunakea AK,Chepelev I,Zhao K.Epigenome mapping in normal and disease States.Circ Res,2010,107:327-339.
10 Tajuddin SM,Amaral AF,Fernandez AF,et al.Genetic and non-genetic predictors of LINE-1 methylation in leukocyte DNA.Environ Health Perspect,2013,121:650-656.
11 Gribble MO,Tang WY,Shang Y,et al.Differential methylation of the arsenic (III) methyltransferase promoter according to arsenic exposure.Arch Toxicol,2014,88:275-282.
12 Goodrich JM,Sanchez BN,Dolinoy DC,et al.Quality control and statistical modeling for environmental epigenetics:a study on in utero lead exposure and DNA methylation at birth.Epigenetics,2015,10:19-30.
13 Vidal AC,Semenova V,Darrah T,et al.Maternal cadmium,iron and zinc levels,DNA methylation and birth weight.BMC Pharmacol Toxicol,2015,16:20.
14 Virani S,Rentschler KM,Nishijo M,et al.DNA methylation is differentially associated with environmental cadmium exposure based on sex and smoking status.Chemosphere,2016,145:284-290.
15 Sakamoto M,Yasutake A,Domingo JL,et al.Relationships between trace element concentrations in chorionic tissue of placenta and umbilical cord tissue:potential use as indicators for prenatal exposure.Environ Int,2013,60:106-111.
16 冯兰兰,梁春梅,黄锟,等.孕期和脐带血清砷水平及其与妊娠期高血压疾病关系.中国公共卫生,2018:1-3.
17 Okano M,Bell DW,Haber DA,et al.DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development.Cell,1999,99:247-257.
18 Hossain MB,Vahter M,Concha G,et al.Low-level environmental cadmium exposure is associated with DNA hypomethylation in Argentinean women.Environ Health Perspect,2012,120:879-884.
19 Jin X,Tian X,Liu Z,et al.Maternal exposure to arsenic and cadmium and the risk of congenital heart defects in offspring.Reprod Toxicol,2016,59:109-116.