不孕症是指一年或以上时间未采取任何避孕措施,性生活正常(每周两次及以上)而没有成功妊娠[1]。有15%的夫妇在育龄期会发生不孕不育,其中有50%为男性不育。其中,无精子症占男性不育原因的20%[2],包括梗阻性无精症(obstructive azoospermia, OA)和非梗阻性无精症(non-obstructive azoospermia,NOA)。OA患者可以通过附睾或睾丸外科取精获得精子,但NOA患者则失去了获得精子的机会。2011年Takuya Sato等提出了两种体外诱导精子发生的方法:一种是器官培养法,将新生小鼠睾丸组织撕成约1 mm3大小的组织块,置于1.5%琼脂糖凝胶上34℃、5%CO2培养箱中培养,获得精子并生育后代[3];另一种是从未成熟小鼠睾丸分离收集生殖干细胞,将其移植到受体睾丸组织,然后组织培养,获得单倍体精子细胞,采用显微受精技术获得可育后代[4]。本研究利用白消安对雄性小鼠的生殖毒性及在体修复作用建立不同损伤程度的NOA动物模型,为生精障碍睾丸组织器官培养提供稳定的研究对象,为临床治疗NOA提供理论支持。首先,本研究通过HE染色和Johnsen法评估生精细胞损伤程度。接着,通过免疫组化法对受损严重组的生精小管进一步定位,判断损伤组织减数分裂阶段,评估可供组织体外培养的研究时间。
一、材料与方法
1.实验动物:BALB/c小鼠为SPF级实验鼠,生产许可证号[SCXK-(军)2012-0004],使用许可证号[SYXK-(晋)2015-0001]。所用实验动物为6~8周龄性成熟的BALB/c雄性小鼠,共45只,平均体重约(27±3)g。
根据文献报道[5],采用NIH、ICR、BALB/c 3个品系的小鼠在35 mg/kg白消安以上3个剂量组(35mg/kg、40mg/kg、45mg/kg)获得无精子症模型动物。为了更客观的反应白消安的剂量、时间效应,本研究分0 mg/kg组、30 mg/kg组、40 mg/kg组,每组15只,共45只。30 mg/kg组每只小鼠单次腹腔注射30 mg/kg白消安;40 mg/kg组每只小鼠单次腹腔注射40 mg/kg白消安;0 mg/kg组每只单次腹腔注射1ml生理盐水。
2.主要试剂:白消安(Busulfan,B2635,Sigma,美国),二甲基亚砜(DMSO,D5879,Sigma,美国),PBS(P1022,索宝来,北京),鼠卵泡刺激素 ELISA试剂盒 (48-T,Mlbio,上海),鼠睾酮ELISA 试剂盒(48-T,Mlbio,上海)兔抗STRA8多克隆抗体(ab49602,Abcam,英国)、兔抗SCP3多克隆抗体(ab15093,Abcam,英国)、兔抗TNP1多克隆抗体(ab73135,Abcam,英国)等。
白消安溶液配制:取0.1 g白消安溶于10 mL DMSO溶液中,将10 mg/mL的白消安溶液分装于1.5 mL Eppendorf离心管中4℃避光保存备用,使用前用灭菌生理盐水稀释10倍(终浓度为1 mg/mL)。
二、实验方法
1.基本情况:注射白消安当天记为第0天,于注射白消安第2、4、6、8、10周分别取3只小鼠,记录体重、双侧睾丸湿重。
2.HE染色:睾丸组织10%甲醛固定,乙醇脱水,石蜡包埋,5μm厚切片,HE染色,在200倍显微镜下观察,采用 Johnsen法[6]评价精子发生障碍程度,即完好的精子发生为 10 分; 各级生精细胞存在,但排列紊乱为9分; 生精小管中有少量精子(5~10个)为8分; 无精子,但有许多精子细胞为7分; 无精子,仅有少量精子细胞(5~10个)为6分; 无精子, 但有许多精母细胞为5分:无精子细胞, 仅有个别精母细胞(<5个为4分);仅有精原细胞为3分;无生精细胞,仅有支持细胞为2分;管腔内无细胞为1分。
3.免疫组化:睾丸组织10%甲醛固定,乙醇脱水,石蜡包埋,5 μm厚切片,根据抗体说明书步骤完成免疫组化染片,通过Lecia Applaction Stiue图像系统分别取三个不同位置的平均光密度值进行统计分析。
三、统计学分析
数据经SPSS 17.0软件分析,数据服从正态检验,同一时间点白消安处理组与对照组相比用单因素方差分析,P<0.05表示差异有统计学意义。
结 果
一、小鼠基本情况
1.与0 mg/kg组相比,30 mg/kg组、40 mg/kg组小鼠在注射白消安后毛色暗淡无光,部分小鼠背部皮毛脱落明显,耳廓及唇部皮肤颜色与0 mg/kg组相比略显苍白,活动减少、慵懒状,进食量减少、饮水量增加。第4周时小鼠体貌特征改变最明显,直至实验结束,实验组小鼠仍没有完全恢复到正常小鼠生理状态。
2.体重与睾丸湿重:注射白消安第2周,30 mg/kg组、40 mg/kg组体重减低:40 mg/kg组体重下降趋势大于30 mg/kg组;第6~10周两组小鼠体重出现恢复,但40 mg/kg组恢复慢于30 mg/kg组。第2周后30 mg/kg组、40 mg/kg组睾丸湿重持续下降,且下降趋势明显,6周后睾丸湿重维持稳定,均明显低于0 mg/kg组,具有统计学意义(P<0.05),如图1所示。
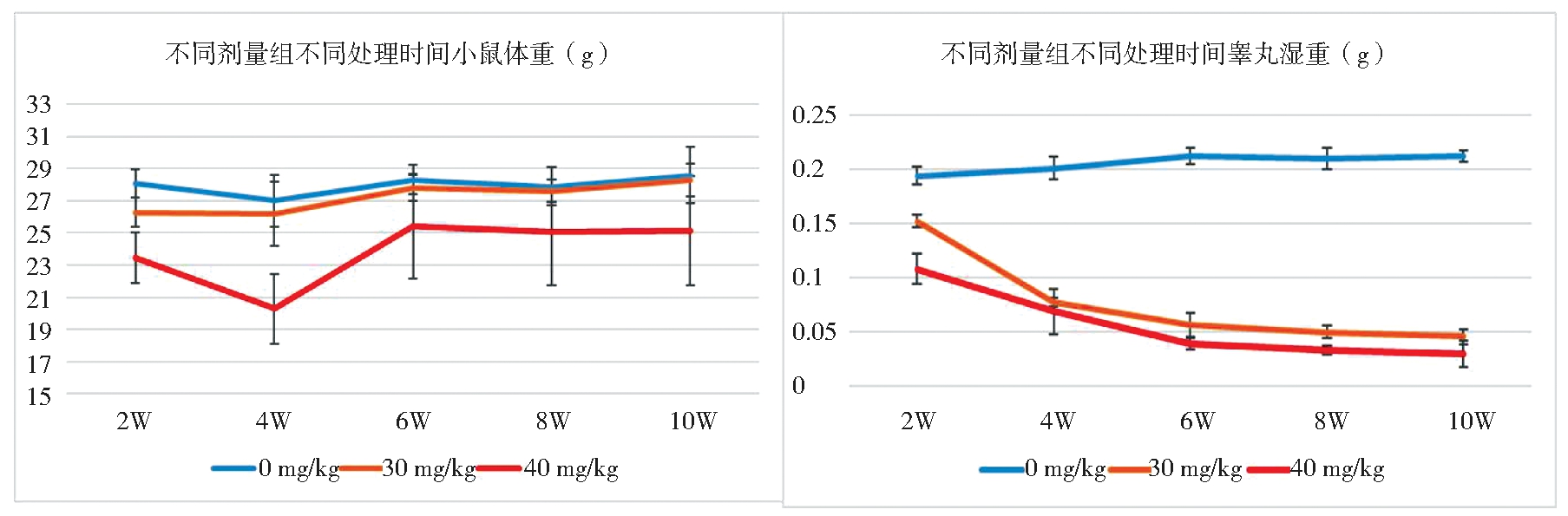
图1 白消安对小鼠体重、睾丸湿重的影响
Figure 1 The effect of busulfan on the body weight and wet testis weight of mice
二、HE染色
注射白消安第2周,生精小管中生精细胞出现断层样变化,第4周管腔空泡化改变,且40 mg/kg组损伤最为严重;第6周30 mg/kg组生精细胞开始恢复,个别生精小管出现精原细胞,而40 mg/kg组生精小管则基本均处于完全空泡化状态;第8~10周30 mg/kg组、40 mg/kg组极少部分生精小管出现精原细胞(如图2所示)。根据Johnsen评分标准,在200倍显微镜下分别对0 mg/kg组、30 mg/kg组、40 mg/kg组的50个曲细精管进行评分,评分越低生精小管损伤越严重,如表1所示。
表1 不同浓度白消安、不同时间点的Johnsen评分(n=50)
Table 1 Johnsen scores of different concentrations of busulfan and different time points (n=50)

Group2W4W6W8W10W0 mg/kg9.54±0.509.78±0.519.96±0.519.56±0.439.66±0.2330 mg/kg8.66±1.66∗3.84±1.74∗∗4.30±1.23∗3.82±1.04∗6.58±0.84∗40 mg/kg7.64±0.56∗2.66±1.30∗∗3.24±1.04∗3.54±1.27∗4.60±2.16∗
*P<0.05, **P<0.05

三、免疫组化
根据HE染色及Johnsen评分结果可知,40 mg/kg组损伤最严重且损伤持续时间最长,更适合作组织培养的动物模型。对其进行免疫组化检测,可得与0 mg/kg组相比,注射白消安4周40 mg/kg组中 STRA8、SCP3的表达最少,TNP1极少表达;6周后 STRA8、SCP3表达开始增加,8周基本接近0 mg/kg组水平,TNP1少量表达(如图3所示)。

图3 40mg/kg组不同时间段STRA8、SCP3和TNP1表达情况
Figure 3 Expression of STRA8, SCP3 and TNP1 in the 40mg/kg group at different time periods
讨 论
无精子症(azoospermia)是指射出的精液里没有精子,若要得出无精子症的诊断,精液检测应至少进行3次,每次间隔1周以上,所有精液标本离心后沉淀物中未见精子。NOA是曲细精管中,精子发生成熟障碍导致的无精子症,占无精子症的60%,是男性不育最严重的类型,主要依靠供精或保养获得后代[7-8]。本研究旨在建立一种稳定、可靠的生精功能障碍动物模型,为器官培养、细胞培养生精障碍睾丸组织提供稳定的动物模型。
常用的去除睾丸生精细胞的方法包括电离辐射、热处理、药物、激素处理以及基因敲除等。电离辐射可以造成各级的生精细胞凋亡,间质和支持细胞损伤,FSH、LH升高[9]。热处理主要损伤初级精母细胞[10],而激素法所制备无精子症动物模型耗时且不稳定[11]。截止当前,白消安常用来制作精原干细胞移植模型,但最佳浓度报道不一[12-13]。有研究报道,3个品系小鼠(NIH、ICR、BALB/c)在35 mg/kg白消安以上3个剂量组(35 mg/kg、40 mg/kg、45 mg/kg)造模成功,获得无精子症模型动物,且造模后 NIH 与ICR、BALB/c小鼠的外观体征表现明显不同,ICR 和BALB/c小鼠外观体征表现轻微[5]。因此,本研究选用BALB/c雄性小鼠单次腹腔注射30 mg/kg、40 mg/kg的白消安来建立生精功能障碍动物模型。
王德志[14]研究中,小于20 mg/kg的白消安不会造成BALB/c小鼠死亡, 30 mg/kg、40 mg/kg、50 mg/kg的死亡率可达到为6.5%、86.7%、100%。本研究过程中仅有40 mg/kg组中出现1只死亡,经统计学分析,P﹥0.05无差异学统计意义,这一结果与研究报道不符,其可能原因是种属间个体差异,导致了死亡率的差异,有待于大批量实验动物重复剂量组进行验证。
白消安在损伤生精细胞的同时,有较强的骨髓抑制作用 [15] ,可导致营养不良。本研究中白消安组第2、4、6、8、10周体重均低于对照组,且第2~4周40 mg/kg组体重下降趋势大于30 mg/kg组;第6~10周实验组小鼠体重出现恢复,但40 mg/kg组恢复慢于30 mg/kg组,此结果与文献报道一致。另外,在第2周取样时,肉眼观察发现白消安组睾丸体积小于同期生理盐水组睾丸体积;第4周时实验组小鼠睾丸体积减小二分之一;10周时实验组睾丸体积仍小于对照组,但30 mg/kg组恢复状态较40 mg/kg组好。这一结果表明白消安可以使睾丸发生萎缩,可能与其生殖毒性、骨髓抑制相关。
白消安作为一种烷化剂,是一种强化疗药,主要通过损伤DNA链来抑制细胞分裂,但不影响DNA的合成[16-17]。因此,具有高度分裂的器官、组织、细胞更易受到白消安毒性的影响,例如睾丸、生精细胞[18]。在精子发生过程中,二倍体生殖细胞经过减数分裂过程分化为圆形单倍体精子细胞。所以,白消安的细胞毒性可以使小鼠的生精细胞减数分裂过程阻滞,当白消安对处于G1期的细胞产生毒性后,将抑制下一阶段的有丝分裂[19-20]。本研究中注射白消安2周模型鼠睾丸组织HE染色后观察到生精细胞有断裂现象,4周时30 mg/kg组、40 mg/kg组生精小管基本都处于空泡化程度,说明生精细胞减数分裂过程被抑制,与报道一致。由于临床常见的非梗阻性无精子症患者中,部分睾丸组织仍有生精功能,因此本研究通过Johnson评分标准对各阶段模型小鼠进行生精功能判定,选择评分为3~5分时间段的动物为疾病模型,作为睾丸组织体外培养研究对象。
STRA8在动物生殖细胞由有丝分裂转变为减数分裂前特异表达,其阳性表达常预示着生殖细胞减数分裂启动,SCP3是联会复合体的重要组件,在减数分裂的过程中起着重要作用,可作为初级精母细胞的标记蛋白,TNP1是精子细胞特异性基因,主要在精子细胞变形阶段表达,标志生殖细胞进入减数分裂后期。经白消安处理后,40 mg/kg组4~8周可分别模拟临床上不同损伤程度的NOA患者,在睾丸组织中相关标志物STRA8、SCP3、TNP1水平结合组织学变化,可以清晰的分辨生精功能阻滞在某一阶段,更有利于评价体外培养用睾丸组织的培养效果。研究人员不断探索寻找体外诱导精子发生的途径,主要方式为细胞培养法及器官培养法,但精子发生是一个涉及细胞增殖和分化的复杂过程,需要睾丸组织的特定微环境,尤其是支持细胞[21],因此推断器官培养法比细胞培养法更有利于诱导精子体外发生[22]。Sato T. 等利用琼脂糖凝胶培养法分别将胎鼠睾丸组织、新生鼠睾丸组织和成熟鼠睾丸组织进行体外培养,发现减数分裂后标志物精子头粒蛋白ACROSIN和成熟精子标志物GSG2均显著上调表达,证实小鼠睾丸组织中的精原细胞能够被诱导分化成精子[23-25]。因此,建立稳定且明确阻滞阶段的NOA疾病动物模型,对体外诱导精子发生十分有意义。
综上所述,利用白消安建立BALB/c生精功能障碍动物模型可操作性强、效果稳定、阻滞阶段明确、模型动物存活率高,且以单次腹腔注射40mg/kg组周期短、损伤久、效果佳。
(图2见封底)
1 Pfeifer S,Goldberg J,Lobo R,et al.Definitions of infertility and recurrent pregnancy loss:a committee opinion.Fertil steril,2013,99:63.
2 Harton GL,Tempest HG.Chromosomal disorders and male infertility.Asian J Androl,2012:32-39.
3 Sato T,Katagiri K,Gohbara A,et al.In vitro production of functional sperm in cultured neonatal mouse testes.Nature,2011,24:504-507.
4 Sato T,Katagiri K,Yokonishi T,et al.In vitro production of fertile sperm from murine spermatogonial stem cell lines.Nat Commun,2011,2:1.
5 暴国,王尚明,张长勇,等.三个品系小鼠白消安无精子症模型的比较.生殖医学杂志,2015,24:663-665.
6 Johnsen SG.Testicular biopsy score count-a method for registration of spermatogenesis in human testes:normal values and results in 335 hypogonadal males.Horm,1970,1:2-25.
7 Fogle RH,Steiner AZ,Marshall FE,et al.Etiology of azoospermia in a large nonreferral inner-city population.Fertil Steril,2006,86:197-199.
8 Jarow JP,Espeland MA,Lipshultz LI.Evaluation of the azoospermic patient.J Urol,1989,142:62-65.
9 葛勇,张家庆,麦智广.放射损伤的内分泌改变.国外医学·放射医学·核医学分册,1992,16:152-157.
10 许多,秦达念,王勇,等.大鼠睾丸局部热作用对生精细胞凋亡的影响.中华男科学杂志,2003,9:170-174.
11 黄勋彬,李红钢.小鼠无精子症动物模型的构建,中华男科学杂志,2007,13:147-149.
12 Shinohara T,Orwig KE,Avarbock MR,et al.Germ line stem cell competition in postnatal mouse testes.Biol Reprod,2002,66:1491-1497.
13 Brinster CJ,Ryu BY,Avarbock MR,et al.Restoration of fertility by germ cell transplantation requires effective recipient preparation.Biol Reprod,2003,69:412-420.
14 王德志.白消安对雄性小鼠生精、性行为和不育影响的研究.武汉大学,2014.
15 Bucci LR,Meistrich ML.Effects of busulfan on murine spermatogenesis:cytotoxicity,sterility,sperm abnormalities,and dominant lethal mutations.Mutation Res,1987,176:259-268.
16 Iwamoto T,Hiraku Y,Oikawa S,et al.DNA intrastrand cross-link at the 5′-GA-3′ sequence formed by busulfan and its role in the cytotoxic effect.Cancer Sci,2004,95:454-458.
17 Panahi M,Keshavarz S,Rahmanifar F,et al.Busulfan induced azoospermia:Stereological evaluation of testes in rat.Vet Res Forum,2015,6:273-278.
18 Dun MD,Aitken RJ,Nixon B.The role of molecular chaperones in spermatogenesis and the post-testicular maturation of mammalian spermatozoa.Hum Reprod Update,2012,18:420-435.
19 De Rooij DG,Vergouwen RP.The estimation of damage to testicular cell lineages.Prog Clin Biol Res,1991,372:467-80.
20 Griswold MD.The central role of Sertoli cells in spermatogenesis.Semin Cell Dev Biol,1998,9:411-416.
21 Russell LD,Ettlin RA,Hikim APS,et al.Histological and Histopathological Evaluation of the Testis.Int J Androl,2010,16:83-83.
22 Reuter K,Schlatt S,Ehmcke J,et al.Fact or fiction:In vitro spermatogenesis.Spermatogenesis,2012,2:245-252.
23 Sato T,Katagiri K,Kubota Y,et al.In vitro sperm production from mouse spermatogonial stem cell lines using an organ culture method.Nat Protoc,2013,8:2098-2104.
24 Sato T,Katagiri K,Kojima K,et al.In Vitro Spermatogenesis in Explanted Adult Mouse Testis Tissues.PLoS One,2015,10:e0130171.
25 Kojima K,Sato T,Naruse Y,et al.Spermatogenesis in Explanted Fetal Mouse Testis Tissues.Biol Reprod,2016,95:63.