坏死性小肠结肠炎(NEC)是一种早产儿疾病,死亡率约在20%~40%[1]。近年来,尽管早产儿的护理取得了进展,但NEC的总体发病率和死亡率并没有显著下降。一般来说,NEC是由于新生儿肠道屏障和免疫系统不成熟导致细菌入侵和过度炎症而引起的[2]。因此,已有许多研究评估了能够建立靶向未成熟肠屏障以预防或治愈NEC的有效疗法[3-4]。众所周知,维生素A对维持身体健康至关重要,尤其对于视觉系统和上皮组织的发育有很大帮助。研究发现维生素A不仅有助于正常代谢、抗感染,还能增强免疫力[5]。据报道,新生儿易患维生素A缺乏症,这可能是导致新生儿肠道屏障不成熟和诱发NEC的重要因素[6]。为了进一步探讨维生素A和NEC之间的关系,本研究比较了NEC和非NEC新生儿的血清维生素A水平,旨在为预防和治疗NEC提供理论支持。
对象与方法
1.研究对象:2016年1月至2018年6月期间共有396名早产儿(≤36周胎龄)入住本院新生儿重症监护室,参加了这项前瞻性研究。排除标准为:父母拒绝参与,以及诊断为自发性肠穿孔、严重先天畸形和染色体异常的婴儿。研究方案经本院伦理委员会批准。所有婴儿家长均签署知情同意书。
2.NEC诊断:NEC根据临床和影像学检查结果进行诊断,并根据改良的Bell标准进行分类。在NEC病例中,前48 h每隔6 h重复一次腹部X光片,随后在随访期间减少为24 h一次,直到停止NEC抗菌治疗[7]。腹部X光片结果由同一儿科放射科医师评估。根据改良Bell标准和放射学检查结果进行分类:NECⅠ期包括肠扩张或轻度肠梗阻;NECⅡ期为伴有或不伴有腹水的肠扩张、肠梗阻和肠道积气;NECⅢ期为气腹。NEC的临床症状包括腹部肿胀或压痛、血便、胃残余物、血性或胆汁性胃吸引物、呕吐、喂养不耐受、肠音缺失或降低、腹壁红斑。诊断为NEC的婴儿接受适当的抗生素和支持疗法,如胃减压、机械通气或用血液制品扩容支持。
3.数据收集:记录母亲的人口统计学特征,包括年龄、教育程度和患病情况。记录所有新生儿的胎龄、出生体重、性别、分娩方式、Apgar评分。从每个新生儿身上采集静脉血样进行常规检查。离心后分离血清,并将血清样品收集在无菌管中,置于80 ℃冷冻至测定。采用LC-20AT型高效液相色谱系统(日本京都岛津科学仪器公司生产)测定维生素A的含量。
4.数据处理:使用SPSS 21.0软件处理数据。分类变量汇总为计数和百分比,而连续变量表示为![]() 呈正态分布的连续变量采用t检验进行组间比较;而采用χ2检验对分类变量进行比较。通过Logistic回归模型评估新生儿维生素A水平对NEC的影响,该回归模型已针对以下变量进行了调整:绒毛膜羊膜炎、早产胎膜早破和母亲先兆子痫、新生儿胎龄和出生体重、动脉导管未闭及脓毒症、全氧治疗持续时间、机械通气及持续气道正压通气持续时间。P<0.05认为差异具有统计学意义。
呈正态分布的连续变量采用t检验进行组间比较;而采用χ2检验对分类变量进行比较。通过Logistic回归模型评估新生儿维生素A水平对NEC的影响,该回归模型已针对以下变量进行了调整:绒毛膜羊膜炎、早产胎膜早破和母亲先兆子痫、新生儿胎龄和出生体重、动脉导管未闭及脓毒症、全氧治疗持续时间、机械通气及持续气道正压通气持续时间。P<0.05认为差异具有统计学意义。
结果
1.人口统计学特征:在入选的396例早产儿中,39例出现NEC,患病率为9.8%。NEC发病年龄为(3~29)d,平均年龄为(11.1±6.5)d。在NEC患者中,27名(69.2%)和11名(28.2%)婴儿分别出现了ⅡA和ⅡB阶段的NEC,只有1名患者(2.6%)出现NEC Ⅲ期。表1总结了NEC组和非NEC组的人口学特征。与非NEC组相比,NEC组的胎龄和出生体重明显降低(P<0.05),并且NEC组的机械通气持续时间、补充氧治疗总持续时间、住院时间以及诊断动脉导管未闭、脑室内出血、早产儿视网膜病变和支气管肺发育不良的患者人数显著增加(P<0.05)。此外,两组在母亲年龄、母亲教育状况和母亲患病率方面无显著差异(P>0.05)。
表1 研究组的人口统计学特征
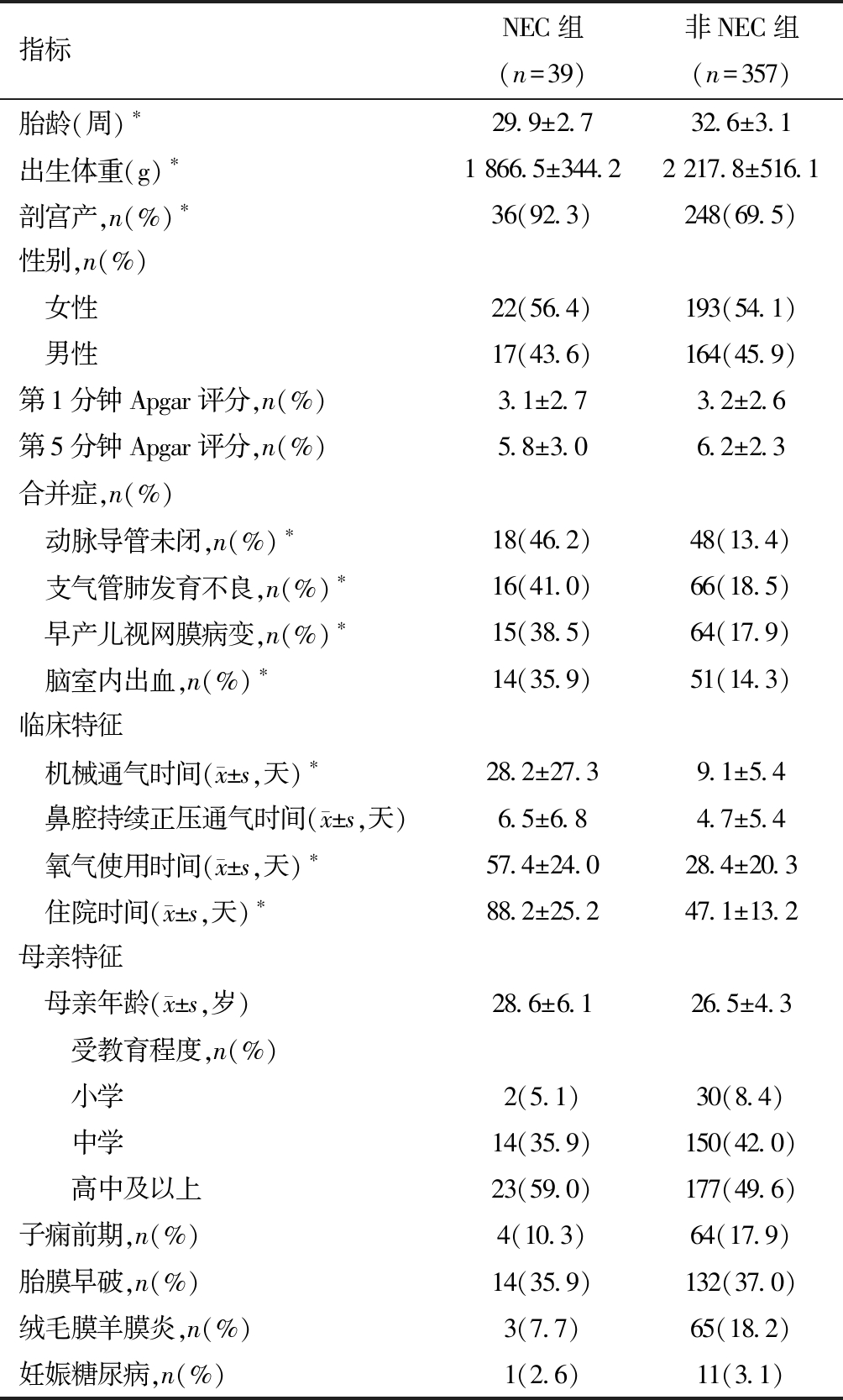
指标NEC组(n=39)非NEC组(n=357)胎龄(周)∗29.9±2.732.6±3.1出生体重(g)∗1 866.5±344.22 217.8±516.1剖宫产,n(%)∗36(92.3)248(69.5)性别,n(%) 女性22(56.4)193(54.1) 男性17(43.6)164(45.9)第1分钟Apgar评分,n(%)3.1±2.73.2±2.6第5分钟Apgar评分,n(%)5.8±3.06.2±2.3合并症,n(%) 动脉导管未闭,n(%)∗18(46.2)48(13.4) 支气管肺发育不良,n(%)∗16(41.0)66(18.5) 早产儿视网膜病变,n(%)∗15(38.5)64(17.9) 脑室内出血,n(%)∗14(35.9)51(14.3)临床特征 机械通气时间(x±s,天)∗28.2±27.39.1±5.4 鼻腔持续正压通气时间(x±s,天)6.5±6.84.7±5.4 氧气使用时间(x±s,天)∗57.4±24.028.4±20.3 住院时间(x±s,天)∗88.2±25.247.1±13.2母亲特征 母亲年龄(x±s,岁)28.6±6.126.5±4.3 受教育程度,n(%) 小学2(5.1)30(8.4) 中学14(35.9)150(42.0) 高中及以上23(59.0)177(49.6)子痫前期,n(%)4(10.3)64(17.9)胎膜早破,n(%)14(35.9)132(37.0)绒毛膜羊膜炎,n(%)3(7.7)65(18.2)妊娠糖尿病,n(%)1(2.6)11(3.1)
两组比较,*P<0.01
2.新生儿维生素A水平:与非NEC组相比,NEC组新生儿的维生素A水平明显降低(P<0.05),并且NEC组中维生素A水平正常(>0.3 mg/L)和缺乏(0.2~0.3 mg/L)的比例显著降低(P<0.05),而重度缺乏(<0.2 mg/L)的比例显著升高(P<0.05)(表2)。
表2 新生儿维生素A水平

组别维生素A水平(x±s,mg/L)∗维生素A水平正常(>0.3 mg/L)∗维生素A水平缺乏(0.2~0.3 mg/L)∗维生素A水平重度缺乏(<0.2 mg/L)∗NEC组(n=39)0.19±0.052(5.1)14(35.9)23(59.0)非NEC组(n=357)0.42±0.13104(29.1)197(55.2)56(15.7)
两组比较,*P<0.01
3.NEC的危险因素分析:在多因素Logistic回归分析中,分析母亲年龄、供氧时间和新生儿维生素A水平对NEC的发展有影响。每增加1 d的氧气补充,NEC的风险增加0.056倍(OR:1.056,95%CI:1.007~1.094,P=0.022);鼻腔持续正压通气治疗天数每增加1 d,风险降低19.5%(OR:0.805,95%CI:0.664~0.976);母亲年龄每增加1岁,NEC的风险增加0.145倍(OR:1.145,95%CI:1.005~1.304);新生儿维生素A水平每增加0.1 mg/L,NEC风险降低14.2%(OR:0.858,95%CI:0.765~0.962)(表3)。
表3 单因素和多因素回归分析结果
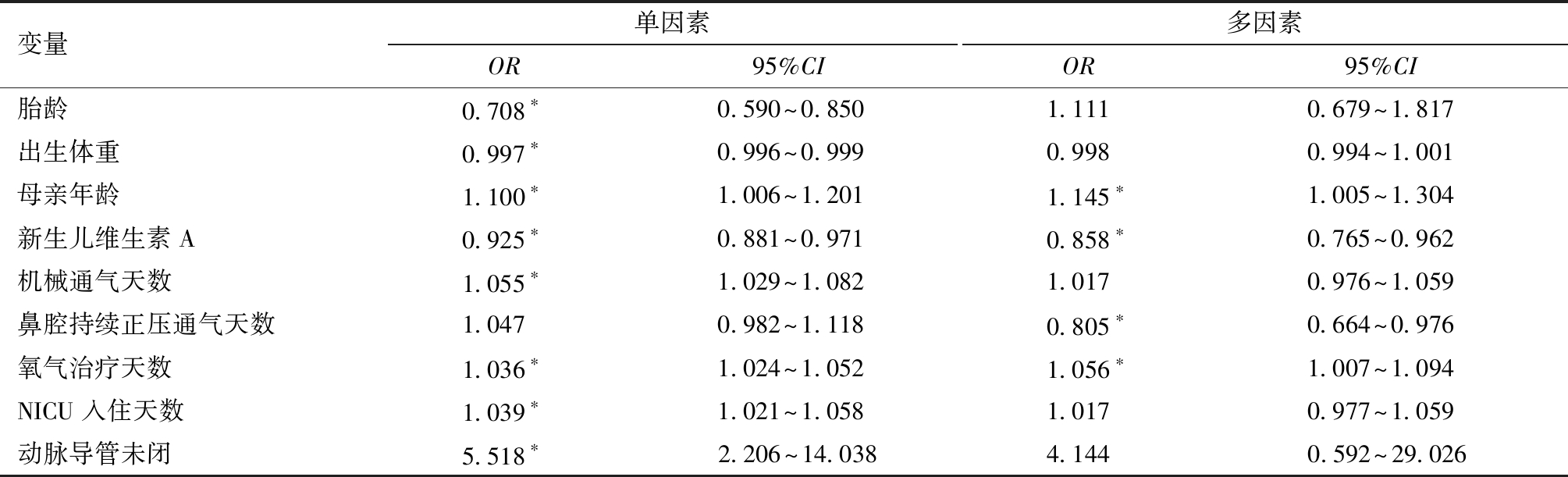
变量单因素OR95%CI多因素OR95%CI胎龄0.708∗0.590~0.8501.1110.679~1.817出生体重0.997∗0.996~0.9990.9980.994~1.001母亲年龄1.100∗1.006~1.2011.145∗1.005~1.304新生儿维生素A0.925∗0.881~0.9710.858∗0.765~0.962机械通气天数1.055∗1.029~1.0821.0170.976~1.059鼻腔持续正压通气天数1.0470.982~1.1180.805∗0.664~0.976氧气治疗天数1.036∗1.024~1.0521.056∗1.007~1.094NICU入住天数1.039∗1.021~1.0581.0170.977~1.059动脉导管未闭5.518∗2.206~14.0384.1440.592~29.026
*P<0.01
讨论
NEC是新生儿的一种严重急性肠道疾病。NEC的危险因素包括微生物群的改变、不成熟的肠屏障功能和肠缺氧/缺血[8]。由于各种因素的参与,构成NEC病理生理学基础的分子机制仍不完整[9]。炎症是NEC的重要潜在原因,尽管NEC的发病机制尚不明确,但强有力的证据,如NEC患者的血浆和肠道组织中细胞因子水平升高、产前使用糖皮质激素可以降低NEC的发病率、肠细胞发育调节因子IL-17生成等,都是表明NEC过度炎症的原因[10-11]。此外,异常肠道细菌定植减少有益的共生菌群和增加的病原菌可能使早产儿易患NEC[7]。这种异常的肠道菌群主要由革兰氏阴性细菌组成,它们的外膜上含有脂多糖(LPS或内毒素),是炎症级联反应的一种有效触发因素;与TLR-4结合后的LPS激活NF-κB转录基因,进而促进释放炎症因子,如IL-1、IL-6、IL-8、肿瘤坏死因子-α和干扰素[12]。在炎症过程中,TJ蛋白的表达和定位也被破坏,导致肠道通透性增大和细菌易位[10]。因此,在一个不成熟的免疫系统,不完善的胃肠道粘膜屏障,和异常的肠道定植的内环境中易导致进行性炎症和细菌入侵,出现肠道坏死。在本研究中,NEC患者的维生素A水平低于非NEC患者。Xiao等[13]研究发现维生素A及其体内代谢产物维甲酸通过降低炎症因子的表达来增强NEC小鼠模型的肠上皮屏障,并且维生素A具有调节肠道微生物的能力。因此,NEC的发生可能与维生素A的缺乏密切相关。
维生素A是一种脂溶性的醇类物质,除其在维持正常视觉功能和维护上皮组织细胞完整的关键作用外,还具有重要的免疫调节和抗炎作用[14]。维生素A可参与免疫球蛋白的合成,这对于上皮的正常形成与发育十分重要[15]。在一项纳入多项研究的综述中,作者总结了维生素A对免疫细胞炎症特征的影响机制,包括:(1)维生素A降低了TLR-2和TLR-4的蛋白表达;(2)维生素A可以抑制NF-κB激活,从而降低肿瘤坏死因子-α、IL-6、IL-1β等细胞因子的转录;(3)维生素A的激活可以促进细胞内谷胱甘肽水平的提高,从而减少过量的活性氧物质的产生[16]。此外,如上所述,肠道屏障缺陷是NEC和炎症性肠道炎症发生和传播的重要因素。据报道,活性维生素A可上调TJ蛋白,从而保护肠道屏障[13]。最近的研究表明,在临床相关浓度下,脂多糖通过下调TJ蛋白水平导致肠屏障功能障碍,而活性维生素A能减弱脂多糖诱导的TJ蛋白的下调和再分布[17-18]。他们的研究为维生素A在脂类相关肠道疾病(如NEC和炎症性肠道疾病)的临床应用提供了证据。
鉴于支持证据表明维生素A在维持肠道内的平衡中起着非常重要的作用,本研究旨在分析早产儿血清维生素A水平与NEC发展之间是否存在关联,研究结果显示,与非NEC新生儿相比,NEC新生儿的维生素A水平显著降低,且NEC组新生儿的维生素A水平均不在足量范围内,即<0.3 mg/L。在NEC组中,维生素A水平在严重缺乏量范围内的新生儿百分比明显较高;而在非NEC组中,维生素A含量在足量范围内的新生儿比例明显较高,但仍然有15.7%新生儿的维生素A水平<0.2 mg/L。上述现象表明,维生素A缺乏在早产儿中较为常见,尤其是患NEC的早产儿。进一步多因素分析结果显示,新生儿维生素A水平每增加0.1 mg/L,NEC风险降低0.86倍。因此,血清维生素A水平的降低可能会加重NEC新生儿的病情,并增加死亡的风险。这些结果提供了关于疾病严重性的警告,并且可能在疾病进展中起促进作用,从而影响NEC新生儿的预后。另外,根据本研究结果,将维生素A水平与母亲年龄、供氧时间和鼻腔持续正压通气治疗天数相结合,可能有助于评估NEC的状况,从而制定出相应的干预措施。
总之,新生儿维生素A水平降低与NEC发展之间存在密切关系,低水平的维生素A不能为防止NEC对肠上皮屏障的损害提供足够的保护。鉴于维生素A在维持肠道内环境的平衡中起着至关重要的作用,补充维生素A可能是治疗或预防新生儿NEC的有效辅助疗法,当然这一结论还应该得到更多样本量的研究支持。
1 刘利,李秋宇,安瑶,等.早产与足月新生儿坏死性小肠结肠炎临床对比分析.重庆医科大学学报,2017,42:92-96.
2 Palleri E,Kaiser S,Wester T,et al.Complex fluid collection on abdominal ultrasound indicates need for surgery in neonates with necrotizing enterocolitis.Eur J Pediatr Surg,2017,27:161-165.
3 Ferretti E,Tremblay E,Thibault MP,et al.The nitric oxide synthase 2 pathway is targeted by both pro- and anti-inflammatory treatments in the immature human intestine.Nitric Oxide,2017,66:53-61.
4 Blackwood BP,Wood DR,Yuan C,et al.A role forcAMP and protein kinase a in experimental necrotizing enterocolitis.Am J Pathol,2017,187:401-417.
5 Konstantyner T,Warkentin S,Taddei JA.Prevalence and determinants of vitamin a deficiency among Brazilian children under 2 years of age from the 2006 National Demographic Health Survey.Food Nutr Bull,2014,35:422-430.
6 陶恩福,袁天明.维生素A水平与早产儿疾病.中国当代儿科杂志,2016,18:177-182.
7 郭城,张琳.益生菌在新生儿坏死性小肠结肠炎中的应用.中国实用儿科杂志,2017,32:120-125.
8 Rozé JC,Ancel PY,Lepage P,et al.Nutritional strategies and gut microbiota composition as risk factors for necrotizing enterocolitis in very-preterm infants.Am J Clin Nutr,2017,106:821-830.
9 Lee JY,Park KH,Kim A,et al.Maternal and placental risk factors for developing necrotizingenterocolitis in very preterm infants.Pediatr Neonatol,2017,58:57-62.
10 侯阿娜,李雪,富建华.新生儿坏死性小肠结肠炎76例高危因素分析.中国实用儿科杂志,2017,32:611-614.
11 Tian J,Liu Y,Jiang Y,et al.Association of single nucleotide polymorphisms of IL23R and IL17 with necrotizingenterocolitis in premature infants.Mol Cell Biochem,2017,430:201-209.
12 Hou Y,Lu X,Zhang Y.IRAK inhibitor protects the intestinal tract of necrotizing enterocolitis by inhibiting the toll-like receptor (TLR) inflammatory signaling pathway in rats.Med Sci Monit,2018,24:3366-3373.
13 Xiao S,Li Q,Hu K,et al.Vitamin a and retinoic acid exhibit protective effects on necrotizingenterocolitis by regulating intestinal flora and enhancing the intestinal?.Epithelial Barrier.Arch Med Res,2018,49:1-9.
14 任红立,汪晶晶,金三俊,等.维生素A对机体免疫系统的影响.黑龙江畜牧兽医,2017,9:226-229.
15 肖露,崔婷,李莹莹,等.孕期开始的持续维生素A缺乏加重LPS诱导的仔鼠肠上皮屏障功能障碍.免疫学杂志,2017,10:837-843.
16 Fabisiak N,Fabisiak A,Watala C,et al.Fat-soluble vitamin deficiencies and inflammatory bowel disease:systematic review and Meta-Analysis.J Clin Gastroenterol,2017,51:878-889.
17 Mezaki Y,Fujimi T J,Senoo H,et al.The coordinated action of lecithin:retinol acyltransferase and cellular retinol-binding proteins for regulation of vitamin A esterification.Med Hypotheses,2016,88:60-62.
18 He C,Deng J,Hu X,et al.Vitamin a inhibits the action of LPS on the intestinal epithelial barrier function and tight junction proteins.FoodFunct,2019,10:1235-1242.