近年来,超重和肥胖女性中不孕症的发病率呈上升趋势,约有1/7的不孕夫妇被认为与肥胖直接或间接相关[1],越来越多的肥胖不孕患者寻求体外受精(in vitro fertilization,IVF)助孕。目前,国内外对于肥胖是否影响IVF助孕结局仍存在争议,Sarais等[1]对1 602例新鲜周期IVF助孕的女性研究发现,与体重正常女性相比,超重患者的不孕持续时间更长,但认为不同体重指数(body mass index,BMI)组间临床妊娠率没有差异。但最近一项荟萃分析[2]显示,与正常BMI妇女相比,超重或者肥胖妇女进行IVF助孕,其临床妊娠率及活产率均降低,流产率增加。BMI与IVF助孕的相关性研究目前主要集中于卵巢正常反应或者多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者,关于卵巢其他反应性的文献较少,本文回顾性分析了IVF助孕中BMI对不同卵巢反应性女性助孕结局的影响。
对象与方法
一、对象
收集2014—2018年在山西医科大学第一医院生殖遗传科首次进行IVF 助孕并新鲜移植患者1 712例,所有患者均采用黄体期长方案。纳入标准包括输卵管因素、排卵障碍及不明原因不孕。排除标准包括合并男方因素、子宫内膜异位症、子宫内膜息肉、子宫瘢痕、子宫肌瘤、子宫腺肌症、宫颈病变、生殖道畸形、卵巢手术史、合并严重的内分泌疾病(甲状腺、肾上腺功能异常)及资料不全者等。
由于卵巢反应性可能会对助孕结局产生影响,依据《辅助生殖技术临床关键指标质控专家共识》[3],将所有研究对象分为3组,即卵巢低反应组(150 例)、卵巢正常反应组(775 例)、卵巢高反应组(787 例)。参考BMI亚洲标准[4]再将每组病例依据BMI不同分为4个亚组,即低体重组(BMI<18.5 kg/m2)、正常体重组(18.5 kg/m2≤~<24 kg/m2 )、超重组(24 kg/m2≤~<28 kg/m2 )、肥胖组(BMI≥28 kg/m2 )。在不孕患者中,有相当一部分人群是PCOS患者,鉴于此,本研究结合2003年鹿特丹诊断标准及2011年中国PCOS行业诊断标准[5],将符合诊断标准的研究对象以PCOS亚组(423 例)再单独进行分析。考虑患者的年龄可能会对结果产生影响,本研究将所有研究对象分为活产组(474例)和非活产组(814例),分析年龄与新鲜周期活产率之间是否相关性。
二、方法
1.促排卵方案:入组研究对象均采用黄体期长方案促排,在黄体高峰期根据患者年龄、卵巢储备功能给予酸曲普瑞林(达菲林,益普生生物技术公司,法国)肌注1.5 ~1.6 mg,月经第3 天抽血,当FSH<5 IU/L、LH<5 IU/L、E2<50 ng/L、内膜<5 mm,无功能性卵巢囊肿时,依据患者年龄、基础窦卵泡数、基础FSH水平和BMI综合决定卵巢刺激的起始剂量,阴道超声监测卵泡数量、直径,并定期测定血LH、E2、P水平适时调整剂量。有1个卵泡直径达18 mm或3 个卵泡直径达17 mm时,当晚肌注人绒毛膜促性腺激素(hCG,珠海丽珠医药)6 000~10 000 IU扳机,36~38 h后行阴道超声引导下穿刺取卵手术,取卵当日丈夫留精,体外培养。
取卵后72 h根据胚胎情况及患者身体情况行新鲜胚胎移植术,依据伊斯坦布尔共识[5]胚胎评分标准,至少移植一枚优质胚胎,移植术后给予黄体支持。
2.妊娠结局:移植后14 d化验血hCG,当hCG>10 IU/L时确定生化妊娠;移植后28 d行阴道超声显示有宫内妊娠囊或者异位妊娠者确定为临床妊娠;临床妊娠≤12周的自然流产以及由于胚胎停止发育进行的医源性、治疗性人工流产为早期流产。
3.观察指标:观察年龄、孕产次、不孕年限、不孕原因、不孕类型、bFSH、bLH、bAFC,Gn起始剂量、使用天数、Gn总剂量、获卵数、受精率、2PN、卵裂数、MII卵数、可利用胚胎数、优质胚胎数、移植胚胎数,临床妊娠率、胚胎着床率、活产率、早期流产率、中晚期流产率、宫外孕率、剖宫产率、生化妊娠率、分娩孕周及新生儿出生体重等指标。因本研究卵巢过度刺激征(OHSS)发生例数较少,故本文未对其进行阐述。
4.统计学处理:采用SPSS 21.0对数据进行统计分析。计量资料均采用均数±标准差表示,正态分布数据组间比较采用单因素方差分析,进一步采用LSD法对各组间有统计学意义的指标进行两两比较。不符合正态分布的数据均采用Kruskal-Wallis H检验对各组间数据进行两两比较,进一步采用Nemenyi法对各组间有统计学意义的指标进行两两比较。分类计数资料均采用例数(百分比)表示,无序分类资料组间比较采用χ2比较;有序分类资料组间比较采用Kruskal-Wallis H检验。检验水准均为P <0.05表示差异有统计学意义。
结 果
一、一般资料分析
在卵巢低反应组中,超重组bLH水平低于正常组;在卵巢正常反应组中, 肥胖组不孕年限最长,超重组和肥胖组bFSH、bLH均低于正常体重组,肥胖组bAFC最多;在卵巢高反应组中,肥胖组不孕年限最长;在PCOS组,肥胖组不孕年限最长;以上差异均有统计学意义,各组年龄、孕产次、不孕类型、不孕原因等指标差异均无统计学意义。
二、卵巢低反应组患者不同BMI助孕结局比较
卵巢低反应性组共150 例,其中低体重组6 例(4.0%),正常体重组85 例(56.7%),超重组41 例(27.3%),肥胖组18 例(12.0%)。与其余三组相比,肥胖组Gn起始剂量、Gn总剂量最多,与正常体重组及超重组相比,肥胖组使用天数最长,差异均有统计学意义(P<0.05)。正常体重组胚胎着床率、临床妊娠率、活产率较低体重组或肥胖组有升高趋势,但差异无统计学意义。各组间获卵数、卵裂数、MII卵数、2PN数、受精率、可利用胚胎数、优质胚胎数、移植胚胎数、孕周、新生儿出生体重、早期流产率、中晚期流产率、异位妊娠率、生化妊娠率、周期取消率差异均无统计学意义。见表1。
表1 卵巢低反应性患者不同BMI组助孕结局比较
Table 1 Summary of assisted pregnancy outcomes by different BMI groups in patients with ovarian hyporesponsiveness

GroupInitialdoseofGn(IU)Usagedays(d)TotaldoseofGn(IU)Numberofeggsretrieved(N)FertilizationrateCleavage(N)MII(N)Lowweight206.25±31.3711.50±2.072670.83±1227.133.00±1.410.38±0.421.50±1.383.00±1.55Normal263.82±59.70a12.46±3.063618.53±1270.683.76±1.270.29±0.312.14±1.373.74±1.79Overweight267.99±77.56a12.83±3.683740.85±1425.513.46±1.290.28±0.321.63±1.303.32±1.21Obesity329.17±50.18abc16.67±6.57abc4445.83±2069.98ab3.11±1.230.44±0.431.61±1.203.17±1.47Group2PN(N)Numberofavailableembryos(N)Numberofhighqualityembryos(N)Numberoftransferredembryos(N)ClinicalpregnancyratePositiverate(%)Positive(N)Total(N)ImplantationratePositiverate(%)Positive(N)Total(N)LivebirthratePositiverate(%)Positive(N)Total(N)Gestationalage(weeks)Lowweight1.33±1.212.5±1.381.67±1.861.33±1.2125.01412.51825.01438.0±0.0Normal2.56±3.783.18±1.591.66±1.481.4±0.8341.8286728.63411935.8246735.9±3.08Overweight1.8±1.272.63±1.141.41±1.201.34±0.9730.3103319.3115724.283335.8±1.24Obesity1.67±1.142.5±1.380.83±0.861.33±0.8421.431412.532421.431434.0±2.65GroupNeonatalweight(g)≤25002500~4000≥4000EarlyabortionratePositiverate(%)Positive(N)Total(N)LateabortionratePositiverate(%)Positive(N)Total(N)EctopicpregnancyratePositiverate(%)Positive(N)Total(N)CesareansectionratePositiverate(%)Positive(N)Total(N)BiochemicalpregnancyratePositiverate(%)Positive(N)Total(N)CyclecancellationratePositiverate(%)Positive(N)Total(N)Lowweight01(100.0)0001001001100.01100433.326Normal2(8.3)20(83.3)2(8.3)3.61280028002841.710243.026721.21885Overweight1(12.5)7(87.5)010.01100010001075.0686.123319.5841Obesity02(66.7)1(33.3)00300300366.723001422.2418
aCompared with low weight, bCompared with normal, CCompared with overweight, abcP<0.05
三、卵巢正常反应组患者不同BMI助孕结局比较
卵巢正常反应组共计775 例,其中低体重组47例(6.0%),正常体重组436 例(56.3%),超重组223 例(28.8%),肥胖组69 例(8.9%)。正常体重组胚胎着床率最高,肥胖组次之,低体重组最低,差异有统计学意义。正常体重组临床妊娠率、活产率较低体重组及肥胖组有升高趋势,差异无统计学意义。各组间获卵数、受精率、卵裂数、MII卵数、2PN数、可利用胚胎数、优质胚胎数、移植胚胎数、孕周、新生儿出生体重、早期流产率、中晚期流产率、异位妊娠率、生化妊娠率、周期取消率差异均无统计学意义。见表2。
表2 卵巢正常反应性患者不同BMI组助孕结局比较
Table 2 Summary of assisted pregnancy outcomes by different BMI groups in patients with normal ovarian response

GroupInitialdoseofGn(IU)Usagedays(d)TotaldoseofGn(IU)Numberofeggsretrieved(N)FertilizationrateCleavage(N)MII(N)Lowweight232.18±47.9711.17±1.902822.87±716.7410.83±3.290.56±0.387.43±4.09.26±3.31Normal235.78±57.4011.81±2.233084.95±1632.1710.94±2.790.63±0.417.31±3.49.95±3.06Overweight234.30±53.9212.67±3.6ab3241.42±1255.610.57±2.610.59±0.376.97±3.49.76±2.96Obesity236.96±62.1815.29±5.64abc4044.93±1498.75abc10.61±2.500.60±0.346.99±3.059.81±2.55Group2PN(N)Numberofavailableembryos(N)Numberofhighqualityembryos(N)Numberoftransferredembryos(N)ClinicalpregnancyratePositiverate(%)Positive(N)Total(N)ImplantationratePositiverate(%)Positive(N)Total(N)LivebirthratePositiverate(%)Positive(N)Total(N)Gestationalweek(weeks)Lowweight5.51±3.317.77±3.204.36±2.881.6±0.8532.4123718.7147527.0103738.0±0.00Normal5.60±2.708.50±2.943.41±2.641.64±0.8345.416436131.122572340.414636135.9±3.08Overweight5.35±2.948.25±2.963.16±2.521.67±0.8444.78519026.19937936.36919035.8±1.24Obesity5.17±2.368.16±2.642.93±2.071.41±0.9833.9195620.02110526.8155634.0±2.65
四、卵巢高反应组患者不同BMI助孕结局比较
卵巢高反应组共计787 例,其中低体重组51 例(6.5%),正常体重组466 例(59.2%)超重组200 例(25.4%),肥胖组70 例(8.9%)。超重组、肥胖组Gn起始剂量大、使用天数长、总剂量大,差异有统计学意义。低体重组获卵数最少,差异有统计学意义。低体重组周期取消率最高,肥胖组周期取消率最低,差异有统计学意义。临床妊娠率、活产率随BMI升高均下降,差异无统计学意义。正常体重组胚胎着床率较低体重组或肥胖组有升高趋势,但差异无统计学意义。各组间MII卵数、2PN数、受精率、可利用胚胎数、优质胚胎数、移植胚胎数、孕周、新生儿出生体重、早期流产率、中晚期流产率、异位妊娠率、生化妊娠率差异均无统计学意义。见表3。
表3 卵巢高反应性患者不同BMI组助孕结局比较
Table 3 Summary of assisted pregnancy outcomes by different BMI groups in patients with high ovarian response
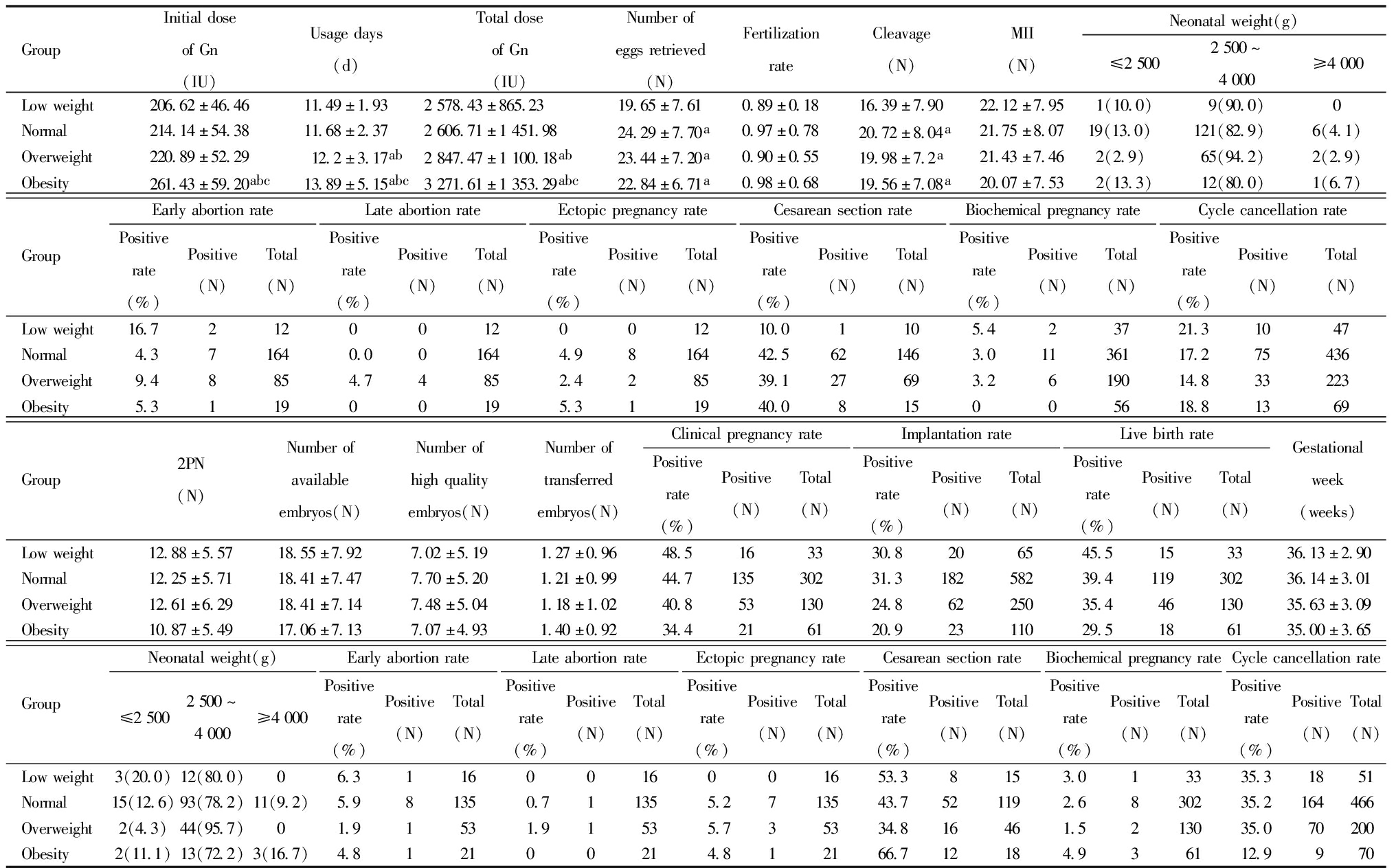
GroupInitialdoseofGn(IU)Usagedays(d)TotaldoseofGn(IU)Numberofeggsretrieved(N)FertilizationrateCleavage(N)MII(N)Neonatalweight(g)≤25002500~4000≥4000Lowweight206.62±46.4611.49±1.932578.43±865.2319.65±7.610.89±0.1816.39±7.9022.12±7.951(10.0)9(90.0)0Normal214.14±54.3811.68±2.372606.71±1451.9824.29±7.70a0.97±0.7820.72±8.04a21.75±8.0719(13.0)121(82.9)6(4.1)Overweight220.89±52.2912.2±3.17ab2847.47±1100.18ab23.44±7.20a0.90±0.5519.98±7.2a21.43±7.462(2.9)65(94.2)2(2.9)Obesity261.43±59.20abc13.89±5.15abc3271.61±1353.29abc22.84±6.71a0.98±0.6819.56±7.08a20.07±7.532(13.3)12(80.0)1(6.7)GroupEarlyabortionratePositiverate(%)Positive(N)Total(N)LateabortionratePositiverate(%)Positive(N)Total(N)EctopicpregnancyratePositiverate(%)Positive(N)Total(N)CesareansectionratePositiverate(%)Positive(N)Total(N)BiochemicalpregnancyratePositiverate(%)Positive(N)Total(N)CyclecancellationratePositiverate(%)Positive(N)Total(N)Lowweight16.72120012001210.01105.423721.31047Normal4.371640.001644.9816442.5621463.01136117.275436Overweight9.48854.74852.428539.127693.2619014.833223Obesity5.311900195.311940.0815005618.81369Group2PN(N)Numberofavailableembryos(N)Numberofhighqualityembryos(N)Numberoftransferredembryos(N)ClinicalpregnancyratePositiverate(%)Positive(N)Total(N)ImplantationratePositiverate(%)Positive(N)Total(N)LivebirthratePositiverate(%)Positive(N)Total(N)Gestationalweek(weeks)Lowweight12.88±5.5718.55±7.927.02±5.191.27±0.9648.5163330.8206545.5153336.13±2.90Normal12.25±5.7118.41±7.477.70±5.201.21±0.9944.713530231.318258239.411930236.14±3.01Overweight12.61±6.2918.41±7.147.48±5.041.18±1.0240.85313024.86225035.44613035.63±3.09Obesity10.87±5.4917.06±7.137.07±4.931.40±0.9234.4216120.92311029.5186135.00±3.65GroupNeonatalweight(g)≤25002500~4000≥4000EarlyabortionratePositiverate(%)Positive(N)Total(N)LateabortionratePositiverate(%)Positive(N)Total(N)EctopicpregnancyratePositiverate(%)Positive(N)Total(N)CesareansectionratePositiverate(%)Positive(N)Total(N)BiochemicalpregnancyratePositiverate(%)Positive(N)Total(N)CyclecancellationratePositiverate(%)Positive(N)Total(N)Lowweight3(20.0)12(80.0)06.31160016001653.38153.013335.31851Normal15(12.6)93(78.2)11(9.2)5.981350.711355.2713543.7521192.6830235.2164466Overweight2(4.3)44(95.7)01.91531.91535.735334.816461.5213035.070200Obesity2(11.1)13(72.2)3(16.7)4.812100214.812166.712184.936112.9970
aCompared with low weight, bCompared with normal, CCompared with overweight, abcP<0.05
五、PCOS组患者不同BMI助孕结局比较
PCOS组共计423 例,其中低体重组15例(3.6%),正常体重组210 例(49.6%),超重组142 例(33.6%),肥胖组56 例(13.2%)。与其余三组相比较,肥胖组Gn起始剂量最多、Gn天数最长、Gn总剂量最多,差异有统计学意义。肥胖组可利用胚胎数、胚胎着床率低,差异有统计学意义。肥胖组新生儿出生体重≥4 000 g明显高于其他三组,差异有统计学意义。临床妊娠率、活产率随BMI升高均下降,但差异无统计学意义。获卵数、卵裂数、MII卵数、2PN数、受精率、优质胚胎数、移植胚胎数、孕周、早期流产率、中晚期流产率、异位妊娠率、生化妊娠率、周期取消率差异均无统计学意义。见表4。
表4 PCOS患者不同BMI组助孕结局比较
Table 4 Summary of assisted pregnancy outcomes by different BMI groups in patients with PCOS
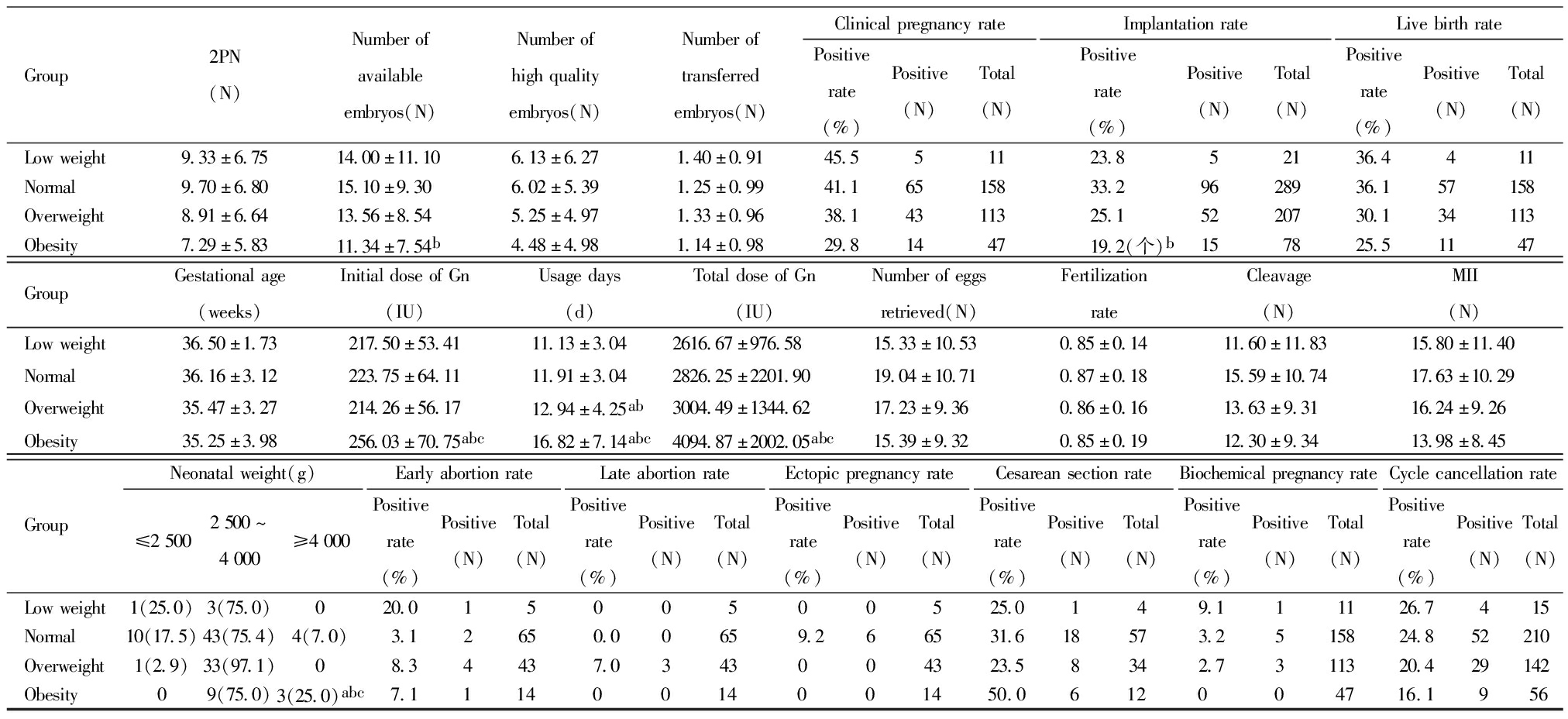
Group2PN(N)Numberofavailableembryos(N)Numberofhighqualityembryos(N)Numberoftransferredembryos(N)ClinicalpregnancyratePositiverate(%)Positive(N)Total(N)ImplantationratePositiverate(%)Positive(N)Total(N)LivebirthratePositiverate(%)Positive(N)Total(N)Lowweight9.33±6.7514.00±11.106.13±6.271.40±0.9145.551123.852136.4411Normal9.70±6.8015.10±9.306.02±5.391.25±0.9941.16515833.29628936.157158Overweight8.91±6.6413.56±8.545.25±4.971.33±0.9638.14311325.15220730.134113Obesity7.29±5.8311.34±7.54b4.48±4.981.14±0.9829.8144719.2(个)b157825.51147GroupGestationalage(weeks)InitialdoseofGn(IU)Usagedays(d)TotaldoseofGn(IU)Numberofeggsretrieved(N)FertilizationrateCleavage(N)MII(N)Lowweight36.50±1.73217.50±53.4111.13±3.042616.67±976.5815.33±10.530.85±0.1411.60±11.8315.80±11.40Normal36.16±3.12223.75±64.1111.91±3.042826.25±2201.9019.04±10.710.87±0.1815.59±10.7417.63±10.29Overweight35.47±3.27214.26±56.1712.94±4.25ab3004.49±1344.6217.23±9.360.86±0.1613.63±9.3116.24±9.26Obesity35.25±3.98256.03±70.75abc16.82±7.14abc4094.87±2002.05abc15.39±9.320.85±0.1912.30±9.3413.98±8.45GroupNeonatalweight(g)≤25002500~4000≥4000EarlyabortionratePositiverate(%)Positive(N)Total(N)LateabortionratePositiverate(%)Positive(N)Total(N)EctopicpregnancyratePositiverate(%)Positive(N)Total(N)CesareansectionratePositiverate(%)Positive(N)Total(N)BiochemicalpregnancyratePositiverate(%)Positive(N)Total(N)CyclecancellationratePositiverate(%)Positive(N)Total(N)Lowweight1(25.0)3(75.0)020.01500500525.0149.111126.7415Normal10(17.5)43(75.4)4(7.0)3.12650.00659.266531.618573.2515824.852210Overweight1(2.9)33(97.1)08.34437.0343004323.58342.7311320.429142Obesity09(75.0)3(25.0)abc7.11140014001450.0612004716.1956
aCompared with low weight, bCompared with normal, CCompared with overweight, abcP<0.05
六、年龄与新鲜周期活产率的关系
活产组(474例)平均年龄(30.5±3.7)岁,非活产组(814例)平均年龄(30.2±4.1)岁,两组样本经独立样本t 检验结果显示,差异无统计学意义。
讨 论
目前,超重和肥胖患者日趋增加,在经历了自然受孕失败,尝试促排卵效果仍欠佳后,寻求辅助生殖技术助孕的人数呈现上升趋势。因此,肥胖与不孕症近年来备受关注,关于二者是否相关存在争议,Broughton等[7]认为,肥胖女性的生育能力下降,其自然受孕的概率随着BMI升高呈线性下降趋势。本研究显示,肥胖患者不孕年限明显延长,这表明肥胖女性自然受孕比较困难。卵巢正常反应组显示BMI升高、bFSH降低、bAFC增加,可能是因为肥胖患者体内胰岛素水平升高,刺激卵巢雄激素生成增加,从而转化为更多的雌激素,对下丘脑-垂体-卵巢轴产生负反馈,抑制FSH产生,这表现为排卵功能障碍[7]。
关于BMI对IVF促排效果的影响,各研究者看法不一。Sarais等[1]对1 602例新鲜移植的患者依据BMI进行分组,在各体重组间比较,认为Gn总剂量、Gn持续时间、获卵数、受精率等方面差异均无统计学意义。而Sermondade等[2]通过荟萃分析认为,肥胖患者所需的Gn肥胖患者体内游离脂肪酸增多,损害卵母细胞内线粒体和内质网等细胞器,会造成卵母细胞凋亡增加[9],另外肥胖可能改变卵泡液中代谢产物成分,造成卵泡代谢环境紊乱,影响卵泡发育[10],导致最终的获卵数目不满意。另外,汪离志等[11]对年龄与新鲜周期活产率之间的相关性进行了分析,结果显示新鲜周期活产率随着年龄增长呈下降趋势。本研究结果尚未发现年龄与新鲜周期活产率之间有相关性,可能与样本量不足有关,后续需要增加样本量来进行更全面的分析。
Provost等[12]对239 127 例新鲜移植周期回顾性分析,发现随着BMI升高,胚胎着床率、临床妊娠率、活产率呈现下降趋势。并且Bellver等[13]对赠卵周期研究,肥胖组胚胎着床率下降,认为肥胖可能会影响子宫内膜环境。本研究结果显示,在卵巢正常反应组中,超重组、肥胖组较体重正常组,胚胎着床率明显下降,由于肥胖患者常合并胰岛素抵抗,胰岛素影响子宫内膜的发育、代谢及容受性[14]。在饮食诱导小鼠肥胖(DIO)模型[15]研究显示,肥胖雌鼠葡萄糖耐量、空腹胰岛素水平升高,子宫内膜蜕膜化(蜕膜化对于内膜容受性的发生起关键作用)降低,且胚胎着床位点减少。另外,胚胎发育异常也可能会导致胚胎着床率下降,Leary等[16]发现,BMI>25 kg/m2者卵母细胞较小,受精后胚泡比正常体重组更快达桑椹胚阶段,所含细胞数减少,认为肥胖可能会导致卵母细胞发育动力学延迟和细胞成分改变,这可能会影响胚胎质量。本研究显示,正常体重组临床妊娠率、活产率最高,BMI升高或者降低都有较差结果,但差异无统计学意义,可能需要更大的样本量来进一步验证。
BMI与周期取消率的相关仍有争议,Kudesia等[17]对多家生殖中心51 198 例患者进行回顾性分析发现,随着BMI升高,周期取消率增加。Maged等[18]对185 例卵巢低反应患者进行BMI与助孕结局前瞻性研究显示,各研究组周期取消率差异没有统计学意义。本研究发现,卵巢低反应组周期取消率各体重组间差异无统计学意义,但在卵巢高反应组显示,低体重组周期取消率高,肥胖组周期取消率低,提示低BMI可能是卵巢过度刺激征(OHSS)发生的危险因素,这与Kudesia等[17]的结果不一致,可能是因为对BMI划分标准不一致及人群构成差异造成。
PCOS发病机制复杂,目前仍未完全阐明,Provost等[12]对PCOS患者研究中,认为随着BMI增加,胚胎着床率、临床妊娠率、自然流产率和活产率都趋向于较差的结局。Kudesia等[17]对PCOS单独分析发现,超重组和肥胖组与正常体重组相比,可利用胚胎数明显减少。本研究发现,肥胖组较正常体重组可利用胚胎数、胚胎着床率均降低,可能是由于PCOS组患者自身卵泡数目多所致,徐丽湘等[19]通过研究发现卵泡数目增加可能会使成熟卵母细胞减少,提示在促排卵治疗中,可能会发生卵泡发育与卵母细胞成熟不同步现象从而影响胚胎质量,导致可利用胚胎数目减少。另外,本研究PCOS组显示,肥胖组新生儿出生体重≥4 000 g明显高于其他三组,提示母亲肥胖可能会对子代的健康造成影响,但Sarais等[1]认为新生儿出生体重在母亲各体重组中并无明显差异,所以需要更大的样本量来进一步证实这一观点。
低BMI对妊娠结局的影响也不容忽视,但目前此方面研究较少,并且观点尚不统一,Kawwass等[20]认为体重不足女性对妊娠和活产差异没有统计学意义。Li等[21]认为体重不足可能会导致获卵数减少。Cai等[22]对4 798 个新鲜周期研究发现,体重不足组较体重正常组获卵数较多,活产率降低,自然流产率增加,提示低BMI可能是IVF助孕结局的负向预测因素,但作者并没有对胚胎着床率进行探讨。本研究显示,在卵巢高反应组中,低体重组获卵数低于正常组,这与Li等[21]看法一致;在卵巢正常反应组中,低体重组胚胎着床率低于正常体重组。其可能的机制是,低BMI可能代表能量摄入不足,影响促性腺激素的合成、卵泡生长和卵母细胞质量,进而影响胚胎质量[7]。瘦素是一种脂肪组织分泌的激素,与BMI呈正相关,它可以调节食物摄入和能量平衡,也在胚胎植入子宫内膜期间起着关键作用,即子宫内膜中瘦素表达降低与胚胎着床率下降有关[7]。
综上所述,BMI升高,女性不孕年限延长。在IVF助孕过程中,BMI既影响患者促排卵效果,即(Gn起始剂量、使用时间及总剂量、获卵数),也影响可利用胚胎数、胚胎着床率、周期取消率及新生儿出生体重,而PCOS可能加剧了这些负面影响,并且无论BMI过低还是超重及肥胖均可能对助孕结局有影响。这提示临床工作者在结合卵巢功能的前提下,指导BMI异常患者改善生活方式,适当减重或增重,以获得更好的妊娠结局。
1 Sarais V,Pagliardini L,Rebonato G,et al.A Comprehensive Analysis of Body Mass Index Effect on in Vitro Fertilization Outcomes.Nutrients,2016,8:109.
2 Sermondade N,Huberlant S,Bourhis-Lefebvre V,et al.Female obesity is negatively associated with live birth rate following IVF:a systematic review and meta-analysis.Hum Reprod Update,2019,25:439-451.
3 乔杰,马彩虹,刘嘉茵,等.辅助生殖促排卵药物治疗专家共识.生殖与避孕,2015,35:211-223.
4 中国肥胖问题组.中国成人超重和肥胖症预防控制指南(节选).营养学报,2004,1:1-4.
5 中国医师协会内分泌代谢科医师分会 多囊卵巢综合征诊治内分泌专家共识.中华内分泌代谢杂志,2018,34:1-7.
6 The Istanbul consensus workshop on embryoassessment:proceedings of an expert meeting.Hum Reprod,2011,26:1270-1283.
7 Broughton DE,MoleyKH.Obesity and female infertility:potential mediators of obesity′s impact.Fertil Steril,2017,107:840-847.
8 Kasum M,Oreškovic′ ![]() E,et al.The role of female obesity on in vitro fertilization outcomes.Gynecol Endocrinol,2018,34:184-188.
E,et al.The role of female obesity on in vitro fertilization outcomes.Gynecol Endocrinol,2018,34:184-188.
9 Wu LL,Norman RJ,Robker RL.The impact of obesity on oocytes:evidence for lipotoxicity mechanisms.Reprod Fertil Dev,2011,24:29-34.
10 Robker RL,Akison LK,Bennett BD,et al.Obese women exhibit differences in ovarian metabolites,hormones,and gene expression compared with moderate-weight women.J Clin Endocrinol Metab,2009,94:1533-1540.
11 汪离志.IVF-ET临床妊娠率和活产率及其影响因素研究.复旦大学,2014.
12 Provost MP,Acharya KS,Acharya CR,et al.Pregnancy outcomes decline with increasing body massindex:analysis of 239,127 fresh autologous in vitro fertilization cycles from the 2008-2010 Society for Assisted Reproductive Technology registry.Fertil Steril,2016,105:663-669.
13 Bellver J,Melo MA,Bosch E,et al.Obesity and poor reproductive outcome:the potential role of the endometrium.Fertil Steril,2007,88:446-451.
14 Strowitzki T,von Eye HC,Kellerer M,et al.Tyrosine kinase activity of insulin-like growth factor I and insulin receptors in human endometrium during the menstrual cycle:cyclic variation of insulin receptor expression.Fertil Steril,1993,59:315-322.
15 Rhee JS,Saben JL,Mayer AL,et al.Diet-induced obesity impairs endometrial stromal cell decidualization:a potential role for impaired autophagy.Human reprod,2016,31:1315-1326.
16 Leary C,LeeseHJ,Sturmey RG.Human embryos from overweight and obese women display phenotypic and metabolic abnormalities.Human reprod,2015,30:122-132.
17 Kudesia R,Wu H,Hunter Cohn K,et al.The effect of female body mass index on in vitro fertilization cycle outcomes:a multi-center analysis.J Assist Reprod Genet,2018,35:2013-2023.
18 Maged AM,Fahmy RM,Rashwan H,et al.Effect of body mass index on the outcome of IVF cycles among patients with poor ovarian response.Int J Gynaecol Obstet,2019,144:161-166.
19 徐丽湘,唐永梅,韦立红,等.IVF-ET中低受精率事件发生相关因素分析.右江医学,2015,43:706-710.
20 Kawwass JF,Kulkarni AD,Hipp HS,et al.Extremities of body mass index and their association with pregnancy outcomes in women undergoing in vitro fertilization in the United States.Fertil Steril,2016,106:1742-1750.
21 Li Y,Yang D,Zhang Q.Impact of overweight and underweight on IVF treatment in Chinese women.Gynecol Endocrinol,2010,26:416-422.
22 Cai J,Liu L,Zhang J,et al.Low body mass index compromises live birth rate in fresh transfer in vitro fertilizationcycles:a retrospective study in a Chinese population.Fertil Steril,2017,107:422-429.