明确胚胎发育中基因突变及突变来源情况,不仅利于在遗传学因素中查找线索,防止缺陷新生儿的出生,也可为再次妊娠采取针对性措施提供帮助。然而目前传统产前检测方法,如绒毛活检、羊膜腔穿刺术等取材进行DNA检查,对于孕妇和胎儿均具有一定的损伤,其导致的流产率可达0.5%~1%[1],故寻求稳定可靠的无创伤产前基因突变检测方法是国内外研究热点之一。上世纪末,Khalil等[2]发现孕妇血浆中存在微量游离胎儿DNA,这为无创伤产前基因突变检测带来了希望。但研究显示,母体外周血中的游离胎儿DNA多在0.3 kb以下,游离胎儿DNA含量较低带来的检测灵敏度低的缺点限制了其在临床上的应用[3]。高通量基因测序(next generation sequencing,NGS)技术是基因检测的新技术,文献报道显示,NGS技术辅助以DNA片段化处理技术在基因染色体异常片段测序及长度测量中具有较高的灵敏度和特异度(均可达到95%以上)[4],这给母体游离胎儿DNA检测带来了技术保障。软骨发育不全和致死性侏儒症均是胚胎发育中基因突变后的常见骨骼疾病,年发病率分别约在3.6~6.4  和2.1~5.1
和2.1~5.1  ,60%以上常见骨骼疾病多因纤维细胞生长因子受体基因突变所产生,且这种基因突变具有典型父源遗传性[5]。鉴于此,本研究以山西医科大学第一医院妇产科近期收治的软骨发育不全和致死性侏儒症诊断的孕妇为研究对象,采用NGS技术联合DNA片段化处理技术对母体游离胎儿DNA进行基因突变检测,并观察其在筛查胎儿新发突变或父源遗传疾病中的应用可行性。
,60%以上常见骨骼疾病多因纤维细胞生长因子受体基因突变所产生,且这种基因突变具有典型父源遗传性[5]。鉴于此,本研究以山西医科大学第一医院妇产科近期收治的软骨发育不全和致死性侏儒症诊断的孕妇为研究对象,采用NGS技术联合DNA片段化处理技术对母体游离胎儿DNA进行基因突变检测,并观察其在筛查胎儿新发突变或父源遗传疾病中的应用可行性。
资料与方法
一、一般资料
选取2017年1月—12月于山西医科大学第一医院产前诊断中心就诊的27例孕妇,其孕30~32周超声提示或既往胎生史为软骨发育不良症和致死性侏儒症。孕妇年龄在20~35岁,平均年龄(28.7±2.5)岁。其中超声提示或既往胎生史为软骨发育不良症就诊孕妇19例,致死性侏儒症就诊8例。纳入研究的孕妇及配偶身体健康,自身无软骨发育不良症或致死性侏儒症,无妊娠期高血压、糖尿病、脂肪肝等妊娠期合并症或并发症,肝肾功能正常,无妇科疾病。本研究所有孕妇及家属对研究知情且签订同意书。
二、方法
1.检测方法:27例孕妇均于孕30~32周在超声引导下羊膜穿刺采集羊水2 mL和外周血20 mL,送实验室分别进行基因组DNA Sanger检测和游离胎儿DNA突变检测。(1)基因组DNA Sanger检测。采用DNA Mini Kit试剂盒(美国公司ABI公司生产)提取胎儿基因组DNA,采用Sanger测序法行软骨发育不良症和致死性侏儒症常见突变位点(c.1123、c.1138、c.1130)检测[6],以此基因组DNA Sanger测序检测结果作为本研究金标准。(2)游离胎儿DNA突变检测。首先进行母体游离胎儿DNA提取,标本顺序ID编号(000-027),离心血浆(1 600 ram/min, 4 ℃,10 min),取上清2 mL转移至无菌离心管内,采用DNA Nucleic Acid Kit试剂盒(美国公司ABI公司生产)提取母体游离胎儿DNA。(3)游离胎儿DNA片段化处理。采用共聚焦超声波仪器(型号:Covaris E210;生产商:澳大利亚Ccorbett全司)对游离胎儿DNA进行片段化处理,目标片段跨度150~200 bp,以PCR Clean-Up磁珠碎片化并提纯,40 μL缓冲液回溶,采用Bioanalyzer 2100 生物分析仪(生产商:北京东胜创新生物科技)对游离胎儿DNA 片段进行长度测定。(4)荧光定量游离胎儿DNA浓度。采用Qubit© 2.0 荧光定量仪(生产商:北京天根生化科技)对游离胎儿DNA进行浓度定量,对应浓度按照10%、6%、3%、1%和0.5%标准,采用高通量染色体测序(NGS)技术对各浓度荧光定量游离胎儿DNA片段进行测序,以100 bp为最低基因序列片段测试长度,通过测序以对位点基因片段进行拍照。测序序列结果以文件形式保存以供评估。
2.评估标准:(1)片段化产物测序分析。将NGS测序序列结果与人类基因图谱进行对比,如DGV、UCSC等数据库,获取母体游离胎儿DNA片段化产物测序诊断结果。DGV数据库软骨发育不良症和致死性侏儒症波峰分布132.5~158 bp之间[7]。(2)质控标准分析。NGS测序测序完成后,对测序序列进行质控,即去掉小于100 bp的序列后生产样本问卷,使用mtools软件进行sort模块排序,得到对应浓度样本波形图获取纵轴荧光OD值。DGV数据库软骨发育不良症和致死性侏儒症的DNA片段的Proton标准区间为200~300 bp[8]。(3)NGS测序突变及突变来源分析。仔细观察突变区域,对比DGV数据库软骨发育不良症和致死性侏儒症基因序列片段,得出突变区域和类型。使用iTools软件的Xamtools对基因突变片段进行统计,得出对比区域位点碱基深度,提取各浓度样本单核苷酸多态性(SNP)位点碱基深度,取最大深度和次大深度,计算样品MAF值,当MAF<0.1%时,为纯合位点,基因突变来源为父亲基因,当MAF>0.1%,为位点基于杂合突变,基因突变来源为胎儿。
3.统计学处理:分析软件采用SPSS 19.0,计数资料采用频率描述,计量资料采用![]() 描述,以DNA Sanger测序结果作为金标准,对比母体游离胎儿DNA检测的准确性。
描述,以DNA Sanger测序结果作为金标准,对比母体游离胎儿DNA检测的准确性。
结 果
一、27例母体游离胎儿DNA片段化产物测序分析
27例母体游离胎儿DNA(浓度3%)片段化产物集中在143.5 bp区域,区域跨度在132.5~158 bp之间,与生理条件下软骨发育不良症和致死性侏儒症的DNA片段的波峰分布特征吻合。典型病例DNA片段化产物波峰分布见图1。

Note:The horizontal "Fragment length" indicates the length of DNA fragment in unit bp, while the vertical "Fluorescence unit" indicates the fluorescence OD value.
 : Pregnant woman, Wang, 28 years old, 31 weeks of gestation, medical examination due to the past history of fetal chondrodysplasia, DNA fragment peak 142 bp, consistent with the DGV database of DNA fragmentation product peak distribution towards chondrodysplasia.
: Pregnant woman, Wang, 28 years old, 31 weeks of gestation, medical examination due to the past history of fetal chondrodysplasia, DNA fragment peak 142 bp, consistent with the DGV database of DNA fragmentation product peak distribution towards chondrodysplasia. : Pregnant woman, Zhou, 30 years old, 32 weeks of gestational age, medical examination for suspected chondroplasia due to fetal short limb suggested by previous ultrasound.The peak of DNA fragment was 132 bp, which was in line with the distribution of DNA fragment peak of fatal dwarfism in DGV database.Ⓒ: Pregnant woman, Li, 32 years old, 33 weeks of gestation, medical examination due to previous ultrasound findings of fetal short limb suspected of chondrodysplasia, DNA fragment peak 154 bp, consistent with the DGV database of DNA fragmentation product peak distribution towards chondrodysplasia.
: Pregnant woman, Zhou, 30 years old, 32 weeks of gestational age, medical examination for suspected chondroplasia due to fetal short limb suggested by previous ultrasound.The peak of DNA fragment was 132 bp, which was in line with the distribution of DNA fragment peak of fatal dwarfism in DGV database.Ⓒ: Pregnant woman, Li, 32 years old, 33 weeks of gestation, medical examination due to previous ultrasound findings of fetal short limb suspected of chondrodysplasia, DNA fragment peak 154 bp, consistent with the DGV database of DNA fragmentation product peak distribution towards chondrodysplasia. : Pregnant woman, Rong, 26 years old, 32 weeks of gestation, medical examination due to previous ultrasound indicating fetal thoracic stenosis suspected of chondrodysplasia.The DNA fragment peak was 145 bp, which was in line with the distribution of the DNA fragment peak of chondrodysplasia in DGV database.
: Pregnant woman, Rong, 26 years old, 32 weeks of gestation, medical examination due to previous ultrasound indicating fetal thoracic stenosis suspected of chondrodysplasia.The DNA fragment peak was 145 bp, which was in line with the distribution of the DNA fragment peak of chondrodysplasia in DGV database.
图1 典型病例DNA片段化产物波峰分布图
Figure 1 Distribution of DNA fragmentation products in typical cases
二、27例母体游离胎儿DNA文件质控标准评价
见图2,母体游离胎儿DNA浓度分别为10%、6%、3%、1 %和0.5%时的片段化产物波峰分别为264 bp、263 bp、262 bp、261 bp、272 bp,主要分布于260~272 bp,属于DGV数据库DNA片段区间200~300 bp的标准,符合DNA文件质控水平符合Proton质控标准。
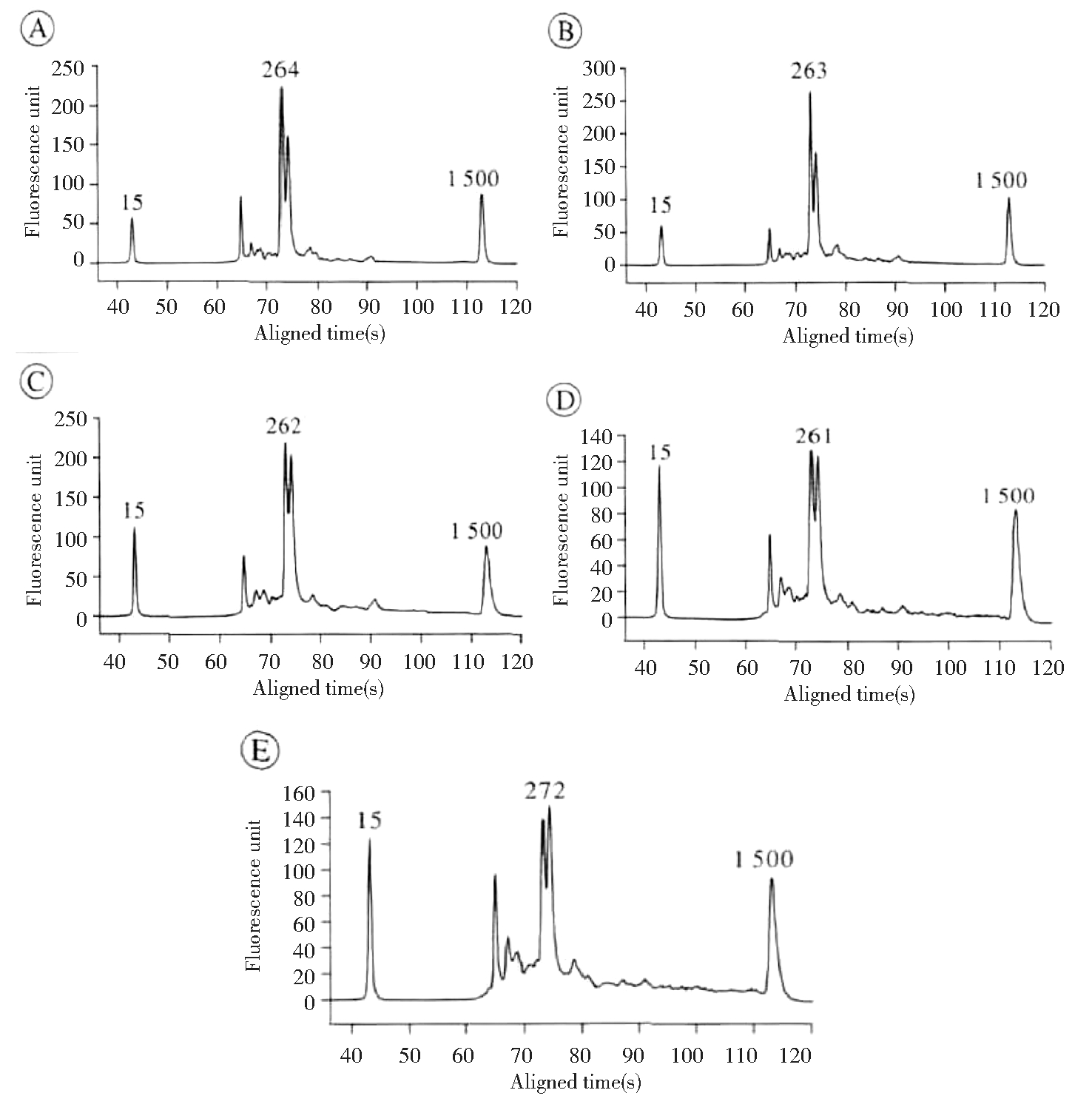
Note:The horizontal "Fragment length" indicates the length of DNA fragment in unit bp, while the vertical "Fluorescence unit" indicates the fluorescence OD value.
Pregnant woman, Wang, 28 years old, 31 weeks of gestation, medical examination due to the past history of fetal chondrodysplasia. The peak distribution of the fragment product at 10% DNA concentration.
The peak distribution of the fragment product at 10% DNA concentration. The peak distribution of the fragment product with a DNA concentration of 6%.Ⓒ The peak distribution of the fragment product with DNA concentration of 3%.
The peak distribution of the fragment product with a DNA concentration of 6%.Ⓒ The peak distribution of the fragment product with DNA concentration of 3%. The peak distribution of fragment products with DNA concentration of 1%.
The peak distribution of fragment products with DNA concentration of 1%. The peak distribution of the fragment product with DNA concentration of 0.5%.
The peak distribution of the fragment product with DNA concentration of 0.5%.
图2 DNA浓度分别为10%、6%、3%、1%和0.5%时片段化产物波峰分布图
Figure 2 Peak distribution of fragmentation products at DNA concentration of 10 %, 6 %, 3 %, 1 % and 0.5 %, respectively
三、27例母体游离胎儿DNA的NGS测序突变及突变来源分析
如表1所示。母体游离胎儿DNA浓度分别为10%、6%、3%时,NGS测序共检出6例基因突变,其中软骨发育不良症4例,致死性侏儒症2例,检测结果与基因组DNA Sanger测序突变结果吻合;母体游离胎儿DNA浓度为1%时,NGS测序共检出3例基因突变,其中软骨发育不良症2例,致死性侏儒症1例;母体游离胎儿DNA浓度为0.5 %时,NGS测序共检出1例基因突变,为软骨发育不良症。4例软骨发育不良症样本中,在c.1138位点基因突变峰明显高于其他位点(母体游离胎儿DNA浓度为10%、6%、3%和1%时),即胎儿携带c.1138>A突变基因,突变来源于胎儿,典型病例碱基变异分布见图3(孕妇王某,28周岁,孕周31周,因既往胎儿软骨发育不良症生育史就诊检查)。2致死性侏儒症样本c.1138(Chr4 1806119)位点的突变峰变化<0.1%,致死性侏儒症基因突变来源为父亲基因。
表1 27例母体游离胎儿DNA的NGS测序突变及突变来源分析
Table 1 NGS sequencing mutation and source analysis of 27 maternal free fetal DNA cases

CasenumberAge(years)Gestationalweek(weeks)InspectionevidenceMutationresultsofNGStestwithdifferentDNAconcentrations10%6%3%1%0.5%Sourceofmutation0082831PreviousfetalhistoryDetectedDetectedDetectedDetectedDetectedFoetus0123032PreviousfetalhistoryDetectedDetectedDetectedNotdetectedNotdetectedFoetus0143233UltrasonicpromptDetectedDetectedDetectedDetectedNotdetectedFoetus0152731UltrasonicpromptDetectedDetectedDetectedNotdetectedNotdetectedFoetus0182834UltrasonicpromptDetectedDetectedDetectedDetectedNotdetectedPaternalsource0242632UltrasonicpromptDetectedDetectedDetectedNotdetectedNotdetectedPaternalsource

Note:The longitudinal "SNP Percentage" indicates the proportion of variation at different concentrations of a site, while the transverse"SNP position" is the detection site.
图3 典型软骨发育不良症病例FGFR3 c.1 138 G>A突变比例图
Figure 3 Proportion of mutation of fibroblast growth factor R3 C.1 138 G > A in typical cases of chondrodysplasia
讨 论
软骨发育不良胎儿在孕11~18周时采用超声检查多无异常,大多数在孕中晚期超声检查时才能发现胚胎骨骼生长速度明确滞后,故本研究将采血时间定为30~32孕周[9]。另外,致死性侏儒症虽然能在孕中期影像学检查中出现异常,如胸廓狭窄、四肢短小等,但由于各胎儿母体内致死性侏儒症异常表现特征并无特异性编制,因此仅以影像学检查难以鉴别诊断[10]。本研究通过对孕妇外周血微量游离胎儿DNA进行基因片段化处理后,采用荧光定量游离胎儿DNA浓度,然后运用NGS无创产前基因检测技术,初步探讨母体游离胎儿DNA检测在筛查胎儿骨骼疾病新发突变或父源遗传疾病的可行性。实验结果显示,当游离胎儿DNA定量浓度高于3%时,NGS无创产前基因检测技术可以准确的对胎儿骨骼疾病的突变基因进行检测,与基因组DNA Sanger测序法的突变检查结果吻合。由此提示,母体游离胎儿DNA检测可用于胎儿骨骼疾病新发突变的检测,这已得到文献研究[11]的证实。
致死性侏儒症、软骨发育不良症等骨骼疾病的显著特征是父源效应,即致病基因突变几乎均来自于父方隐性基因[12]。研究显示,当父方年龄高于35周岁时,父方携带骨骼疾病隐基因,如c.1123、c.1138、c.1130位点的成骨纤维因子突变基因,其生育后代骨骼疾病风险增加,与25岁以下相比,父亲35周岁时,后代软骨发育不良症和致死性侏儒症的风险分别增加2.8倍和3.4倍[13]。随着国内二胎政策全面放开,高龄人群生育意愿有所增加,因此,相关遗传疾病产前检查显得意义重大。本研究显示,4例软骨发育不良症样本中,在c.1138位点基因突变峰明显高于其他位点(母体游离胎儿DNA浓度为10%、6%、3%和1%时),即胎儿携带c.1138>A突变基因,突变来源于胎儿。而Li等[14]大样本研究显示软骨发育不良症基因突变源也可来源于父亲方,研究中87例软骨发育不良症活生儿中,31例基因突变来源于父亲方,占比高达35.6%。与本研究结果有一定的差异,可能原因在于本研究样本量相对较小。另外,本研究结果还显示,2例致死性侏儒症样本在c.1138(Chr4 1806119)位点的突变峰变化<0.1%,故致死性侏儒症基因突变来源为父亲基因。致死性侏儒症有两种类型,即致死性侏儒症1型和致死性侏儒症2型,前者胎儿影像学表现为长骨短而弯曲,后者胎儿影像学则表现为长骨短而直,尤其是后者大都是由父亲方c.1138(Chr4 1806119)位点基因突变所至[15-16]。
综上所述,可将母体游离胎儿DNA检测应用于其他遗传性疾病胎儿的基因突变检测,但需注意以下几点:(1)由于游离胎儿DNA在母体中属于微量(约在0.3 kb以下),故需进行荧光定量游离胎儿DNA浓度,以便于精确处理[17];(2)多数实验室将游离胎儿DNA浓度下限设定在5%或10%[18-19],而将母体游离胎儿DNA浓度设定在3%时,可尽早查出胎儿基因突变,这具有重要的意义;(3)以母体游离胎儿DNA为检测对象,必须明确致病基因片段分布特点,使母体游离胎儿DNA片段分布尽可能接近致病基因DNA片段分布规律[20];(4)在病例纳入中,必须排除尽可能多的影响因素。如软骨发育不良症、致死性侏儒症,妊娠期高血压、糖尿病、脂肪肝等,才可保障母体背景不受干扰。
综上所述,虽然本研究样本量较少,但仍然以真实样本进行试验验证,初步证实了母体游离胎儿DNA检测在筛查胎儿新发突变或父源遗传疾病中的应用可行性。即当游离胎儿DNA浓度≥3% 时,母体游离胎儿DNA检测在筛查胎儿新发软骨发育不良症和致死性侏儒症的基因突变或父源遗传性中具有较高的质控水平和准确性,以此可类推到其他类型新发突变或父源遗传疾病的产前诊断,表明母体游离胎儿DNA检测在单基因遗传疾病产前诊断中具有较好的应用前景。
1 张志佳,钱君,单春剑,等.放射免疫分析仪检测产前初乳收集对GDM产妇围产期血清泌乳素水平的影响.中国医疗设备,2018,33:23-25.
2 Khalil A,Pajkrt E,Chitty S,et al.Early prenatal diagnosis of skeletal anomalies.Prenat Diagn,2017,31:115-124.
3 罗颖,鲁婷,陶靖,等.母血游离胎儿DNA检测在染色体非整倍体无创产前诊断的应用.中国妇幼保健,2016,31:1481-1483.
4 周丽颖.自然流产遗传病因的高通量测序检测.中国优生与遗传杂志,2016,8:35-36.
5 祝建疆,戚红,李伟,等.胎儿骨骼发育异常的遗传因素研究进展.中国优生与遗传杂志,2018,26:123-126,128.
6 周燕,冀小平.探讨无创产前基因检测胎儿染色体非整倍体技术的应用.疾病监测与控制,2017,9:247-250.
7 Tabor A,Alfirevic Z.Update on procedure-related risks for prenatal diagnosis techniques.Fetal Diagn Ther,2017,27:1-7.
8 Lo YM,Corbetta N,Chamberlain PF,et al.Presence of fetal DNA in maternal plasma and serum.Lancet,2017,350:485-487.
9 王春霞,喻进,卢晓晓,等.sFRP4基因在肉鸡胫骨软骨发育不良中的表达及生物信息学分析.动物医学进展,2018,3990-95.
10 姜煜,潘敬新,郭东炜,等.致死性侏儒症p.R248C突变热点的快速检测和三例TD-Ⅰ型高危胎儿的快速产前诊断.分子诊断与治疗杂志,2017,9:228-233.
11 翁慧男,梁嘉颖,曾伟宏,等.无创产前基因测序在胎儿染色体非整倍体基因检测中的临床应用.国际检验医学杂志,2016,23:2386-2388.
12 Zhu H,Miao Z,Qian Y,et al.Detection of cell-free fetal DNAin maternal plasma for noninvasive prenatal screening of fetalchromosomal aneuploidies in women of advanced maternal age.Zhejiang Da Xue Xue Bao Yi Xue Ban,2017,46:256-261.
13 Hui WW,Chiu RW.Noninvasive prenatal testing beyondgenomic analysis:what the future holds.Curr Opin Obstet Gynecol,2016,28:105-110.
14 Li Y,Page-Christiaens GC,Gille JJ,et al.Non-invasive prenatal detection of achondroplasia in size-fractionated cell-free DNA by MALDI-TOF MS assay.Prenat Diagn,2017,27:11-17.
15 杨洁霞,郭芳芳,彭海山,等.无创产前基因检测技术在胎儿染色体非整倍体筛查中的应用研究.中国产前诊断杂志,2016,8:31-34.
16 薛秀平.孕妇外周血中游离胎儿DNA检测在染色体非整倍体无创产前诊断中的意义.中国妇幼保健,2017,32:417-419.
17 殷一旋,梅瑾,王昊,等.无创产前基因检测技术在胎儿性染色体非整倍体检测中的临床应用.中国优生与遗传杂志,2017,24:24-25.
18 哈迎春,冯佳,王婧,等.无创DNA产前检测在胎儿染色体非整倍体疾病中的应用.宁夏医科大学学报,2016,38:456-458.
19 郑芳秀,周琴,陈英苹,等.高通量基因测序在胎儿性染色体非整倍体产前检测中的应用价值.南京医科大学学报(自然科学版),2017,36:1796-1798.
20 郑琳,吴忠琴.无创DNA检测在产前诊断胎儿染色体非整倍体疾病中的应用.中国优生与遗传杂志,2016,24:42-43.