基因工程技术应用于新品种作物栽培已有近40年历史,该技术为人类应对粮食短缺和农作物病虫害提供了有效途径[1]。1993年转入Bt(Bacillus thuringiensis)基因的抗虫玉米研发问世,抗虫玉米的应用解决了玉米螟对作物的啃食问题,减少了抗虫农药使用量,在保护环境和提高经济收益方面产生了积极影响[2]。然而,近年来,基因工程作物食用安全性问题存在争议[1-4]。对基因工程作物开展研究可以考察其食用安全性,并为进一步应用提供依据。欧洲替代方法验证中心(European Center for Validation of Alternative Methods, ECVAM)推荐的胚胎细胞微团培养试验为有效性较高的体外胚胎毒性发育试验[5],腭板培养也是研究受试物对实验动物发育影响和机理的主要手段[6]。因此,本研究通过大鼠中脑细胞微团培养和腭板培养两种方法,对基因工程玉米Bt799及目的蛋白Cry1Ac进行了发育毒性研究,为基因工程作物食用安全性评价提供了实验参考依据。
材料与方法
一、受试物
Cry1Ac蛋白冻干粉(95%~98%)(Laboratory of Biochemistry Dept,School of Medicine, Case Western Reserve University),基因工程玉米Bt799(中国农业大学)。Bt799玉米转入了Cry1Ac基因,各部位可稳定表达Cry1Ac蛋白,种子中Cry1Ac蛋白表达量为(130.0±1.3)ng/g(n=3)。亲本玉米郑58种子中未检测到Cry1Ac蛋白。两种玉米主要营养成分见表1。
表1 Bt799玉米和郑58玉米主要营养成分对比(mean±SD, n=3, g/100 g)
Table 1 Comparison of main nutritional components between Bt799 maize and zheng 58 maize(mean±SD, n=3, g/100 g)
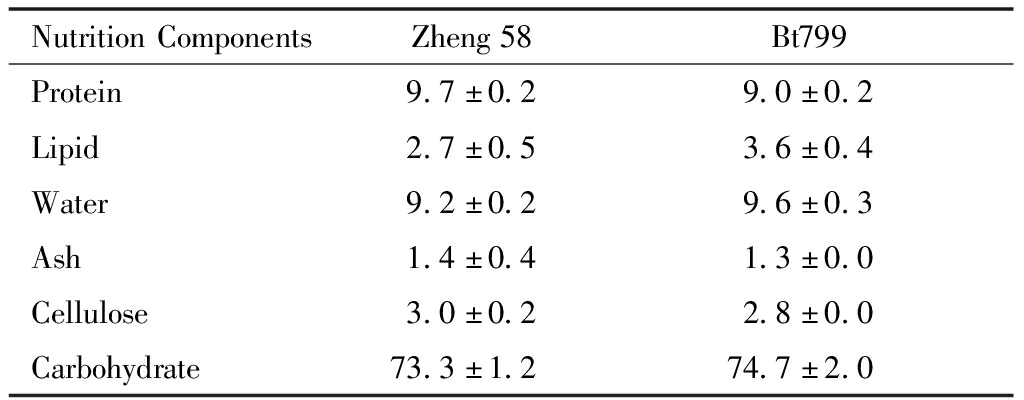
NutritionComponentsZheng58Bt799Protein9.7±0.29.0±0.2Lipid2.7±0.53.6±0.4Water9.2±0.29.6±0.3Ash1.4±0.41.3±0.0Cellulose3.0±0.22.8±0.0Carbohydrate73.3±1.274.7±2.0
二、实验动物
SPF级健康未生育雌性Wistar大鼠,9周龄,体重(200±20)g;SPF级健康未生育雄性Wistar大鼠,9周龄,体重(300±20)g。大鼠按雌雄比1∶1于18:00合笼并于次日8:00检查阴栓,以查见阴栓之日为孕0 d。雌鼠全部受孕后,使用加工饲料按照分组喂养雄鼠并制备即刻离心血清(immediate centrifugation serum, ICS),制备后使用ELISA试剂盒检测ICS中Cry1Ac蛋白含量。雌鼠用于提取胚胎中脑细胞和胚胎腭板。实验用大鼠购自北京大学医学部实验动物中心(动物合格证号:SCXK11-00-0004;实验动物使用许可证号:SYXK(京)2006-0025;实验动物生产许可证号:SCXK(京)2006-0008)。饲养于北京大学医学部实验动物部(动物实验环境设施(SPF)合格证书:医动字第01-2055)。环境温度范围:(25±1)℃,相对湿度范围:50%~60% RH,室内照明:12 h:12 h明暗交替。单笼饲养,自由饮水进食。动物喂养及实验操作严格按照《北京市实验动物管理条例》执行。
三、主要试剂
双酚A(美国Sigma公司),0.1%中性红(美国Amresco公司),苏木精(美国Sigma公司),全反式视黄酸(all-trans retinoic acid,ATRA)(美国Sigma公司),BGjb标准培养基(美国Gibco公司),二甲基亚砜(dimethyl sulphoxide, DMSO)(美国Hyclone公司),Bt-Cry1Ac-ELISA试剂盒(美国Agdia公司)。
四、主要仪器
恒温旋转培养装置(金坛区金城致杰实验仪器厂),混合供气系统(雷蒙特科学实验室设备有限公司),超净工作台(北京半导体设备一厂),体视显微镜(北京西冲科技发展有限公司),酶标仪(美国分子仪器公司)。
五、中脑细胞微团培养实验
1.中脑细胞提取方法:于孕13 d时脱颈处死孕鼠并消毒,无菌舱中剖腹取出子宫分离胚胎。体视显微镜下选择处于34~36体节数时期的胚胎,分离胚胎中脑组织,将中脑组织于37 ℃下以PBS冲洗三次后孵育20 min,弃去PBS以适量0.5%胰蛋白酶消化10 min。加入Ham′s F12完全培养液终止消化并连续冲洗三次。于适量Ham′s F12培养液中吹吸打散组织块,200目筛过滤得到单细胞悬液后计数细胞,将所提取细胞的细胞密度调整到5×109/L,接种于24孔板或96孔板中,分别进行细胞分化与增殖观察。
2.实验分组与剂量设计:中脑细胞微团培养分八个组进行,分别对应表2中描述的八种不同培养环境。将制备ICS的Wistar大鼠随机分为六组,其中NM(Naturel Parent:亲本对照)组、TM3(Time 3 Days:干预3天)组、TM1M(Time 1 Month:干预1个月)组、TM3M(Time 3 Days:干预3个月)组、PCB(Positive Control B:阳性对照B)组为前五组大鼠,BP(Bt Protein:Bt蛋白组)组、BC(Black Control:空白对照组)组、PCA(Positive Control A:阳性对照A)组因大鼠未经直接干预且不影响组间比较,故共同使用第六组大鼠的血清。在上述分组中NM组、TM3组、TM1M组、TM3M组使用添加玉米样本的加工饲料。以玉米所含淀粉完全替代AIN-93G标准饲料中碳水化合物,由此计算出玉米最大可添加量为84.7%。饲料制作确保主要营养成分构成不变,蛋白质不足部分以酪蛋白补充。BP组Cry1Ac蛋白的添加量为依照饲料中玉米添加量、Bt799玉米种子中Cry1Ac蛋白含量、大鼠饲料摄入量计算所得的最大可能暴露剂量。于雌鼠孕13 d获得胚胎中脑细胞,不同条件下进行细胞增殖和分化观察,分组与干预方式如表2。
3.苏木精染色法观察中脑细胞分化情况:吸取20 μL细胞悬液加入24孔板,按照表2中分组描述进行干预,每个剂量组设10个平行样。细胞于37 ℃条件下贴壁2 h。CO2培养箱中连续培养中脑细胞5 d,然后吸去培养基,10%甲醛固定20 min,弃甲醛并以苏木精染色1~3 min,去离子水洗去染液静置返蓝15 min后风干。显微镜下计数着色集落,根据中脑细胞集落数量确定细胞分化情况。集落分化百分比(%)=实验组集落数/溶剂对照组集落数×100%。
4.中性红摄取法观察中脑细胞增殖情况:吸取10 μL细胞悬液加入96孔板,按照表2中分组描述进行干预,每个剂量组设10个平行样。细胞于37 ℃条件下贴壁2 h。CO2培养箱中连续培养中脑细胞5 d。弃去培养基,于戊二醛中固定中脑细胞20 min,随后以生理盐水清洗三次。于0.05%中性红溶液中室温孵育30 min,弃去中性红并以生理盐水清洗三次,再以50%甲醛提取2 h。使用分光光度计于550 nm波长处测量吸光度值(A),并根据吸光度值判断细胞增殖情况。细胞存活率(%)=A实验组/A溶剂对照组×100%。
表2 大鼠胚胎中脑细胞微团培养分组与干预方式
Table 2 Grouping and intervention methods of rat embryonic midbrain cells mass culture
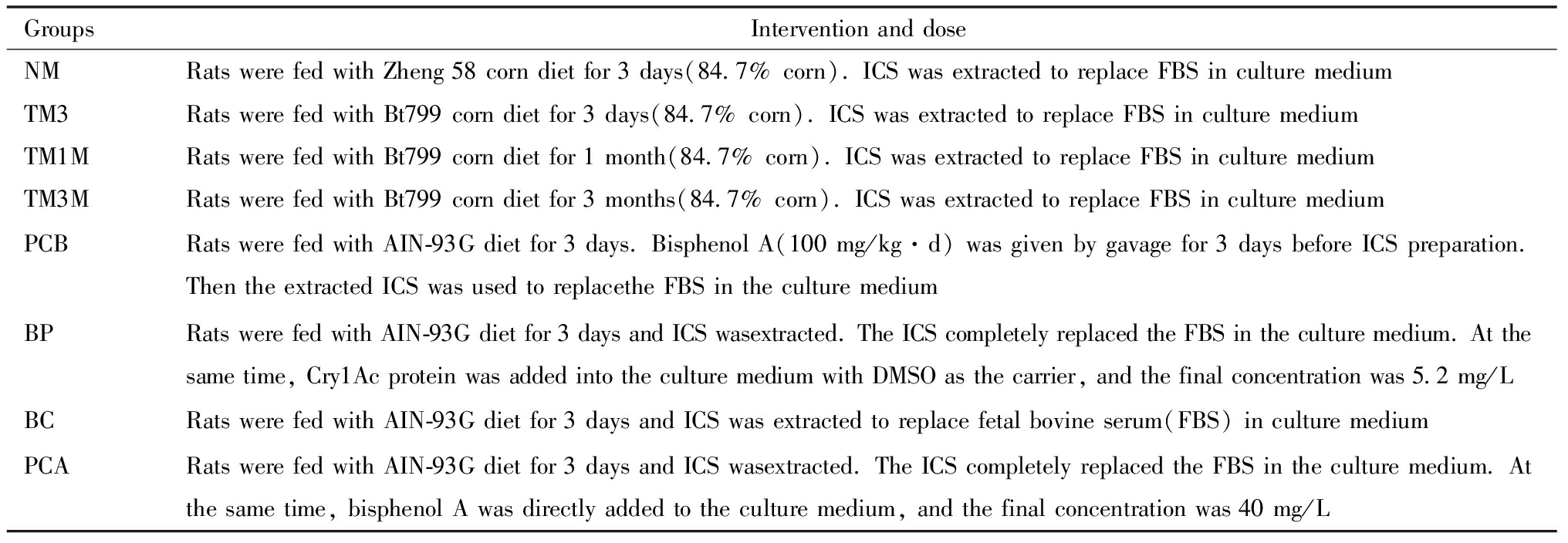
GroupsInterventionanddoseNMRatswerefedwithZheng58corndietfor3days(84.7%corn).ICSwasextractedtoreplaceFBSinculturemediumTM3RatswerefedwithBt799corndietfor3days(84.7%corn).ICSwasextractedtoreplaceFBSinculturemediumTM1MRatswerefedwithBt799corndietfor1month(84.7%corn).ICSwasextractedtoreplaceFBSinculturemediumTM3MRatswerefedwithBt799corndietfor3months(84.7%corn).ICSwasextractedtoreplaceFBSinculturemediumPCBRatswerefedwithAIN-93Gdietfor3days.BisphenolA(100mg/kg·d)wasgivenbygavagefor3daysbeforeICSpreparation.ThentheextractedICSwasusedtoreplacetheFBSintheculturemediumBPRatswerefedwithAIN-93Gdietfor3daysandICSwasextracted.TheICScompletelyreplacedtheFBSintheculturemedium.Atthesametime,Cry1AcproteinwasaddedintotheculturemediumwithDMSOasthecarrier,andthefinalconcentrationwas5.2mg/LBCRatswerefedwithAIN-93Gdietfor3daysandICSwasextractedtoreplacefetalbovineserum(FBS)inculturemediumPCARatswerefedwithAIN-93Gdietfor3daysandICSwasextracted.TheICScompletelyreplacedtheFBSintheculturemedium.Atthesametime,bisphenolAwasdirectlyaddedtotheculturemedium,andthefinalconcentrationwas40mg/L
六、腭板培养方法
1.腭板的体外旋转培养:孕12.5 d(以妊娠第12.5 d的14:00为准)时脱颈处死雌鼠并消毒,于无菌舱中分离胚胎,以眼科剪将胚胎顺口凹与眼水平线剪下颅面中部。以解剖刀沿腭板下沿水平切去后脑组织、舌头及下腭,保留腭板。将9 mL的BGjb培养液(37 ℃预温)加入50 mL培养瓶中并向培养液中加入对应受试物,用吸管将腭板转移入培养瓶,培养密度每瓶3~4个。于旋转培养箱中以不同分组条件连续培养腭板72 h(37 ℃,25 r/min)。分别于培养第0 h、24 h、48 h向培养瓶充入无菌过滤混合气体2.5 min,混合气体体积比为50:5:45(O2:CO2:N2)。
2.实验分组:于恒温旋转培养箱中依照表3进行72 h腭板连续培养。分组与干预如表3。
表3 大鼠胚胎腭板旋转培养分组与干预方式
Table 3 Grouping and intervention methods of rotating culture of rat embryos palatal plate

GroupsInterventiondoseNumberofpalatalplatesRAATRAwasloadedwithBGjbmediumandDMSOasthecarrier.ThefinalconcentrationofATRAwas10-2μM17BPCry1AcproteinwasloadedwithBGjbmediumandDMSOasthecarrier.ThefinalconcentrationofCrt1Acproteinwas5.2mg/L18BCStandardserum-freeBGjbmedium20
3.腭板培养评分:腭板融合情况分5个类型,即(1)双侧腭突仍分离计为1分;(2)双侧腭突靠近但未接触计为2分;(3)双侧腭突接触但未融合计为3分;(4)双侧腭突部分融合(后部软腭融合)计为4分;(5)双侧腭突完全融合(融合长度>1/2中线长度)计为5分。每只腭板根据上述分类情况计分,并计算融合率(融合率=计分为4分和5分的腭板数/总腭板数)。
七、统计学处理
计量资料采用均数±标准差的形式表示。采用SPSS 24.0软件进行单因素方差分析(one-way ANOVA),行方差齐性检验,方差齐时组间比较使用单因素方差分析、Tukey′s事后两两比较检验;方差不齐数据采用Kruskal-Wallis H非参数检验,并用Dunnett ′s进行组间比较。计数资料采用卡方检验。P<0.05认为差异有统计学意义。
结 果
一、Cry1Ac蛋白及不同ICS对大鼠胚胎中脑细胞增殖分化的影响
如表4所示,TM3组、TM1M组、TM3M组和BP组中脑细胞增殖率略低于BC组和NM组,但差异无统计学意义。TM3M组细胞分化率低于BC组和NM组,但差异无统计学意义,其他各组细胞分化率均未同时低于BC组和NM组。PCA组和PCB组细胞增殖与集落分化率都明显减少,与NM组、BC组相比差异均有统计学意义。TM3组、TM1M组、TM3M组、BP组之间细胞增殖率和细胞分化率差异均无统计学意义。
表4 Cry1Ac蛋白、双酚A和不同ICS对大鼠胚胎中脑细胞增殖与分化的影响(mean±SD, n=10)
Table 4 Effects of Cry1Ac protein, bisphenol A and different ICS on proliferation and differentiation of rat embryos midbrain cells(mean±SD, n=10)

GroupsCellproliferationrate(%)Celldifferentiationrate(%)DMSO100.0100.0BC102.0±6.2104.8±7.8NM103.2±4.999.6±5.1TM398.9±5.499.7±7.1TM1M99.4±3.9102.3±7.8TM3M96.8±6.197.2±4.7PCA43.5±4.6#∗14.7±2.8#∗PCB58.7±3.2#∗19.1±3.3#∗BP101.2±9.299.6±6.2
Compared with BC group, * P<0.05; Compared with NM group, # P<0.05
二、Cry1Ac蛋白对大鼠胚胎腭板形态的影响
如图1-A和图1-B所示,BC组和BP组多数腭板正常融合;如图1-C所示,RA组可见较多双侧腭突未接触的腭板。如表5所示,BP组腭板融合率与BC组相比差异无统计学意义;RA组腭板融合率与BC组相比明显降低,差异具有统计学意义。
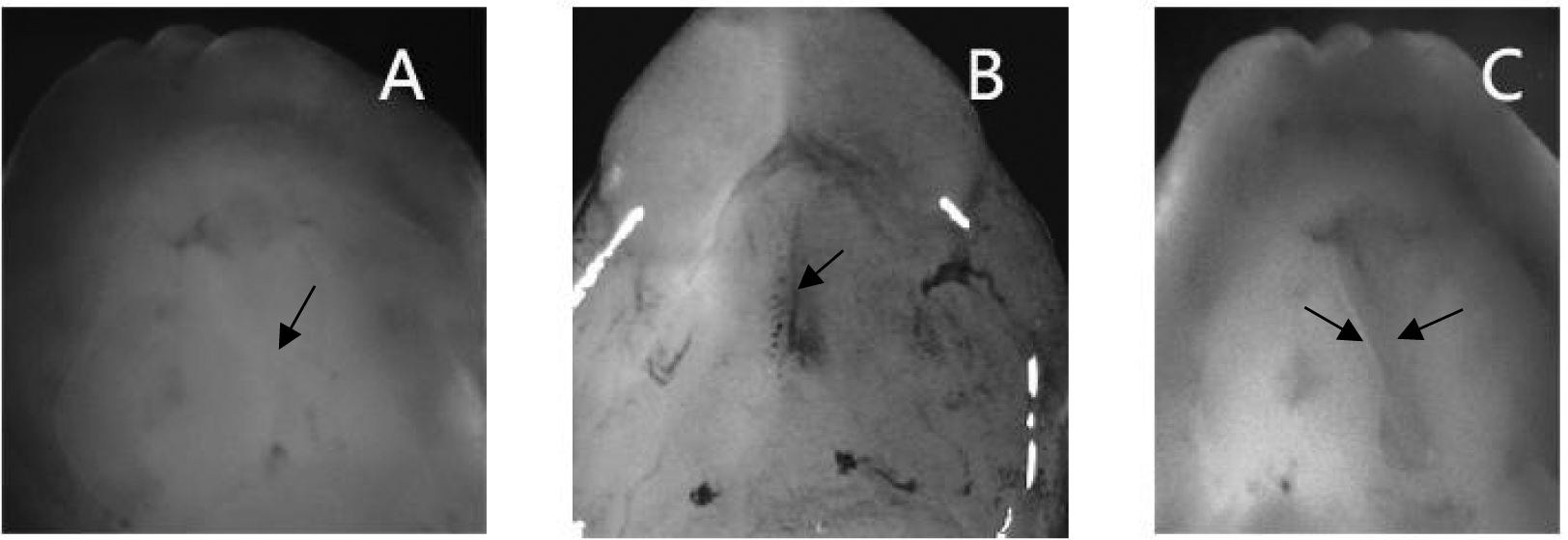
A:Fused palate of BP group; B:Fused palate of BC group; C:Palatal plate without fusion of RA group
图1 Cry1Ac蛋白和全反式视黄酸对腭板融合的影响
Figure 1 Effect of Cry1Ac protein and all trans retinoic acid on palatal fusion
表5 Cry1Ac蛋白与全反式视黄酸对Wistar大鼠胚胎腭板融合率的影响
Table 5 Effects of Cry1Ac protein and all trans retinoic acid on the fusion rate of Wistar Rat embryos palatal plate
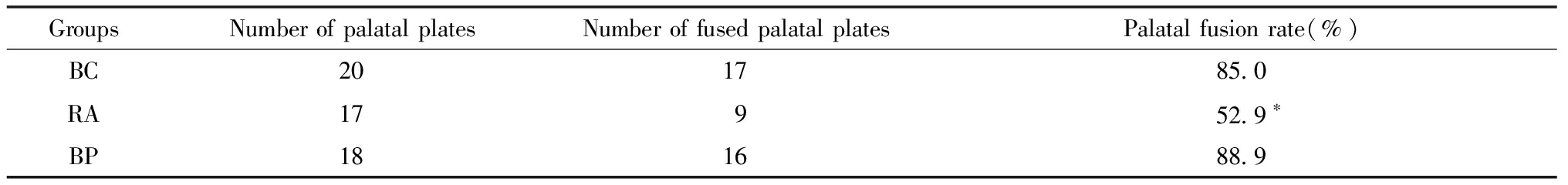
GroupsNumberofpalatalplatesNumberoffusedpalatalplatesPalatalfusionrate(%)BC201785.0RA17952.9∗BP181688.9
Compared with BC group, *P<0.05
三、大鼠血清中Cry1Ac蛋白的含量
按照分组使用加工饲料分别喂养大鼠3 d、1个月、3个月后,所制备ICS中Cry1Ac蛋白含量接近,TM3、TM1M、TM3M组间结果两两比较,差异无统计学意义,MN、BC组大鼠ICS中未检出Cry1Ac蛋白(检测限>0.01μg/L)。TM3、TM1M、TM3M组结果与BC、NM组相比,差异具有统计学意义。
表6 Bt799玉米喂养不同时间后各组大鼠ICS中Cry1Ac蛋白含量(mean±SD, n=8)
Table 6 Cry1Ac protein content in ICS of rats fed with Bt799 maize for different time(mean±SD, n=8)
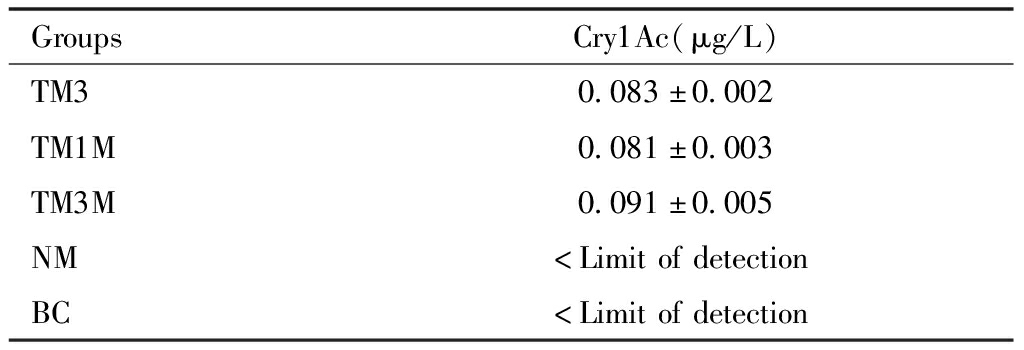
GroupsCry1Ac(μg/L)TM30.083±0.002TM1M0.081±0.003TM3M0.091±0.005NM
讨 论
本研究通过微团培养和腭板培养两种方法,参照食品安全国家标准生殖发育毒性实验(GB 15193.25-2014)对基因工程玉米Bt799及其目的蛋白Cry1Ac进行了发育毒性研究。为了判断饲喂Bt799玉米是否会导致大鼠血清中出现Cry1Ac蛋白,并研究血清中存在Cry1Ac蛋白情况下可能带来的进一步影响,本研究在微团培养中采用经Bt799玉米喂养大鼠的ICS进行实验。与此同时设立BP组,使用Cry1Ac蛋白对胚胎中脑细胞进行干预,通过两种暴露途径共同探究了基因工程玉米Bt799及Cry1Ac蛋白发育毒性的可能性。本研究结果显示,TM3组和BP组细胞增殖率都与BC组和NM组有细微差异,而TM3组血清是存在Cry1Ac蛋白的,提示Cry1Ac蛋白可能对中脑细胞增殖产生了轻微影响。但因整体食物与食物中主要成分无法等价,食物中特定物质的影响也不能代表整体食物的影响,故存在Bt799玉米本身对中脑细胞增殖产生影响的可能性。本研究结果发现,Bt799玉米与已具备足够安全性的亲本对照郑58玉米相比不具备更高危险性;此外BP组与BC组相比细胞增殖率、分化率无明显差异,表明Cry1Ac蛋白未产生不良影响,进一步验证了Bt799玉米的安全性。已有研究证实双酚A具有发育毒性[7],其可能机制是通过影响Notch-Hes通路,增加了Notch1和Hes1 mRNA的表达水平[8]。李勇等[6]研究发现双酚A为阳性致畸物,在40 mg/L的暴露剂量下对中脑细胞微团培养存在不良影响。本研究发现PCA组细胞增殖率与分化率明显低于BC组,这与既往研究结果一致,并与TM3组的结果形成阳性对照,表明Bt799玉米与双酚A相比安全性较高。PCB组细胞增殖率与分化率明显低于BC组,这与既往研究结果一致,并与BP组的结果形成阳性对照,表明Cry1Ac蛋白与双酚A相比安全性较高。但考虑到双酚A的化学结构与Cry1Ac蛋白相比差距较大。建议在后续实验中,进一步以蛋白质类致畸物作为阳性对照,以提高实验结果的准确性。
以上研究结果表明在最大可添加剂量下,Bt799玉米和Cry1Ac蛋白均不会对大鼠胚胎中脑细胞的增殖与分化产生影响。Flint[9]认为受试物的半数分化抑制浓度在10 μg/mL以下时为强致畸物,在100 μg/mL以上时无致畸作用。本研究中Cry1Ac蛋白添加剂量为5.2 mg/L,此剂量下Cry1Ac蛋白未对大鼠中脑细胞增殖与分化产生影响。在后续研究中应设置更高剂量梯度,计算Cry1Ac蛋白的半数分化抑制浓度和半数增殖抑制浓度,从而判定Cry1Ac蛋白的致畸性。从实际暴露的角度出发,Cry1Ac蛋白的唯一暴露途径为通过基因工程作物经口摄入,暴露水平不会高于5.2 mg/L,与此同时Cry1Ac蛋白检测结果提示喂养不同时长后大鼠ICS中Cry1Ac蛋白含量无明显差异,提示Cry1Ac蛋白未表现出蓄积性,进一步说明不存在暴露水平高于5.2 mg/L的可能性。因此,探索Cry1Ac蛋白的半数分化抑制浓度和半数增殖抑制浓度仅可作为Cry1Ac蛋白研究的补充,但不具备较高食品安全评价价值。TM3组、TM1M组、TM3M组细胞增殖率、分化率与BC组、NM相比均无明显差异,表明在最大可添加量下,饲喂Bt799玉米三个月不会对大鼠胚胎中脑细胞活动产生不良影响,喂养时长不是可能导致不良结果的主要因素。本研究里ICS中Cry1Ac蛋白检测结果表明,使用含Bt799玉米的加工饲料喂养大鼠可导致Cry1Ac蛋白在血清中的存在,这提示亲代大鼠摄入Bt799玉米后,其胎仔存在暴露于Cry1Ac蛋白的可能性;但血清中可检测到Cry1Ac蛋白的具体原因尚不明确,有待进一步实验确认。与此同时,本次研究所用ICS均来自雄鼠,所测结果可能与雌鼠羊水中Cry1Ac浓度存在差异,建议在后续研究中,同时检测雌鼠孕期血清与羊水中Cry1Ac蛋白浓度,明确该蛋白通过胎盘屏障的可能性。大鼠胎仔生物结构尚未发育完全,血脑屏障是否能阻断Cry1Ac蛋白的通过存在不确定性,故在后续研究中建议检测大鼠胎仔大脑中Cry1Ac蛋白含量,判断该蛋白通过血脑屏障的可能性。
腭板培养是判断物质致畸性的常用方法[10]。Shiota等[11]认为血清中含有不确定物质,不利于体外环境的控制。本研究采用无血清的标准BGjb培养液作为腭板培养基,排除了血清对实验的影响。本研究结果显示,RA组腭板融合率显著低于BC组,表明ATRA在本研究所用剂量下会显著影响腭板融合,这与Han等[12]的研究结果一致。并与BP组形成阳性对照,表明在最大可能暴露剂量下,Cry1Ac蛋白对大鼠腭板融合无不良影响。
本研究结果表明,在最大可能暴露剂量下,Bt799玉米和目的蛋白Cry1Ac均不具备发育毒性。Guo等[13]使用Bt799玉米喂养雄性大鼠13周,未发现该玉米对大鼠健康状况和生殖系统的不良影响。Hu等[14]使用可表达Cry1Ac蛋白的基因工程大米对大鼠进行连续三代的喂养,除观察到一些血液学指标变化外未观察到其他不良改变。总体而言,Bt799玉米是安全的。对Cry1Ac蛋白的安全性研究可作为基因工程作物食用安全性的证据[15],但目前Cry1Ac蛋白的安全性尚无定论。Santos-Vigil等[16]通过灌胃Cry1Ac蛋白的方式对大鼠进行干预,发现该蛋白具有肠道致敏性。Torres-Martínez等[17]研究发现Cry1Ac蛋白可影响大鼠巨噬细胞的活动,通过NAPK和NF-κB途径诱导巨噬细胞的活化。所以围绕Cry1Ac蛋白的研究依然具有实际价值。但受毒理学资料不足以及最大可添加剂量的限制,目前只能在一定限度内说明Cry1Ac蛋白对大鼠胚胎发育的安全性,而对Cry1Ac蛋白是否属于致畸物这一问题的判断需要毒理学研究的补充。
国内目前对基因工程作物的态度为应以实质等同性原则为基础并综合采纳其他方法开展研究,其中也包括危险性评价和个案处理原则[18]。本研究使用体外实验替代了整体动物实验,一方面降低了对实验动物的伤害,另一方面在体外获得了更加直观的结果。同时也从新的角度针对基因工程作物展开了研究,为后续研究提供了新的数据与方法参考。此外,目前国内外围绕基因工程作物的研究多为整体动物实验。体外研究较少且评价方法单一,分子水平研究的报道较少[19]。因此,后续应在目前研究的基础上,更加深入地探讨基因工程作物的安全性,最大限度保证基因工程作物在实际应用中的安全性。
综上所述,本研究未观察到Bt799玉米及其表达蛋白Cry1Ac对大鼠胚胎中脑细胞和腭板发育的不良影响。
1 Guimaraes V,Drumare MF,Lereclus D,et al.In vitro digestion of Cry1Ab proteins and analysis of the impact on their immunoreactivity.J Agric Food Chem,2010,58:3222-3231.
2 Adel-Patient K,Guimaraes VD,Paris A,et al.Immunological and metabolomic impacts of administration of Cry1Ab protein and MON 810 maize in mouse.PLoS One,2011,6:16346.
3 Herman RA,Schafer BW,Korjagin VA,et al.Rapid digestion of Cry34Ab1 and Cry35Ab1 in simulated gastric fluid.J Agric Food Chem,2003,51:6823-6827.
4 Gomez I,Pardo-Lopez L,Munoz-Garay C,et al.Role of receptor interaction in the mode of action of insecticidal Cry and Cyt toxins produced by Bacillus thuringiensis.Peptides,2007,28:169-173.
5 Park JJ,Weldon BA,Hong S,et al.Characterization of 3D embryonic C57BL/6 and A/J mouse midbrain micromass in vitro culture systems for developmental neurotoxicity testing.Toxicol In Vitro,2018.4,48:33-44.
6 李勇,龙鼎新,裴新荣.采用微团培养技术探讨双酚A的体外发育毒性.卫生研究,2002,31:178-179,183.
7 Morrissey RE,GeorgeJD,Price CJ,et al.The developmental toxicity of bisphenol A in rats and mice.Fundam Appl Toxicol,1987,8:571-582.
8 刘然,蒋建军,尚兰琴,等.双酚A抑制大鼠胚胎中脑微团细胞的存活和分化与Notch-Hes通路有关.中国药理学与毒理学杂志,2014,28:175-181.
9 Flint OP.An in Vitro Test for Teratogens:Its Practical Application.Food Chem Toxicol,1986,24:627-631.
10 韩静,肖颖,林久祥,等.小鼠腭板旋转培养模型的建立及其初步应用.卫生研究,2006,1:33-35.
11 Shiota K,Kosazuma T,Klug S,et al.Development of the fetal mouse palate in suspension organ culture.Acta Anat(Basel),1990,137:59-64.
12 Han J,Li L,Zhang Z,et al.Platelet-derived growth factor C plays a role in the branchial arch malformations induced by retinoic acid.Birth Defects Res A Clin Mol Teratol,2007,79:221-230.
13 Guo QY,He LX,Zhu H,et al.Effects of 90-Day Feeding of Transgenic Maize BT799 on the Reproductive System in Male Wistar Rats.Int J Environ Res Public Health,2015,12:15309-15320.
14 Hu Y,Zhuo Q,Gong Z,et al.Three-generation reproduction toxicity study of genetically modified rice with insect resistant genes.Food Chem Toxicol,2017,99:190-198.
15 Wang C,Li W,Kessenich CR,et al.Safety of the Bacillus thuringiensis-derived Cry1A.105 protein:Evidence that domain exchange preserves mode of action and safety.Regul Toxicol Pharmacol,2018,99:50-60.
16 Santos-Vigil KI,Ilhuicatzi-Alvarado D,García-Hernández AL,et al.Study of the allergenic potential of Bacillus thuringiensis Cry1Ac toxin following intra-gastric administration in a murine model of food-allergy.Int Immunopharmacol,2018,61:185-196.
17 Torres-Martínez M,Rubio-Infante N,García-Hernández AL,et al.Cry1Ac toxin induces macrophage activation via ERK1/2,JNK and p38 mitogen-activated protein kinases.Int J Biochem Cell Biol,2016,78:106-115.
18 周小宁.两类转基因食品安全原则的对立及伦理考量.前沿,2013,7:57-59.
19 谭小燕,陈高峰,周晓冰,等.转Bt基因水稻的食用安全性评价研究进展.食品科学,2015,36:297-302.