耳聋是严重影响人类健康和生活质量的疾病之一,遗传因素在其发病中占有重要位置。大约 80%遗传性耳聋为非综合征型[1]。近期,国内开展的大规模耳聋分子流行病学研究表明,相当一部分非综合征性耳聋由为数不多的几个基因引起,如 GJB2 基因、SLC26A4 基因、12SrRNA基因以及GJB3 基因等[2]。
目前,国内一些地方已开展利用遗传性耳聋基因检测试剂盒,对新生儿进行耳聋基因筛查[3],这一工作对于早期发现患者和携带者有重要意义。但新生儿筛查是在孩子出生后进行的检查,聋儿出生后没有根治的方法,只能是对症治疗,对预防聋儿出生并没有起到真正作用。
市场上常用的遗传性耳聋基因检测试剂盒,主要是针对GJB2 基因、SLC26A4 基因、12SrRNA基因、GJB3 基因进行检测。
临床上抽取羊水主要是为了诊断胎儿的染色体病。为了使羊水细胞生长的更旺盛,通常在收获羊水细胞前需要更换培养基,为了防止在制备染色体核型标本中发生失败,通常将换液时旧培养基放在另一培养瓶中培养,等胎儿染色体分析完成后,这个培养物通常被废弃。那么是否可以利用这部分羊水细胞进行胎儿耳聋基因检测是本研究所要探讨的问题。如果能够利用这部分羊水细胞进行胎儿耳聋基因的检测,对于防止耳聋患儿出生,早期发现耳聋基因携带者将起重要作用,而且对于充分利用胎儿遗传物质对胎儿遗传病筛查和诊断将有重要意义。
对象和方法
1.对象:选取2019年6月至2019年7月间在内蒙古医科大学附属医院妇产科进行羊水穿刺查胎儿染色体孕妇作为研究对象。入组标准为因母体血清筛查高风险和高龄孕妇(年龄大于35岁患者),且无明显其他疾病史,胎儿染色体核型正常;排除标准为胎儿超声异常,或有明显遗传病病史的孕妇。
2.羊水细胞的收集:用吸管轻轻刮出培养瓶上的羊水细胞,将其与培养液一起吸入离心管,1 500转/5分钟离心。
3.羊水细胞DNA提取和含量检测:选用深圳亚能生物科技有限公司提供的DNA试剂盒,按照试剂盒使用说明进行操作提取羊水标本中DNA,用分光光度法检测标本DNA含量。
选用深圳亚能生物科技有限公司生产的遗传性耳聋基因检测试剂盒,按照试剂盒使用说明进行操作。通过对DNA的扩增、杂交显色,判断待测标本是否存在耳聋相关的基因的突变。
该试剂盒主要检测4个常见的遗传性耳聋基因的16个突变位点,包括GJB2基因的四个突变位点(35del G、176-191del 16、235del C、299-300del AT),GJB3基因的两个突变位点(538C>T、547G>A),SLC26A4基因的八个突变位点(IVS7-2A>G、2168A>G、1174A>T、1226G>A、1229C>T、IVS15+5G>A、1975G>C、2027T),12SrRNA基因的两个位点(1494C>T、1555A>G),通过DNA反向杂交位点显色,判断相应位点的突变情况。图1显示在模条上各基因位点的位置。

图1 耳聋基因检测模条各基因位点图
结果
1.羊水标本的DNA含量:16个羊水DNA标本含量见表1,标本8没有提取到足够DNA。
表1 16个羊水DNA标本含量
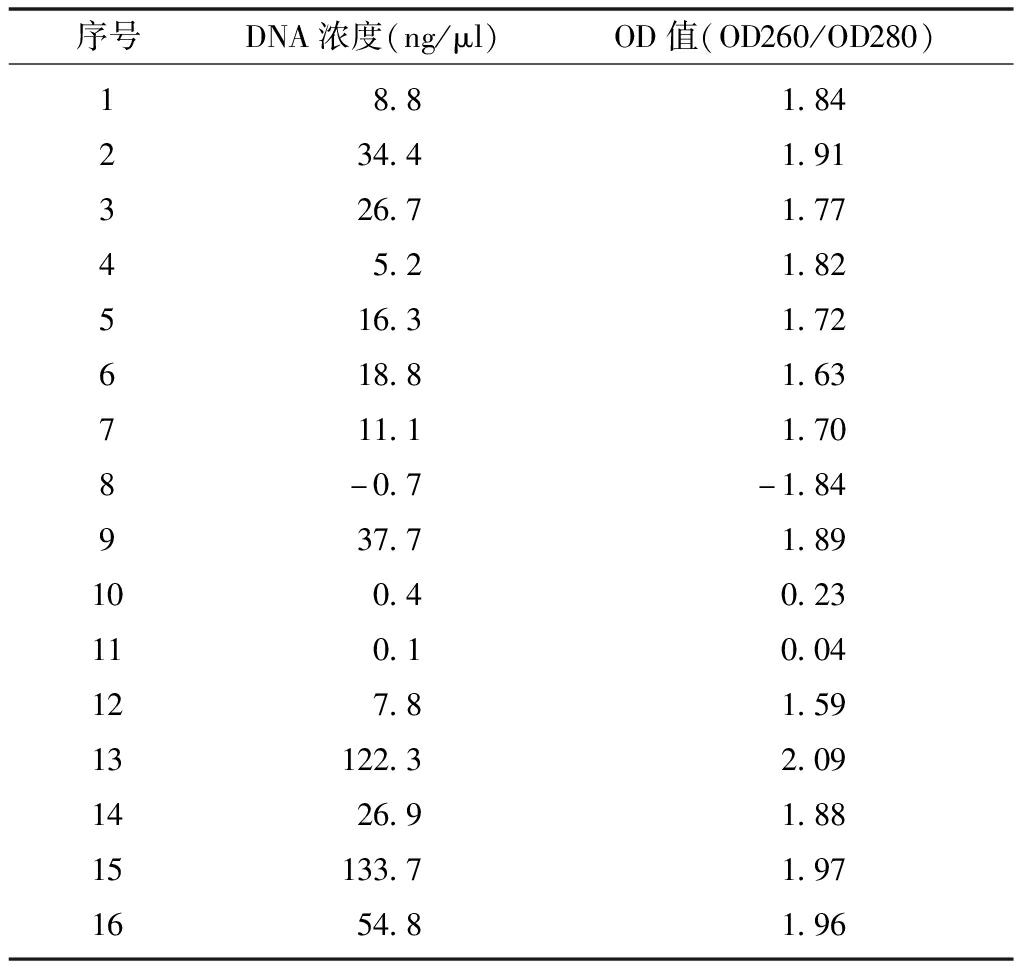
序号DNA浓度(ng/μl)OD值(OD260/OD280)123456789101112131415168.834.426.75.216.318.811.1-0.737.70.40.17.8122.326.9133.754.81.841.911.771.821.721.631.70-1.841.890.230.041.592.091.881.971.96
2.耳聋基因的检测结果:对15个羊水标本和1个已知遗传性耳聋基因携带者外周血标本进行检测,16个标本均可显示清晰的杂交斑点。在15个羊水标本中,6号标本为GJB2 基因突变(235del C突变)杂合子。结果见图2。

图2 6号标本的遗传性耳聋基因检测结果
讨论
本研究结果显示,利用染色体核型分析后剩余羊水标本可以提取足够的DNA进行耳聋基因检测。这一研究结果对于以后开发和利用染色体核型分析后剩余羊水标本对胎儿遗传病进行筛查和诊断有重要意义。
GJB2基因,常染色体隐性遗传。GJB2 基因突变主要导致先天性非综合征性耳聋。GJB2基因的编码产物Cx26蛋白对维持耳内正常渗透压和听觉生理有着极其重要的作用[4]。GJB2基因的致聋机制主要是各种突变所致的Cx26结构和定位异常,从而导致蛋白通道的功能异常[4]。
SLC26A4基因,常染色体隐性遗传。SLC26A4 基因与大前庭水管综合征(enlarged vestibular aqueduct syndrome,EVAS)和Pendred氏综合征密切相关[5]。SLC26A4基因编码产生Pendrin蛋白,表达于内耳、甲状腺和肾脏,SLC26A4基因突变导致Pendrin蛋白的合成和功能的异常,引起前庭水管扩大,使耳蜗前庭的内环境容易受到颅内压的影响,最终导致内耳毛细胞受损,听神经萎缩,造成听觉障碍[6]。
12SrRNA基因是线粒体基因,母系遗传,与氨基糖苷类药物敏感性耳聋密切相关,该基因突变可改变线粒体DNA空间结构,形成与氨基糖苷类药物作用的结合位点,二者结合后阻碍线粒体核糖体蛋白质的合成、抑制ATP合成,K+、Na+、Ca2+离子泵丧失功能,最终因听毛细胞逐渐死亡而引起不可逆性耳聋[7]。
GJB3基因,常染色体显性或隐性遗传性耳聋,与后天高频感音神经性耳聋有关[8]。GJB3基因突变使缝隙连接蛋白Cx31结构发生改变,最终导致后天高频感音神经性耳聋[9]。间隙连接蛋白在耳蜗Corti氏器的K+循环通路中至关重要,GJB3基因突变导致其编码的Cx31蛋白在细胞膜上丢失,导致K+循环被破坏,使Corti氏器局部K+浓度过高,发生钾中毒,最终导致耳聋[9]。
羊水中的细胞主要来源于胎儿皮肤和黏膜的脱落细胞,在这些细胞中仅有少量活细胞,因此在制备染色体标本时需要对羊水细胞进行1周左右的培养,让少量活细胞增殖达到一定数量时才能制备染色体核型标本,羊水细胞以贴壁方式增殖[10]。在培养液中仅有少量的活细胞,本研究将这部分细胞放入另一个培养瓶中,少量的活细胞又可以增殖、贴壁。本研究主要是从第二次贴壁羊水细胞中提取DNA。在从培养瓶上刮出贴壁细胞前,都在倒置显微镜下观察到有细胞增殖的克隆。在16个标本中,有15个标本都提取到了一定量的DNA,有一个标本没有提取到足够DNA。导致没有提取到足够DNA的可能的原因有以下两个方面:(1)细胞增殖不够充分,活细胞量少;(2)在DNA提取过程中有操作失误。在今后的研究中,可以通过评估细胞增殖的克隆数来选取提取羊水细胞DNA的时机,提高提取DNA的成功率。
本研究主要是通过商业化的遗传性耳聋基因检测试剂盒对常见的四种耳聋基因进行检测,这四种耳聋基因遗传方式明确,耳聋基因致病机制复杂,到目前为止对于遗传性耳聋没有根治的方法。如果在行胎儿染色体检查时,同时对耳聋基因进行检测,对减少聋儿出生的发生风险有重要意义。
志谢:内蒙古医科大学附属医院妇产科遗传室武艾宁、于荣鑫和万骁文老师
1 章雪芹,魏澄,王栋,等.遗传性耳聋基因筛查在新生儿听力筛查中应用研究.中国实用妇科与产科杂志,2016,32:273-275.
2 Pan J,Xu P,Tang W,et al.Mutation analysis of common GJB2,SCL26A4 and 12S rRNA genes among 380 deafness patients in northern China.Int J Pediatr Otorhinolaryngol,2017,98:39-42.
3 Jiang Y,Huang S,Deng T,et al.Mutation spectrum of common deafness-causing genes in China.Gene,2015,570:272-276.
4 姜增誉,陈文青,何生.致聋基因GJB2的研究现状.临床医药实践,2018,27:624-626,636.
5 Wang QJ,Zhao YL,Rao SQ,et al.A distinct spectrum of SLC26A4 mutations in patients with enlarged vestibular aqueduct in China.Clin Genet,2007,72:245-254.
6 赵雪雷,黄丽辉,王雪瑶,等.SLC26A4基因突变与听力表型的关系.国际耳鼻咽喉头颈外科杂志,2017,41:327-330,336.
7 侯小娟,阿布利克木·依明,康本,等.乌鲁木齐地区线粒体12SrRNA基因突变筛查分析.中国耳鼻咽喉头颈外科,2015,22:63-66.
8 孟卫京,卢文亮,宁伟霞,等.GJB3基因在山西省晋城地区新生儿筛查中的突变分析.山西医药杂志,2019,48:359-360.
9 胡煜,孙敬武,孙家强,等.非综合征型聋患者常见耳聋基因突变分析.中华耳科学杂志,2013,11:121-125.
10 张志强,林少宾,谢英俊,等.改良孕中晚期羊水细胞培养方法的实验研究.中华医学遗传学杂志,2014,31:109-110.