·生殖医学·
体外受精/卵胞质内单精子显微注射(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)控制性超促排卵(controlled ovarian hyperstimulation,COH)过程中的GnRH拮抗剂(gonadotropin-releasing hormone antagonist,GnRH-antagonist)方案与GnRH激动剂(gonadotropin-releasing hormone agonist, GnRH-agonist)方案相比,在控制早发黄体生成激素(luteal hormone,LH)峰出现的同时,又能避免卵泡期LH水平过低,或降调节后雌激素水平过低导致围绝经期症状、有效降低卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)发生率和治疗周期更短的优点[1-2],本中心自2014年开始采用拮抗剂方案,从黄体支持[3]、雌激素预处理[4]等方面对该方案不断优化,但拮抗剂方案新鲜周期胚胎移植(fresh embryo transferred, ET)率在卵巢正常反应人群中始终较低,本文就此分析其原因并探讨对策。
回顾性分析2015年7月1日—2017年6月30日期间本中心采用拮抗剂灵活方案和激动剂方案超促排卵并取卵的卵巢正常反应患者的临床资料。
两组患者的纳入标准:年龄<38岁、基础促卵泡素(follicle-stimulating hormone, FSH)≤12 IU/L、5<基础窦卵泡数<15个、3<获卵数<15个,体重指数(body mass index,BMI)为17~25 kg/m2。
排除标准:(1)拟行胚胎植入前遗传学诊断或筛查患者;(2)助孕周期数≥3个;(3)合并宫腔粘连、宫腔占位或先天性子宫畸形者;(4)配偶重度畸形精子症;(5)随访至2020年6月30日尚未活产,且还有冷冻胚胎者,或虽已获临床妊娠但尚未活产者;(6)失访者。
1. GnRH拮抗剂方案:采用拮抗剂灵活方案,患者自超促排卵的前次月经黄体中期开始口服天然雌激素17β-雌二醇(商品名:芬吗通,红色片;荷兰雅培制药,2 毫克/片) 2 mg,bid预处理,至月经来潮第2日,根据卵巢储备功能及BMI确定促性腺激素(gonadotropin,Gn) 启动剂量,Gn包括基因重组卵泡刺激素(商品名:果纳芬,默克雪兰诺,瑞士;或商品名:普利康,默沙东,美国)或尿源性FSH(商品名:丽申宝,珠海丽珠制药),剂量为112.5~300 IU/d,根据卵泡的反应性调整Gn用量,Gn第4~6天开始间隔1~3日复查性激素、卵泡生长情况。当最大卵泡直径≥10 mm、血清雌二醇(E2)>500 pg/mL,且血清LH较Gn启动日有上升趋势时,开始皮下注射拮抗剂(注射用西曲瑞克,默克雪兰诺,瑞士;或注射用醋酸加尼瑞克,默沙东,美国;0.25 毫克/支)0.125~0.25 mg/d,根据卵泡生长及激素水平调整Gn及拮抗剂使用剂量,当至少3个优势卵泡直径达17 mm时,当日20:30左右注射hCG(商品名:丰泽;安微丰原药业)6 000~10 000 IU扳机,存在OHSS风险的患者,使用hCG 2 000 IU与短效GnRH-a(醋酸曲普瑞林,0.1 毫克/支,博福益普生生物制药,法国) 0.1~0.2 mg “双扳机”。36~38 h后阴道超声引导下经阴道穿刺取卵。
2. GnRH激动剂方案:于COH周期的月经第2天,或前次月经排卵前或黄体中期,进行垂体降调节,使用长效GnRH-a(醋酸曲普瑞林,博福益普生制药公司,法国,3.75 毫克/支) 1.125~3.75 mg肌肉注射,或短效GnRH-a (醋酸曲普瑞林,博福益普生制药公司,法国,0.1 毫克/支) 0.05 mg每日皮下注射,14~28 d后检测性激素、窦卵泡直径,达到降调节标准后根据卵巢储备功能及BMI确定Gn启动剂量,使用Gn第5~6天开始间隔1~3日复查性激素、卵泡生长情况,根据卵泡生长情况及激素变化调整Gn用量;hCG 6 000~10 000 IU扳机,扳机标准同拮抗剂方案。
3取卵后处理:获卵后根据患者情况行常规IVF或ICSI,授精后16~18 h观察受精情况,参照胚胎评分标准将受精正常、第3日细胞数为7~9的Ⅰ、Ⅱ级卵裂期胚胎[5]及第5/6日4BC或4CB以上囊胚[6]评为优质胚胎;体外培养72 h移植或玻璃化冷冻1~2枚卵裂期胚胎,剩余胚胎均继续培养,如有优质囊胚形成行玻璃化冷冻。本研究中无新鲜囊胚移植病例。新鲜周期取消移植标准为(1)存在以下OHSS风险,扳机日雌二醇>5 000 pg/mL或穿刺卵泡数>20个、或获卵数>15个;(2)子宫因素(拟移植日存在宫腔积液或内膜厚度<6 mm等);(3)晚卵泡期孕酮升高,扳机日孕酮(progesterone,P)≥1.5 ng/mL;(4) 无可移植胚胎(包括未获卵、未正常受精、劣质胚胎、胚胎退化等);(5) 其他因素(包括拟移植日发热、腹痛、阴道炎、移植日男方未到场、证件不符等突发情况)。移植后按常规行黄体支持治疗。
4.冻胚胎移植方案:全胚冷冻患者,择日行冻融胚胎移植。月经周期规则患者选用自然周期,有排卵障碍患者采取激素替代周期,移植后按常规黄体支持。
5.观察指标:临床妊娠率(临床妊娠率=临床妊娠周期数/总移植周期数×100%)、流产率(流产率=流产周期数/临床妊娠周期数×100%)、每取卵周期累积活产率(累积活产率=活产周期数/取卵周期数×100%)[7]。活产主要通过电话随访登记。重度OHSS标准参照2016 年美国生殖医学协会《中重度卵巢过度刺激综合征的预防和治疗的临床指南》[8]。
6.统计学处理:应用SPSS 22.0统计软件进行数据分析。正态分布资料以![]() 表示,对正态分布的计量资料,组间比较采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
表示,对正态分布的计量资料,组间比较采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
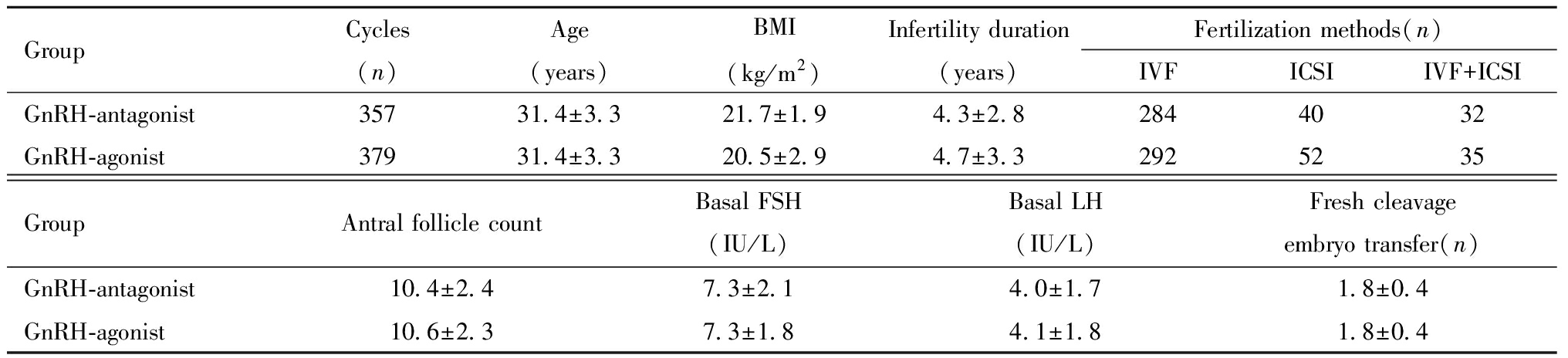
纳入拮抗剂方案357例,激动剂方案379例,两方案患者的年龄、BMI、不孕年限、基础窦卵泡数、基础促卵泡素、基础促黄体生成素、受精方式、新鲜周期移植胚胎数等差异均无统计学意义,见表1。
表1 拮抗剂方案与激动剂方案一般情况比较
Table 1 Comparison of bascic characteristics between GnRH-antagonist and GnRH-agonist protocol
GroupCycles(n)Age(years)BMI(kg/m2)Infertility duration(years)Fertilization methods(n)IVFICSIIVF+ICSIGnRH-antagonist 35731.4±3.321.7±1.94.3±2.82844032GnRH-agonist 37931.4±3.320.5±2.94.7±3.32925235GroupAntral follicle countBasal FSH(IU/L)Basal LH(IU/L)Fresh cleavageembryo transfer(n)GnRH-antagonist10.4±2.47.3±2.14.0±1.71.8±0.4GnRH-agonist10.6±2.37.3±1.84.1±1.81.8±0.4
拮抗剂组COH周期的Gn总天数较长、扳机日子宫内膜较薄,差异有统计学意义。两方案患者Gn总量、MII卵数、优胚数、优质囊胚数、每取卵周期累积活产率比较,差异无统计学意义。拮抗剂方案新鲜周期移植228例,激动剂方案新鲜周期移植308例,两方案新鲜周期移植的临床妊娠率、流产率、宫外孕率、重度OHSS发生数差异均无统计学意义,见表2。
表2 拮抗剂方案与激动剂方案临床及实验室情况比较
Table 2 Comparison of clinical and laboratory data between GnRH-antagonist and GnRH-agonist protocol

GroupCycles(n)The cumulative live birth rate per oocyteretrieval cycle(%)Fresh embryo transferred(n)Pregnancy rate per ET(%)Miscarriagerate per ET(%)Ectopic pregnancy rate per ET(%)GnRH-antagonist 35761.622847.412.94.6GnRH-agonist 37958.030841.27.84.7GroupDosage of Gn used(IU)Gn used duration(d)∗Endometrial thickness onhCG day(mm)∗D3 good embryos(n)Good blastocyst(n)Embryos transferred(n)No. of severe OHSSGnRH-antagonist 2 562.6±648.110.9±1.210.7±1.97.2±3.13.7±2.71.7±1.21GnRH-agonist 2 579.7±619.210.3±1.511.8±2.46.8±3.33.3±2.61.5±1.12
Note: Comparison between the two group, *P<0.05
拮抗剂方案新鲜周期移植取消率明显高于激动剂方案,差异有统计学意义。取消原因:(1)因晚卵泡期孕酮升高拮抗剂方案82例,是拮抗剂方案新鲜周期移植(ET)取消率高的最主要原因,占该方案取卵人数的22.9% ;激动剂方案18例,占该方案取卵人数的4.7%,差异有统计学意义。(2)为预防OHSS发生和无可移植胚胎拮抗剂方案均为13例,占该方案取卵人数的3.6%(13/357);激动剂方案分别为预防OHSS 3.9%(15/379)、无可移植胚胎3.6%(20/379);拮抗剂方案低于激动剂方案,两方案比较差异有统计学意义。(3)因子宫因素(宫腔积液、内膜薄等),及其他原因(发热、阴道炎、腹痛、男方未到场、证件不符等)拮抗剂方案与激动剂方案比较差异均无统计学意义。见表3。
表3 拮抗剂方案与激动剂方案新鲜周期移植取消率及原因比较
Table 3 Comparison of cancellation rate and reason about embryos transfer

GroupCycles(n)ET cancellation rate(%)∗Rate of preventing severe OHSS(%)∗Rate of high level of serum progesterone(%)∗Rate of uterus factor(%) Rate of poor embryos quality(%)∗Rate of others(%)GnRH-antagonist 35736.13.622.93.13.62.8GnRH-agonist 37918.73.94.72.65.21.5
Note: Comparison between the two group, *P<0.05
1.一般情况:晚卵泡期孕酮升高取消移植82例,与新鲜移植周期228例比较,年龄、BMI、基础窦卵泡数、基础促卵泡素、基础促黄体生成素等差异均无统计学意义,具可比性。见表4。
表4 拮抗剂方案新鲜移植与晚卵泡期孕酮升高取消移植亚组一般情况比较
Table 4 Comparison of bascic characteristics between the ET sub-group and the
ET cancellation because of elevated progesterone sub-group in late follicular phase during the fresh cycles of antagonist protocol

GroupCycles(n)Age(years)BMI(kg/m2)Antral follicle count(n)Basal FSH(IU/L)Basal LH(IU/L)ET22831.6±3.120.6±1.910.3±2.47.3±2.13.9±1.7ET cancellation because of elevated P8231.2±3.920.8±2.110.4±2.47.3±1.63.9±1.6
2.Gn使用情况:同样经COH周期前雌二醇预处理,新鲜周期移植组较晚卵泡期孕酮升高组Gn启动日血清雌二醇更高、血清促黄体生成素较低,差异有统计学意义;两组Gn启动日促卵泡素、Gn总量、Gn总天数差异均无统计学意义,见表5。
表5 拮抗剂方案新鲜移植与晚卵泡期孕酮升高取消移植亚组Gn使用情况比较
Table 5 Comparison of data of Gn between the ET sub-group and the ET cancellation
because of elevated progesterone sub-group in late follicular phase during the fresh cycles of antagonist protocol

GroupCycles(n)Estradiol of D0(pg/mL)∗FSH of D0(IU/L)LH of D0(IU/L)∗Dosage of Gn(IU)Gn used duration (d)ET228131.5±70.15.2±2.42.4±1.32 539.6±668.810.9±1.2ET cancellation because of elevated P 8296.7±58.25.6±2.63.0±1.72 632.3±582.610.9±1.2
Note: Comparison between the two group, *P<0.05
3.拮抗剂使用情况:晚卵泡期孕酮升高取消移植组更早添加拮抗剂,添加拮抗剂日卵泡数更多、拮抗剂总剂量、总天数更高,拮抗剂添加日孕酮更高,差异有统计学意义。而拮抗剂添加日血清雌二醇两组差异无统计学意义。见表6。
表6 拮抗剂方案新鲜移植与晚卵泡期孕酮升高取消移植周期拮抗剂使用情况比较
Table 6 Comparison of data about GnRH-agonist between the ET sub-group and the
ET cancellation because of elevated progesterone sub-group in late follicular phase during the fresh cycles of antagonist protocol

GroupCycles(n)Stimulation duration before GnRH-antagonist(days)∗No.of follicle at GnRH-agonist start day#∗E2 on GnRH-agonist start day(pg/mL)LH on GnRH-agonist start day(IU/L)Progesteroneon GnRH-agonist start day(ng/mL)∗Dosage of GnRH-agonist(ug)∗GnRH-agonist used duration(d)∗ET2288.6±1.19.8±3.51 174.4±546.55.5±3.70.8±0.30.7±0.33.1±1.1ET cancellation because of elevated P827.9±1.28.1±3.51 110.2±709.85.4±4.41.2±0.70.9±0.33.7±1.2
Note: Comparison between the two group, *P<0.05;#Follicles of>=6mm present on day 5/6 of stimulation, Follicles of>=11mm present on day7/8 of stimulation
4.扳机日情况及胚胎结局:晚卵泡期孕酮升高取消移植组扳机日血清雌二醇、孕酮更高,所获合格卵数更多,差异有统计学意义。但两组扳机日促黄体生成素、优胚数、优质囊胚数差异均无统计学意义。见表7。
表7 拮抗剂方案新鲜移植与晚卵泡期孕酮升高取消移植亚组扳机日及胚胎情况比较
Table 7 Comparison embryo quality on trigger day between the ET sub-group and the
ET cancellation due to elevated progesterone sub-group in late follicular phase during the fresh cycles of antagonist protocol

GroupCycles(n)E2 level on hCG day(pg/mL)∗LH level onhCG day(IU/l)P level onhCG day(ng/mL)∗Endometrial thickness onhCG day(mm)Number of MII oocytes∗Number of top qualityembryosNumber of high-quality lastocystET2282 232.5±898.02.1±1.60.9±0.310.7±1.86.9±2.83.8±2.61.7±1.2ET cancellation because of elevated P822 672.8±1 021.52.3±3.11.8±0.510.7±2.17.9±2.94.1±2.71.5±1.1
Note: Comparison between the two group, *P<0. 05
拮抗剂方案较激动剂方案,可使垂体快速降调节,且无“一过性升高”效应、可以大幅减少OHSS的发生率和严重程度,与全胚冷冻策略配合尤其适用于卵巢高反应患者。子宫内膜含GnRH受体,GnRH拮抗剂的使用降低了子宫内膜容受性[9],因此,本研究中拮抗剂方案扳机日内膜厚度较激动剂方案低,但Gn总量、获卵数、优胚数、优质囊胚数、累积活产率两方案比较差异均无统计学意义;对于卵巢正常反应人群,超促排卵同样存在OHSS风险;本研究中,拮抗剂方案组为预防OHSS取消移植率、无可移植胚胎率较低,因此,拮抗剂方案也适用于卵巢正常反应人群。本研究中拮抗剂方案均经雌激素预处理,因此Gn天数较激动剂方案长,但Gn总量差异并无统计学意义,在临床结局上,两组差异也无统计学意义;这点与Toftager等的研究结论相似[10]。
全胚冷冻延长了患者获得妊娠的时间、增加了经济费用。近年来,研究表明冻胚移植较鲜胚移植子代出生体重增加及孕妇子痫前期风险增加[11],本研究中,拮抗剂方案新鲜周期取消移植率36.1%,明显高于激动剂方案的18.7%,其中因晚卵泡期孕酮升高取消移植率高达22.9%,差异有统计学意义。因此,迫切需要深入探究正常反应人群行拮抗剂方案晚卵泡期孕酮升高的原因。
卵泡的募集始于前个月经周期的黄体晚期,拮抗剂方案黄体中晚间高水平雌激素的负反馈作用使COH周期Gn启动时的促卵泡生成素、促黄体生成素降低,目的在于提高卵泡发育同步性。王彩霞等[4]的研究发现,正常反应人群拮抗剂方案周期前雌激素预处理可以改善卵泡同步性,增加可利用卵率,从而改善累积妊娠率。本研究中,拮抗剂方案晚卵泡期孕酮升高取消移植组经雌激素预处理后的血清雌二醇水平虽上升至(96.7±58.2)IU/L,但较该方案鲜胚移植组的(131.5±70.1)IU/L明显偏低;血清促黄体生成素水平为(3.0±1.7)IU/L,较移植组的(2.4±1.3)IU/L也明显偏高;血清促卵泡素水平为(5.6±2.6)IU/L,与移植组的(5.2±2.4)IU/L 比较,差异虽无统计学意义,但存在上升趋势;两组窦基础卵泡数无显著差异,但添加拮抗剂日晚卵泡期孕酮升高组卵泡数为(9.8±3.5)个,大于移植组的(8.1±3.5)个;孕酮值达(1.2±0.7)ng/mL,明显高于移植组的(0.8±0.3)ng/mL,差异显著。较多生长的优势卵泡在卵泡晚期参与了孕酮的升高,即使早加拮抗剂也无法阻止扳机日孕酮值升至(1.8±0.5)ng/mL,明显高于移植组的(0.9±0.3)ng/mL。因此,正常反应人群行拮抗剂方案晚卵泡期孕酮的升高可能源于正常反应人群中的部分亚人群对雌激素预处理的反应不足。鉴别这部分亚人群,调整预处理策略,或采用降调节方案可能更能获得鲜胚移植的机会。
同时,虽然晚卵泡期孕酮升高取消移植组较GnRH鲜胚移植组有较多优势卵泡生长,获合格卵数也较多,但并未增加优胚数和优质囊胚形成数。有研究[12]认为,无论激动剂还是拮抗剂方案,当孕酮水平过高,均伴随妊娠率的降低,这可能与晚卵泡期孕酮水平升高加速子宫内膜向分泌期转化,着床窗提前关闭有关[13]。大样本meta分析提示,外源性Gn每日剂量过高、天数延长与扳机日孕酮升高及妊娠率下降有关[14],本研究中,因孕酮升高取消移植组Gn总量为(2 632.3±582.6)IU/L,较移植组有升高趋势,差异虽无统计学意义,但提示个体化地选择合适的Gn剂量可能有助于降低扳机日孕酮值。
杨婷等[15]研究发现,拮抗剂方案晚卵泡期孕酮高于1.5 ng/mL且持续0~2 d不影响临床妊娠率,超过4 d妊娠率下降,建议取消移植。徐蓓等[16]研究发现,低、中、高反应者孕酮水平降低妊娠率的切点值不同,依次为1.5 ng/mL、1.75 ng/mL、2.25 ng/mL;本中心将孕酮升高取消移植的切点值定为1.5 ng/mL,是否进一步根据卵巢不同反应制定不同的取消移植的孕酮切值及高孕酮暴露时间值得将来进一步探讨。
综上所述,拮抗剂方案较激动剂方案新鲜周期取消移植率高,但两方案临床结局相近,拮抗剂方案OHSS发生风险明显降低,激动剂患者有更好的子宫容受性;识别对雌激素预处理反应不良人群、进一步调整预处理策略,甚至改变刺激方案以降低超促排卵晚卵泡期孕酮水平是提高卵巢刺激周期鲜胚移植率的关键因素。
本研究既有通过实时数据反馈及时给临床工作提供有价值信息的优点,也存在回顾性分析较多混杂因素等不足之处。进一步可尝试(1)细分研究人群,按卵巢正常反应人群周期前雌激素预处理后的血清雌激素水平分为预处理敏感型和不敏感型进行研究;(2)探究不同反应人群扳机日不同孕酮切值以及高孕酮暴露的时间长短对鲜胚移植妊娠率的影响;(3)在此基础上,进行前瞻性队列研究。
1 Al-Inany HG,Youssef MA,Ayeleke RO,et al.Gonadotrophin-releasing hormone antagonists for assisted reproductive technology.Cochrane Database Syst Rev,2016,4:14-16.
2 Ovarian Stimulation TEGGO,Bosch E,Broer S,et al.ESHRE guideline:ovarian stimulation for IVF/ICSI.Hum Reprod Open,2020,2:1-13.
3 毛丽华,刘芸,黄吴键,等.拮抗剂方案促排卵新鲜周期移植的黄体支持方案分析.生殖医学杂志,2020,29:323-327.
4 王彩霞,刘芸,黄吴键,等.雌激素预处理在不同卵巢反应人群使用拮抗剂方案中的应用研究.中华生殖与避孕杂志,2020,40:708-715.
5 Veeck L.Preembryo grading and degree of cytoplasmi c fragmentation.In:Veeck L,ed.An atlas of human gametes and conceptuses:an illustrated reference for assisted reproductive technology.New York:The Parthenon Publishing Group,1999:46-51.
6 Jansen R,Mortimer D,editors.Toward reproductive certainty:infertility and genetics beyond.Carnforth:Parthenon Publishing,1999:378-388.
7 中国医师协会生殖医学专业委员会.基于单次促排卵周期的累积分娩/活产率专家共识.中华生殖与避孕杂志,2018,38:963-968.
8 Practice Committee of the American Society for Reproductive Medicine.Electronic address:ASRM@asrm.org; Practice Committee of the American Society for Reproductive Medicine.Prevention and treatment of moderate and severe ovarian hyperstimulation syndrome:a guideline.Fertil Steril,2016,106:1634-1647.
9 Chen Q,Yu F,Li Y,et al.Comparative proteomics reveal negative effects of gonadotropin-releasing hormone agonist and antagonist on human endometrium.Drug Des Devel Ther,2019,13:1855-1863.
10 Toftager M,Bogstad J,L ssl K,et al.Cumulative live birth rates after one ART cycle including all subsequent frozen-thaw cycles in 1050 women:secondary outcome of an RCT comparing GnRH-antagonist and GnRH-agonist protocols.Hum Reprod,2017,32:556-567.
ssl K,et al.Cumulative live birth rates after one ART cycle including all subsequent frozen-thaw cycles in 1050 women:secondary outcome of an RCT comparing GnRH-antagonist and GnRH-agonist protocols.Hum Reprod,2017,32:556-567.
11 Maheshwari A,Raja EA,Bhattacharya S.Obstetric and perinatal outcomes after either fresh or thawed frozen embryo transfer:an analysis of 112,432 singleton pregnancies recorded in the Human Fertilisation and Embryology Authority anonymized datase.Fertil Steril,2016,106:1703-1708.
12 吴惠华,孟庆霞,邹琴燕,等.GnRH激动剂及GnRH拮抗剂方案中HCG日孕酮水平对IVF-ET妊娠结局的影响.生殖医学杂志,2017,26:24-28.
13 Liu L,Sailan S,Li T,et al.The effect of a high progesterone concentration before oocyte retrieval on the peri-implantation endometrium.Reprod Bio Med Online,2015,31:739-746.
14 Venetis CA,Kolibianakis EM,Bosdou JK,et al.Progesterone elevation and probability of pregnancy after IVF:a systematic review and meta-analysis of over 60 000 cycles.Hum Reprod Update,2013,19:433-457.
15 杨婷,王薇,朱海英,等.GnRH拮抗剂方案中晚卵泡期高孕酮暴露时间对临床妊娠率的影响.中华生殖与避孕杂志,2018,38:210-214.
16 徐蓓,李舟,章汉旺,等.血清孕酮升高对卵巢不同反应者体外受精胚胎移植结局的影响.生殖医学杂志,2013,22:685-691.