先天发育结构异常是新生儿出生缺陷中最常见的一种,目前发生率约占临床活产儿的3%,轻度畸形可对家庭造成负担,严重时则会对新生儿生命造成威胁[1]。胎儿超声软指标是指在超声检查时发现的胎儿结构的微小改变,在正常胎儿和染色体异常胎儿中均可发生,但在染色体异常胎儿中发生率更高,国内外越来越多研究表明,产前超声软指标与染色体异常相关 [2-4]。有研究指出超声软指标异常及结构畸形时,胎儿发生染色体异常风险显著增高,对胎儿进行选择性染色体核型分析,可显著降低出生缺陷率[5]。染色体核型分析是目前细胞遗传学产前诊断的主要方法,但其获得结果所需时间相对较长,且因受实验室显微镜分辨率、显带技术等影响,无法明确检测出亚显微异常、未知染色体异常[6]。DNA拷贝数变异(copy number variations, CNVs),是指1 kb以上的异常DNA结构,包括DNA片段的重复、缺失、插入、倒位,CNVs不仅可以在人类基因组中作为遗传多态性分布,也与异常表型相关,可以导致出生缺陷,目前,已有超过300例由致病性CNVs引起的染色体微缺失或微重复综合征,合并发病率近1/600,占染色体畸变所致出生缺陷的一半 [7-8]。高通量测序技术,即第二代测序技术,可一次性对几十乃至几百万DNA分子序列进行测定,该技术的出现,使得基因领域的研究取得了突破性进展[9]。高通量测序技术可在全基因组的范围内对CNVs进行检测并发现亚显微结构的染色体异常,无需细胞培养,耗时短,已经被证明在产前样本中检测胎儿CNVs具有高可靠性、准确性和重复性[10]。本研究通过对胎儿超声存在结构异常或软指标异常的患者同时行染色体核型分析及高通量测序技术检测,比较分析染色体核型异常及CNVs检测与胎儿超声异常的关系,探讨高通量测序技术在产前诊断中的临床应用价值。
资料与方法
一、资料来源
选择2017年7月—2019年6月于哈尔滨医科大学附属第二医院产前诊断中心就诊、并自愿进行羊水穿刺的孕妇为研究对象,对其中350例超声提示胎儿结构及软指标异常的孕妇进行常规染色体核型分析及高通量测序CNVs检测。孕妇年龄 18~45岁,平均(30.7±2.5)岁;孕周17~27周,平均(20.5±2.5)周。
二、方法
1. 胎儿超声软指标异常和超声结构异常:使用SIEMENS-6超声仪对胎儿进行系统筛查。系统筛查目的包括(1)超声软指标异常。即脉络丛囊肿、心室强回声光点、颈后皮肤增厚、肠管强回声、轻度肾盂扩张(孕20~30 周, 肾盂前后径>5 mm;孕30~40周, 7 mm<肾盂前后径<10 mm,不伴有肾盏扩张)、轻度侧脑室增宽、鼻骨短小和单脐动脉等[11]。(2)超声结构异常。
2. 羊膜腔穿刺术:在超声引导下,无菌抽取羊水25~30 mL ( 20 mL行染色体核型分析,5~10 mL行高通量测序CNVs检测)。
3. 染色体核型分析:在无菌操作条件下,将抽取的羊水标本离心后弃上清液,将沉淀制成细胞悬液,接种于羊水培养基培养。7日后观察细胞生长情况、换液。经过消化、低渗、固定等步骤,将获得的沉淀制成细胞悬液,在冰片上制片,G显带染色。每例标本选择形态适中、显带清楚的核型分析至少5例,计数至少20个核型,如遇异常或有疑问的标本则计数不少于50个分裂相。
4. 全基因组CNVs:应用QIAamp DNA提取试剂盒提取5 mL羊水全基因组DNA,纯化后的DNA浓度大于10 ng/μL。取50 ng基因组DNA,应用染色体拷贝数变异检测试剂盒(测序法)构建测序文库,纯化所得文库DNA浓度大于20 nM/μL,使用MGISEQ-2000测序平台,测序深度0.4X进行测序。测序结果通过生物信息分析获得CNVs,再通过检索多个数据库平台,UCSC、DGV、OMIM、HGMD、DECIPHER、PubMed和ISCA等数据库,参考美国医学遗传学会指南(American College of Medical Genetics, ACMG)指南[12],对检测结果进行判定。
5. 结果判读:胎儿染色体细胞遗传学命名参考《人类细胞遗传学国际命名体制(ISCN)(2013)》[13],高通量测序结果分为致病性、多态性及临床意义未明、正常三种情况。
6. 统计学处理:应用SPSS24.0进行分析,计数资料的组间比较进行χ2(%)检验,P<0.05表示差异具有统计学意义。
结 果
一、超声异常分类及产前诊断结果
胎儿超声异常350例,共检出核型异常78例(22.3%,78/350),致病性CNVs 87例(24.9%,87/350)。其中超声软指标异常243例,占所有胎儿超声异常的69.4%,检测出核型异常49例(20.2%,49/243),致病性CNVs 54例(22.2%,54/243);超声结构异常107例,占所有胎儿超声异常的30.6%,检测出核型异常29例(27.1%,29/107),致病性CNVs 33例(30.8%,33/107)。其中胎儿结构异常中以鼻骨缺失患者的染色体异常核型和致病性CNVs检出率最高,其次为多个结构异常、心脏结构异常等,超声软指标异常中肠管回声增强患者的染色体异常核型和致病性CNVs检出率最高,其次为单脐动脉、鼻骨短小等。超声软指标异常与超声结构异常发生染色体核型异常及致病性CNVs的概率,差异无统计学意义。见表1。
350例胎儿超声异常中,染色体核型正常、CNVs检测提示为多态性及临床意义未明者,共178例(50.9%),染色体核型分析及CNVs检测均未检测出异常者,共77例(22.0%)。
表1 超声异常中染色体核型异常及致病性CNVs检出概况
Table 1 Detection of chromosomal karyotype abnormalities and pathogenic CNVs in ultrasound abnormalities
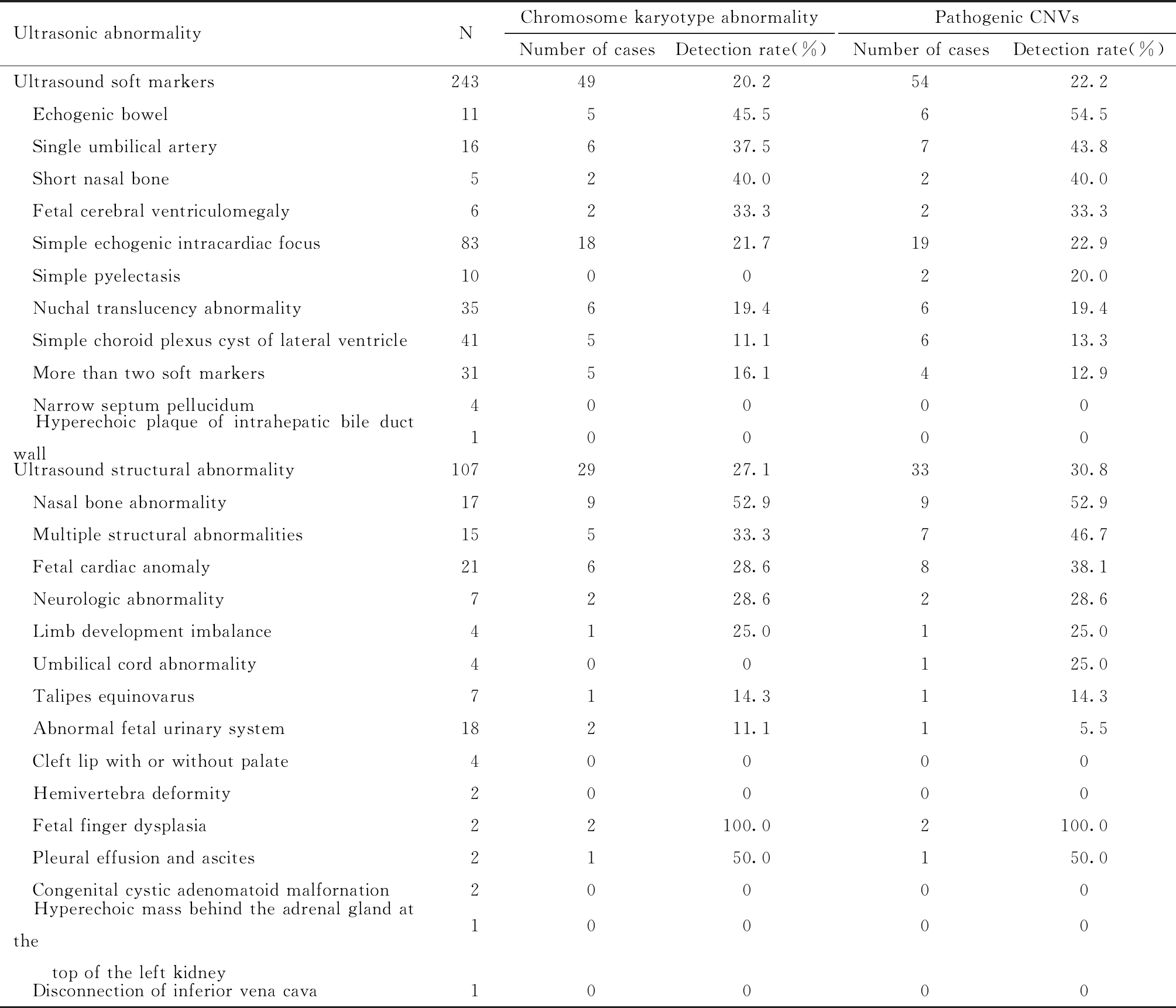
Ultrasonic abnormalityNChromosome karyotype abnormalityNumber of casesDetection rate(%)Pathogenic CNVsNumber of casesDetection rate(%)Ultrasound soft markers2434920.25422.2 Echogenic bowel11545.5654.5 Single umbilical artery16637.5743.8 Short nasal bone5240.0240.0 Fetal cerebral ventriculomegaly6233.3233.3 Simple echogenic intracardiac focus831821.71922.9 Simple pyelectasis1000220.0 Nuchal translucency abnormality35619.4619.4 Simple choroid plexus cyst of lateral ventricle41511.1613.3 More than two soft markers31516.1412.9 Narrow septum pellucidum40000 Hyperechoic plaque of intrahepatic bile duct wall10000Ultrasound structural abnormality1072927.13330.8 Nasal bone abnormality17952.9952.9 Multiple structural abnormalities15533.3746.7 Fetal cardiac anomaly21628.6838.1 Neurologic abnormality7228.6228.6 Limb development imbalance4125.0125.0 Umbilical cord abnormality400125.0 Talipes equinovarus7114.3114.3 Abnormal fetal urinary system18211.115.5 Cleft lip with or without palate40000 Hemivertebra deformity20000 Fetal finger dysplasia22100.02100.0 Pleural effusion and ascites2150.0150.0 Congenital cystic adenomatoid malfornation20000 Hyperechoic mass behind the adrenal gland at the top of the left kidney10000 Disconnection of inferior vena cava10000
二、胎儿超声异常中染色体核型结果分析
在350例胎儿超声异常中,染色体核型异常78例,见表2。其中包括3例染色体多态性,分别是(46,X,Yqh+)、(46,XN,1qh+)、(46,XN,21pstk+)。
三、胎儿超声异常中CNVs结果分析
在350例超声异常患者中,共检测出致病性CNVs 87例,其中有17例患者核型分析未见异常(4.9%,17/350),具体致病片段、重复或缺失片段大小及所对应的超声异常,见表3,其中有2例携带同样的致病片段,有1例同时存在2个致病片段。另在染色体核型分析时发现染色体易位、倒位及染色体多态性共计8例,CNVs检测均未提示有致病变异。
四、妊娠结局随访
243例超声软指标异常中检出54例致病性CNVs,其中2例选择继续妊娠,分别为(47,XXX)、(47,XYY),余下52例均选择引产。107例超声结构异常中,检出33例致病性CNVs,均选择引产;余下74例有36例选择引产,34例选择继续妊娠,4例随访失败。
表2 胎儿染色体异常核型检出及构成
Table 2 Detection and composition of fetal abnormal karyotype

Chromosome karyotype abnormalityNumbers of casesDetection rate(%)47, XN, +213747.5247,XN,+1845.1247,XN,+1322.5647,XXY810.2447,XXX45.1247,XYY22.5645,X11.2846,XN,del(9)(p24)11.2846,XN,i(18)(q10)11.2847,XN,+mar11.2846,XN,inv(9)(p11q13)33.8446,XN,del(X)(q21.1)11.2846,XN,t(2;4)(q37;q25)pat11.2846,XN,i(21)(q10)45.1246,XN,rob(14;21)(q10;q10),+2111.2846,XN,inv(9)11.2847,XN,+21[22]/46,XN[78]11.2846,XN,del(3)(q11.1q21)[18]/46,XN[12]11.2846,XN,del(10)add(10)(q26)11.2846,X,Yqh+11.2846,XN,1qh+11.2846,XN,21pstk+11.28Total78100
表3 胎儿超声异常,染色体核型正常,携带致病性CNVs构成分类
Table 3 Classification of pathogenic CNVs in fetuses with normal karyotype and abnormal ultrasound
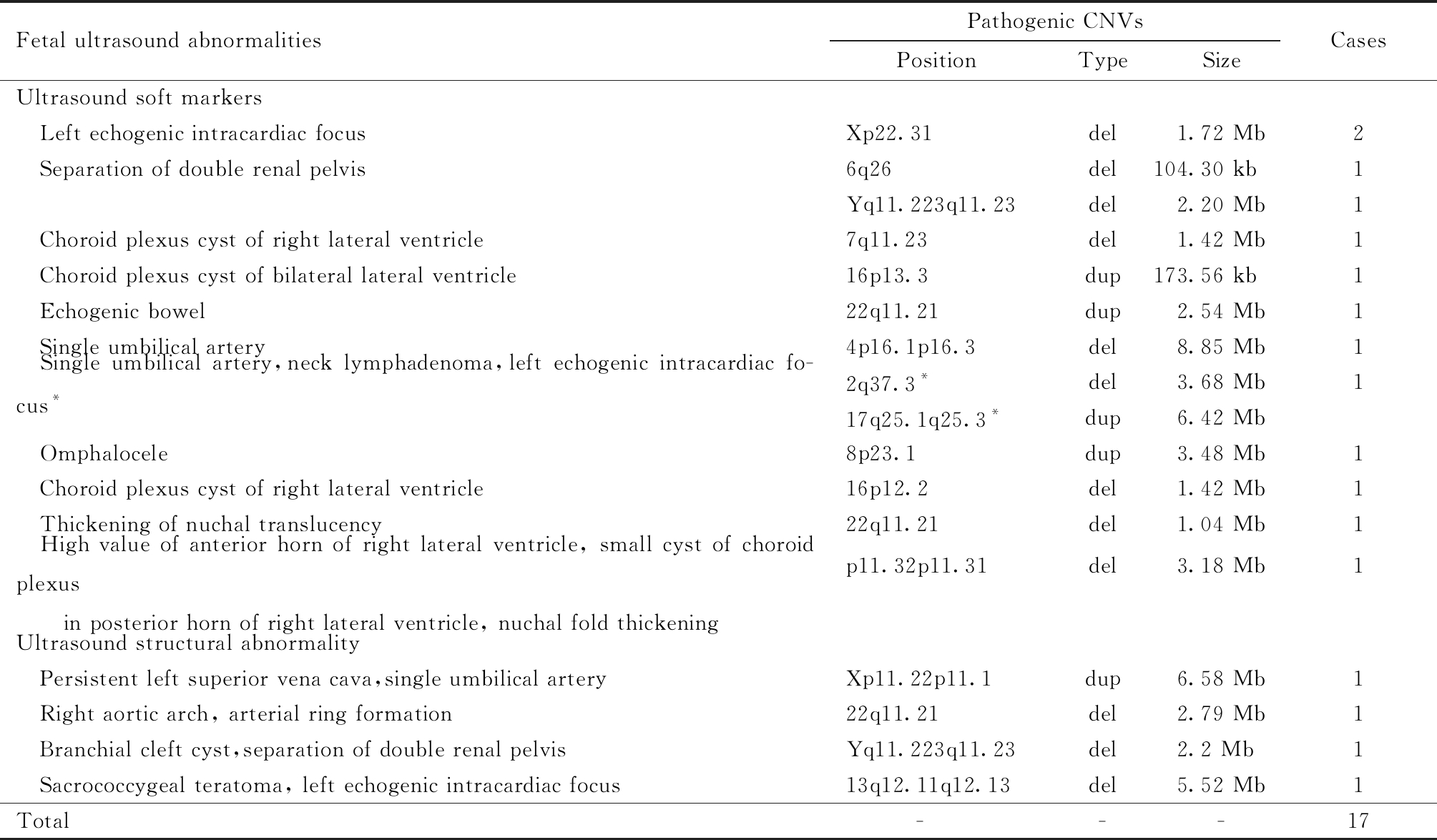
Fetal ultrasound abnormalitiesPathogenic CNVsPositionTypeSizeCasesUltrasound soft markers Left echogenic intracardiac focusXp22.31del1.72 Mb2 Separation of double renal pelvis6q26del104.30 kb 1Yq11.223q11.23del2.20 Mb1 Choroid plexus cyst of right lateral ventricle7q11.23del1.42 Mb1 Choroid plexus cyst of bilateral lateral ventricle16p13.3dup173.56 kb1 Echogenic bowel22q11.21dup2.54 Mb1 Single umbilical artery4p16.1p16.3del8.85 Mb1 Single umbilical artery,neck lymphadenoma,left echogenic intracardiac fo-cus*2q37.3*del3.68 Mb117q25.1q25.3*dup6.42 Mb Omphalocele8p23.1dup3.48 Mb1 Choroid plexus cyst of right lateral ventricle16p12.2del1.42 Mb1 Thickening of nuchal translucency22q11.21del1.04 Mb1 High value of anterior horn of right lateral ventricle, small cyst of choroid plexus in posterior horn of right lateral ventricle, nuchal fold thickeningp11.32p11.31del3.18 Mb1Ultrasound structural abnormality Persistent left superior vena cava,single umbilical arteryXp11.22p11.1dup6.58 Mb1 Right aortic arch, arterial ring formation22q11.21del2.79 Mb1 Branchial cleft cyst,separation of double renal pelvisYq11.223q11.23del2.2 Mb1 Sacrococcygeal teratoma, left echogenic intracardiac focus13q12.11q12.13del5.52 Mb1Total ---17
*There were two pathogenic fragments in this case
讨 论
一、染色体核型分析联合高通量测序CNVs在超声异常胎儿产前诊断中的临床应用
核型分析仍然是目前检测染色体异常的常规方法,能够检测出5~10 Mb以上片段的染色体异常,对基因组平衡的染色体易位及倒位、低水平嵌合的检出率约为30%~40%,但其对微小染色体缺失或重复的检出率较低[14-15]。与染色体核型分析相比,高通量测序技术具有较高的特异性、敏感性,能够精确分析细微染色体片段变异,受人为主观影响小,与染色体核型分析技术具有较高的一致性。国外有学者认为在产前超声发现胎儿超声结构畸形时,高通量测序CNVs检出率明显高于常规核型分析[16-17]。本研究也证实了这一观点,在350例胎儿超声异常中,染色体核型分析检出染色体异常78例,异常检出率为22.3%;CNVs片段87例,异常检出率为33.2%;在272例染色体核型分析正常病例中,CNVs有17例存在致病性拷贝数异常,提示染色体核型分析对微小片段的漏筛率为4.9%。此外,在本研究中,CNVs检测提示为多态性及临床意义未明者占50.9%,这为进行临床检测后的遗传咨询提出了新的挑战,但也意味着随着临床数据的不断累计,人类基因组数据库的不断完善,会有更多的微缺失与微重复的致病性得到证实,该技术在推动遗传学产前诊断方面会起到更重要的作用。
染色体核型分析发现染色体易位、倒位及染色体多态性共计8例,CNVs检测均未提示有致病变异。因此,在产前诊断和遗传咨询时,仍需要考虑到高通量测序技术的局限性,比如无法发现染色体相互异位、倒位等染色体平衡性结构重排,也无法区分游离型三体和易位型三体等,因此,建议结合核型分析进行诊断[9,18]。
二、胎儿超声异常与染色体核型及致病性CNVs的相关性
1. 胎儿超声结构异常与染色体核型及致病性CNVs的相关性:产前胎儿超声异常与胎儿染色体异常的相关性因不同的系统异常而不同, 在本研究中,鼻骨缺失患者的染色体异常核型和致病性CNVs检出率最高,这一异常发生率远高于其他相关文献数据,Ting等[19]的研究表明,单纯鼻骨缺失染色体异常发生率较低,当合并其他系统结构畸形时,染色体异常风险明显增高,本研究中这一异常增高可能与气候等地域条件相关,但因样本量较少,尚需进一步观察。此外本研究结果提示存在多个结构异常、心脏结构异常等情况时染色体异常风险较高,在王咏梅等[20]研究中也指出在产前超声筛查中2个及以上系统胎儿结构畸形、复杂性先天性心脏病或鼻骨缺失合并其他系统畸形胎儿的染色体异常风险增高,Edwards等[21]报道也指出,超声检测出胎儿结构异常越多,胎儿罹患染色体疾病风险越大,这与本研究结果是相一致的。因此,笔者认为当出现上述情形进行产前咨询时应建议行介入性产前诊断以确定胎儿是否为致病性染色体异常。
2. 胎儿超声软指标与染色体核型及致病性CNVs的相关性:近年来,随着超声仪器分辨率的提高和超声医师技术水平的提高,超声软指标的检出率不断提高。对于这部分非明确超声结构异常胎儿是否进行介入性产前诊断仍存在较大争议。文献报道[22-23],胎儿颈部超声异常表型是目前提示胎儿染色体异常最敏感最特异的超声指标,除与染色体非整倍体相关外,胎儿颈项透明层(nuchal translucency,NT)及颈后皮肤皱褶(nuchal fold,NF)异常还与CNVs异常相关,因此,对于超声提示NT/NF增宽的患者建议行介入性产前诊断。Lu等[3]的研究认为单个单次超声软标记在妊娠期多为短暂表现,在没有其他结构缺陷的情况下,在低风险人群中,单个超声软标记物通常会自发消失,预后良好,而当出现多个超声软指标时,染色体异常风险较高,建议在仔细评估后进行介入性产前诊断。目前,各研究尚无统一定论,结合本研究结果,也可发现不同软指标异常的患者染色体异常检出率有明显不同,应根据不同超声软指标异常结合产妇背景风险,决定是否进行羊水穿刺,减少不必要的侵入性检查;在今后的临床工作中也应积累更多的样本,从而更加有效地指导临床产前咨询并制定科学合理的诊疗方案。值得一提的是,上述软指标与染色体异常虽尚无确切相关性,但也可作为仔细筛查胎儿畸形的线索,提醒操作者应仔细检查胎儿有无合并其他部位异常。
三、胎儿超声异常行染色体检测的临床意义
本研究350例胎儿超声异常中,87例检测出致病性CNVs,其中85例尽早选择了终止妊娠,避免了缺陷儿的出生。通过遗传学检测和分析,一方面可以让孕妇尽早选择产科处理,减轻对孕妇的精神和心理伤害,另一方面有利于对患者及家庭再次妊娠后胎儿再发风险的评估。
本研究不足之处是样本量相对较少,病种类型相对单一,不排除样本收集过程中对某种疾病病种的偏倚情况,在胎儿结构异常与软指标异常中,染色体核型异常及致病性CNVs的检出率无显著差异,这可能与本研究样本量不足,以及在临床中面对一些较为严重的结构畸形,患者及家属选择终止妊娠而拒绝行任何产前诊断有关。因此,加强对孕妇及家属的宣传教育在临床工作中应得到重视;对于检测出致病性CNVs的样本,未能用另外一种检测技术进行验证,可能也会存在一定结果的偏倚。
综上所述,规范的产前超声监测,对胎儿的发育、结构等进行系统的排畸检查,具有无创、可反复、操作性强等优势,在产前筛查和诊断中具有重要作用。高通量测序技术能有效地检测出微小片段的染色体异常,但对于染色体易位、倒位的诊断率不及染色体核型分析,故在提高出生缺陷检出率方面,两者具有互补作用。当发现胎儿超声异常时,应该考虑进行产前诊断、染色体核型分析、CNVs检测,以有效提高致病染色体片段的检出率,降低出生缺陷的发生风险,从而更好指导临床工作。
1 刘宸宁.早孕期系统超声切面检查在胎儿结构畸形筛查方面的应用.中外医疗,2016,35:196-198.
2 Kazemi M,Salehi M,Kheirollahi M.Down syndrome:current status,challenges and future perspectives.Int J Mol Cell Med,2016,5:125-133.
3 Lu JW,Lin L,Xiao LP,et al.Prognosis of 591 fetuses with ultrasonic soft markers during mid-term pregnancy.J Huazhong Univ Sci Technolog Med Sci,2017,37:948-955.
4 马涛,杨晓,岳军,等.妊娠中晚期超声软指标与胎儿染色体异常及其围生结局.实用妇产科杂志,2017,33:110-113.
5 刘百灵,王远流,蒋建穗,等.孕期超声筛查胎儿结构畸形和软指标异常的临床意义探讨.中国优生与遗传杂志,2015,23:98-100.
6 Wapner RJ,Martin CL,Levy B,et al.Chromosomal microarray versus karyotyping for prenatal diagnosis.N Engl J Med,2012,367:2175-2184.
7 Freeman,JL,Perry GH,Feuk L,et al.Copy number variation:New insights in genome diversity.Genome Research,2006,16:949-961.
8 Levy B,Wapner R.Prenatal diagnosis by chromosomal microarray analysis.Fertil Steril,2018,109:201-212.
9 何冰,黄莉,张鹏.羊水细胞高通量测序与染色体核型分析在产前诊断中的应用研究.中国临床新医学,2015,8:1113-1116.
10 Wang J,Chen L,Zhou C,et al.Prospective chromosome analysis of 3429 amniocentesis samples in China using copy number variation sequencing.Am J Obstet Gynecol,2018,219:287.e1-287.e18.
11 黄湛,白宇翔,漆洪波.美国胎儿影像指南(2014)解读.中国实用妇科与产科杂志,2015,07:587-591.
12 South ST,Lee C,Lamb AN,et al.ACMG Standards and Guidelines for constitutionalcytogenomic microarray analysis,including postnatal and prenatal applications:revision.2013.Genet Med,2013,15:901-909.
13 金雪鸿,陈鹏龙,陈明妹.等.染色体芯片检测下胎儿心脏发育异常与遗传学异常相关性.中国现代医生,2020,02:111-115,193.
14 Jansen FA,Blumenfeld YJ,Fisher A,et al.Array comparative genomic hybridization and fetal congenital heart defects:a systematic review and meta-analysis.Ultrasound Obstet Gynecol,2015,45:27-35.
15 刘洋,谢建生,耿茜,等.G显带和多重连接依赖探针扩增联合分析心脏发育畸形胎儿的染色体异常.中华医学遗传学杂志,2017,34:1-5.
16 Committee Opinion No.682:Microarrays and next-generation sequencing technology:The use of advanced genetic diagnostictools in obstetrics and gynecology.Obstet Gynecol,2016,128; e262-262e268.
17 Luo S,Meng D,Li Q,et al.Genetic testing and pregnancy outcome analysis of 362 fetuses with congenital heart disease identified by prenatal ultrasound.Arq Bras Cardiol,2018,111:571-577.
18 中华医学会医学遗传学分会临床遗传学组.低深度全基因组测序技术在产前诊断中的应用专家共识.中华医学遗传学杂志,2019,4:293-296.
19 Ting YH,Lao TT,Lau TK,et al.Isolated absent or hypoplasticnasal bone in the second trimester fetus:is amniocentesisnecessary?.J Matern Fetal Neonatal Med,2011,24:555-558.
20 王咏梅,曹荔,吴云,等.胎儿超声结构畸形与染色体微阵列分析的相关性.中国医学影像学杂志,2017,12:919-922.
21 Edwards L,Hui L.First and second trimester screening for fetal structural anomalies.Semin Fetal Neonatal Med,2018,23:102-111.
22 Shirai K,Higashi Y,Shimojima K,et al.An Xq22.1q22.2 nullisomy in a male patient with severe neurological impairment.Am J Med Genet A,2017,173:1124-1127.
23 Lan L,Wu H,She L,et al,Analysis of copy number variation by sequencing in fetuses with nuchal translucency thickening.J Clin Lab Anal,2020,34:p.e23347.