子痫前期(pre-eclampsia,PE)发生率约为5%,是造成孕产妇和围产儿高发病率和死亡率的主要原因,其主要特征为孕妇在妊娠20周后出现高血压、蛋白尿以及全身水肿等症状[1]。尽管目前已对子痫前期进行了广泛的研究,但其确切的病因仍是未知的。
有证据表明,孕妇对妊娠的全身炎症反应是子痫前期发病的关键环节[2-3]。Redman等[4]研究了子痫前期孕妇的炎症反应,指出其与多种促炎趋化因子的水平升高有关。趋化因子(chemokines)是一类由细胞分泌的小细胞因子或信号蛋白(8-10 kDa),因能引起免疫细胞定向趋化而得名,分为CXC、CC、CX3C和XC四个主要亚组。CXCL9、CXCL10及CXCL12均属于CXC亚型,能在一些免疫反应中起主导作用,是向炎症/感染器官募集免疫细胞的主要趋化因子[5-6]。除定向趋化作用外,趋化因子还具有血管生成、血管抑制以及器官生成等多种功能。CXCL12在缺氧组织中的选择性表达与成人干细胞募集和组织再生有关[7],在造血干细胞的动员和归巢中发挥了至关重要的作用[8]。CXCL9和CXC10能被干扰素-γ诱导,与具有促进血管生成作用的CXCL12不同,干扰素-γ诱导的趋化因子表现出抗血管生成的特性[9]。
本研究旨在比较子痫前期孕妇和婴儿CXCL9、CXCL10及CXC12表达水平的变化,探究趋化因子在子痫前期中的意义。
对象与方法
1.对象:研究对象为2018年5月至2019年7月在陕西中医药大学附属医院产科住院诊治及分娩的30名子痫前期孕妇(研究组)和30名正常健康孕妇(对照组)。排除有多胎妊娠、慢性高血压、糖尿病、感染以及自身免疫性疾病病史的孕妇,所有孕妇未观察到胎膜破裂。子痫前期的诊断基于美国妇产科医师学会(ACOG)的标准[10]。胎儿生长受限(fetal growth restriction,FGR)的诊断标准参考2019美国妇产科学会胎儿生长受限指南[11],纳入产妇的新生儿出生体重小于对应孕龄体重第10百分位数。排除标准包括(1)慢性高血压病史、慢性肾脏疾病史,慢性肝脏疾病史以及合并严重其他内外科疾病的孕产妇;(2)放弃妊娠行引产术或胎死宫内后行引产术,无新生儿娩出或无新生儿病例资料者。
2.主要试剂:各趋化因子免疫分析试剂盒购自R&D Systems;裂解缓冲液购自Cell Signal Technology;血尿素氮、肌酐以及C-反应蛋白检测试剂盒购自南京建成生物工程研究所;趋化因子的抗体购自sigma Aldrich公司。
3.生化指标检测:采集孕妇分娩前早晨空腹血液和新生儿脐带血,将血样在4℃下以4 000 rpm/min离心15 min以获得血清。按照试剂盒制造商的说明测量血清肌酐(Cr)、血尿素氮(BUN)和C-反应蛋白(CRP)。
4.酶联免疫吸附试验:按照ELISA试剂盒制造商的说明,检测了孕妇血液和胎盘中CXCL9、CXCL10、CXCL12水平。利用分光光度计测量吸光值(OD)并计算表达量。
5.免疫印迹分析:在冰冷环境下粉碎冻干的胎盘。然后,在裂解缓冲液中匀浆,4℃下12 000 rpm/min离心10 min,收集上清液。采用Bradford法(Bio-Rad)测定蛋白质浓度后进行SDS-PAGE,分离蛋白质。将分离的蛋白质转移到硝酸纤维素膜上,然后用3% (w/v)的脱脂奶粉在含0.1%吐温20的PBS (10 mM Tris,140 mM NaCl,0.1% Tween 20,pH 7.4)中室温封闭1 h。之后加入一抗,4℃孵育过夜。再用二抗室温孵育1 h。以β-actin作为内参,用化学发光(ECL)检测系统进行分析。
6.统计学处理:应用SPSS 20.0统计软件对数据进行分析。所有数据采用均值±标准差表示,组间比较采用方差分析,组间两两比较采用LSD法,相关性采用Spearman相关分析,以P<0.05为差异具有统计学意义。
结果
1.研究对象基本情况及生化指标:研究组比对照组的平均分娩孕周短1.6周,BMI高2.9 kg/m2,剖宫产几率高43.0%,差异具有统计学意义。孕妇分娩的新生儿体重不足2.5 kg,研究组比例为60.0%,对照组为26.7%,差异具有统计学意义。研究组胎儿生长受限的比例为36.7%,对照组为6.7%,差异具有统计学意义。此外,研究组孕妇的血尿素氮[(3.4±0.3)mmol/L]、肌酐[(63.4±2.9)μmol/L]以及C-反应蛋白[(7.3±1.0)mg/L]与对照组孕妇[(2.9±0.3)mmol/L,(49.6±2.2)μmol/L,(2.9±0.9)mg/L]相比均显著升高(P<0.05)。见表1。
表1 孕妇基本情况及血液生化指标
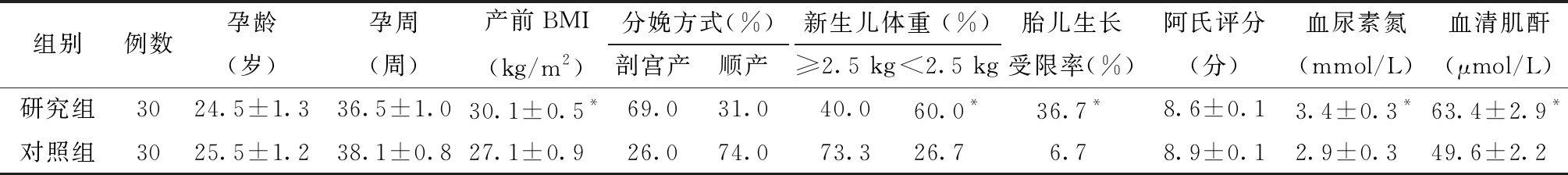
组别例数孕龄(岁)孕周(周)产前BMI(kg/m2)分娩方式(%)剖宫产顺产新生儿体重 (%)≥2.5 kg<2.5 kg胎儿生长受限率(%)阿氏评分(分)血尿素氮(mmol/L)血清肌酐(μmol/L)C-反应蛋白(mg/L)研究组3024.5±1.336.5±1.030.1±0.5*69.031.040.060.0*36.7*8.6±0.13.4±0.3*63.4±2.9*7.3±1.0*对照组3025.5±1.238.1±0.827.1±0.926.074.073.326.76.78.9±0.12.9±0.349.6±2.22.9±0.8
与对照组比较,*P<0.05
2.孕妇外周血血清趋化因子表达变化:与对照组孕妇相比,研究组孕妇血清CXCL9[(269.6±19.7) pg/mL]和CXCL12水平[(110.4±5.3) pg/mL]均显著升高(P<0.05)。而CXCL10水平[(139.5±18.3) pg/mL] 并无显著差异。见图1。
3.新生儿脐带血血清趋化因子表达变化:研究组孕妇分娩的新生儿脐带血CXCL9[(135.4±12.2) pg/mL]和CXCL10水平[(82.9±6.2) pg/mL]均显著低于对照组孕妇分娩的新生儿[(208.3±1.4) pg/mL,(139.5±2.1) pg/mL,P<0.05]。研究组孕妇分娩的新生儿脐带血CXCL12水平[(108.2±2.8) pg/mL]较对照组[(85.4±2.3) pg/mL]显著升高(P<0.05)。见图2。
4.胎盘组织趋化因子表达变化:与正常孕妇相比,子痫前期孕妇胎盘组织中的CXCL9和CXCL12水平均显著上升(P<0.05),而CXCL10水平则无明显差异。见图3。
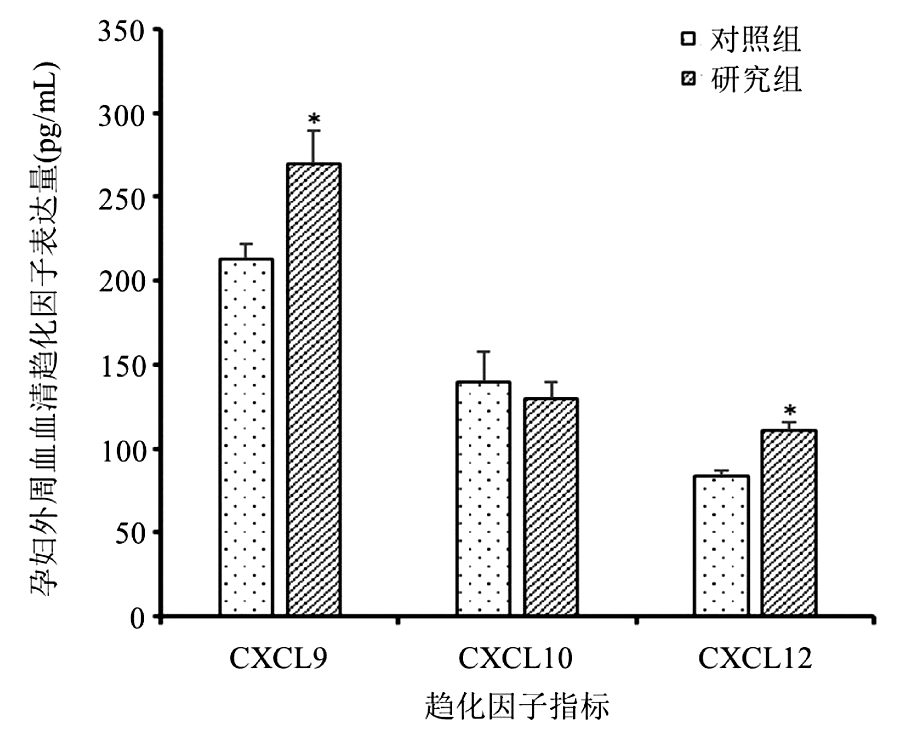
与对照组比较,*P<0.05
图1 孕妇外周血血清趋化因子表达水平
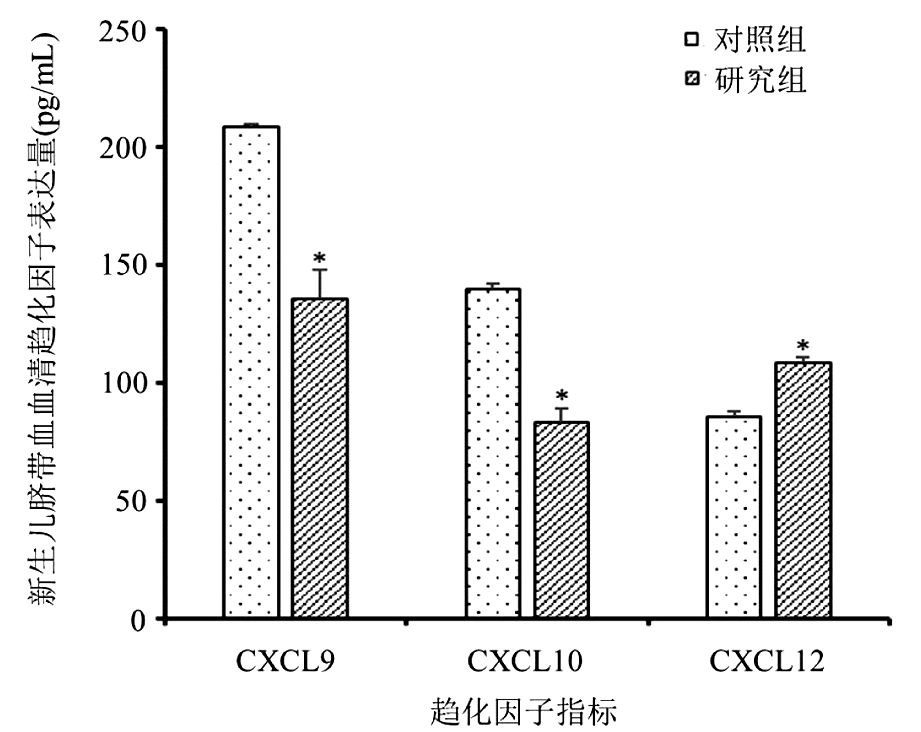
与对照组比较,*P<0.05
图2 新生儿脐带血血清趋化因子表达水平
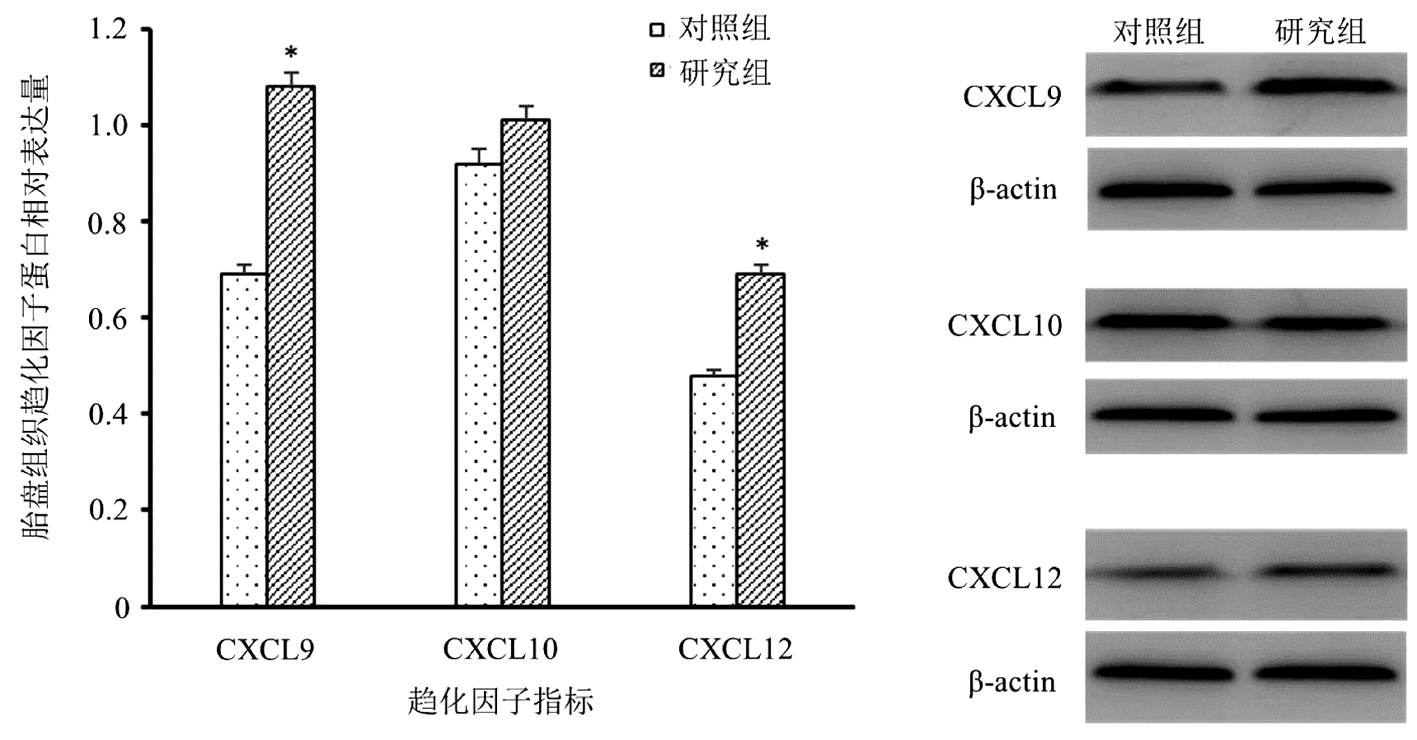
与对照组比较,*P<0.05
图3 胎盘组织CXCL表达量
5.子痫前期孕妇血清趋化因子与肾功能指标、胎儿生长受限的相关性分析:子痫前期孕妇血清CXCL9与肾功能指标血尿素氮、血清肌酐呈正相关性,与C-反应蛋白、新生儿体重及胎儿生长受限率的发生呈负相关性。CXCL10与肾功能指标及新生儿体重、胎儿生长受限率的发生均呈负相关性。CXCL12与胎儿生长受限率的发生呈正相关性,与肾功能指标及新生儿体重均呈负相关性。见表2。
表2 子痫前期孕妇血清趋化因子与肾功能指标、胎儿生长受限的相关性
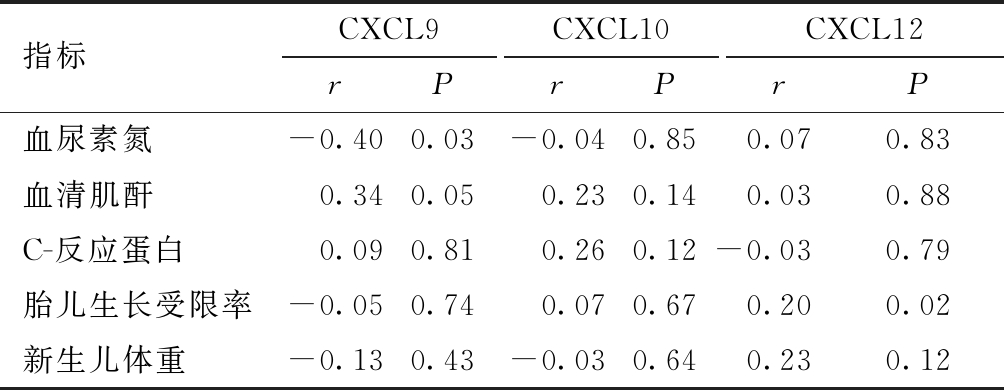
指标CXCL9rPCXCL10rPCXCL12rP血尿素氮-0.400.03-0.040.850.070.83血清肌酐0.340.050.230.140.030.88C-反应蛋白0.090.810.260.12-0.030.79胎儿生长受限率-0.050.740.070.670.200.02新生儿体重-0.130.43-0.030.640.230.12
讨论
本研究利用ELISA分别检测了子痫前期和健康孕妇母体和胎儿血清中CXCL9、CXCL10、CXCL12的表达水平,与正常孕妇相比,子痫前期孕妇血清中的CXCL9和CXCL12均显著升高,而CXCL10则无明显变化,Western blot对胎盘组织的检测进一步证实了该结果;但母体外周血与胎儿脐带血的CXCL趋化因子水平变化呈现不同的趋势,子痫前期胎儿脐带血血清CXCL9和CXCL10水平较正常孕妇分娩的新生儿均显著下降,而CXCL12显著升高;相关性分析的结果与血清、胎盘组织结果一致。这提示了趋化因子在母体和胎儿脐血中的变化可能存在不同的模式。
T淋巴细胞是人体重要的免疫细胞,根据功能不同分为Th1和Th2两种亚型,前者主要分泌IL-2、IFN-γ和TNF-α,免疫反应表现为免疫杀伤,后者主要分泌IL-4、IL-5、IL-6、IL-9以及IL-13,免疫反应表现为免疫防护。研究证明,妊娠是一种特殊的以Th2型免疫反应为主的现象,在妊娠期间Thl/Th2保持平衡,趋向Th2型免疫反应移动并建立了新的平衡[12]。而越来越多的证据表明,子痫前期与具有占优势的Th1型免疫反应相关。Saito等[13-14]在研究子痫前期妇女炎症反应时观察到,子痫前期患者Th1型细胞比例显著高于正常孕妇,Th2型细胞则显著低于正常妇女。在子痫前期孕妇的血浆或血清中,一些与调节趋化因子表达相关的上游炎症分子水平升高,比如IL-2、IFN-γ、TNF-α和IL-12,同时还伴随着外周血单个核细胞(PBMCs)数量增加[13-18];IL-10、IL-4水平则表现为降低[18-19]。Rinehart等[20]研究发现,子痫前期患者胎盘组织IL-1β、TNF-α的mRNA及蛋白质水平均显著上升。Sargent等[21]发现,在子痫前期孕妇中,倾向于Th2型免疫反应并没有发生,Th1 型免疫反应没有被抑制,表现出以免疫杀伤为主。因此,子痫前期患者血浆或血清趋化因子水平上升可能是促炎状态或血管内炎症的特征之一。本研究发现,子痫前期患者及新生儿血清、胎盘CXCL9及CXCL12水平均显著上升,进一步证实了子痫前期发病与趋化因子水平的相关性。虽然大量研究表明CXCL10与子痫前期有密切关联,但本研究未发现CXCL10水平在两组中存在显著差异,因此,关于CXCL10在子痫前期中的作用还有待后续实验进行观察验证。目前,关于子痫前期发病与促炎因子水平变化的因果关系暂无定论,一些学者猜测可能是由于趋化因子水平升高,使得体内的非特异性免疫过度激活,介导Th1型免疫反应,导致平衡失调,过度的炎症反应促进了子痫前期的发病[22]。也有一些学者认为,趋化因子水平的升高可能是子痫前期的发生导致Th1细胞过度产生TNF-α和IFN-γ引起的。已有充分证据证实,子痫前期会导致促炎特异性介质表达水平的升高(IL-6,CXCL8,CXCL10和CCL2等),其临床状态为一个全身促炎环境。子痫前期患者中出现的促炎趋化因子水平升高可能是一种代偿现象[23]。Herder等[24]在对冠心病患者的随访中发现,冠心病患者CXCL10水平显著高于非冠心病患者。而在调整了心血管和免疫危险因素后,这种相关性消失了。这不仅表明CXCL10的升高可能先于冠心病发生,同时由于子痫前期和动脉粥样硬化之间存在高度的相似之处,该发现也为子痫前期与趋化因子水平异常的因果关系提供了一些思路[25]。
另一方面,趋化因子和其他促炎介质被认为是内皮功能障碍的潜在调节因子,而内皮功能障碍被认为是子痫前期母体综合征的主要标志,包括肾脏、肝脏和脑在内的多个重要器官都受到子痫前期的严重影响。有证据表明,这些促炎分子在介导肾损伤中起着核心作用[24],本研究发现子痫前期孕妇肾功能出现损伤,同时其体内CXC趋化因子也发生不同模式改变。通过相关性分析发现,肾功能损伤与CXCL9有关。还有一些研究表明胎盘是子痫前期孕妇炎症细胞因子的重要来源之一[26],原因可能与母体内皮细胞功能障碍有关[27-28]。而本研究对胎盘组织的检测表明,子痫前期的发生的确会影响胎盘CXCL9和CXCL12的水平。此外,CXCL趋化因子在子痫前期中也影响了新生儿。CXCL9和CXCL10表现出强大的抗血管生成特性,而CXCL12是血管生成因子[29]。母体血清中抗血管生成趋化因子的改变可能会促进子痫前期孕妇抗血管生成状态的产生。在本研究,子痫前期孕妇的新生儿出现宫内生长受限的比例高于正常孕妇,其宫内生长受限的发生与CXCL12有关。
总地来说,子痫前期孕妇所表现的肾功能损伤,与趋化因子CXCL9有关,而胎儿宫内生长受限的发生则与趋化因子CXCL12有关。由于母体和胎儿趋化因子的改变并不表现出正相关性,因此二者趋化因子的改变可能具有不同的模式,需要做进一步的研究。
1 李博雅,杨慧霞.低分子肝素预防子痫前期的循证医学证据.中华妇产科杂志,2018,53:278-281.
2 Redman CW,Sacks GP,Sargent IL.Pre-eclampsia:an excessive maternal inflammatory response to pregnancy.Am J Obstet Gynecol,1999,180:499-506.
3 Saito S,Shiozaki A,Nakashima A,et al.The role of the immune system in Pre-eclampsia.Mol Aspects Med,2007,28:192-209.
4 Redman CW,Sargent IL.Pre-eclampsia,the placenta and the maternal systemic inflammatory response-a review.Placenta,2003,24:S21-27.
5 Tokunaga R,Zhang W,Naseem M,et al.CXCL9,CXCL10,CXCL11/CXCR3 axis for immune activation-a target for novel cancer therapy.Cancer Treat Rev,2018,63:40-47.
6 Moosavi SR,Khorramdelazad H,Amin M,et al.The SDF-1 3′A genetic variation is correlated with elevated intra-tumor tissue and circulating concentration of CXCL12 in glial tumors.J Mol Neurosci,2013,50:298-304.
7 Askari AT,Unzek S,Popovic ZB,et al.Effect of stromal-cell-derived factor 1 on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy.Lancet,2003,362:697-703.
8 Wright DE,Bowman EP,Wagers AJ,et al.Hematopoietic stem cells are uniquely selective in their migratory response to chemokines.J Exp Med,2002,195:1145-1154.
9 Karimabad MN,Falahati-Pour SK,Hassanshahi G.Significant role (s) of CXCL12 and the SDF-1 3′ a genetic variant in the pathogenesis of multiple sclerosis,Neuroimmunomodulation.2016,23:197-208.
10 American College of Obstetricians and Gynecologists.Hypertension in pregnancy.report of the american college of obstetricians and gynecologists′ task force on hypertension in pregnancy.Obstet Gynecol,2013,122:1122-1131.
11 No authors listed.ACOG Practice bulletin no.134:fetal growth restriction.Obstet Gynecol,2013,121:1122-1133.
12 郭学敏.CXCL10在子痫前期患者胎盘组织中的表达及意义.山西医科大学,2014.
13 Saito S,Umekage H,Sakamoto Y,et al.Increased T-helper-1-type immunity and decreased T-helper-2-type immunity in patients with Pre-eclampsia.Am J Reprod Immunol,1999,41:297-306.
14 Saito S,Sakai M,Sasaki Y,et al.Quantitative analysis of peripheral blood Th0,Th1,Th2 and the Th1:Th2 cell ratio during normal human pregnancy and Pre-eclampsia.Clin Experim Immunol,1999,117:550-555.
15 Sunder-Plassmann G,Derfler K,Wagner L,et al.Increased serum activity of interleukin-2 in patients with pre-eclampsia.J Autoimmun,1989,2:203-205.
16 Vince GS,Starkey PM,Austgulen R,et al.Interleukin-6,tumour necrosis factor and soluble tumour necrosis factor receptors in women with pre-eclampsia.Br J Obstet Gynaecol,1995,102:20-25.
17 Daniel Y,Kupferminc MJ,Baram A,et al.Plasma interleukin-12 is elevated in patients with preeclampsia.Am J Reprod Immunol,1998,39:376-380.
18 Arriaga-Pizano L,Jimenez-Zamudio L,Vadillo-Ortega F,et al.The predominant Th1 cytokine profile in maternal plasma of preeclamptic women is not reflected in the choriodecidual and fetal compartments.J Soc Gynecol Investig,2005,12:335-342.
19 Hennessy A,Pilmore HL,Simmons LA,et al.A deficiency of placental IL-10 in preeclampsia.J Immunol,1999,163:3491-3495.
20 Rinehart BK,Terrone DA,Lagoo-Deenadayalan S,et al.Expression of the placental cytokines tumor necrosis factor alpha,interleukin 1beta,and interleukin 10 is increased in preeclampsia.Am J Obstet Gynecol,1999,181:915-920.
21 Sargent IL,Borzychowski AM,Redman CWG,et al.Immunoregulation in normal pregnancy and pre-eclampsia:an overview.Reprod Biomed Online,2006,13:680-686.
22 孔艳,李小芳,孔祥.炎症-免疫因素与子痫前期发病机制研究进展.中华临床医师杂志(电子版),2016,10:2176-2179.
23 Benian A,Madazli R,Aksu F,et al.Plasma and placental levels of interleukin-10,transforming growth factor-beta1,and epithelial-cadherin in pre-eclampsia.Obstet Gynecol,2002,100:327-331.
24 Herder C,Baumert J,Thorand B,et al.Chemokines and incident coronary heart disease:results from the MONICA/KORA Augsburg case-cohort study,1984-2002.Arterioscler Thromb Vasc Biol,2006,26:2147-2152.
25 Gotsch F,Romero R,Friel L,et al.CXCL10/IP-10:a missing link between inflammation and anti-angiogenesis in preeclampsia? J Matern Fetal Neonatal Med,2007,20:777-792.
26 Benyo DF,Smarason A,Redman CW,et al.Expression of inflammatory cytokines in placentas from women with Pre-eclampsia.J Clin Endocrinol Metab,2001,86:2505-2512.
27 de Lima TH,Sass N,Mattar R,et al.Cytokine gene polymorphisms in Pre-eclampsia and eclampsia.Hypertens Res,2009,32:565-569.
28 Haggerty CL,Ferrell RE,Hubel CA,et al.Association between allelic variants in cytokine genes and Pre-eclampsia.Am J Obstetr Gynecol,2005,193:209-215.
29 Strieter RM,Burdick MD,Gomperts BN,et al.CXC chemokines in angiogenesis.Cytokine Growth Factor Rev,2005,16:593-609.