在辅助生殖治疗周期中有相当一部分患者,由于所获得的卵子数量少或质量不佳,从而导致了周期失败。对于这样的患者,临床医生一方面通过各种改良超促排卵方案改善妊娠结局;另一方面,通过添加辅助药物改善胚胎质量而改变妊娠结局。一些最常见的辅助治疗包括脱氢表雄酮或睾酮等类固醇补充剂,以及皮下注射生长激素(growth hormone,GH)等补充治疗,但是目前,人们对于这些治疗的真正获益效果仍有争议。
GH是由位于垂体前叶的嗜酸性细胞分泌的一类单链多肽蛋白质激素。通过调控颗粒细胞中促性腺激素的作用调节胰岛素生长因子-I(IGF-I)的合成,在性激素的合成和卵母细胞成熟中起着重要作用[1-2]。然而针对性地开展GH对体外受精/卵胞浆内单精子显微注射(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)治疗预后不良患者的临床研究却很少,尤其是在排除促排卵方案对妊娠结局的影响,通过自身前后对照研究生长激素对妊娠结局的影响更是少之又少。因此本研究主要收集了前次IVF/ICSI助孕失败患者的临床资料,保持促排卵方案不变,在再次助孕时于促排前一周期月经的第2~3天添加小剂量的GH(2 IU/d),或于前一周期黄体期及促排日添加GH(2 IU/d或4 IU/d)直至取卵日,观察GH是否能够增加获卵数、提高胚胎质量,改善临床妊娠结局。
对象与方法
1.研究对象与分组:选择2016年1月—2019年3月于郑州大学第三附属医院生殖中心行IVF/ICSI-ET助孕的112例患者为研究对象。纳入标准包括(1)年龄20~44岁,已婚女性;(2)前次IVF/ICSI助孕失败;(3)第一周期优质胚胎率≤20%;(4)前一周期未添加GH治疗。排除标准(具备下列任一项者即不可入选)包括(1)血糖异常者(包括胰岛素抵抗及糖耐量异常)及甲状腺疾病患者;(2)合并有子宫肌瘤病变、子宫内膜异位症、输卵管积水的患者;(3)甲状腺功能异常的患者;(4)对生长激素过敏者。
2. 根据GH使用天数分组:以35 d为分界线分为两组,即(1)GH使用天数<35 d组。在前一周期的黄体期添加GH 2 IU/d或促排日添加GH 4 IU/d直至取卵日,共58例;其中于前一周期黄体期添加GH(2 IU/d)共14例,使用天数26~32 d,平均天数28 d;于促排日添加GH(4 IU/d)共44例,使用天数6~17 d,平均天数11 d;(2)GH使用天数≥35 d组。在促排前一周期月经的第2~3天添加GH 2IU/d至取卵日,共54例,GH使用天数35~79 d,平均天数45 d;
3. 促排卵治疗:患者前一周期促排卵方案均采用本中心常规的促排卵方案(长方案、拮抗剂方案、MPA方案等多种促排卵方案),促排卵药物有注射用重组人促卵泡激素(雪兰诺,瑞士)及注射用尿促卵泡素(珠海丽珠)等,进行胚胎移植后未获得持续性妊娠,再次行助孕治疗时,促排方案不变,在促排前一周期月经的第2~3天、黄体期或促排卵时添加小剂量GH(注射用重组人生长激素,30U/瓶,长 春 金 赛 药 业)(2~4 IU/d)皮下注射直至人绒毛膜促性腺激素(hCG)日。当直径≥18 mm卵泡占直径≥14 mm卵泡总数的70%以上时,注射hCG(珠海丽珠)10 000 U或重组hCG(雪兰,瑞士)250 μg扳机,36 h后取卵。取卵后均采用常规IVF或ICSI授精,选择1~2个第3天可利用胚胎进行移植。
4. 胚胎评价及标准:根据卵裂期胚胎评分标准[3]将第3天(D3)胚胎分为I~IV级,Ⅰ级卵裂球大小均匀、形态规则、胞质均匀清晰、碎片<10%、无颗粒现象;Ⅱ级卵裂球大小略不均匀、形态略不规则、碎片10%~20%、胞质可有颗粒现象;Ⅲ级卵裂球大小明显不均、形态明显不规则、碎片21%~50%、胞质可有颗粒现象;Ⅳ级卵裂球大小严重不均、碎片>50%、胞质可有颗粒现象。I级、II级胚胎为优质胚胎,Ⅰ级、Ⅱ级及Ⅲ级胚胎为可利用胚胎。
5. 观察指标:(1)患者一般情况。年龄、体重指数(BMI)、不孕年限、抗苗勒管激素(anti-mullerian)、基础FSH。(2)实验室各项指标及临床妊娠结局。 Gn使用天数、Gn总用量、hCG日子宫内膜厚度(mm)、hCG日雌二醇(E2)、hCG日孕酮(P)、获卵数、2PN受精率[(2PN数/获卵总数)×100%];优质胚胎率[(优质胚胎数/2PN卵裂数)×100%];可利用胚胎率[(可利用胚胎数/2PN卵裂数)×100%];临床妊娠率[(新鲜周期临床妊娠数/新鲜周期移植总数)×100%];流产率[(流产人数/新鲜周期临床妊娠数)×100%]。
6. 统计学处理:应用SPSS 21.0统计软件进行分析;正态分布的计量资料用均数±标准差表示,并采用配对样本t检验进行组间比较;计数资料用率(%)表示,并采用χ2 检验进行组间比较(若四格表中任意一格期望值<5,则采用Fisher精确检验);以 P<0.05 为差异有统计学意义。
结果
1. GH使用天数<35 d患者自身前后对照的临床及实验室各项指标的比较:
(1)患者一般资料。纳入研究的58例患者年龄范围24~43岁,平均年龄(34.1±5.8)岁,BMI为(23.9±3.0)kg/m2,不孕年限0.3~19年,平均为(4.0±3.3)年,抗苗勒管激素(AMH)为(2.67±2.05)ng/mL,基础FSH(8.4±5.2)U/L,单侧基础窦卵泡数(bAFC)为(6.6±3.8)个。
(2)实验室及临床结果比较。GH实验组在Gn使用天数、Gn使用总量、hCG日P、获卵数、2PN受精率、移植胚胎数与自身对照组相比,差异均无统计学意义;但hCG日E2及子宫内膜厚度、可利用胚胎率及优质胚胎率均显著高于自身对照组(P<0.05);GH实验组临床妊娠率为51.7%,显著高于自身对照组的3.7%(P<0.01);但GH实验组的流产率与自身对照组比较,差异无统计学意义。见表1。
2. GH使用天数≥35 d自身前后对照的临床及实验室各项指标的比较:
(1)患者一般资料。纳入研究的54例患者年龄范围21~44岁,平均年龄(31.2±4.5)岁,BMI为(22.4±2.8)kg/m2,不孕年限0.2~12年,平均为(3.8±2.6)年,抗苗勒管激素(AMH)为(3.8±2.2)ng/mL,基础FSH(7. 1±2.6)U/L,单侧基础窦卵泡数(bAFC)为(8.1±3.6)个。
(2)实验室及临床结果比较。GH实验组在Gn使用总量、hCG日E2及P、获卵数、2PN受精率及移植胚胎数与自身对照组相比,差异均无统计学意义;但Gn使用天数、hCG日子宫内膜厚度、可利用胚胎率及优质胚胎率均显著高于自身对照组(P<0.05);GH实验组临床妊娠率为66.7%,显著高于自身对照组的10.8%(P<0.01),同时GH实验组的流产率(7.7%)显著低于自身对照组(100%,P=0.001)。见表2。
表1 GH使用天数<35 d患者自身前后对照临床及实验室各项指标的比较
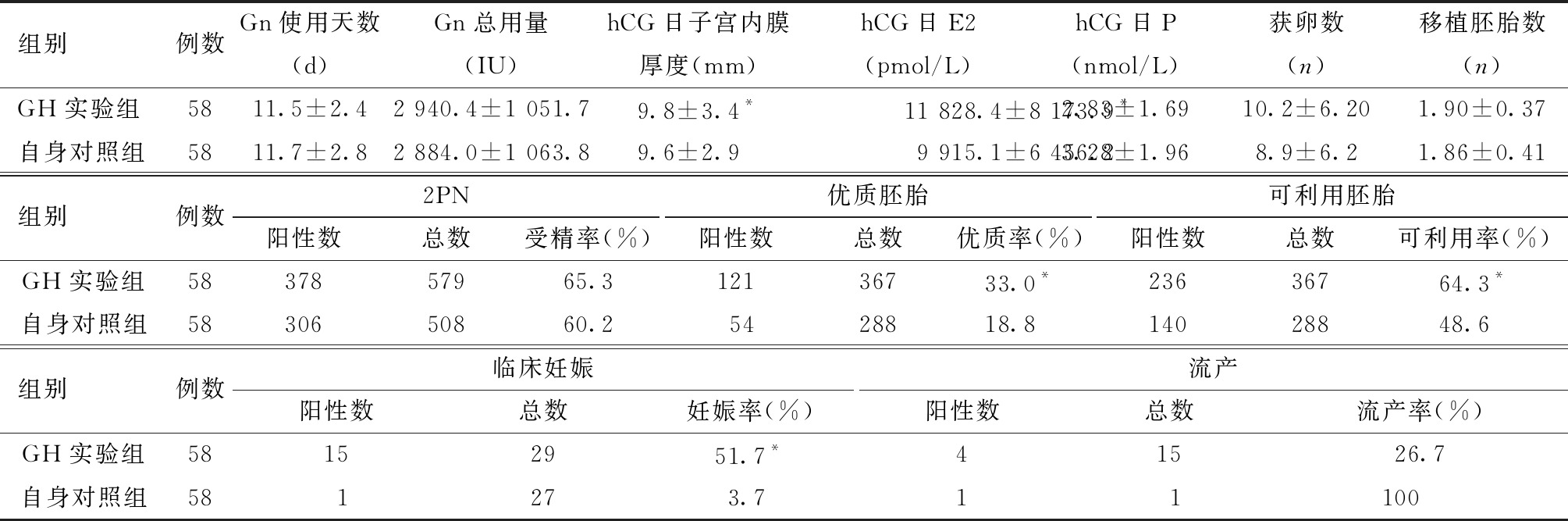
组别例数Gn使用天数(d)Gn总用量(IU)hCG日子宫内膜厚度(mm)hCG日E2(pmol/L)hCG日P(nmol/L)获卵数(n)移植胚胎数(n)GH实验组5811.5±2.42 940.4±1 051.79.8±3.4*11 828.4±8 173.9*2.83±1.6910.2±6.201.90±0.37自身对照组5811.7±2.82 884.0±1 063.89.6±2.99 915.1±6 456.23.28±1.968.9±6.21.86±0.41组别例数2PN阳性数总数受精率(%)优质胚胎阳性数总数优质率(%)可利用胚胎阳性数总数可利用率(%)GH实验组5837857965.312136733.0*23636764.3*自身对照组5830650860.25428818.814028848.6组别例数临床妊娠阳性数总数妊娠率(%)流产阳性数总数流产率(%)GH实验组58152951.7*41526.7自身对照组581273.711100
与对照组比较, *P<0.05
表2 GH使用天数≥35天自身前后对照临床及实验室各项指标的比较
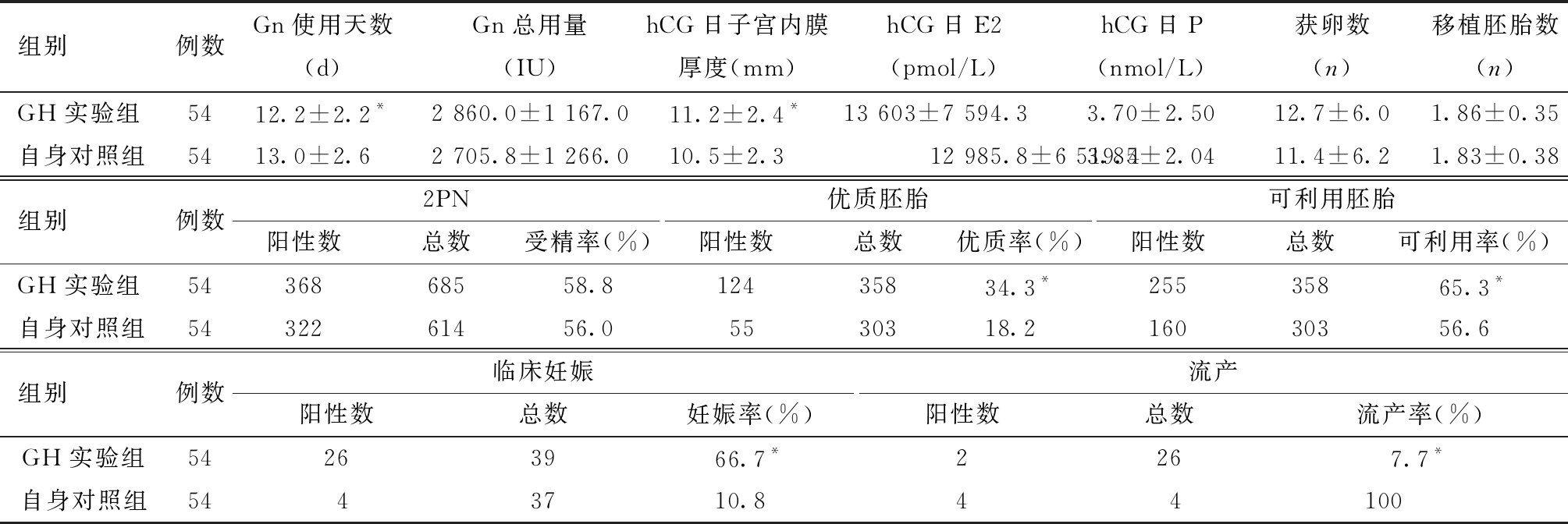
组别例数Gn使用天数(d)Gn总用量(IU)hCG日子宫内膜厚度(mm)hCG日E2(pmol/L)hCG日P(nmol/L)获卵数(n)移植胚胎数(n)GH实验组5412.2±2.2*2 860.0±1 167.011.2±2.4*13 603±7 594.33.70±2.5012.7±6.01.86±0.35自身对照组5413.0±2.62 705.8±1 266.010.5±2.312 985.8±6 519.43.85±2.0411.4±6.21.83±0.38组别例数2PN阳性数总数受精率(%)优质胚胎阳性数总数优质率(%)可利用胚胎阳性数总数可利用率(%)GH实验组5436868558.812435834.3*25535865.3*自身对照组5432261456.05530318.216030356.6组别例数临床妊娠阳性数总数妊娠率(%)流产阳性数总数流产率(%)GH实验组54263966.7*2267.7*自身对照组5443710.844100
与对照组比较,*P<0.05
讨论
随着辅助生殖技术的发展,如何提高助孕成功率是生殖医学的研究热点,而良好的胚胎质量和子宫内膜容受性是临床妊娠成功的基础[4]。研究显示,GH能够提高卵巢对Gn的反应性,参与卵泡发育的各个阶段及成熟,改善卵子质量,增加优质胚胎数,有助于提高临床妊娠率[5-10]。本研究发现,对于上一周期因胚胎质量欠佳而助孕失败的患者,再次助孕时,在促排方案不变的情况下,无论是GH使用天数<35 d还是≥35 d,添加GH均可改善卵子质量、增加优质胚胎率、进而提高临床妊娠率。国外的一项研究[11]显示,GH可以增加获卵数及受精率,但本研究中GH实验组较自身对照组在获卵数及2PN受精率指标,差异没有统计学意义,Cai等[12]及宋慧玲等[13]研究结果也表明使用GH不能增加获卵数及受精率。
在子宫内膜容受性方面,临床上常用子宫内膜下血流分级、子宫内膜厚度及子宫内膜容积等指标表示,在Hu等[14]的研究中发现,在羊的体内注射GH后可增加子宫内膜腺体数量,增强其分泌能力,分泌更多的子宫乳蛋白,从而改善子宫内膜的容受性,获得更多的受孕机会。龚斐等[15]认为,GH可通过促进卵巢分泌E2,增加子宫内膜厚度;同时,吴晓燕等[16]的研究认为,GH作用于生长激素受体(GHR),通过改善子宫内膜的局部血液循环,增强E2及孕激素的敏感性,并协调着床因子间的相互关系及表达,使胚胎容易粘着于子宫内膜,进而提高胚胎种植率,提高临床妊娠率。本研究中,无论GH使用天数≥35 d或<35 d,GH实验组较自身对照组的hCG日E2均有升高趋势,但差异无统计学意义;同时GH使用天数≥35 d时,GH实验组hCG日子宫内膜的厚度却是显著高于自身对照组,并且GH实验组流产率也显著低于自身对照组,这可能也是早卵泡期同步添加小剂量的GH,通过改善子宫内膜厚度,进而提高临床妊娠率和降低流产率的原因之一,而在GH使用天数<35 d组中,GH组hCG日子宫内膜的厚度较自身对照组差异无统计学意义,但有升高趋势。
目前,对于GH添加时机及使用剂量尚未有统一的标准,但目前大多数生殖中心发表的研究[4,12,17]均在控制性超促排前4~12周开始添加GH,本研究GH使用天数≥35 d组与此一致。对于GH使用剂量,在Tanaka等[18]的研究显示超大剂量的GH可诱导胰岛素抵抗或高血糖,引起眼睑或下肢水肿、腰部疼痛等一些副作用;Burger等[19]的研究则对进行促排的患者各给予4、12、24 IU三种不同单位的GH隔日注射,结果发现三种剂量的GH具有相似的促排效果,本研究显示了小剂量的GH(2 IU/d或4 IU/d)是可以提高优胚率及临床妊娠结局。
综上所述,在IVF/ICSI治疗中,对于因胚胎质量欠佳而助孕失败的患者,再次助孕时可在促排前一月经期第2~3天、前一黄体期或促排卵日根据患者情况同步添加小剂量的GH(2 IU/d或4 IU/d),以改善胚胎质量、提高临床妊娠率。对于既往子宫内膜薄并胚胎质量欠佳的患者,可选择在早卵泡期添加GH 2 IU/d直至取卵日,以提高临床妊娠率、降低流产率。
1 Tesarik J,Hazout A,Mendoza C.Improvement of delivery and live birth rates after ICSI in women aged >40 years by Ovarian co-stimulation with growth hormone.Hum Reprod,2005,20:2536-2541.
2 Eftekhar M,Aflatoonian A,Mohammadian F,et al.Adjuvant growth hormone therapy in antagonist protocol in poor responders undergoing assisted reproductive technology.Arch Gynecol Obstet,2013,287:1017-1021.
3 Racowsky C,Combelles CM,Nureddin A,et al.Day 3 and day 5 morphological predictors of embryo viability.Reprod Biomed Online,2003,6:323-331.
4 田莉,马淳,周寒鹰,等.重组生长激素应用于IVF前次失败患者的初步探讨.生殖医学杂志,2017,26:438-441.
5 Kolodziejczyk J,Gregoraszuk EL,Leibovich H,et al.Different action of ovine GH on porcine theca and granulosa cells proliferation and insulin-like growth factors I- and II-stimulated estradiol production.Reprod Biol,2001,1:33-41.
6 Weall BM,Al-Samerria S,Conceicao J,et al.A direct action for GH in improvement of oocyte quality in poor-responder patients.Reproduction,2015,149:147-154.
7 Lattes K,Brassesco M,Gomez M,et al.Low-dose growth hormone supplementation increases clinical pregnancy rate in poor responders undergoing in vitro fertilization.Gynecol Endocrinol,2015,31:565-568.
8 Kolibianakis E,Venetis C,Diedrich K,et al.Addition of growth hormone to gonadotrophins in ovarian stimulation of poor responders treated by in-vitro fertilization:a systematic review and meta-analysis.Hum Reprod Update,2009,15:613-622.
9 Kyrou D,Kolibianakis EM,Venetis CA,et al.How to improve the robability of pregnancy in poor responders undergoing in vitro fertilization:a systematic review and meta-analysis.Fertil Steril,2009,91:749-766.
10 Pandian Z,McTavish AR,Aucott L,et al.Interventions for ‘poor responders’ to controlled ovarian hyper stimulation (COH) inin-vitro fertilisation (IVF).Cochrane Database Syst Rev,2016,24:CD004379.
11 Dakhly DMR,Bassiouny YA,Bayoumi YA,et al.The addition of growth hormone adjuvant therapy to the long down regulation protocol in poor responders undergoing in vitro fertilization:randomized control trial.Eur J Obstet Gynecol Reprod Biol,2018,228:161-165.
12 Cai MH,Liang XY,Wu YQ,et al.Six-Week pretreatment with growth hormone improves clinical outcomes of poor ovarian responders undergoing in vitro fertilization treatment:a self-controlled clinical study.J Obstet Gynaecol Res,2019,45:376-381.
13 宋慧玲,郭艺红,郭华娟,等.生长激素对卵巢储备功能低下的年轻患者体外受精-胚胎移植治疗结局的影响.中国实用医刊,2012,39:58-60.
14 Hu ZP,Wang Y,Du XG,et al.Effects of Growth Hormone Supplementation in Patients Undergoing IVF/ICSI-ET with Poor Ovarian Response to Gonadotropin.J Reprod Contraception,2014,25:32-40.
15 龚斐,李元.卵巢低反应辅助治疗策略.生殖医学,2016,25:901-903.
16 吴晓燕,谭展红,刘蓓媚,等.POR患者采用拮抗剂方案加用GH对子宫内膜容受性及妊娠结局的影响.中国性科学,2018,28:79-83.
17 苏琼,伍琼芳,田莉峰,等.重组人生长激素在首次早卵泡期长效长方案治疗失败患者再次助孕中的应用.中华生殖与避孕杂志,2019,39:87-91.
18 Tanaka T,Yokoya S,Fujieda K,et al.Efficacy and safety of up to 8 years of long-term growth hormone treatment in short children born small for gestational age in Japan:nanlysis of the subpopulation according to the Japanese guidehne.Clin Pediatr Endocrinol,2012,21:57-68.
19 Burger HG,Kovacs GT,Polson DM,et al.Ovarian sensitization to gonadotrophins by human growth hormone.Persistence of the effect beyond the treated cycle.Clin Endocrinol,1991,35:119-122.