染色体17p13.3基因组失衡会导致不同的临床症候群:(1)Miller-Dieker综合征(Miller-Dieker syndrome,MDS)。主要由PAFAB1H1(LIS1)基因及其远端的YWHAE、CRK等重要基因缺失引起,会导致严重的无脑回畸形,同时伴有面部结构异常以及生长发育障碍。(2)无脑回畸形(lissencephaly,LIS)。主要与PAFAB1H1基因缺失有关,其远端基因正常保留,导致的无脑回畸形较MDS程度更轻,且通常不伴有面部畸形[1-2]。(3)17p13.3微缺失综合征(17p13.3 microdeletion syndrome)。病变仅涉及YWHAE、CRK等远端基因,病情较前两者更轻,由于保留正常PAFAB1H1基因,通常不会引起无脑回畸形,临床特征为面部畸形、发育迟缓、智力低下伴/不伴轻度的颅内结构异常,预后往往较LIS和MDS好。通过检索PubMed、中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、维普数据库(VIP)和万方数据资源系统等数据库,迄今为止,国内外文献报道的17p13.3微缺失综合征仅20余例[1-7],且无新生儿期临床表现及头颅影像学的相关报道。本文首次报道1例新生儿17p13.3微缺失综合征及其家系的临床表现,并进行相关文献复习。
临床资料
患儿,女,生后16 d,因“自觉皮肤黄染加重1 d”于2019年3月收入北京大学人民医院儿科。患儿系第4胎第1产,胎龄39周因“臀位”剖宫产娩出,出生体重3 000 g,无宫内窘迫及生后窒息史。生后第3天出现皮肤黄染,逐渐加重,入院时经皮测胆红素16.5 mg/dL;生后混合喂养,母乳占比约一半,吸吮力尚可,但进奶量偏少,约40 mL Q3H,入院体重2 740 g,较出生体重下降8.7%,处于同胎龄儿同期平均体重的P10以下。患儿父母非近亲结婚,其母前三胎中有2胎流产及1胎停育。其母亲及外祖母均于当地医院诊断“智力障碍”,并持有智力残疾证。
入院查体:生命体征平稳,精神反应尚可,全身皮肤黄染,颜色较鲜亮,前囟平,张力不高,前额突出,双颞区下陷,鼻根高,鼻孔上翻,上唇缘薄,人中沟平坦,小下颌,耳位低,双手通贯掌,足底纹理浅,背部毳毛较多,心肺腹查体无特殊,四肢肌张力正常,新生儿反射正常引出。见图1和图2。
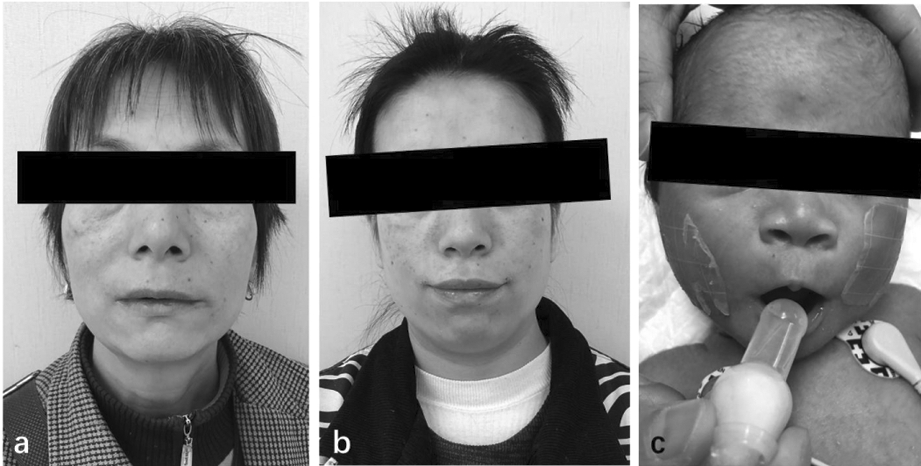
a、b:患儿外祖母(a)及母亲(b)均有小下颌畸形及低耳位;c:患儿表现为前额突出、双颞区下陷、鼻根高、鼻孔上翻、上唇缘薄、人中沟平坦、小下颌、低耳位
图1 患儿外祖母、母亲及患儿面部特征
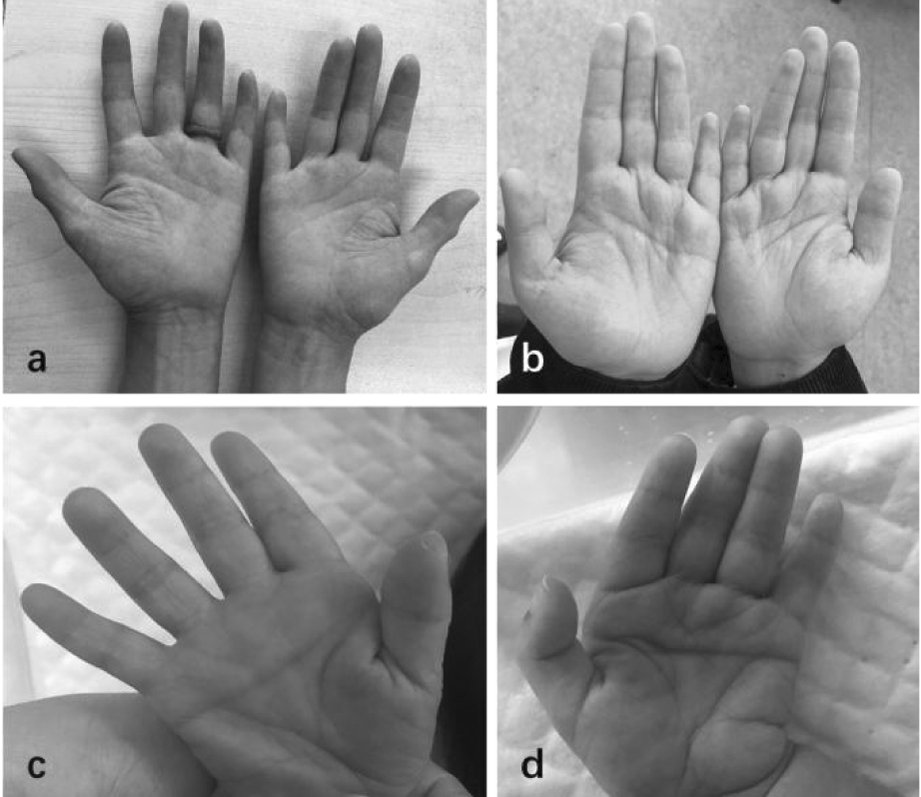
a:患儿外祖母双手小指内扣;b:患儿母亲双手小指较正常人偏短;c、d:患儿双手通贯掌
图2 患儿外祖母、母亲及患儿手部特征
辅助检查:总胆红素最高达193.7 umol/L;头颅超声:双侧侧脑室前角旁囊实性结构,考虑室管膜下出血(吸收期表现);头部MRI平扫未见明显异常表现(图3);脑电图显示轻度异常新生儿脑电图,睡眠期双侧额、额中线区为主少量多灶性尖波散发(图4);超声心动图示三尖瓣少量反流;多次听力筛查(OAE-AABR)发现左耳OAE及AABR均未通过,右耳OAE未通过,AABR通过;母亲羊水aCGH测序发现Chr17p13.3缺失0.726 Mb(可能致病性),包含20余个小基因,其中OMIM(人类孟德尔数据库)记录的有RILP,RPRF8,MIR22,WDR81,SERPINF2,SERPINF1,RPA1,RTN4RL1,OVCA1(DPH1),OVCA2,MIR132,MIR212,HIC1,SMG6,SRR等10余个基因,突变来源于母亲。
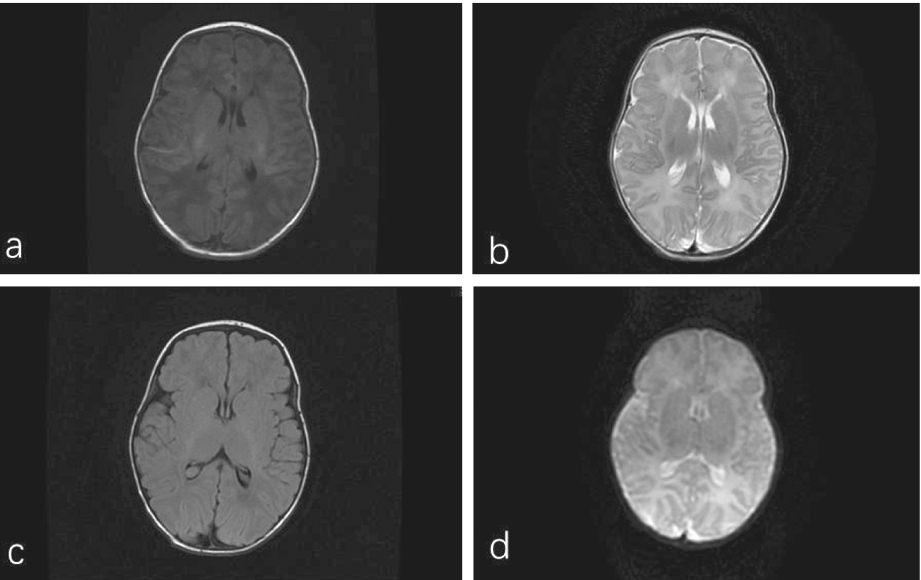
a:T1WI;b:T2WI;c:T2FLAIR;d:DWI
注:脑实质内未见异常信号,灰白质分界清楚。脑室系统大小形态未见异常,脑中线结构无移位。颅骨未见明显异常信号。
图3 患儿头颅MRI
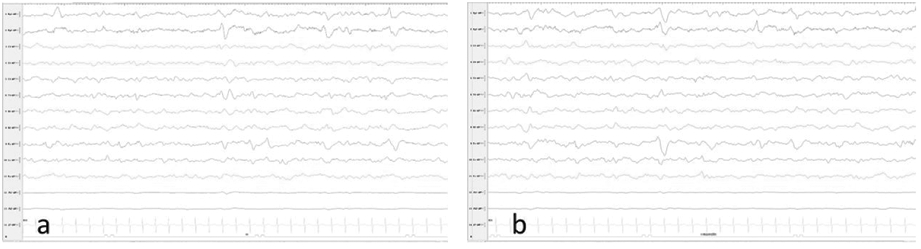
a:睡眠期左侧额、额中线区尖波;b:睡眠期右侧额、额中线区尖波
注:轻度异常新生儿脑电图,睡眠期双侧额、额中线区为主少量多灶性尖波散发。
图4 患儿脑电图
诊疗经过:入院后予早产儿配方奶粉(81 kcal/100 mL)加强喂养,积极光疗及对症补液治疗,患儿自主吃奶可,体重稳步增长至同胎龄儿同期平均体重的P10以上;黄疸较前显著下降,但因存在胆汁淤积症,予熊去氧胆酸利胆治疗。住院期间动态监测感染指标均正常,动态监测血常规示贫血,血红蛋白最低119 g/L,予口服铁剂治疗。住院第12天,生后第28天时患儿一般情况可,自主吃奶好,生命体征稳定,体重稳步增长至3 280 g(>P10),头围35 cm(>P10),身长52 cm(>P10),查体未见明显异常,故准予出院。患儿于生后6个月及12个月门诊随诊,定期监测脑电图未见明显异常,但发育评估示轻度智力运动发育落后。此外,患儿听力在生后6个月复查时恢复正常。
家系分析:患儿有智力障碍家族史(图5),其母亲及外祖母均有典型小下颌及低耳位的表现,与患儿的面部特征一致。三者手部表现具有个体化差异,患儿外祖母双手小指内扣,母亲双手小指较正常人偏短,两人均无通贯掌表现(图2)。患儿母亲及外祖母均于当地医院诊断“智力障碍”,有一定程度的理解能力差、记忆力差、语言交流困难表现,两者基因验证结果均与患儿一致。
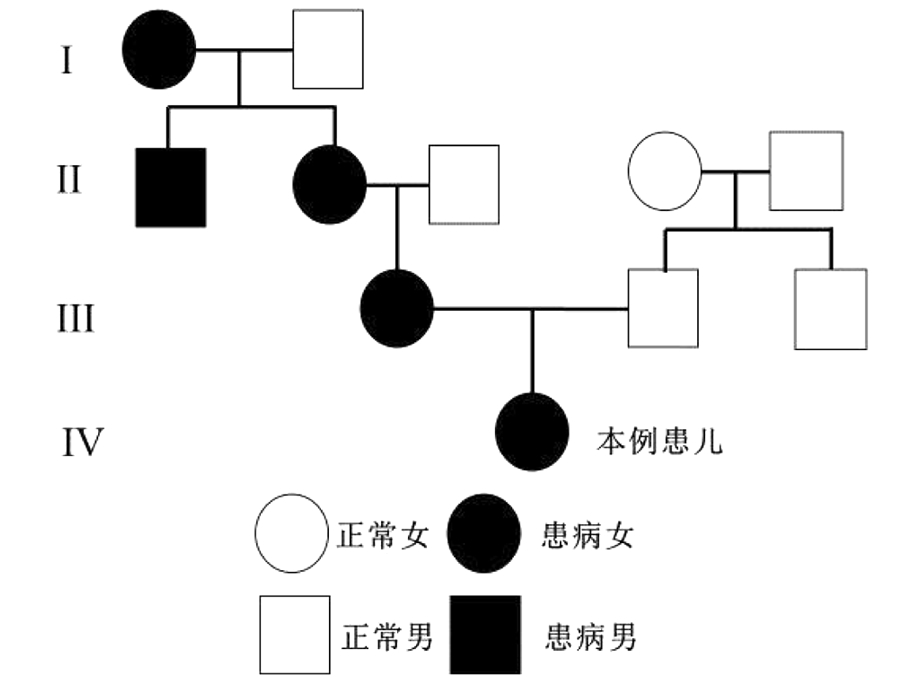
图5 患儿家系图
讨论
目前已确认染色体17p13.3上的基因组缺失会引起脑内神经元移行障碍,导致大脑结构或功能异常,根据缺失基因片段的位点及大小,可分为MDS、LIS及17p13.3几种临床症候群[1-3]。MDS主要由PAFAH1B1基因及其远端的基因共同缺失引起,是一种致畸、致死性染色体病,临床上极为罕见,发病率约1/10万,往往导致极为严重的颅内结构畸形,如无脑回、无脑沟等,同时伴有面部结构和其他发育异常,预后极差,患儿大多在2岁前死亡[2]。LIS则仅涉及PAFAH1B1基因,临床主要表现为无脑回畸形,病变程度较MDS轻,且不存在面部结构异常。17p13.3微缺失综合征则保留了正常的PAFAH1B1基因,主要影响其远端的基因,包括YWHAE、CRK、OVCA1、HIC1等,这一综合征主要特点为生长发育迟缓、轻至中度的智力低下、面部畸形以及轻度的脑部结构异常[1]。关于本病的国内外报道十分罕见,多于幼儿期甚至成人期确诊,本例为首次报道的新生儿期确诊的临床病例。
1.颅内结构:Reiner等[8]发现,PAFAH1B1(又称LIS1)基因缺失与无脑回畸形或灰质异位密切相关,是导致LIS或MDS的重要基因位点,这是由于该基因编码血小板活化因子乙酰水解酶亚型1Bα亚基,在神经系统发育的信号转导通路中发挥重要作用。Schiff等[5]证实,当17p13.3微缺失仅涉及PAFAH1B1远端的基因时,不会引起无脑回畸形等致死性神经系统病变。本例患儿头部MRI平扫未见明显异常表现,不存在无脑回畸形,基因检测显示不存在PAFAH1B1的突变或缺失,这提示保留PAFAH1B1基因的患儿颅内病变轻微,预后较LIS或MDS更好,与既往的研究结果一致。但新生儿颅脑发育尚未完全成熟,仍需要定期复查头颅影像学及脑电图,严密观察脑回等颅内结构情况。
2.外貌畸形:面部畸形主要与PAFAH1B1远端的基因有关,其中最主要的有YWHAE、CRK、OVCA1、HIC1等,这些基因被证实与MDS的核心症状密切相关。本例患儿主要涉及OVCA1与HIC1基因。Yu等[9]发现,OVCA1在神经嵴细胞衍生为鼻骨和下颌骨的发育过程中起到重要作用,与颅面部畸形密切相关。Loucks等[10]发现,OVCA1基因编码与白喉酰胺合成相关的酶,该基因缺失会导致常染色体隐性遗传的智力低下及面部畸形。Barros等[1]通过病例研究发现,HIC1和OVCA1与颚弓形成密切相关,并且这两个基因的缺失会引起腭裂及其他多发面部畸形。本例患儿存在典型的特殊面容,如前额突出、双颞区下陷、鼻根高、鼻孔上翻、人中沟平坦、上唇缘薄、小下颌等,其母亲与外祖母均表现为小下颌及低耳位,与既往文献报道一致。但患儿不存在唇腭裂,并观察到背部毳毛多、双手通贯掌等异常,同时患儿母亲小指较短,患儿外祖母小指内扣,说明本病的临床表型具有多样性,且在同样的遗传学背景下可能表现出不同的临床特点,有助于进一步丰富完善17p13.3微缺失综合征的临床表型,也表明基因型与临床表型之间的准确联系仍有待于进一步深入探究。
3.喂养问题:对于患有本病的新生儿,喂养问题是临床治疗与护理的重点。本例患儿入院时体重处于同胎龄儿同期体重的P10以下,提示存在严重的入量不足与生长发育迟缓,入院后加强喂养,患儿吃奶好,体重平稳增长,这表明17p13.3微缺失综合征的新生儿本身并不存在喂养困难问题,但由于其母亲有智力障碍难以掌握正确喂养方法,使喂养问题成为本病患儿家庭护理的难题。因此,对于17p13.3微缺失的染色体病患儿,在新生儿期需要特别注意其母亲的疾病是否会影响新生儿的喂养及看护,并让其他家属指导和帮助母亲喂养患儿。
综上所述,本例患儿主要表现为外貌异常,伴有新生儿期严重听力障碍,头颅MRI示颅内结构正常,患儿母亲及外祖母具有与患儿一致的临床表型及基因检测结果。17p13.3微缺失综合征发病率低,本文描述了新生儿期的临床表现,进一步丰富了该综合征的临床表型,有助于在新生儿期尽早识别染色体病,对本病患儿的合理喂养、智力和生长发育评估以及长期随访等问题提供一定的参考,也强调了产前诊断的重要性。本病基因型与临床表型之间的联系与发病机制尚未完全阐明,全面认识该病仍有待于进一步的分子遗传学研究与基因功能的精准化定位。
1 Barros Fontes MI,dos Santos AP,Rossi Torres F,et al.17p13.3 Microdeletion:Insights on Genotype-Phenotype Correlation.Mol Syndromol,2017,8:36-41.
2 杨滢,朱瑞芳,朱湘玉,等.一例涉及17p13.3微缺失患儿家系的临床表型、遗传学分析及产前诊断.中华围产医学杂志,2017,20:414.
3 Nagamani SC,Zhang F,Shchelochkov OA,et al.Microdeletions including YWHAE in the Miller-Dieker syndrome region on chromosome 17p13.3 result in facial dysmorphisms,growth restriction,and cognitive impairment.J Med Genet,2009,46:825-833.
4 Bruno DL,Anderlid BM,Lindstrand A,et al.Further molecular and clinical delineation of co-locating 17p13.3 microdeletions and microduplications that show distinctive phenotypes.J Med Genet,2010,47:299-311.
5 Schiff M,Delahaye A,Andrieux J,et al.Further delineation of the 17p13.3 microdeletion involving YWHAE but distal to PAFAH1B1:Four additional patients.Eur J Med Genet,2010,53:303-308.
6 Shimojima K,Sugiura C,Takahashi H,et al.Genomic copy number variations at 17p13.3 and epileptogenesis.Epilepsy Res,2010,89:303-309.
7 Enomoto K,Kishitani Y,Tominaga M,et al.Expression analysis of a 17p terminal deletion,including YWHAE,but not PAFAH1B1,associated with normal brain structure on MRI in a young girl.Am J of Med Genet,2012,158:2347-2352.
8 Reiner O,Carrozzo R,Ying S,et al.Isolation of a Miller-Dieker lissencephaly gene containing G protein β-subunit-like repeats.Nature,1993,364:717-721.
9 Yu YR,You LR,Yan YT,et al.Role of OVCA1/DPH1 in craniofacial abnormalities of Miller-Dieker syndrome.Hum Mol Genet,2014,23:5579-5596.
10 Loucks CM,Parboosingh JS,Shaheen R,et al.Matching Two Independent Cohorts Validates DPH1 as a Gene Responsible for Autosomal Recessive Intellectual Disability with Short Stature,Craniofacial,and Ectodermal Anomalies.Hum Mutat,2015,36:1015-1019.