妊娠期高血压疾病(hypertensive disorders of pregnancy,HDP)是一类常见的妊娠并发症,主要临床表现为妊娠20周后新发高血压,伴或不伴有蛋白尿。HDP是导致流产、早产、小于胎龄儿和孕妇围产期死亡等不良妊娠结局的主要原因之一,影响子代近期和远期健康效应[1]。全球HDP发病率高达10%[2],中国HDP患病率约为7.6%,其中华北地区高达10.6%[3]。妊娠期高血压(gestational hypertension,GH)和子痫前期(preeclampsia,PE)是HDP最常见的两类临床表型,PE患者除妊娠期出现高血压外,往往还伴发尿蛋白[4]。HDP病因及发病机制复杂,目前尚未完全明确,环境因素是HDP发生的重要危险因素之一[5-6]。邻苯二甲酸酯(Phthalates,PAEs)是一类重要的环境内分泌干扰物,被用作塑料增塑剂,广泛存在于食品包装、医疗用品和个人护理用品等塑料制品中,PAEs可破坏人体内环境稳态,进一步导致多种激素水平异常及代谢紊乱。有限的证据显示,孕期PAEs暴露可影响母体血压升高[7],但目前相关研究较少,且未有一致结论[8-10]。鉴于PAEs的广泛存在,有必要就其对HDP发病的影响进行深入探讨。本文就PAEs暴露与HDP发病的相关性进行Meta分析,为进一步预防和控制HDP发生提供理论依据。
一、文献纳入、排除标准及检索策略
1.纳入标准:研究需符合以下全部标准可被纳入,即 (1)研究内容为评价孕期PAEs暴露与HDP相关性的观察性流行病学研究;(2)研究对象排除有既往高血压病史、PE病史、严重妊娠并发症及不良妊娠结局的孕妇;(3)对结局变量HDP有明确的定义和诊断方法。
2. 排除标准:研究符合以下任意一项即排除,即 (1)非原始研究,类型为综述、Meta分析、讲座等;(2)动物实验或体外模型研究;(3)未报告OR值及95% CI效应指标;(4)重复发表的文献;(5)非中英文文献。
3. 文献检索策略:通过检索PubMed、Embase、Web of science、中国知网和万方数据库,系统性回顾截至2021年10月31日有关孕期邻苯二甲酸酯暴露与HDP相关性的研究。中文检索词包括邻苯二甲酸酯、邻苯二甲酸盐、HDP、GH、妊娠高血压、妊娠合并高血压、妊娠期高血压综合症、子痫。以中国知网为例,采用专业检索,中英文扩展,检索式为TKA=′邻苯二甲酸酯′+′邻苯二甲酸盐′ AND TKA=′GH′+′妊高症′+′子痫′+′HDP′+′妊娠合并高血压′+′妊娠高血压′。英文检索词包括phthalates、phthalate metabolites、hypertension during pregnancy、hypertensive disorders of pregnancy、pregnancy induced hypertension、gestational hypertension、gestational hypertensive disorders、preeclampsia,以PubMed为例,采用高级检索,检索式为(′phthalates[ALL]′ OR ′phthalate metabolites[ALL]′) AND (′hypertensive disorders of pregnancy[ALL]′ OR ′gestational hypertension[ALL]′ OR ′preeclampsia[ALL]′ OR ′hypertension during pregnancy[ALL]′ OR ′pregnancy induced hypertension[ALL]′ OR ′gestational hypertensive disorders[ALL]′)。
二、文献筛选及质量评价
文献检索过程由两名研究员独立完成,后交叉核对,如有分歧则通过第三方或讨论解决,直至各数据库检索结果均达成一致。排除各数据库的重复记录后,根据纳入排除标准对剩余记录进行筛选,对符合纳入排除标准的文献进行全文审核,确认最终纳入Meta分析的文献。提取各项纳入研究的第一作者、发表年限、研究人群特征、年龄、暴露指标、结局指标、样本量、调整的混杂因素、检测的生物样本、暴露对比、检测的PAEs组分及相应效应估计值(OR值及95% CI)等数据。
由2名研究员对纳入的研究独立进行质量评价,然后交叉核对。针对病例对照研究及队列研究,采用Newcastle-Ottawa Scale (NOS)质量评价标准进行质量评价[11]。每个NOS量表共9个得分点,4个得分点用于评价研究对象的选择,2个得分点用于评价组间可比性,3个得分点用于评价病例对照研究的暴露评估或队列研究的结局评估方法。总分7分及以上的研究定为高质量,4~6分定为中等质量,3分及以下定为低质量。
三、偏倚风险评估及Meta分析
由2名研究员独立对纳入的研究采用ROBINS-1工具进行偏倚风险评价,然后交叉核对。该工具于2016年由Sterne等学者发表于英国医学杂志上,适用于评价队列研究、病例对照研究、类实验等多种非随机干预性研究的偏倚风险[12]。ROBINS-1工具评价内容包括7个领域,即混杂偏倚、研究对象选择的偏倚、干预分类的偏倚、偏倚既定干预的偏倚、缺失数据的偏倚、结局测量的偏倚和结果选择性报告的偏倚[13]。本文纳入的研究类型为队列研究、巢式病例对照研究和巢式横断面研究,故进行偏倚风险评价时不涉及干预分类及偏倚既定干预的偏倚,更改为评价暴露分类的偏倚。根据上述6个评价内容对纳入文献进行偏倚风险评价。
应用Review Manager 5.4.1软件进行数据分析。利用χ2检验P值及I2对纳入的各研究进行异质性检验,若异质性较小且异质性对分析结果影响较小(P>0.10且I2<30%)则采用固定效应模型进行合并分析;若异质性较大或异质性对分析结果影响较大(P ≤ 0.10或I2≥30%)则采用随机效应模型进行合并分析并谨慎解释结果[14],并进行敏感性分析。筛选至少5项研究均检测并报告效应指标(OR值及95% CI)的PAEs组分,对各组分分别进行合并分析后,计算各组分对HDP的总和效应。Meta分析结果报告为汇总OR值及95% CI。绘制漏斗图并利用Stata/SE 16.0软件进行Egger检验以判别是否存在发表偏倚。
四、结果
1.文献筛选结果及纳入文献基本特征:本研究初检文献共98篇,其中PubMed、Embase、Web of science、中国知网、万方数据库分别25篇、20篇、37篇、12篇、4篇。去除重复记录后剩余54篇,根据纳入排除标准筛选并审核全文后共6篇文献纳入Meta分析,包含5篇英文文献和1篇中文文献,具体筛选流程见图1。纳入文献的发表年限为2015~2021年,国家和地区包括美国(3/6)、中国(1/6)、荷兰(1/6)、法国(1/6)。6项研究中3项为队列研究[8-9,15],2项为巢式病例对照研究[10,16],1项为巢式横断面研究[17],样本量共计4 159例。
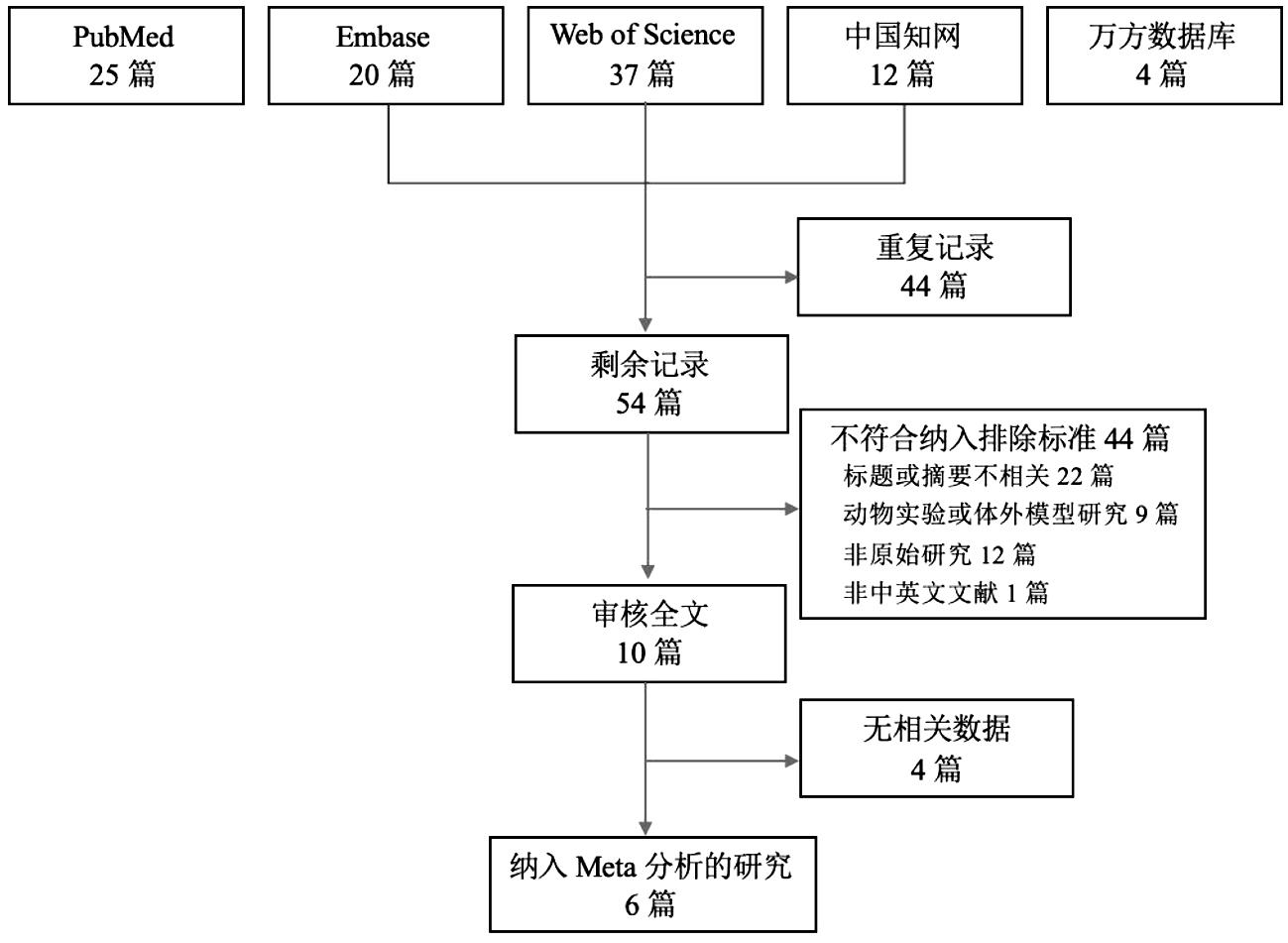
图1 文献筛选流程图
各研究的结局变量均为二分类变量,报告的效应指标均为OR值及95% CI。其中1项巢式病例对照研究[10]以PE为病例组,2项队列研究[8,15]以GH/PE/HELLP综合征/子痫为观察结局,其余研究以GH为病例组或观察结局。5项研究对尿液样本、1项研究[16]对血清样本进行检测以获取PAEs暴露数据。本研究主要关注MEP、MBP、MCPP、MBzP和DEHP这5种重要PAEs组分。各项研究的基本特征、质量评价结果及报告的效应指标见表1和表2,偏倚风险评价结果见图2。
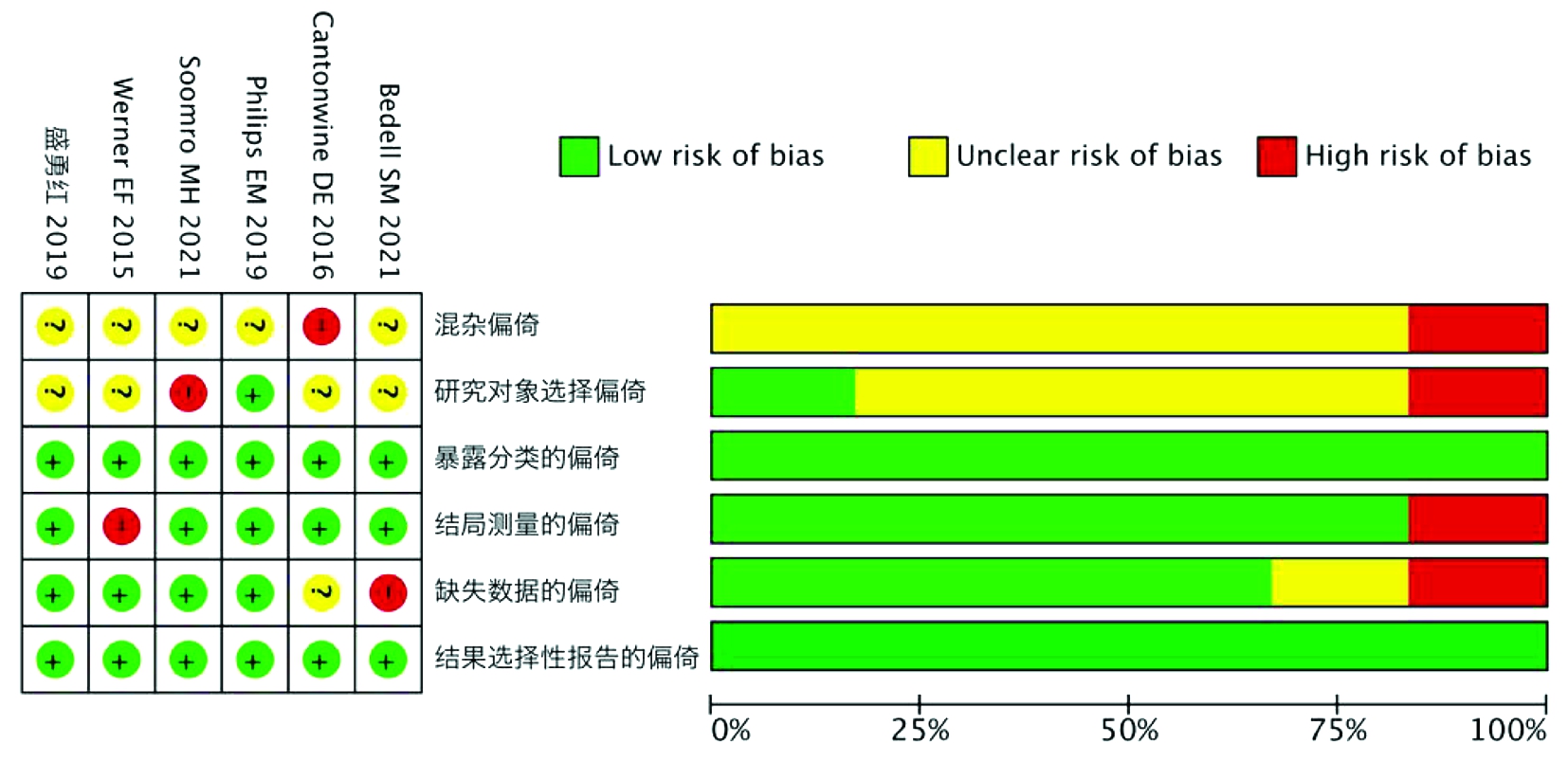
左:单个研究偏倚风险;右:总体偏倚风险
图2 纳入研究的偏倚风险评价结果
2.Meta分析结果:纳入的6项研究存在异质性(P=0.07,I2=31%),故采用随机效应模型进行Meta分析。结果显示,孕期MEP组分高暴露与较高的HDP风险相关(OR=1.25,95% CI =1.09~1.43),MBP、MCPP、MBzP、DEHP与HDP发病的关联无统计学意义。汇总分析显示,孕期5种PAEs暴露可显著增加HDP发病风险(OR=1.16,95% CI:1.06~1.26)。Meta分析结果见图3。
表1 纳入研究的基本特征
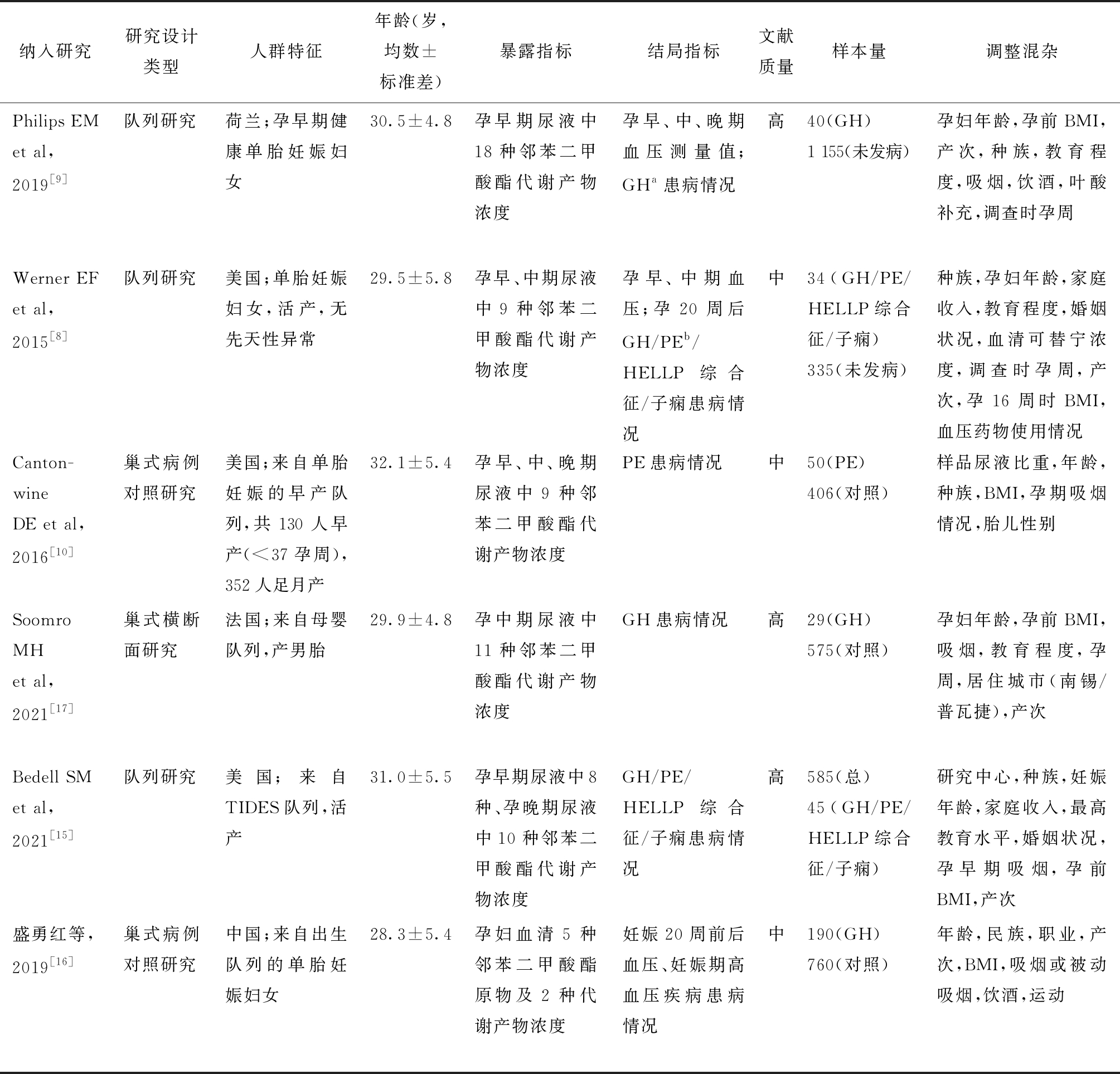
纳入研究研究设计类型人群特征年龄(岁,均数±标准差)暴露指标结局指标文献质量样本量调整混杂Philips EM et al,2019[9]队列研究荷兰;孕早期健康单胎妊娠妇女30.5±4.8孕早期尿液中18种邻苯二甲酸酯代谢产物浓度孕早、中、晚期血压测量值;GHa患病情况高40(GH)1 155(未发病)孕妇年龄,孕前BMI,产次,种族,教育程度,吸烟,饮酒,叶酸补充,调查时孕周Werner EF et al,2015[8]队列研究美国;单胎妊娠妇女,活产,无先天性异常29.5±5.8孕早、中期尿液中9种邻苯二甲酸酯代谢产物浓度孕早、中期血压;孕20周后 GH/PEb/HELLP综合征/子痫患病情况中34(GH/PE/HELLP综合征/子痫)335(未发病)种族,孕妇年龄,家庭收入,教育程度,婚姻状况,血清可替宁浓度,调查时孕周,产次,孕16周时BMI,血压药物使用情况Canton-wine DE et al,2016[10]巢式病例对照研究美国;来自单胎妊娠的早产队列,共130人早产(<37孕周),352人足月产32.1±5.4孕早、中、晚期尿液中9种邻苯二甲酸酯代谢产物浓度PE患病情况中50(PE)406(对照)样品尿液比重,年龄,种族,BMI,孕期吸烟情况,胎儿性别Soomro MH et al,2021[17]巢式横断面研究法国;来自母婴队列,产男胎29.9±4.8孕中期尿液中11种邻苯二甲酸酯代谢产物浓度GH患病情况高29(GH)575(对照)孕妇年龄,孕前BMI,吸烟,教育程度,孕周,居住城市(南锡/普瓦捷),产次Bedell SM et al,2021[15]队列研究美国;来自TIDES队列,活产31.0±5.5孕早期尿液中8种、孕晚期尿液中10种邻苯二甲酸酯代谢产物浓度GH/PE/HELLP综合征/子痫患病情况高585(总)45(GH/PE/HELLP综合征/子痫)研究中心,种族,妊娠年龄,家庭收入,最高教育水平,婚姻状况,孕早期吸烟,孕前BMI,产次盛勇红等,2019[16]巢式病例对照研究中国;来自出生队列的单胎妊娠妇女28.3±5.4孕妇血清5种邻苯二甲酸酯原物及2种代谢产物浓度妊娠20周前后血压、妊娠期高血压疾病患病情况中190(GH)760(对照)年龄,民族,职业,产次,BMI,吸烟或被动吸烟,饮酒,运动
aGH:Gestational Hypertension; bPE:Preeclampsia
表2 纳入文献的研究结果
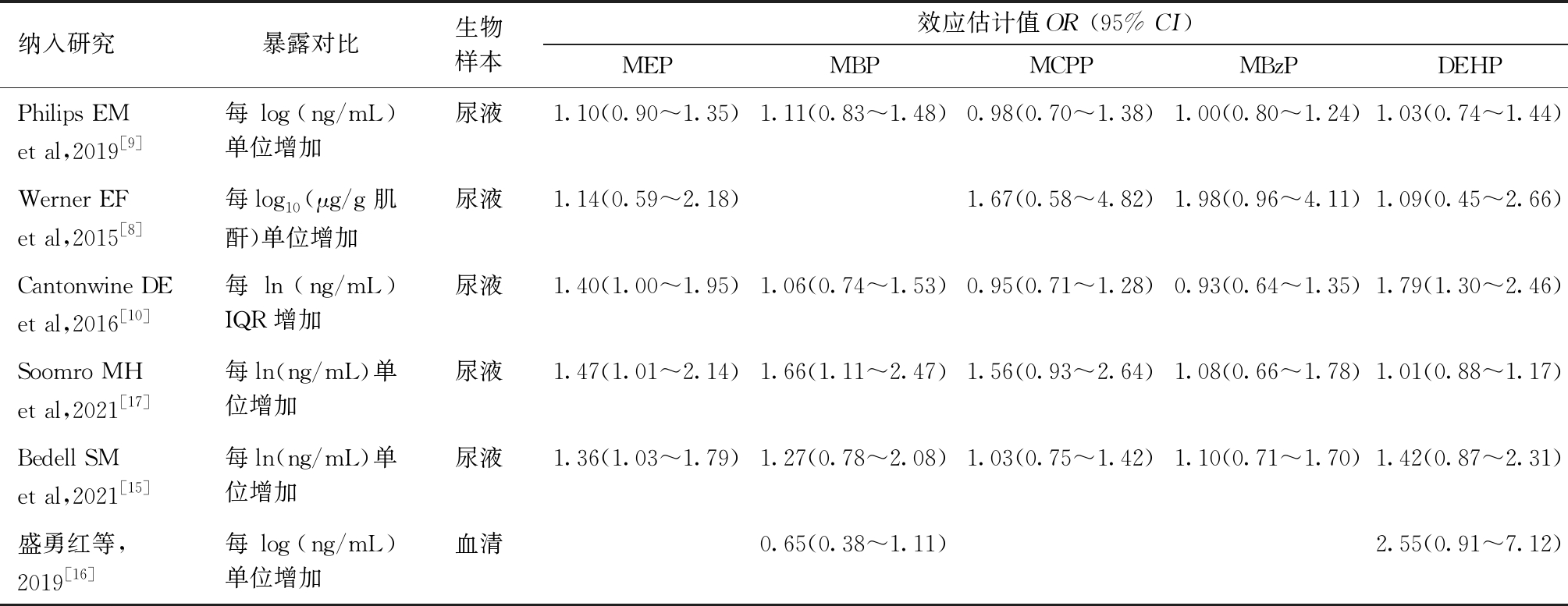
纳入研究暴露对比生物样本效应估计值OR (95% CI)MEPMBPMCPPMBzPDEHPPhilips EM et al,2019[9]每log(ng/mL)单位增加尿液1.10(0.90~1.35) 1.11(0.83~1.48)0.98(0.70~1.38)1.00(0.80~1.24)1.03(0.74~1.44)Werner EF et al,2015[8]每log10(μg/g肌酐)单位增加尿液1.14(0.59~2.18)1.67(0.58~4.82)1.98(0.96~4.11)1.09(0.45~2.66)Cantonwine DE et al,2016[10]每ln(ng/mL)IQR增加尿液1.40(1.00~1.95)1.06(0.74~1.53)0.95(0.71~1.28)0.93(0.64~1.35)1.79(1.30~2.46)Soomro MH et al,2021[17]每ln(ng/mL)单位增加尿液1.47(1.01~2.14)1.66(1.11~2.47)1.56(0.93~2.64)1.08(0.66~1.78)1.01(0.88~1.17)Bedell SM et al,2021[15]每ln(ng/mL)单位增加尿液1.36(1.03~1.79)1.27(0.78~2.08)1.03(0.75~1.42)1.10(0.71~1.70)1.42(0.87~2.31)盛勇红等,2019[16]每log(ng/mL)单位增加血清0.65(0.38~1.11)2.55(0.91~7.12)
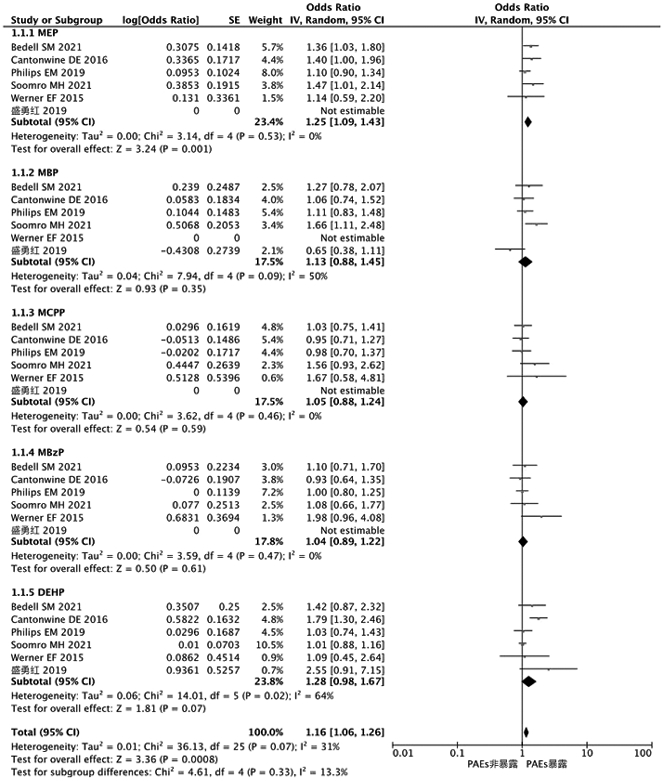
图3 PAEs与妊娠期高血压疾病的Meta分析结果
剔除以血清为检测样本的1项研究[16]后,文献间异质性显著下降(P=0.16,I2=22%),以尿液为检测样本的5项研究Meta分析结果(OR=1.16,95% CI:1.07~1.25)与总和效应基本一致。以PE或GH/PE/HELLP综合征/子痫为结局指标的3项研究[8,10,15]间异质性较小(P=0.25,I2=19%),Meta分析结果(OR=1.22,95% CI: 1.08~1.38)与总和效应基本一致;以GH为结局指标的3项研究[9,16,17]仍存在异质性(P=0.11,I2=35%),Meta分析结果(OR=1.11,95% CI:0.99~1.24)也与总和效应基本一致。敏感性分析结果提示文献间异质性的重要来源可能为检测的生物样本及结局指标的不尽一致,Meta汇总分析结果具有较好稳健型。
3.发表偏倚分析:利用本文纳入的6项研究绘制的漏斗图(图4)对称性良好,组分MEP、MBP、MCPP、MBzP及DEHP的Egger检验P值分别为0.405,0.700,0.083,0.165和0.190,提示存在发表偏倚的可能性较低。
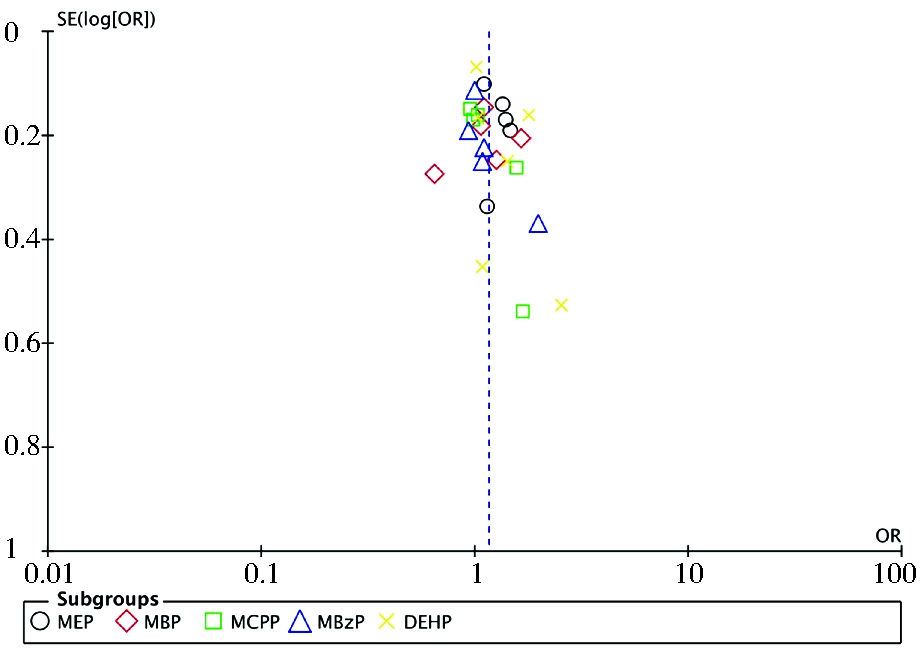
图4 漏斗图
五、讨论
HDP是一类常见的妊娠并发症,与多种不良妊娠结局相关,是导致孕产妇和围产儿健康损害及死亡的重要原因之一,目前其病因及发病机制尚未明确。GH及PE是其中最常见的两种亚型。环境中的PAEs广泛存在于塑料制品中,是导致多种激素水平异常及代谢紊乱的重要环境内分泌干扰物。孕妇是对多种不良环境因素暴露敏感的特殊人群,较低剂量环境污染物即可能对孕妇健康产生严重不良影响[18],有必要探究孕期PAEs暴露与HDP发病的相关性。本研究的Meta分析结果显示,孕期PAEs暴露可显著提高HDP发病风险,其中MEP可能是重要组分,MBP、MCPP、MBzP和DEHP与HDP发病不存在显著关联。
本文Meta分析发现,MEP可显著增加HDP风险,与大多研究结果较为一致[10,15-17],然而Philips等[9]学者在荷兰低风险人群中开展孕妇队列研究,他们在单胎妊娠妇女中发现孕早期PAEs组分MEP高暴露与HDP没有显著相关性。Werner等[8]研究者在369例样本中进行的PAEs-HDP关联研究报告了较宽的95% CI,可能原因是样本量较小,且同一个体不同孕期时间点的代谢能力差异较大,尿液中PAEs浓度表现出较高的变异性,主要涉及的PAEs组分包括MEP、MCPP、MBzP和DEHP。与其他4项研究不同,中国的研究结果[16]报告MBP对GH效应的OR值<1,而DEHP对GH效应的OR值较其他5项研究更高,不一致结果可能是广西壮族队列的人群遗传背景与其他人群存在差异,并且这项研究使用母体血清作为生物样本检测DEHP暴露水平,而其他5项研究均以尿液中四种代谢产物(MEHP、MEHHP、MEOHP、MECPP)的加和作为母体DEHP的暴露量,母体DEHP与DEHP代谢产物对HDP的效应及作用机制可能不尽一致。
HDP的病因及发病机制复杂,主要涉及炎症反应、内皮功能障碍和氧化应激等多种病理改变。有研究表明,HDP是一种氧化应激水平极度增加的病理状态,HDP孕妇的氧化应激和脂质过氧化程度显著升高[19]。PE发生与胎盘形成不良和胎盘氧化应激相关[20],而GH可能是先前存在亚临床血管功能障碍,无法适应妊娠期生理变化的结果[21]。PAEs及其代谢产物可诱导胎盘细胞中氧化应激反应发生[22],在胎盘植入、分化、侵袭和血管生成等方面产生不良影响,进而损害胎盘的发育及功能[23],相关机制有待进一步研究。
本文对PAEs-HDP关系进行了系统全面的文献检索,采取了严格的文献纳入排除标准,根据NOS量表对文献质量进行了客观评价,采用ROBINS-1工具进行了偏倚风险评价,最终筛选出的文献对所研究的问题具有一定的参考价值。此外,纳入分析的6项研究质量均为中等及以上,均采用队列研究设计或基于队列的巢式病例对照、巢式横断面研究设计,能更好地明确暴露与结局的时序性,且汇总结果没有观察到明显的发表偏倚,一定程度上增加了论证强度。6项研究均利用生物样本检测进行体内暴露测量,由专业调查人员检测血压或通过医院诊断记录确定疾病结局,一定程度上避免了回忆及报告偏倚,结论具有较强说服力。
本项Meta分析纳入的各项研究间存在异质性,可能由检测的生物样本及结局指标的差异等因素造成,因此,采用了随机效应模型进行Meta分析,下结论时应谨慎。Cantonwine等[10]的研究基于早产队列,Soomro等[17]的研究仅纳入了生产男胎孕妇,可能存在选择偏倚。本研究纳入的6篇文献中,1篇以PE为病例组,2篇以GH/PE/HELLP综合征/子痫为观察结局,3篇以GH为病例组或观察结局。GH与PE的病情严重程度不同,病因及发病机制存在差异,因此将以PE或GH为结局指标的文献进行合并分析,可能导致对真实效应的误判。
六、结论
本文就孕期PAEs暴露与HDP发病的相关性进行了Meta分析,结果表明,孕期PAEs暴露与HDP发病存在显著关联,其中MEP可能是重要组分,未发现MBP、MCPP、MBzP、DEHP与HDP发病的相关性。为进一步确认二者关系并明确疾病机制,还需开展更多高质量、大样本、更深入的研究加以验证。
1 Henry A,Canoy D.Editorial:Hypertension During Pregnancy and Future Risk of Cardiovascular and Other Long-Term Health Outcomes.Front Cardiovasc Med,2020,7:569735.
2 Sutton ALM,Harper LM,Tita ATN.Hypertensive Disorders in Pregnancy.Obstet Gynecol Clin North Am,2018,45:333-347.
3 李丽,付强强.中国妊娠期高血压疾病患病率的Meta分析.中国妇幼保健,2019,14:3378-3381.
4 杨孜,张为远.妊娠期高血压疾病诊治指南.中华产科急救电子杂志,2015,4:206-213.
5 Choe SA,Jun YB,Kim SY.Exposure to air pollution during preconceptional and prenatal periods and risk of hypertensive disorders of pregnancy:a retrospective cohort study in Seoul,Korea.BMC Pregnancy Childbirth,2018,18:340.
6 Mendola P,Wallace M,Liu D,et al.Air pollution exposure and preeclampsia among US women with and without asthma.Environ Res,2016,148:248-255.
7 Rolfo A,Nuzzo AM,De Amicis R,et al.Fetal-Maternal Exposure to Endocrine Disruptors:Correlation with Diet Intake and Pregnancy Outcomes.Nutrients,2020,12:1744.
8 Werner EF,Braun JM,Yolton K,et al.The association between maternal urinary phthalate concentrations and blood pressure in pregnancy:The HOME Study.Environ Health,2015,14:75.
9 Philips EM,Trasande L,Kahn LG,et al.Early pregnancy bisphenol and phthalate metabolite levels,maternal hemodynamics and gestational hypertensive disorders.Hum Reprod,2019,34:365-373.
10 Cantonwine DE,Meeker JD,Ferguson KK,et al.Urinary Concentrations of Bisphenol A and Phthalate Metabolites Measured during Pregnancy and Risk of Preeclampsia.Environ Health Perspect,2016,124:1651-1655.
11 Wells GA,Shea B,O′Connell D,et al.The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in Meta-analyses.Oxford,2000.
12 Hinneburg I.ROBINS-1:A tool for asssessing risk of bias in non-randomised studies of interventions.Med Monatsschr Pharm,2017,40:175-177.
13 孙凤,高乐,杨智荣,等.偏倚风险评估系列:(五)非随机干预性研究.中华流行病学杂志,2018,39:374-381.
14 Higgins JP,Thompson SG,Deeks JJ,et al.Measuring inconsistency in meta-analyses.BMJ,2003,327:557-560.
15 Bedell SM,Lyden GR,Sathyanarayana S,et al.First- and Third-Trimester Urinary Phthalate Metabolites in the Development of Hypertensive Diseases of Pregnancy.Int J Environ Res Public Health,2021,18:10627.
16 盛勇红.孕妇血清中邻苯二甲酸酯暴露水平与妊娠期高血压疾病发生风险的关系.广西医科大学,2019.
17 Soomro MH,Maesano CN,Heude B,et al.The association between maternal urinary phthalate metabolites concentrations and pregnancy induced hypertension:Results from the EDEN Mother-Child Cohort.J Gynecol Obstet Hum Reprod,2021,50:102216.
18 Green MP,Harvey AJ,Finger BJ,et al.Endocrine disrupting chemicals:Impacts on human fertility and fecundity during the peri-conception period.Environ Res,2021,194:110694.
19 Draganovic D,Lucic N,Jojic D.Oxidative Stress Marker and Pregnancy Induced Hypertension.Med Arch,2016,70:437-440.
20 殷为,钟梅.妊娠期高血压疾病的病因、预测及诊疗进展.实用医学杂志,2016,32:1887-1890.
21 Nobles CJ,Williams A,Ouidir M,et al.Differential Effect of Ambient Air Pollution Exposure on Risk of Gestational Hypertension and Preeclampsia.Hypertension,2019,74:384-390.
22 Tetz LM,Cheng AA,Korte CS,et al.Mono-2-ethylhexyl phthalate induces oxidative stress responses in human placental cells in vitro.Toxicol Appl Pharmacol,2013,268:47-54.
23 Martinez-Razo LD,Martinez-Ibarra A,Vazquez-Martinez ER,et al.The impact of Di-(2-ethylhexyl) Phthalate and Mono(2-ethylhexyl) Phthalate in placental development,function,and pathophysiology.Environ Int,2021,146:106228.