子宫内膜异位症(Endometriosis,EMS)是指具有生长功能的子宫内膜组织(腺体和间质)出现在子宫腔被覆黏膜及宫体肌层以外的雌激素依赖性疾病[1],因反复出血,继而引发疼痛、不孕及结节或包块等。2007年《子宫内膜异位症的诊断与治疗规范》中指出,约50%的EMS患者合并不孕[2],2015年《子宫内膜异位症的诊治指南》中指出,40%~50%的EMS患者合并不孕[3]。
既往对于卵巢子宫内膜异位囊肿合并不孕症多采用手术治疗,但手术对于卵巢储备功能的影响以及术后复发率高已逐渐被人们所认识。EMS合并不孕选用体外受精(In-vitro fertilization,IVF)治疗已被广泛运用于各生殖中心,所获得的临床助孕结局也越来越被关注,本文即是对此类患者行体外受精治疗单个取卵周期累积活产率进行统计分析。
资料与方法
一、临床资料
回顾性分析2014年1月—2020年9月在广东省中医院生殖医学科因EMS为主要指征进行IVF治疗的临床资料,按照女方年龄分为≤35岁、35岁<~<40岁、≥40岁组;按照获卵数不同分为0枚、1~3枚,4~5枚、6~10枚、11~15枚、≥16枚组;按照腹腔镜/经腹手术史分为卵巢囊肿剔除组、手术未剔除卵巢囊肿组、未接受手术组。EMS诊断标准参考《子宫内膜异位症的诊治指南》[3]。
本研究纳入标准:(1)夫妻同居,未避孕1年以上未孕;(2)曾行腹腔镜手术或者经腹手术确诊EMS,手术中见到典型EMS腹膜种植灶和/或切(剥)除可疑病灶/内异囊肿壁的病理诊断确诊EMS;或经阴道超声发现卵巢子宫内膜异位囊肿(诊断要点:囊肿呈圆形或者椭圆形,与周围组织如子宫粘连,囊壁厚而粗糙,内见细小絮状光点),满足痛经、性交痛、骶韧带触痛阳性、CA125升高(>35 U/mL)等临床或实验室标准中的任意2项;(3)接受IVF治疗。
排除标准:(1)双方至少有一方染色体核型异常影响生育;(2)男方中重度精子异常或患无精症;(3)影响胚胎着床发育的各种子宫畸形或宫腔粘连;(4)合并内分泌系统或免疫系统严重疾病;(5)具有IVF-ET禁忌症。
二、研究方法
1. 促排卵方案:符合因EMS拟行IVF助孕标准的夫妇,女方进行促排卵治疗。促排卵方案选择标准如下:(1)常规选取长方案/超长方案或拮抗剂方案治疗;(2)微刺激方案或黄体期促排卵方案治疗:用于低反应患者 [(窦卵泡计数(Antral follicle count,AFC)≤3个)]、或采用长方案或拮抗剂方案获卵数≤3个未获得妊娠者重复周期使用。
2. 取卵及受精:女方卵泡达到常规取卵标准(主导卵泡直径2个≥18 mm或3个≥17 mm时,或直径≥16 mm的卵泡数占直径≥14 mm卵泡数60%以上)后,晚上注射人绒毛膜促性腺激素(珠海丽珠)5 000~10 000 U,或重组人绒毛膜促性腺激素(默克雪兰诺,瑞士)250 μg;拮抗剂方案为预防卵巢过度刺激综合征(OHSS)发生采用醋酸曲普瑞林(辉凌,瑞士)0.2 mg扳机;扳机34~38 h后行经阴道B超引导下取卵。精液获取均为手淫取精方式获取,采用直接洗涤法或上游法获得精子,受精方式为IVF。
3. 胚胎移植及黄体支持:采用长方案或超长方案患者可考虑接受新鲜周期胚胎移植,新鲜周期移植患者取卵后第3日进行卵裂期胚胎移植,或取卵后第5日进行囊胚移植;冻融周期胚胎移植患者,均使用醋酸曲普瑞林(辉凌,瑞士)3.75 mg注射1~3个疗程后(单次皮下或肌肉注射醋酸曲普瑞林3.75 mg /28 d为1个疗程),再使用激素替代方案准备子宫内膜,于转化内膜第4日行卵裂期胚胎移植或第6日行囊胚移植。取卵后当日或冻融周期转化内膜日开始给予黄体酮注射液(湖南康都)40 mg/d肌肉注射,或使用阴道黄体酮凝胶(默克雪兰诺,瑞士)90 mg/d阴道给药,并加用地屈孕酮(雅培,美国)10 mg口服(BID)。
4. 随访及观察指标:胚胎移植后随访至分娩。观察指标为原发不孕比例、不孕年限、女方BMI、AFC、可利用胚胎数、优质胚胎数、无可利用胚胎率、每取卵周期累计临床妊娠率、每取卵周期移植后累积自然流产率、每取卵周期累积活产率等。本研究中累积活产率的计算参照2018年中国专家共识,以单个取卵周期累积活产率进行计算[4],随访期限为移植胚胎后直至获得活产分娩或移植完所有胚胎后未获得活产分娩。
5. 指标定义:累积临床妊娠率=获得临床妊娠的取卵周期数/总取卵周期数×100%(临床妊娠:超声确认见妊娠囊和/或见卵黄囊和/或见胎心管搏动);累积自然流产率=发生自然流产的取卵周期数/获得临床妊娠的取卵周期数×100%(自然流产:妊娠未满28周,胚胎/胎儿体重不足1 000 g而出现胚胎/胎儿自然停止发育者);累积活产率=获得活产的取卵周期数/总取卵周期数×100%(活产:妊娠28周以后活产的婴儿)
三、统计学分析
采用SPSS 24.0统计学软件进行数据处理。计量资料正态分布数据采用t检验或单因素ANOVA检验(方差齐),非正态分布数据采用Kruskal-Wallis检验(方差不齐);计数资料采用χ2检验及Fisher′s精确检验。P<0.05为差异有统计学意义。
结 果
一、一般资料
2014年1月—2020年9月期间共201对不育夫妇接受291个取卵周期治疗。女方年龄在22岁~47岁之间,BMI在15.16 kg/m2~31.13 kg/m2之间,获卵数为0~25枚。291个周期中有16个周期(5.5%)未获得卵子,47个取卵周期(16.2%)未获得可利用胚胎。每取卵周期累积临床妊娠率为51.2%(149/291),累积自然流产率为22.2%(33/149),累积活产率为42.6%(124/291),其中8个周期为流产后再次移植同取卵周期剩余冷冻胚胎获得活产。
二、不同年龄分组比较
不孕年限在≤35岁组、35岁<~<40岁组及≥40岁组中进行比较,无统计学差异。女方BMI三组比较:≥40岁组高于≤35岁组,差异有统计学意义。原发不孕比例:≤35岁组与其他各组比较,差异有统计学意义。AFC、获卵数、可利用胚胎数、累积临床妊娠率、累积活产率:≥40岁组均显著低于≤35岁组及35岁<~<40岁组,差异有统计学意义。无可利用胚胎率:≥40岁组显著高于≤35岁组及35岁<~<40岁组,差异有统计学意义。优质胚胎数:≥40岁组少于≤35岁组,差异有统计学意义。随着年龄的增加,累积自然流产率逐渐增加(P<0.05)。见表1。
表1 不同年龄段分组各指标比较![]()
Table 1 Variations of indicators according to female ![]()

Groups(female age,years)Oocytes retrievedcycles(N)Infertile yearsFemaleBMI(kg/m2)AFC(n)Number ofoocytes retrieved(n)Number ofavailable embryos(n)Number ofhigh qualityembryos(n)≤351933.5±2.220.9±2.611.1±7.7∗8.1±6.2∗4.8±4.3∗2.0±2.335<-<40503.5±2.921.5±2.59.7±6.5∗7.3±4.9∗4.4±3.2∗1.5±1.8≥40483.9±3.621.8±1.9△4.5±4.22.7±3.61.7±2.50.8±2.0△Groups(Female age,years)Oocytes retrievedcycles(N)Ratio of primary infertility[%(n/N)]Ratio of noavailable embryos[%(n/N)] Cumulative clinicalpregnancy rate[%(n/N)] Cumulative miscarriage rate[%(n/N)]#Cumulative live birth rate [%(n/N)] ≤3519374.1(143/193)14.0(27/193)∗58.0(112/193)∗12.5(14/112)53.4(103/193)∗35<-<405052.0(26/50)△10.0(5/50)∗62.0(31/50)∗45.2(14/31)40.0(20/50)∗≥404843.8(21/48)△31.3 (15/48)12.50(6/48)83.3(5/6)2.1(1/48)
Compared with the group of age≤35 years old, △P<0.05; Compared with the group of age≥40 years old, *P<0.05; Compared among the 3 groups, #P<0.05.
三、不同获卵数比较
未获卵组及获卵数1~3枚组女方年龄显著高于其他各组(P<0.05);未获卵组及获卵数1~3枚组的AFC显著小于其他各组,获卵数增加与AFC计数呈正相关性(P<0.05)。随着获卵数增加,可利用胚胎数及优质胚胎数呈增加趋势(P<0.05);获卵数1~3枚组无可利用胚胎率为33.7%,而当获卵≥4枚时无利用胚胎率下降为0,差异有统计学意义;不同获卵数组间不孕年限、女方BMI、原发不孕占比、累积自然流产率比较,差异均无统计学意义。累积临床妊娠率、累积活产率:获卵数1~3枚组均显著低于其他各组(P<0.05),随着获卵数的增加,累积临床妊娠率及活产率也均呈上升趋势。见表2。
表2 不同获卵数分组各指标比较![]()
Table 2 Variations of indicators according to the number of retrieved ![]()

Groups(Oocytes number)Oocytes retrieved cycles(N)InfertileyearsFemale age(year) #FemaleBMI(kg/m2)AFC(n) #Number of available embryos(n) #Number of highquality embryos(n)#0164.5±3.636.6±5.221.5±2.34.1±2.3//1-3923.8±3.036.7±5.721.3±2.34.5±3.01.0±0.80.4±0.74-5412.9±1.633.1±4.2 ab21.0±2.57.6±4.1ab2.6±1.11.1±0.96-10643.8±2.732.9±3.9 ab21.3±3.011.7±6.6ab5.2±2.02.0±1.611-15473.4±2.131.7±3.5 ab20.6±2.115.5±7.5ab6.9±2.72.8±2.6≥16313.3±2.432.1±4.2 ab21.0±2.518.7±6.7ab12.0±3.75.0±2.9Groups(Oocytesnumber)OocytesRetrievedcycles(N)Ratio of primary infertility[%(n/N)]Ratio of no available embryos[%(n/N)]Cumulativeclinical pregnancyrate [%(n/N)] #Cumulative miscarriagerate [%(n/N)]Cumulative live birth rate[%(n/N)]#01681.3(13/16)////1-39258.7(54/92)33.7(31/92) 14.1(13/92) 38.5(5/13)8.7(8/92) 4-54170.7(29/41)0.0(0/41)b61.0(25/41)b 12.0(3/25)53.7(22/41)b6-106465.6(42/64)0.0(0/64)b68.8(44/64)b 25.0(11/44)60.9(39/64)b11-154770.2(33/47)0.0(0/47)b78.7(37/47)b 21.6(8/37)63.8(30/47)b≥163161.3(19/31)0.0(0/31)b96.8(30/31)b20.00(6/30)80.7(25/31)b
Compared with the group with no available oocytes,a P<0.05; Compared with the group of oocytes number 1~3,b P<0.05; Compared among the groups,#P<0.05
四、手术史分组比较
201例患者中有82例(40.8%)患者(133个取卵周期)曾接受卵巢子宫内膜异位囊肿剔除术,57例(28.4%)患者(66个取卵周期)接受手术治疗但未行卵巢剔除囊肿,62例(30.8%)患者(92个取卵周期)未接受手术治疗。
卵巢囊肿剔除组、手术未剔除卵巢囊肿组、未接受手术组比较:原发不孕比例、女方BMI及累积自然流产率,三组差异无统计学意义。不孕年限:手术未剔除卵巢囊肿组>卵巢囊肿剔除组>未接受手术组(P<0.05);AFC和获卵数:手术未剔除卵巢囊肿组>未接受手术组>卵巢囊肿剔除组,差异均有统计学意义。女方年龄:未接受手术组高于其他两组(P<0.05)。可利用胚胎数:卵巢囊肿剔除组少于其他两组,P<0.05。无可利用胚胎率:卵巢囊肿剔除组显著高于手术未剔除卵巢囊肿组(P<0.05)。优质胚胎数、累积临床妊娠率、累积活产率:卵巢囊肿剔除组均低于手术未剔除囊肿组,差异均有统计学意义。见表3。
表3 卵巢囊肿剔除组、手术未剔除卵巢囊肿组、未接受手术组各指标比较![]()
Table 3 Variations of indicators among oophorocystectomy group, surgery without oophorocystectomy group, and no surgery ![]()
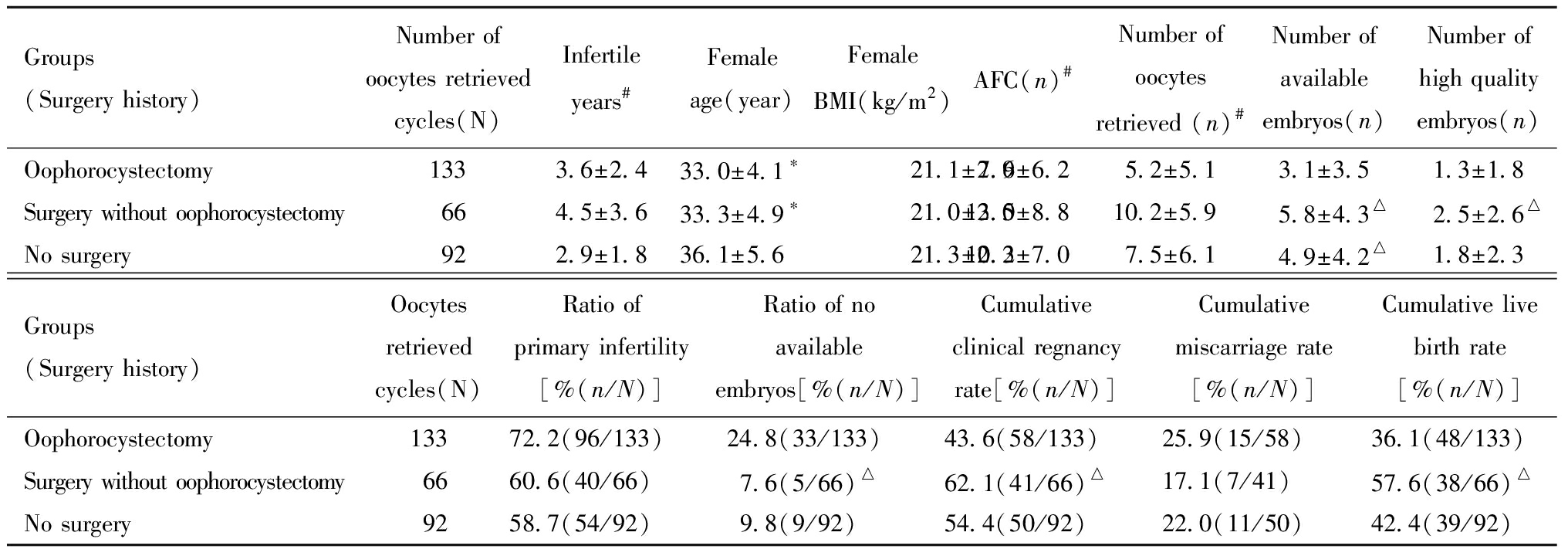
Groups(Surgery history)Number ofoocytes retrievedcycles(N)Infertile years #Female age(year)Female BMI(kg/m2)AFC(n)#Number of oocytes retrieved (n) #Number of available embryos(n)Number ofhigh qualityembryos(n)Oophorocystectomy1333.6±2.433.0±4.1∗21.1±2.67.9±6.25.2±5.13.1±3.51.3±1.8Surgery without oophorocystectomy664.5±3.633.3±4.9∗21.0±2.513.0±8.810.2±5.95.8±4.3△2.5±2.6△No surgery922.9±1.836.1±5.621.3±2.310.2±7.07.5±6.14.9±4.2△1.8±2.3Groups(Surgery history)Oocytesretrievedcycles(N)Ratio of primary infertility[%(n/N)]Ratio of no available embryos[%(n/N)]Cumulativeclinical regnancyrate[%(n/N)]Cumulative miscarriage rate[%(n/N)]Cumulative livebirth rate[%(n/N)]Oophorocystectomy13372.2(96/133)24.8(33/133)43.6(58/133)25.9(15/58)36.1(48/133)Surgery without oophorocystectomy6660.6(40/66)7.6(5/66)△62.1(41/66)△17.1(7/41)57.6(38/66)△No surgery9258.7(54/92)9.8(9/92)54.4(50/92)22.0(11/50)42.4(39/92)
Compared with the group without surgery history,*P<0.05;Compared with the group with oophorocystectomy history,△P<0.05;Compared among the 3 groups,#P<0.05
五、低反应获卵数≤3枚患者数据
当获卵数≤3枚时,>35岁组有18例患者共接受了53个取卵周期治疗,≤35岁组有32例病例共接受55个取卵周期治疗,>35岁组累积自然流产率为100%,累计活产率为0。≤35岁组卵巢囊肿剔除手术率、AFC均高于>35岁组(P<0.05)。未获卵率、可利用胚胎数、无可利用胚胎率比较,两组无统计学差异。≤35岁组累积临床妊娠率略高于>35岁组,但差异无统计学意义。见表4。≤35岁患者中85.5%(47/55)的患者曾行卵巢子宫内膜异位囊肿剔除术者,接受囊肿剔除手术后的患者累积活产率仅为10.6%(5/47),而未接受囊肿剔除手术的患者累计活产率为37.5%(3/8)。
表4 获卵≤3枚患者不同年龄分组各指标比较![]()
Table 4 Variations of indicators according to female age with number of retrieved oocytes ![]()

Groups(Female age, years)OocytesRetrievedcycles(N)Ovarian cyst removed rate[%(n/N)]∗AFC∗Ratio of no available oocytes[%(n/N)]Number ofavailableembryos(n)Ratio of noavailable embryos[%(n/N)]Cumulativeclinicalpregnancy rate[%(n/N)]Cumulativemiscarriagerate[%(n/N)]Cumulativelive birth rate %(n/N)]≤355585.5(47/55)5.1±3.418.2(10/55)0.8±0.849.1(27/55)18.2(10/55) 20(2/10)14.6(8/55)>355337.7(20/53)3.7±1.911.3(6/53) 0.9±0.937.7(20/53)5.7(3/53)100(3/3)0(0/53)
Compared between the 2 groups,*P<0.05
讨 论
EMS引起不孕症的发病机制可能与以下几个方面有关:炎症反应导致盆腔粘连、输卵管扭曲、阻塞等;子宫内膜中由多种细胞介导的免疫成分的改变影响子宫内膜发育,导致子宫内膜容受性下降:子宫内膜异位囊肿导致卵巢组织丢失、卵巢储备功能下降,排卵异常、甚至胚胎质量低下;腹腔液中的免疫异常和炎症反应可造成配子、胚胎发育潜能下降[5]。
体外受精-胚胎移植技术的发展使得越来越多的EMS患者通过这项技术获得活产,本研究根据2018年中国专家共识[4]中提到的依据女方年龄及获卵数对EMS-不孕症患者累积临床妊娠率及活产率进行了分析,并根据这一疾病的特殊诊疗方式按既往是否曾接受腹腔镜/开腹手术治疗予以进一步分析。首先根据女方年龄分层分析,发现当女方年龄≥40岁时,获卵数、可利用胚胎数、累积临床妊娠率与累积活产率均显著下降,而自然流产率显著升高,总的数据显示随着年龄的增加,AFC、获卵数、可利用胚胎数以及累积活产率等均呈下降趋势。其他研究如Malizia等[6]及De Neubourg等[7]通过分析大数据也均得出年龄是影响累积活产率的直接影响因素,随着年龄的增加,累积活产率显著降低。而Ballester等[8]研究也得出>35岁的直肠EMS患者临床妊娠率明显降低。其次是获卵数,普遍认为获卵数可以做为预测累积活产率的一项关键指标,随着获卵数的增加会带来可利用胚胎数增加,进而累积临床妊娠率及累积活产率相应升高[9-10]。本研究数据显示获卵数1~3枚组无可利用胚胎率超过30%,而当获卵≥4枚时均可获得可利用胚胎,同时也可获得较为理想的累积临床妊娠率及累积活产率。回顾病例既往手术史发现,纳入病例中接近70%的患者曾接受盆腔手术治疗,超过40%的患者曾接受卵巢子宫内膜异位囊肿剔除术,虽然目前腹腔镜检查术被认为是诊断EMS的金标准,也被拟定为治疗EMS合并不孕症的重要手段,但本研究发现行卵巢囊肿剔除术的患者即使比较年轻,可能由于卵巢皮质层的破坏,导致AFC下降,致使获卵数、可利用胚胎数及优质胚胎数均显著低于未行卵巢囊肿剔除的手术患者,最终导致这部分患者临床妊娠率及活产率下降。尤其值得注意的是本研究中曾接受卵巢囊肿剔除术治疗的年轻低反应患者单个周期累积活产率仅为10.6%,高龄低反应患者累积活产率为0,极大程度地拉低了累积活产率,另外,这部分患者也面临着不断重复取卵周期治疗,承受着经济与心理上的双重压力。Roux等[11]回顾性研究发现卵巢低反应(POR)(获卵数≤3枚/AFC<5~7 /AMH<0.5~1.1 ng/mL)是影响累积活产率的重要因素之一,Maignien等[12]既往有卵巢肿瘤剔除史,AMH低,AFC少等均可能对临床结局造成负面影响。Roustan等[13]回顾性研究发现,因卵巢囊肿剔除术后导致卵巢功能低下(DOR)的EMS患者每取卵周期临床妊娠率及每取卵周期活产率均低于原发性DOR患者,考虑除了手术损伤导致卵巢功能的下降直接影响了助孕成功率,同时EMS患者胚胎质量及种植率下降也是其中一个因素。还有研究认为既往曾接受手术治疗的患者可能面临着不孕年限延长,卵巢储备功能下降,深部粘连更严重,从而使累积活产率明显下降[14-15]。本研究显示曾接受手术治疗的患者不孕年限大于未接受手术患者,部分患者可能在接受手术治疗时尚无生育要求,或者在术后未采取积极的助孕措施错失了最佳的治疗时机。另一方面,对于曾接受手术治疗但未行卵巢囊肿剔除术的患者,因卵巢皮质层未受到明显破坏,AFC、获卵数等均未受到不良影响,其累积临床妊娠率与活产率在数值上均略高于未接受手术患者,但并无统计学意义,不能排除与样本量的局限有关。国内学者研究认为在进行体外受精治疗前采用手术或手术+GnRHa干预能明显提高EMS患者的累积活产率[16-17],且发现晚干预比早干预可能效果更好,考虑可能与早干预因时间较久导致子宫内膜异位病灶复发有关 [17]。Bendifallah等[18]也对110例深部直肠EMS患者行ART治疗研究发现,行手术治疗再行ART治疗与单纯行ART治疗比较累积活产率,一个周期为32.7% vs.13.0%,二个周期为58.9% vs.24.8%,三个周期为70.6% vs.54.9%。
中国专家2018年共识[19]指出对于年龄大(>35岁)、双侧卵巢子宫内膜异位囊肿、术前有月经紊乱等高危因素的患者,如已有卵巢储备功能低下者,不宜手术应直接行体外受精-胚胎移植(IVF-ET)。而对于疼痛症状严重或可疑卵巢子宫内膜异位囊肿恶变、囊肿逐渐增大无法穿刺、穿刺无效,IVF-ET治疗反复失败者,仍需腹腔镜探查手术,病理检查确诊,但手术本身不能明显改善术后妊娠率。通过文中数据分析,与大部分文献相符的是,女方年龄增加,AFC减少(包括手术损伤)、获卵数减少等直接影响了EMS患者行IVF-ET治疗的累积活产率。
EMS患者因体内免疫调节系统的异常,自然流产率偏高,如Santulli[20]研究发现EMS患者自然流产率可以高达29%,Saraswat等[21]研究也均发现EMS患者早期自然流产率高于无EMS患者。本研究数据显示EMS患者行体外受精治疗单个取卵周期的累积自然流产率达到22.2%,通过各方面数据比较,发现自然流产率仅与女方年龄呈正相关性,随着女方年龄的增加,自然流产率升高,累积活产率也相应下降。
总之,高龄、卵巢功能减退(包括卵巢囊肿剔除术后损伤导致)均是影响EMS患者累积活产率的重要因素。对于EMS尚未生育的患者,即使年轻患者,建议优先评估卵巢储备功能,再决定是否行手术治疗以及慎重选择手术方式,或者考虑对这部分患者实施生育力保存。而对于卵巢功能下降患者,或已经行手术治疗未如期获得妊娠者,建议积极进行体外受精治疗,以免错过最佳助孕时机。
本研究存在不足之处为,因纳入患者并未全部使用手术方法进行诊治,故尚无法准确从EMS分期上来进行分层分析,整体纳入样本量偏小,使研究数据存在一定的偏倚,后期的研究期望加大样本量分析,以获得更有指导性的临床数据。
1 Kennedy S,Bergqvist A,Chapron C,et al.ESHRE guideline for the diagnosis and treatment of endometriosis.Hum Reprod,2005,20:2698-2704.
2 中华医学会妇产科学分会子宫内膜异位症协作组.子宫内膜异位症的诊断与治疗规范.中华妇产科杂志,2007,42:645-648.
3 中华医学会妇产科学分会子宫内膜异位症协作组.子宫内膜异位症的诊治指南.中华妇产科杂志,2015,50:161-169.
4 中国医师协会生殖医学专业委员会.基于单次促排卵周期的累积分娩/活产率专家共识.中华生殖与避孕杂志,2018,38:963-968.
5 王鹏玲.子宫内膜异位症对体外受精--胚胎移植治疗结局的影响及相关因素分析.济南:山东大学,2019:12.
6 Malizia BA,Dodge LE,Penzias AS,et al.The cumulative probability of liveborn multiples after in vitro fertilization:a cohort study of more than 10 000 women.Fertil Steril,2013,99:393-399.
7 De Neubourg D,Bogaerts K,Blockeel C,et al.How do cumulative live birth rates and cumulative multiple live birth rates over complete courses of assisted reproductive technology treatment per woman compare among registries?.Hum Reprod,2016,31:93-99.
8 Ballester M,d′Argent EM,Morcel K,et al.Cumulative pregnancy rate after ICSI-IVF in patients with colorectal endometriosis:results of a multicentre study.Hum Reprod,2012,27:1043-1049.
9 Polyzos NP,Drakopoulos P,Parra J,et al.Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection:a multicenter multinational analysis including ~15,000 women.Fertil Steril,2018,110:661-670.
10 Malchau SS,Henningsen AA,Forman J,et al.Cumulative live birth rate prognosis based on the number of aspirated oocytes in previous ART cycles.Hum Reprod,2019,34:171-180.
11 Roux P,Perrin J,Mancini J,et al.Factors associated with a poor prognosis for the IVF-ICSI live birth rate in women with rAFS stage III and IV endometriosis.J Assist Reprod Genet,2017,34:921-928.
12 Maignien C,Santulli P,Gayet V,et al.Prognostic factors for assisted reproductive technology in women with endometriosis related infertility.Am J Obstet Gynecol,2017,216:280.e1-280.e9.
13 Roustan A,Perrin J,Debals-Gonthier M,et al.Surgical diminished ovarian reserve after endometrioma cystectomy versus idiopathic DOR:comparison of in vitro fertilization outcome.Hum Reprod,2015,30:840-847.
14 Maignien C,Santulli P,Bourdon M,et al.Deep infiltrating endometriosis:a previous history of surgery for endometriosis may negatively affect assisted reproductive technology outcomes.Reprod Sci,2020,27:545-554.
15 Rossi AC,Prefumo F.The effects of surgery for endometriosis on pregnancy outcomes following in vitro fertilization and embryo transfer:a systematic review and meta-analysis.Arch Gynecol Obstet,2016,294:647-655.
16 杨春霞.不同干预方式对子宫内膜异位症患者IVF/ICSI结局影响的队列研究.南京:南京医科大学,2018:1-42.
17 Zhong C,Gao L,Shu L,et al.Analysis of IVF/ICSI outcomes in endometriosis patients with recurrent implantation failure:influence on cumulative live birth rate.Front Endocrinol (Lausanne),2021,12:640288.
18 Bendifallah S,Roman H,Mathieu d,et al.Colorectal endometriosis-associated infertility:should surgery precede ART?.Fertil Steril,2017,108:525-531.e4.
19 中国医师协会妇产科医师分会子宫内膜异位症专业委员会,中华医学会妇产科学分会子宫内膜异位症协作组.子宫内膜异位症长期管理中国专家共识.中华妇产科杂志,2018,53:836-841.
20 Santulli P,Marcellin L,Menard S,et al.Increased rate of spontaneous miscarriages in endometriosis affected women.Hum Reprod,2016,31:1014-1023.
21 Saraswat L,Ayansina DT,Cooper KG,et al.Pregnancy outcomes in women with endometriosis:a national record linkage study.BJOG,2017,124:444-452.