近年胚胎停育患者数量不断增长,病因多样,但是致病机制尚不明确[1]。当前仍然无有效的预防措施,探求胚胎停育病因成为热点。 Chapman Nigel等人[2]研究证实Apelin及其受体血管紧张素II I型受体相关蛋白(putative receptor protein related to the angiotenII typel receptor,APJ)系统对于青蛙和小鼠心脏血管系统的正常发育是必需的,并且它们的缺失导致大多数胚胎中的血管破坏。
国内关于 Apelin/ APJ和胎盘绒毛组织一氧化碳(nitrc oxide,NO)生成关系的研究较少,且 Apelin/ APJ及内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)在胚胎停育患者绒毛组织中表达的文献相对较少,故本次实验旨在检测正常早孕和胚胎停育绒毛组织的Apelin、其受体 APJ、 eNOS的表达,其目的在于探讨 Apelin、其受体 APJ及 eNOS在胚胎发育和妊娠维持过程中的作用。
对象与方法
1. 研究对象:选取2018年3月—2018年12月于山西医科大学第二医院妇产科门诊就诊的20例不明原因早期(停经8~9周)胚胎停育患者为研究组,诊断标准:经超声检查提示妊娠囊在子宫内,且小于停经天数,没有胎芽或者原始的心管搏动的病人[3]。选取同期20例正常早期怀孕妇女,要求流产的病人为对照组,超声检查胎儿发育健康,以往没有不良孕产史。
所有患者月经规律,3个月期间未使用性激素类药物,没有烟酒嗜好;无心、脑、代谢及内分泌疾患;无恶性肿瘤史;无血栓病史;无外科手术史;无严重的心、肝、肾脏功能异常;无未被控制的糖尿病及高血压病;无子宫畸形等引起胚胎停育的诱发因素。经染色体基因检测(采用高通量测序技术)排除染色体问题所致胚胎停止发育,标本采集时通过山西医科大学第二医院伦理委员会审核、批准,患者均知情并签署同意书。两组患者的年龄、停经时间及妊娠次数比较差异无统计学意义(P>0.05),见表1。
表1 两组患者一般资料比较![]()

组别例数年龄(岁)停经时间(天)妊娠次数(次)研究组2027.9±2.960.2±2.81.7±0.8对照组2028.5±2.460.9±2.41.8±0.8
2. 标本采集:人工流产术后取患者绒毛组织,用无菌生理盐水反复清洗组织,绒毛组织分成两份,其中一份立即置入10%甲醛溶液中固定,用于石蜡切片的制作和免疫组织化学研究。另一份用无菌冻存管迅速置于液氮中,待RNA抽提。
3. 实验方法:
(1)绒毛组织中Apelin、APJ 及eNOS 蛋白的表达检测。采用免疫组织化学法,试剂盒购自武汉华联科生物技术有限公司,兔抗人单克隆抗体Apelin、APJ及eNOS 均为bioswamp 公司产品,工作浓度均为1∶50。结果判定:Apelin、APJ 及eNOS蛋白均以细胞质出现棕黄色颗粒为染色阳性细胞。通过显微镜拍照,每张切片选择5个具有代表意义的高倍视野观察Apelin、APJ及eNOS蛋白的分布及表达。采用Image J 分析软件,以平均光密度值表示Apelin、APJ及eNOS蛋白的表达强度。
(2)实时荧光定量逆转录聚合酶链式反应技术(Real-time PCR)检测绒毛组织中Apelin、APJ及eNOS mRNA表达。用Trizol 法提取组织的总RNA,Trizol 购自ambion 公司。引物的设计Real-time PCR以β-Actin 为内参照基因进行PCR扩增。PCR 引物由武汉天一辉远生物科技有限公司合成。采用TAKARA 公司的逆转录试剂盒进行cDNA的合成。采用KAPA Biosystems 公司的SYBR Green PCR 试剂盒,按说明书操作步骤进行PCR扩增,反应体系总体积为20 uL。本研究以β-actin为内参,采用2-△△Ct法计算Apelin、APJ及eNOS的相对表达量,实验重复3次。△Ct=目的基因Ct值-内参照基因的Ct值,△△Ct=胚胎停育组△Ct-对照组△Ct。
4. 统计学方法:使用 SPSS 20.0统计软件包进行统计分析。计量资料以![]() 表示,对所有数据进行正态性检验和方差齐性检验,对非正态分布的计量资料经自然对数转换后再行统计分析;两组间均数比较用独立样本t检验,数据间的相关性分析用Spearson相关分析法,P<0.05为差异有统计学意义。
表示,对所有数据进行正态性检验和方差齐性检验,对非正态分布的计量资料经自然对数转换后再行统计分析;两组间均数比较用独立样本t检验,数据间的相关性分析用Spearson相关分析法,P<0.05为差异有统计学意义。
结果
1. Apelin、APJ 及eNOS 蛋白在绒毛组织中的表达:Apelin蛋白在绒毛组织中的表达部位为绒毛合体滋养细胞及细胞滋养细胞,阳性染色主要位于胞浆。APJ蛋白在绒毛组织的表达主要位于合体滋养细胞、细胞滋养细胞,阳性染色主要位于胞浆。eNOS蛋白在绒毛组织中的表达部位为绒毛合体滋养细胞,阳性染色主要位于胞浆。免疫组化结果显示(见图1):Apelin蛋白、APJ蛋白和eNOS蛋白在研究组绒毛组织中的表达低于对照组绒毛组织中的表达,差异有统计学意义(P<0.05,见表2)。
表2 在两组绒毛组织中Apelin、APJ、eNOS 蛋白的表达
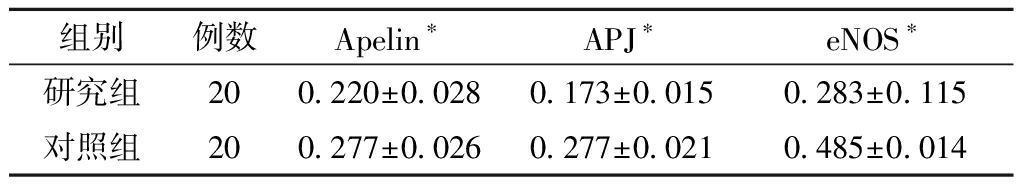
组别例数Apelin∗APJ∗eNOS∗研究组200.220±0.028 0.173±0.0150.283±0.115对照组200.277±0.0260.277±0.0210.485±0.014
注:*两组比较P<0.05。
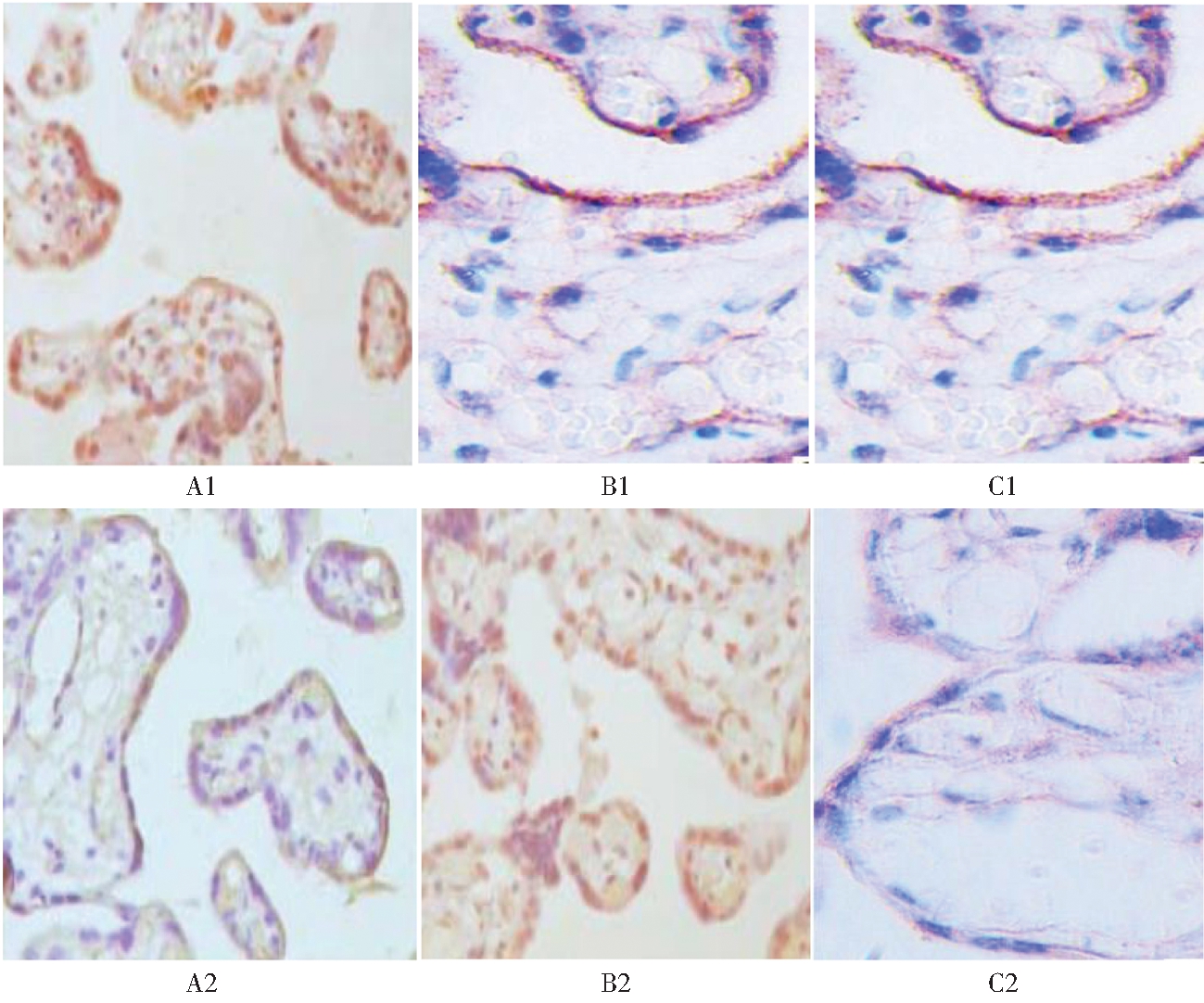
图1 两组绒毛组织中Apelin、APJ、eNOS蛋白的表达(SP×200)
图A1是Apelin在对照组绒毛组织中的表达情况,A2是Apelin在研究组绒毛组织中的表达情况;图B1是APJ在对照组绒毛组织中的表达情况,B2是APJ在研究组绒毛组织中的表达情况;图C1是eNOS在对照组绒毛组织中的表达情况,C2是eNOS在研究组绒毛组织中的表达情况。
2. 绒毛组织中Apelin mRNA、APJ mRNA及eNOS mRNA表达水平的比较:PCR检测结果显示Apelin mRNA、APJ mRNA及eNOS mRNA在两组绒毛组织中都有表达,在研究组的相对表达量较对照组低,差异有统计学意义(如图2,3,4所示)。
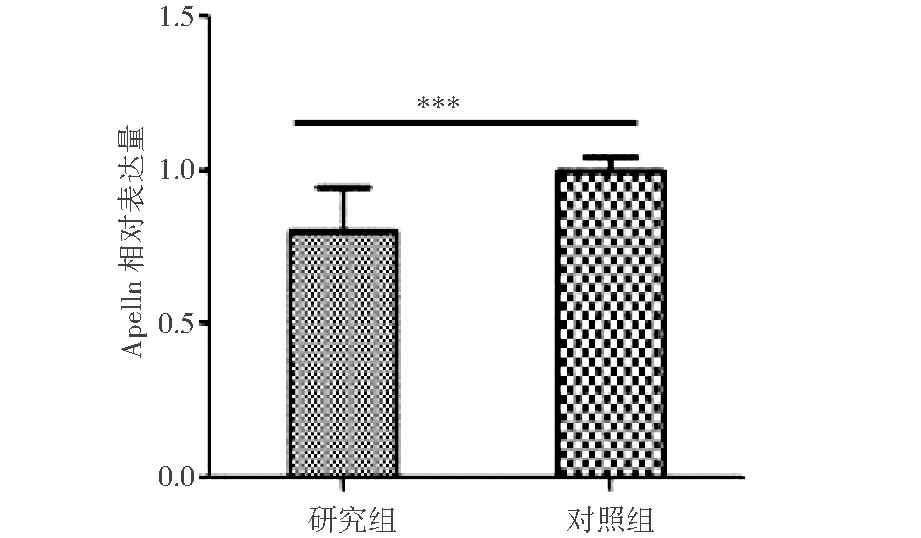
图2 两组绒毛组织中Apelin的相对表达量
注:***P<0.001
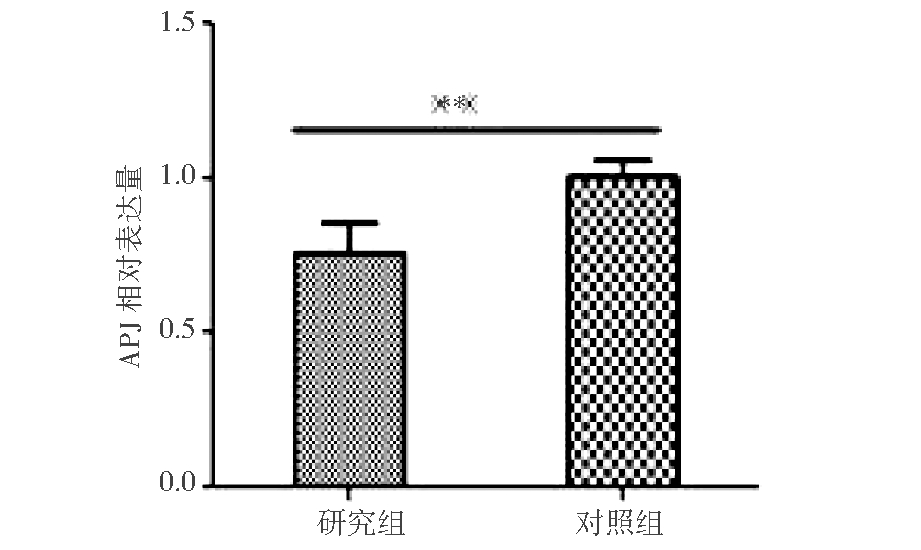
图3 两组绒毛组织中APJ的相对表达量
注:**P<0.01

图4 两组绒毛组织中eNOS的相对表达量
注:* P<0.05
3. 胚胎停育组绒毛组织中Apelin、eNOS表达的相关性
Spearson直线相关分析结果表明,研究组绒毛组织中Apelin与eNOS的表达呈弱的正相关(r=0.26,P=0.048,P<0.05),且差异均有统计学意义。
讨论
近年来学者们[4]发现早期胚胎发育与胚胎血管生成密切相关,血管生成是各种生理过程的中心,如胎儿生长发育、生殖、伤口愈合、组织修复等。目前研究表明Apelin/ APJ及eNOS与胚胎组织中血管的形成有关系,胎盘血管生成对胎盘正常的血液循环及胚胎的发育极其重要,是胎儿与母体物质交换的保证。已有的研究表明:在受精的第19 d早期的胎盘血管生成,它是妊娠初期新生的血管形成最重主要的形式,并且受精的第22 d左右呈现了完整胎儿的毛细血管网[5],许多原因不明复发性流产的产生与胎盘中血管的增生失去平衡及胎儿的血液供应不足有关。成功的妊娠依赖于胎盘良好的发育和生长,在胎盘植入和胎盘形成的过程中,血管的生成对于成功妊娠是非常关键的。
APJ是一种与血管紧张素1型受体相关的 G蛋白偶联受体,APJ与1型受体血管紧张素 II(AT1a)有强烈的序列同源性,不与血管紧张素 II结合[6]。 Apelin是一种生物活性肽,最初由Tatemoto等人从牛胃提取物中鉴定。Apelin是由内皮细胞合成并分泌的血管生成因子,通过自分泌及旁分泌在自身和相邻的细胞起作用。Apelin是APJ的内源性配体,Apelin结合并激活APJ 后可以促进其功能的发挥。
Apelin-APJ有重要的生理和病理作用,包括调节肿瘤、血管平滑肌细胞增殖、缺血/再灌注损伤、体液稳态、心血管功能、血管生成。Apelin-APJ刺激血管内皮细胞的迁移和增殖,人体内假设没有血管内皮生长因子时,也能刺激血管的萌发[7]。研究证明大约20%APJ缺失小鼠在胚胎期10.5 d时在背主动脉和卵黄囊脉管系统中具有缺陷,而另外20%的小鼠在妊娠晚期表现出结构性心脏缺陷和血管平滑肌缺陷[8]。在尿囊中和在胚胎期9.5 d侵入胎盘的脉管系统中有APJ的表达。因此,Apelin-APJ信号传导可在胚外组织以及胚胎组织中起作用,以影响中胚层衍生物的形成,如卵黄囊的脉管系统,造血祖细胞,绒毛膜及尿囊。本次实验证实在两组中Apelin-APJ都有表达,并且在早孕绒毛中分布于绒毛滋养细胞,实验组患者绒毛组织中其表达与对照组相比明显降低,使胚胎血管的发育减少,进而可能参与胚胎停止发育的发生。研究证实Apelin-APJ系统对于青蛙和小鼠心脏血管系统的正常发育是必需的,并且它们的缺失导致大多数胚胎中的血管破坏[3]。可以推测出Apelin-APJ在胎盘的完整血管网形成的阶段可能发挥的功能是必不可少的。eNOS及其产物一氧化氮(NO)调节了许多内皮细胞功能,包括血管生成、血管通透性和血管舒缩张力[9],其参与的信号转导可能在妊娠建立和维持中有重要的作用。NO的合成限速酶是eNOS,其活性的变化导致NO生成的改变。动物实验视网膜血管生成中表明eNOS对于内皮细胞的激活至关重要[10],说明eNOS在血管的生成过程中可以调节内皮细胞增殖、迁移和血管的稳定性。动物研究证明 eNOS在内皮祖细胞(成血管细胞)中有表达,并且血管母细胞和胚胎内皮细胞(Embryonic Endothelial cells,EECs)里Ser1177的磷酸化对NO的调控有着非常重要作用[11]。在血管发育的早期阶段(在鼠交配后7.2~8.5 d),eNOS的表达证实成血管细胞和内皮细胞中,促进血管生成。胚胎血管发育的初期,eNOS的磷酸化是血管生成因子介导其的关键调节因子。研究提示 eNOS活性降低[12],导致 NO合成障碍,进一步使血管损伤后平滑肌细胞增加,使血管壁内膜层增加,血管腔缩小,最终使早期的胚胎停止发育。本研究提示 eNOS在两组中都有表达,且在早孕的绒毛组织中分布于绒毛合体滋养细胞,实验组绒毛组织中其表达与对照组相比明显降低,使胚胎血管生成减少,进而可能参与胚胎停止发育的发生。
有研究报道发现[13]在心血管系统,Apelin通过激活 eNOS引发内皮细胞释放 NO,产生强有力的内皮依赖的血管扩张作用,给予eNOS抑制剂,发现 Apelin的降低血压的作用被抑制,提示 NO是apelin发挥作用的下游信号因子。Apelin扩张动脉和静脉,有血管舒张效应,其机制通过活化血管内皮细胞的内皮型eNOS刺激NO的产生和释放从而舒张血管[14]。动物实验提示 Apelin通过结合并激活 APJ,激活磷酸肌醇3-激酶(PI3 K)[3],导致 Akt活化,进而激活 eNOS使内皮细胞释放NO,进而促进胚胎血管生成。本次实验发现,实验组绒毛组织中 Apelin与eNOS的表达呈弱的正相关,由此可以得知,在胚胎早期的发育过程中Apelin及 eNOS的表达呈正相关,说明 Apelin可以促进 eNOS的生成和发挥作用。可以猜测在胚胎发育早期 Apelin及 eNOS表达升高可以促使 NO的生成,促进了胚胎在宫腔内的着床部位血管的扩张及通透性的增加,还可促使平滑肌的放松,为妊娠的顺利进行提供了适当的环境,进而促使胚胎的植入。
总之,妊娠是个既精致细腻又复杂多样的过程,胚胎的早期发育与胚胎血管生成又联系密切,继续完善这方面的研究,这将有助于对胚胎停育的血管相关因素的认识提供一定的理论依据。
1 Fortis MF,Fraga LR,Boquett JA,et al.Angiogenesis and oxidative stress-related gene variants in recurrent pregnancy loss.Reprod Fertil,2018,30:498-506.
2 Chapman NA,Dupré DJ,Rainey JK .The apelin receptor:physiology,pathology,cell signalling,and ligand modulation of a peptide-activated class A GPCR.Biochem Cell Biol,2014,92:431-440.
3 Bairagi S,Quinn KE,Crane AR,et al.Maternal environment and placental vascularization in small ruminants.Theriogenology,2016,86:288-305.
4 郑金艳,连立芬,侯海燕,等.iNOS 和caspase 3 在胚胎停育绒毛和蜕膜组织中的表达.国际妇产科学杂志,2017,44:336-338.
5 Yoo SY,Kwon SM.Angiogenesis and its therapeutic opportunities.Mediat Inflamm,2013:127170.
6 Huang Z,Luo XL,Liu MQ,et al.Function and regulation of apelin/APJ system in digestive physiology and pathology. J Cell Physiol,2019,234:7796-7810.
7 Luo XL,Liu JQ,Zhou H,et al.Apelin/APJ system:A critical regulator of vascular smooth muscle cell.Cell.Physiol,2018,233:5180-5188.
8 Freyer L,Hsu CW,Nowotschin S,et al.Loss of apela peptide in mice causes low penetrance embryonic lethality and defects in early mesodermal derivatives.Cell Rep,2017,20:2116-2130.
9 Fulton DJR.Transcriptional and posttranslational regulation of eNOS in the endothelium.Adv Pharmacol,2016,77:29-64.
10 Ha JM,Jin SY,Lee HS,et al.Regulation of retinal angiogenesis by endothelial nitric oxide synthase signaling pathway.Korean J.Physiol.Pharmacol,2016,20:533-538.
11 Gentile C,Muise-Helmericks RC,Drake CJ.VEGF-mediated phosphorylation of eNOS regulates angioblast and embryonic endothelial cell proliferation.Dev Biol,2013,373:163-175.
12 McCullagh KJA,Cooney R,O′Brien T.Endothelial nitric oxide synthase induces heat shock protein HSPA6 (HSP70B′) in human arterial smooth muscle cells.Nitric Oxide,2016,52:41-48.
13 Luo XL,Liu JQ,Zhou H,et al.Apelin/APJ system:A critical regulator of vascular smooth muscle cell.Cell.Physiol,2018,233:5180-5188.
14 Wu D,He L,Chen L.Apelin/APJ system:a promising therapy target for hypertension.Mol Biol Rep,2014,41:6691-6703.