全球有8%~12%的育龄期夫妻受到不孕不育的影响[1],世界卫生组织(WHO)和美国生殖医学学会把不孕症定义为一种疾病。目前,还没有任何补救措施可以挽救高龄育龄女性的生育力衰退,但可以为接受体外受精的35岁以上女性提供不同的解决方法。近期丹麦妇女体外受精结果提示高龄孕妇的卵巢储备及生殖结局较差,但是冻融胚胎移植(FET)似乎优于新鲜移植[2]。近年两篇系统综述和meta分析得出结论表明没有足够的证据推荐FET周期中子宫内膜准备的具体方案[3-4]。故本文比较了不同内膜准备方案在高龄育龄女性冻融胚胎中的内膜转换日的激素水平,移植胚胎情况和妊娠结局。
资料与方法
1. 资料来源:回顾性分析2017年1月—2020年6月在新疆医科大学第一附属医院生殖医学中心的1 174例高龄育龄女性FET资料,纳入标准:女性年龄>35岁;有1个以上的冻融胚胎;夫妻双方无染色体异常。排除标准:女性年龄≤35岁;夫妻任何一方染色体异常;连续移植3次以上而未孕者;患有生殖道感染,生殖系统畸形、子宫腺肌症,子宫内膜异位症等;合并宫腔粘连或者宫腔粘连分离术后,行供卵或PGD/PGS助孕者。根据子宫内膜准备方案不同,将最终纳入的研究对象分为三组方案:降调节+人工周期组646例,人工周期组222例,自然周期组306例。
2.三组方案:
(1)降调节+人工周期组。月经第3天肌注达必佳(辉凌,法国长效GnRH-a,3.75 毫克/支),于注射28~35 d后复查性激素及阴道超声,若达到降调节标准(FSH<5 mIU/L,LH<5 mIU/L,E2<50 pg/mL,窦卵泡直径5~6 mm),则开始口服补佳乐(拜尔,德国,戊酸雌二醇2 mg,bid)或者芬吗通(雅培,荷兰,雌二醇片/雌二醇地屈孕酮片2 mg,bid),月经第10天 B超监测子宫内膜厚度,如子宫内膜厚度<7 mm,适当増加补佳乐或芬吗通剂量,如果子宫内膜厚度>7 mm,则维持原剂量,雌激素应用时间>10 d。当子宫内膜厚度≥7 mm,加用达芙通(雅培,荷兰,地屈孕酮10 mg,tid)联合应用雪诺同(黄体酮阴道缓释凝胶90 mg,qd,默克雪兰诺,瑞士)和黄体酮针20 mg行内膜转化,内膜转化的第4 d移植卵裂期胚胎,内膜转化的第6 d移植囊胚。
(2)人工周期组。月经周期第3 d检查性激素正常后开始激素替代,口服补佳乐(拜尔,德国,戊酸雌二醇2 mg,bid)或者芬吗通(雅培,荷兰,雌二醇片/雌二醇地屈孕酮片2 mg,bid),月经第10天 B超监测子宫内膜厚度,如子宫内膜厚度<7 mm,适当増加补佳乐或芬吗通剂量,如果子宫内膜厚度≥7 mm,则维持原剂量,雌激素应用时间>10 d。当子宫内膜厚度≥7 mm,加用达芙通(雅培,荷兰,地屈孕酮10 mg,tid)联合应用雪诺同(默克雪兰诺,瑞士,黄体酮阴道缓释凝胶90 mg,qd)和黄体酮针20 mg行内膜转化,内膜转化的第4 d移植卵裂期胚胎,内膜转化的第6 d移植囊胚。
(3)自然周期组。月经第10~12 d开始阴道超声监测子宫内膜厚度及卵泡发育,当子宫内膜厚度>7 mm和卵泡直径>16 mm,监测是否排卵,必要时给予绒促性素(海丽珠,中国,绒毛膜促性腺激素,5 000 IU/支)10 000 IU诱导排卵,然后开始每日肌注黄体酮针20 mg行内膜转化;内膜转化的第4 d移植卵裂期胚胎,内膜转化的第6 d移植囊胚。
3. 观察指标:比较三组患者的年龄,体重指数(body mass index,BMI),不孕年限,基础卵泡刺激素(follicle stimulating hormone,FSH)值,基础黄体生成素(luteinizing hormone,LH)值,基础雌二醇(Estradiol,E2)值,抗苗勒管激素(anti-müllerian hormone,AMH),促性腺激素使用总天数,促性腺激素使用总量,基础总卵泡,内膜转化日E2,内膜转化日LH,内膜转化日孕酮(progesterone,P),内膜转换日子宫内膜厚度,移植胚胎个数,移植日胚胎类型,移植日子宫内膜厚度,临床妊娠率,异位妊娠率,多胎妊娠率,生化妊娠率,种植率,流产率,早产率,活产率,出生体重等指标是否存在差异。
4. 统计学分析:采用 SPSS 25.0 软件进行数据分析,对于呈正态分布的计量资料以均数±标准差![]() 表示,组间比较采用单因素方差分析,计数资料采用卡方检验;对于呈非正态分布的计量资料以中位数表示,组间比较采用K-W 检验,计数资科比较采用 Fisher 确切法,以P<0.05 表示差异有统计学意义。
表示,组间比较采用单因素方差分析,计数资料采用卡方检验;对于呈非正态分布的计量资料以中位数表示,组间比较采用K-W 检验,计数资科比较采用 Fisher 确切法,以P<0.05 表示差异有统计学意义。
结果
1.一般情况相关指标的比较:三组在月经周期,不孕年限,BMI,基础FSH值,基础LH值,基础E2值,AMH,基础内膜厚度,促性腺激素使用总天数,促性腺激素使用总量,基础总卵泡差异均无统计学意义,三组年龄有统计学差异。见表1。
表1 三组一般情况相关指标的比较![]()

项目降调节+人工周期(n=646)人工周期(n=222)自然周期(n=306)年龄∗ 39.16±2.74 39.58±2.83 38.88±2.35月经周期 29.50±9.21 29.19±7.32 28.22±2.61不孕年限 5.15±3.94 4.98±3.54 4.83±3.43BMI(kg/m2) 22.96±2.99 23.30±3.05 23.24±2.95基础FSH(IU/L) 9.59±13.59 8.59±3.7 8.85±4.0基础E2(pmol/mL)181.28±764.30131.02±490.69111.75±233.28基础LH(IU/L)) 8.34±46.96 5.89±21.29 7.77±45.89AMH 2.22±2.41 2.27±1.97 2.14±1.99基础内膜厚度(mm) 4.93±1.39 5.06±1.47 5.03±1.44促性腺激素使用总天数 16.45±6.35 16.64±6.21 16.59±6.63促性腺激素使用总量(IU)2 779.05±1 054.342 847.86±1 062.312 892.78±993.31基础总卵泡/个 6.87±4.84 7.47±4.97 6.69±4.71
注:三组比较,*P<0.05
2.内膜转换日激素水平及移植相关指标的比较:三组在移植胚胎个数差异无统计学意义,在内膜转化日E2、LH、P,内膜转换日子宫内膜厚度,移植日胚胎类型,移植日子宫内膜厚度差异有统计学意义。见表2。
表2 三组内膜转换日激素水平及移植相关指标的比较![]()
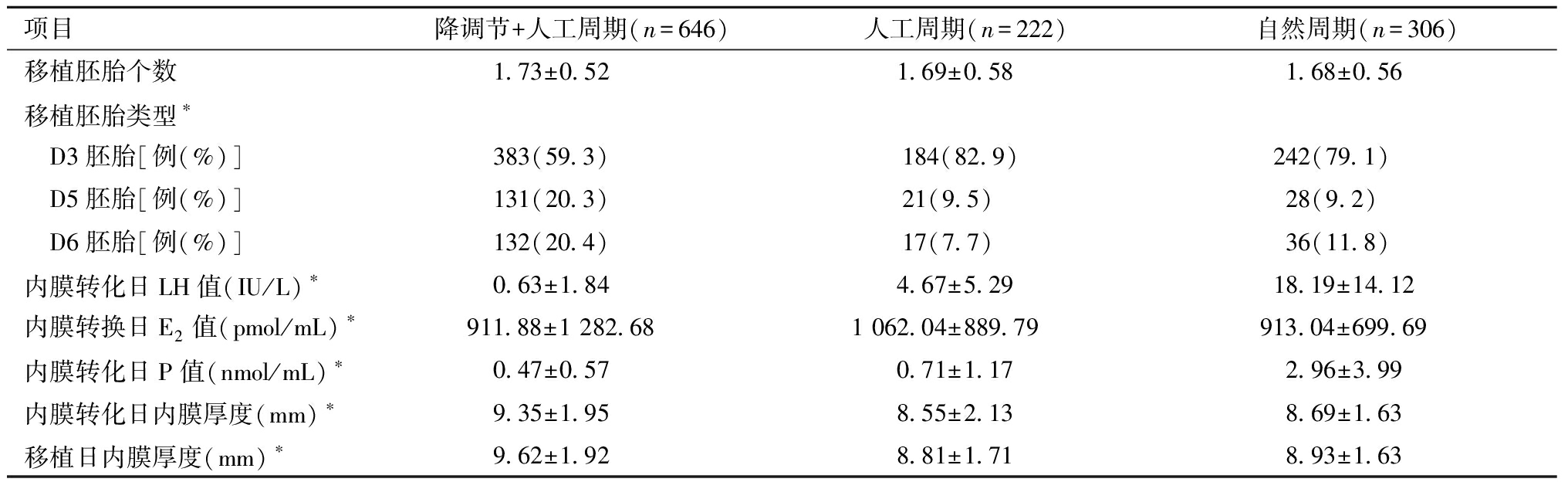
项目降调节+人工周期(n=646)人工周期(n=222)自然周期(n=306)移植胚胎个数 1.73±0.52 1.69±0.58 1.68±0.56移植胚胎类型∗ D3胚胎[例(%)] 383(59.3) 184(82.9)242(79.1) D5胚胎[例(%)] 131(20.3) 21(9.5) 28(9.2) D6胚胎[例(%)] 132(20.4) 17(7.7) 36(11.8)内膜转化日LH值(IU/L)∗ 0.63±1.84 4.67±5.2918.19±14.12内膜转换日E2值(pmol/mL)∗911.88±1 282.681 062.04±889.79913.04±699.69内膜转化日P值(nmol/mL)∗ 0.47±0.57 0.71±1.17 2.96±3.99内膜转化日内膜厚度(mm)∗ 9.35±1.95 8.55±2.13 8.69±1.63移植日内膜厚度(mm)∗ 9.62±1.92 8.81±1.71 8.93±1.63
注:三组比较,*P<0.05
3.临床结局相关指标的比较:三组在生化妊娠率,种植率,分娩孕周,出生体重差异有统计学意义,在临床妊娠率,异位妊娠率,多胎妊娠率,流产率,早产率,活产率差异无统计学意义。见表3。
表3 三组临床结局相关指标的比较[例(%)]

项目降调节+人工周期(n=646)人工周期(n=222)自然周期(n=306)临床妊娠率(%)258(39.9)70(31.5)115(37.6)异位妊娠率(%)23(8.9)10(14.3)20(17.4)多胎妊娠率(%)21(8.1)4(5.7)4(3.5)生化妊娠率(%)∗309(47.8)81(36.1)138(45.1)种植率(%)∗318(28.4)79(21.0)127(24.7)流产率(%)67(26.0)10(14.3)29(25.2)早产率(%)38(14.7)8(11.4)10(8.7)活产率(%)186(16.6)62(16.5)86(16.7)分娩孕周(x±s)∗36.90±3.18 37.59±1.73 37.80±1.36出生体重(x±s)(g)∗3 176.3±603.303 281.0±661.533 371.5±471.71
注:三组比较,*P<0.05
4.临床妊娠的影响因素分析:降调节+人工周期、人工周期和自然周期方案对临床妊娠率的影响差异无统计学意义。与移植D3胚胎组相比,移植D5胚胎组的影响差异有统计学意义,选择D5胚胎相对于D3可以明显提高临床妊娠率(OR=4.06,95% CI=2.86~5.73)。见表4。
表4 影响临床妊娠的Logistic分析

项目BP值OR95%CI子宫内膜准备方案 降调节+人工周期—0.041— 人工周期-0.1270.580.880.56~1.37 自然周期0.3250.171.380.86~2.21内膜转化日LH(IU/L)0.0010.921.000.98~1.01内膜转化日E2(pmol/mL)0.0000.10——内膜转化日P(nmol/mL)0.0280.411.030.96~1.10移植胚胎类型 D3胚胎—<0.0011— D5胚胎1.4<0.0014.062.86~5.73 D6胚胎-0.0750.740.930.59~1.44内膜转化日内膜厚度(mm)-0.0080.820.990.92~1.06移植日内膜厚度(mm)-0.0240.510.980.91~1.04
讨论
在辅助生殖技术中,女性年龄逐渐成为妊娠结局的主要预测因子。随着年龄的增长,女性的生育率下降,特别是35岁以上的女性,因为卵巢功能和卵细胞质量的降低会影响胚胎质量,导致子宫内膜容受性的下降从而影响胚胎着床。而FET的成功依赖于胚胎发育和受孕子宫之间的相互作用[5],而子宫内膜容受性取决于此时的 FET方案,所以本次讨论的FET方案有:降调节+人工周期,人工周期,自然周期。
众所周知,胚胎移植可以消除子宫内膜组织的不规则增生,促进上皮细胞、间质细胞的增殖和分化,并丰富子宫内膜的血流,这为子宫内膜厚度是临床妊娠结果的积极预测因子提供了线索[6],超过20 000个 FET周期的研究表明,子宫内膜厚度为5 mm及以下时,活产率为15.6%;子宫内膜厚度为10 mm时,活产率逐渐增加至33.1%。另一方面,当子宫内膜厚度为5 mm或以下时,流产率为41.7%,当子宫内膜厚度为10 mm时,流产率逐渐降低至26.5%。最佳子宫内膜厚度阈值的统计模型发现,10 mm或以上可最大限度地提高活产率,减少妊娠损失[7]。这与本研究的内容一致,本研究的降调节+人工周期组内膜转化日的内膜厚度平均为9.4 mm,相对于其他两组临床妊娠率及种植率均提高。因此可以在人工周期方案中加入促性腺激素释放激素激动剂,以下调垂体抑制雌激素使用前LH的激增从而阻止卵泡发育,有助于灵活地进行胚胎移植提高了种植率,但是研究表明在有规律月经周期的年轻妇女显示降调节+人工周期中对妊娠有不利影响[8],降调节+人工周期的流产率比自然周期高,而自然周期比降调节+人工周期有稍高的活产率。降调节+人工周期的黄体缺失可能是导致流产率高的一个因素,自然周期由于更接近生理状况而对临床妊娠结局的更具有优势,或者是通过改善母体循环功能而介导[9]。此外暴露于外源性激素的激素替代治疗的周期可能会导致更高的血栓栓塞事件发生风险,并损害胎盘,进而可能导致流产[10]。人工周期中的雌二醇水平高于自然周期,非生理性的高雌二醇水平被认为会导致子宫内膜损伤和植入窗口期的变异,可能导致蜕膜层细胞外基质结构和/或功能的改变,和血管生成相关标记分子的严重缺乏[11],并与怀孕后蜕膜层发育不良有关[12],提示活产率低可能与较薄的子宫内膜有关[13]。本研究中人工周期组E2值均高于其他两组,临床妊娠率,活产率及内膜转化日子宫内膜厚度均低于其他两组,与以上结论一致。
解冻后优质的卵裂期胚胎培养2 h后移植可提高着床率[14],而囊胚移植可以筛选出更具发育潜力的胚胎,具有更高的活产率和妊娠率,降低了新生儿的不良结局[15]。随着女性年龄的增加高质量囊胚发育的越来越少[16],同时超生理E2水平可能会为胚胎植入和胎盘植入创造次优的移植环境,从而导致胎儿异常生长[17],若高龄女性没有优质胚胎,则可以选择延长培养质量较差的卵裂期胚胎,也可获得良好的临床妊娠率,但流产率相对较高[18]。而卵巢反应正常的患者中,在卵裂期进行胚胎移植时比在囊胚移植累积活产率更高,可能是第5天的ET意味着激素水平对着床影响的时间更长[19],植入窗提前和D6胚胎生长较慢这两个因素导致胚胎-子宫内膜同步性较差,提示D6囊胚移植可能与较高的早期流产率有关[20],但第5天整倍体囊胚与第6天整倍体囊胚相比,其着床潜力和早期自然流产率无显著性差异[21]。卵裂期胚胎冷冻移植是异位妊娠的独立危险因素[22],而单囊胚冷冻移植是降低异位妊娠率的较好选择。囊胚培养更接近生理状态子宫内膜和胚胎的发育趋于同步,缩短了胚胎移植到宫腔后进一步发育到着床的时间间隔。同时,由于体内孕酮水平升高,抑制子宫肌层收缩可以减少胚胎迁移的机会,更有利于着床。此外囊胚相对于卵裂期胚胎体积更大,这使得它更难转移到输卵管[23]。在本研究移植不同的胚胎类型是影响临床妊娠的相关因素,且移植D5胚胎相比移植D3胚胎获得临床妊娠的可能性更大。
Greco等人的结果与本研究结果一致,他们发现人工周期和降调节+人工周期的临床结果相似,表示子宫内膜制备方案与临床结果无关[24]。但是子宫内膜制备方案的选择还应根据妇女的月经和排卵特点,或根据患者对周期计划的需要,这需要进一步临床研究来证明。现在,高龄育龄女性在辅助生殖技术上仍面临着巨大的挑战,而且尽管FET被广泛使用,但关于活出生率和妊娠结局的最佳方案也尚未有明确定义[25],在今后需要设计更多的前瞻性多中心随机对照试验的进一步验证高龄育龄女性在冷冻胚胎移植中的存在的问题。
1 McLernon DJ,Steyerberg EW,Te Velde ER,et al.Predicting the chances of a live birth after one or more complete cycles of in vitro fertilisation:population based study of linked cycle data from 113 873 women.BMJ,2016,355:i5735.
2 Kato K,Ezoe K,Yabuuchi A,et al.Comparison of pregnancy outcomes following fresh and electively frozen single blastocyst transfer in natural cycle and clomiphene-stimulated IVF cycles.Hum Reprod Open,2018,2018:1-8.
3 Zhang J,Liu HF,Wang Y,et al.Letrozole use during frozen embryo transfer cycles in women with polycystic ovary syndrome.Fertil Steril,2019,112:371-377.
4 Hosseini-Najarkolaei A,Moini A,Kashani L,et al.The effect of letrozole versus artificial hormonal endometrial preparation on pregnancy outcome after frozen-thawed embryos transfer cycles:a randomized clinical trial.Reprod Biol Endocrinol,2020,18:115.
5 Zheng Y,Li Z,Xiong M,et al.Hormonal replacement treatment improves clinical pregnancy in frozen-thawed embryos transfer cycles:a retrospective cohort study.Am J Transl Res,2013,6:85-90.
6 Bu ZQ,Wang K,Dai W,et al.Endometrial thickness significantly affects clinical pregnancy and live birth rates in frozen-thawed embryo transfer cycles.Gynecol Endocrinol,2016,32:524-8.
7 Gallos ID,Khairy M,Chu J,et al.Optimal endometrial thickness to maximize live births and minimize pregnancy losses:Analysis of 25,767 fresh embryo transfers.Reprod Biomed Online,2018,37:542-548.
8 Liu XT,Shi WH,Shi JZ.Natural cycle frozen-thawed embryo transfer in young women with regular menstrual cycles increases the live-birth rates compared with hormone replacement treatment:a retrospective cohort study.Fertil Steril,2020,113:811-817.
9 von Versen-Höynck F,Schaub AM,Chi YY,et al.Increased preeclampsia risk and reduced aortic compliance with in vitro fertilization cycles in the absence of a corpus luteum.Hypertension,2019,73:640-649.
10 Patel S,Kilburn B,Imudia A,et al.Estradiol elicits proapoptotic and antiproliferative effects in human trophoblast cells.Biol Reprod,2015,93:74.
11 He L,Zhang Z,Li HM,et al.Correlation between endometrial thickness and perinatal outcome for pregnancies achieved through assisted reproduction technology.Perinat Med,2019,48:16-20.
12 Nakamura YK,Yaguchi C,Itoh H,et al.Morphologic characteristics of the placental basal plate in in vitro fertilization pregnancies:a possible association with the amount of bleeding in delivery.Hum Pathol,2015,46:1171-1179.
13 Wang B,Zhu QQ,Wang Y.Pregnancy outcomes after different cycle regimens for frozen-thawed embryo transfer:a retrospective study using propensity score matching.Front Med (Lausanne),2020,7:327.
14 Wang H,Ou ZH,Chen ZH,et al.Influence of different post-thaw culture time on the clinical outcomes of different quality embryos.Adv Clin Exp Med,2019,28:523-527.
15 Bourdon M,Santulli P,Sebbag L,et al.Risk of small for gestational age is reduced after frozen compared with fresh embryo transfer in endometriosis.Reprod Biomed Online,2021,42:133-141.
16 Zhang J,Huang JA,Liu HF,et al.The impact of embryo quality on singleton birthweight in vitrified-thawed single blastocyst transfer cycles.Hum Reprod,2020,35:308-316.
17 Sallem A,Santulli P,Barraud-Lange V,et al.Extended culture of poor-quality supernumerary embryos improves ART outcomes.Assist Reprod Genet,2018,35:311-319.
18 Zhou QW,Jing S,Xu L,et al.Clinical and neonatal outcomes of patients of different ages following transfer of thawed cleavage embryos and blastocysts cultured from thawed cleavage-stage embryos.PLoS One,2018,13:1-15.
19 Borgstrøm MB,Grøndahl ML,Klausen TW,et al.Association between women′s age and stage,morphology,and implantation of the competent blastocyst:a multicenter cohort study.Fertil Steril,2021,115:646-654.
20 Xu HL,Qiu SM,Chen XJ,et al.D6 blastocyst transfer on day 6 in frozen-thawed cycles should be avoided:a retrospective cohort study.BMC Pregnancy Childb,2020,20:519.
21 Lou H,Li N,Guan YC,et al.Association between morphologic grading and implantation rate of Euploid blastocyst.Ovarian Res,2021,14:18.
22 Tan Y,Bu ZQ,Shi H,et al.Risk factors of recurrent ectopic pregnancy in patients treated with fertilization cycles:a matched case-control study.Front Endocrinol (Lausanne),2020,11:552117.
23 Zeng MF,Li LM.Frozen blastocyst transfer reduces incidence of ectopic pregnancy compared with fresh blastocyst transfer:a meta-analysis.Gynecol Endocrinol,2019,35:93-99.
24 Greco E,Litwicka K,Arrivi C,et al.The endometrial preparation for frozen-thawed euploid blastocyst transfer:a prospective randomized trial comparing clinical results from natural modified cycle and exogenous hormone stimulation with GnRH agonist.J Assist Reprod Genet,2016,33:873-84.
25 Ghobara T,Gelbaya TA,Ayeleke RO.Cycle regimens for frozen-thawed embryo transfer.Cochrane Database Syst Rev,2017,7:102.