初级纤毛(primary cilium,PC)是一种以微管为结构基础的细胞器,几乎存在于所有哺乳动物的细胞中。作为个体发育过程中的重要信号中枢,初级纤毛在多条信号通路的信息传递中发挥着重要作用,其结构及功能异常会导致多种发育缺陷。近年来,人们越来越关注初级纤毛与胚胎神经发育之间的关系。本文就初级纤毛通过信号通路调控胚胎神经发育的研究进展予以综述并展开讨论。
一、神经管畸形(neural tube defects,NTDs)
神经管发育是指胚胎腹背轴中线特定外胚层细胞卷曲、融合形成神经管的过程,分为初级神经管形成和次级神经管形成两个阶段。首先,在脊索诱导下与其毗邻的外胚层转变为神经板,然后两侧边缘向上隆起增厚,形成神经嵴,中央凹陷形成神经沟,神经嵴逐渐向背部中线收缩融合形成中空的管道,此过程称为会聚延伸运动(convergent extention,CE)。神经管发育过程依赖多种信号通路,包括音猬因子(sonic hedgehog,Shh)信号通路、Wnt/β-catenin信号通路、平面细胞极性(planar cell polarity,PCP)信号通路、肌醇代谢信号通路等。这些信号通路的异常会引起神经管的闭合不全,进而导致NTDs的发生。NTDs是由于胚胎发育第3~4周时神经管闭合过程发生障碍而引发的先天畸形,主要包括无脑畸形、脑膨出、脊柱裂等表型,全球发病率约为1.86‰,给患者家庭和社会带来严重负担[1]。目前普遍认为NTDs的发生是遗传与包括营养因素在内的环境因素交互作用的结果,其发病机制目前尚未明确,研究发现初级纤毛在NTDs发生过程中发挥着很重要的作用。
二、初级纤毛的结构和功能研究
纤毛是一种突出于细胞表面的特殊细胞器,其形态类似“天线”,具有运动、感知外界刺激、物质运输以及调控细胞生长等多种生物学功能。脊椎动物细胞表面存在运动纤毛和初级纤毛两种纤毛。初级纤毛基本结构包括初级纤毛膜、基体部、纤毛过渡区和轴丝。基体部由一种特殊类型的中心粒构成,位于纤毛底部。轴丝是初级纤毛的主体部分,由9组微管双联体结构构成,其外由纤毛膜包绕,即“9+0”结构。纤毛内存在物质运输(intraflagellar transport,IFT)系统,由驱动蛋白2(Kinesin-2)、动力蛋白2(Dynein-2)以及两种蛋白复合体IFT-A和IFT-B构成,这些纤毛内运输蛋白沿着轴丝微管进行双向物质运输驱动蛋白2和IFT-B形成的复合体实现将构建纤毛所需的微管蛋白、放射性轮辐蛋白以及膜蛋白等由纤毛基部运送到纤毛顶部的顺向运输,胞质动力蛋白2与IFT-A形成的复合体则是实现由纤毛顶部向基部的逆向运输(图1)[2-3]。初级纤毛的形成是一个高度有序的过程,当细胞进入G0/G1期时,基体调控初级纤毛的形成,而当细胞重新进入细胞周期时,初级纤毛会发生解聚。最近的研究表明纤毛形成和解聚在疾病发生发展中有重要作用,Zhang等[4]用脑器官样细胞和小鼠模拟小头畸形揭示了WDR62-CEP170-KIF2A促进初级纤毛解聚的途径,该解聚途径的异常会引起小头畸形。
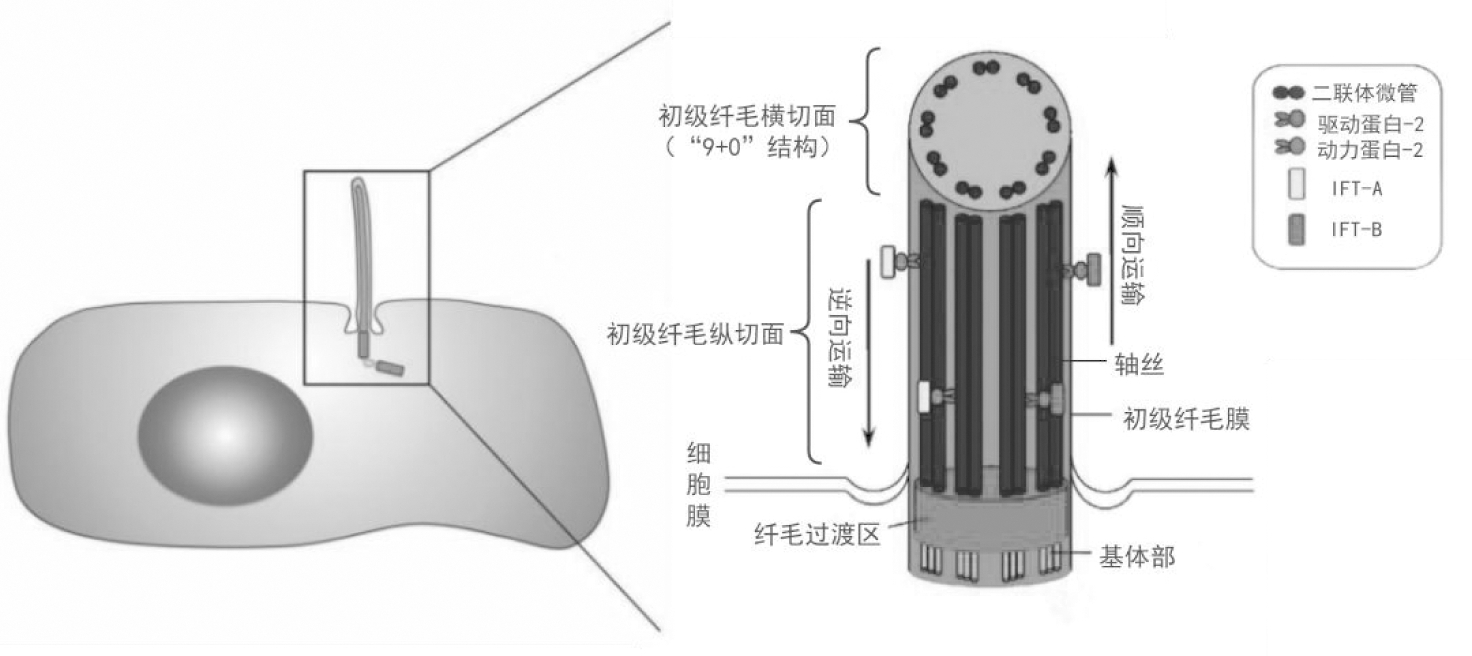
图1 初级纤毛及其结构示意图[2-3]
初级纤毛是个体发育过程中重要的信号转导中心,可以检测并传递细胞外的信号,参与Shh,PCP,Notch,Wnt/β-catenin和受体酪氨酸激酶(receptor tyrosine kinase,RTK)等多种通路的信息传递。由于初级纤毛协调这些信号转导进而影响机体的生长发育及各种器官的正常生理功能,其结构及功能异常会导致多种发育和细胞信号缺陷,从而产生纤毛病(ciliopathy):包括麦克尔综合征(Meckel syndrome,MKS)、茹贝尔综合征 (Joubert syndrome,JBTS)、巴德一毕氏综合征 (Bardet—Biedl syndrome,BBS)、青少年型消耗性肾病(nephronophthisis,NPHP)及1型口-面-指综合征等[5]。
一些初级纤毛相关疾病常常伴发NTDs表征,如MKS、JBTS和BBS的临床表现中有神经系统发育缺陷;脑膨出是MKS和JBTS的共同特征。MKS是一种围产期致死性疾病,其典型临床特征是枕叶脑膨出、多指畸形和多囊肾,还可以合并脑积水、脊柱裂等[2];JBTS是一种隐性神经发育障碍,其特征是先天性小脑和脑干缺陷,典型影像学特征为头颅“臼齿征”[5];BBS患者有头颅或骨骼畸形的表型特征[6]。
三、初级纤毛影响神经管发育的机制
初级纤毛作为多个细胞信号转导通路的重要结构,参与信号通路依赖的中枢神经系统发育过程。研究表明,初级纤毛通过Shh、Wnt/β-catenin、PCP及肌醇代谢信号通路从而影响神经管发育最终导致NTDs发生。
1.Shh信号通路:Shh信号转导高度依赖初级纤毛的结构和功能的完整性,Shh受体蛋白Ptch1(Patched1)、Smo(smoothened)和Gli(glioma-associated oncogene)转录因子均定位于初级纤毛[7]。已有研究表明,内吞调节因子EHD1(Eps15 Homology Domain 1)通过调节Shh通路信号蛋白Smo进入纤毛,调节Shh通路的活性[8]。
已有研究表明,在缺乏Tmem67(transmembrane protein 67)基因的小鼠中,出现神经孔闭合缺损、脑膨出、前脑发育不全等神经系统发育缺陷,神经上皮细胞层纤毛几乎完全丧失,胚胎神经底板和脊索上的Shh蛋白表达降低,Shh在神经管腹侧标记数量减少,提示Shh信号降低[9]。推测可能是由于初级纤毛缺失,不能对Shh信号做出正确反应,从而导致无脑畸形等神经系统发育异常。Shh信号通路中Sufu蛋白定位于初级纤毛内,Sufu突变可导致Shh信号的异常激活,从而导致NTDs的发生[10]。GTP酶 Arl13b定位于初级纤毛上,调节纤毛内外的Shh信号通路,Mariani等[11]报道了小鼠Arl13b突变体以不同的方式影响Arl13b蛋白的纤毛定位、Shh的转录和Shh信号通路中Smo的富集,从而导致JBTS的发生,表现为神经系统发育障碍。以上研究表明,纤毛结构和功能的异常将影响Shh信号通路的信号转导,进而导致神经系统发育缺陷。
2. 经典型Wnt/β联蛋白 (β-catenin)通路:Wnt/β-catenin信号通路被认为与神经发生和神经可塑性相关,是哺乳动物神经系统发育的关键信号通路之一,该通路信号转导异常会导致各种神经功能障碍。Kimura-Yoshida等[12]发现在神经管闭合过程中,β-catenin和Grhl3基因突变,影响神经外胚层发育,出现NTDs表型。初级纤毛异常能够抑制经典Wnt/β-catenin通路,降低β联蛋白的表达。糖原合成激酶-3β(glycogen synthase kinase 3β,GSK-3β)是初级纤毛的组成蛋白之一,阻止β-catenin入核,已有研究表明,全氟辛烷磺酸(perfluorooctane sulfonate,PFOS)通过降低GSK3β的Ser9磷酸化,导致GSK-3β的激活和β-catenin的下调,从而影响神经干细胞的增殖[13]。最近研究显示,纤毛基底部驱动蛋白2家族蛋白A(kinesin -like protein 3A,KIF3A)缺失后,Wnt信号通路异常激活,小鼠神经干细胞无法分化为神经元[14]。Tian等[15]发现在与纤毛构成相关基因Ift88突变小鼠中,出现多种颅面畸形,小鼠细胞纤毛变短,且轴抑制因子2(Axin2)表达显著上调,提示Wnt通路信号增加。Wheway等[16]的研究结果显示,在负责编码纤毛蛋白的MKS1基因缺陷的小鼠中,细胞中核β-catenin的水平增加以及Wnt /β-catenin途径的下游效应蛋白细胞周期蛋白D1(cyclinD-1)的水平升高,提示Wnt信号增加,小鼠表现为后窝缺损和脑积水等MKS的典型特征。初级纤毛与Wnt/β-catenin的关系为探明NTDs的发病机制提供了新的思路和方向,但其具体机制还有待进一步研究。
3. PCP信号通路:PCP信号通路可以调控CE促进细胞形成神经板,异常的CE会导致神经管闭合缺陷。Chen等[17]对184例中国NTDs病人的基因分析,他们发现PCP信号通路中3个CELSR基因(CELSR1,CELSR2和CELSR3)在其中发挥重要作用,这3个基因的突变会导致NTDs患病的风险大大增加。Humphries等[18]在果蝇中进行了NTDs相关的Vangl1/2基因突变对PCP信号通路作用的分析,加强了PCP通路和NTDs之间的联系。WDR34基因编码初级纤毛内动力蛋白2的中链,在WDR34基因敲除的小鼠中,出现了脑膨出、脊柱裂等多种颅面部畸形,小鼠神经上皮细胞初级纤毛生长受限,Shh信号通路被抑制[19]。近期在无脑畸形患者中发现,WDR34基因突变可能通过同时影响Shh和PCP信号通路而导致NTDs的发生[20]。散乱蛋白2(dishevelled 2,DVL2)是PCP信号通路中的关键蛋白因子,且受磷酸化调控,DVL2在初级纤毛的发生过程中起非常重要的作用,在纤毛的基体可以检测到磷酸化的DVL2[21]。Tian等[22]通过对NTDs样本检测发现PCP相关基因拷贝数变异,尤其是VANGL1缺失和DVL2增加,可能增加NTDs的发生风险。Vilboux等[23]的研究结果发现JBTS患者中发生CELSR2双等位基因突变,患者表现为先天性小脑和脑干缺陷,大脑室管膜细胞纤毛发育和功能异常。Arl13b是一个小GTP酶,定位于初级纤毛上,在Arl13b蛋白缺失的情况下,纤毛短小且结构受损。人类ARL13B基因的突变会导致JBTS,表现小脑和脑干缺陷[24]。Song等[25]发现,Arl13b与Vangl2相互作用以调节纤毛的长度,表明初级纤毛通过影响PCP信号通路在胚胎神经发育发挥重要作用,但其具体的影响机制还需要进一步探究。
4. 肌醇代谢信号通路:肌醇(inositol)属于维生素B族物质,是细胞生长与存活及胚胎发育的必需营养素,肌醇及其代谢通路在胚胎发育尤其是神经管发育过程中发挥着重要作用。近期研究发现,磷脂酰肌醇3,4,5三磷酸[PI(3,4,5)P3,PIP3]激活的PI3K/AKT信号通路影响神经元的分化过程[26]。肌醇多聚磷酸5-磷酸酶(inositol polyphosphate-5-phosphatase,INPP5E)是肌醇代谢通路中PIP2合成代谢的关键调控酶,INPP5E蛋白质主要分布于初级纤毛上,可影响初级纤毛的稳定性,Luo等[27]发现斑马鱼INPP5E基因缺失时,初级纤毛变短且数量少。近期研究发现,INPP5E基因突变可致BBS和JBTS综合征,有头颅畸形表现[28]。由此推测肌醇循环信号通路与初级纤毛密切相关,共同作用于神经管发育缺陷。目前研究已经发现1,3,4,5四磷酸肌醇(IP4)在爪蟾胚胎上皮修复过程中调节Rho GTP酶活性,而哺乳动物脊髓神经管闭合需要依赖Rho GTP酶调节的肌动蛋白转换和肌动球蛋白[29],由此推测肌醇代谢通路和神经管闭合过程有密切联系。构造家族(fectonic family member,Tctn)蛋白质是存在于纤毛过渡带的一组蛋白质,对纤毛发育和纤毛形成有重要作用,Tctn3基因敲除小鼠通过改变Shh和PI3K/Akt信号通路导致小鼠细胞凋亡增加、致产前死亡和NTDs[30]。因此,肌醇循环通路在调节神经管发育中起重要作用,对神经系统发育缺陷相关疾病的早期诊断及防控具有重要的意义。
四、 展望
NTDs作为一种严重的出生缺陷,其确切发病的分子机制尚需进一步研究。初级纤毛作为一种古老而重要的细胞器,与NTDs之间的关联逐步得到人们的广泛关注,其通过调控Shh、Wnt/β-catenin、PCP及肌醇代谢信号通路等在神经管发育过程中发挥中重要的作用。随着人们对于初级纤毛的结构、功能、信号转导途径与NTDs发生发展的分子机制的探索,将从初级纤毛形成与解聚角度为NTDs的早期诊治和防控提供新的思路。
1 Martinez H,Weakland AP,Bailey LB,et al.Improving maternal folate status to prevent infant neural tube defects:working group conclusions and a framework for action.Ann N Y Acad Sci,2018,1414:5-19.
2 Mahjoub M.The importance of a single primary cilium.Organogenesis,2013,9:61-9.
3 杨扬,杨京润,黄敏,等.初级纤毛与恶性肿瘤关系的研究进展.实用皮肤病学杂志,2020,13:106-110.
4 Zhang W,Yang SL,Yang M,et al.Modeling microcephaly with cerebral organoids reveals a WDR62-CEP170-KIF2A pathway promoting cilium disassembly in neural progenitors.Nat Commun,2019,10:2612.
5 Parisi MA.The molecular genetics of Joubert syndrome and related ciliopathies:The challenges of genetic and phenotypic heterogeneity.Transl Sci Rare Dis,2019,4:25-49.
6 Haq N,Schmidt-Hieber C,Sialana FJ,et al.Loss of Bardet-Biedl syndrome proteins causes synaptic aberrations in principal neurons.PLoS Biol,2019,17:e3000414.
7 Eguether T,Cordelieres FP,Pazour GJ.Intraflagellar transport is deeply integrated in hedgehog signaling.Mol Biol cell,2018,29:1178-1189.
8 Bhattacharyya S,Rainey MA,Arya P,et al.Endocytic recycling protein EHD1 regulates primary cilia morphogenesis and SHH signaling during neural tube development.Sci Rep,2016,6:20727.
9 Abdelhamed ZA,Wheway G,Szymanska K,et al.Variable expressivity of ciliopathy neurological phenotypes that encompass Meckel-Gruber syndrome and Joubert syndrome is caused by complex de-regulated ciliogenesis,Shh and Wnt signalling defects.Hum Mol Genet,2013,22:1358-1372.
10 Lu XL,Wang Z,Wang JH,et al.An association study between SUFU gene polymorphisms and neural tube defects.Int J Neurosci,2014,124:436-442.
11 Mariani LE,Bijlsma MF,Ivanova AA,et al.Arl13b regulates Shh signaling from both inside and outside the cilium.Mol Biol Cell,2016,27:3780-3790.
12 Kimura-Yoshida C,Mochida K,Ellwanger K,et al.Fate Specification of Neural Plate Border by Canonical Wnt Signaling and Grhl3 is Crucial for Neural Tube Closure.E Bio Medicine,2015,2:513-527.
13 Dong X,Yang JB,Nie XK,et al.Perfluorooctane sulfonate (PFOS) impairs the proliferation of C17.2 neural stem cells via the downregulation of GSK-3β/β-catenin signaling.J Appl Toxicol,2016,36:1591-1598.
14 Chen JL,Chang CH,Tsai JW.Gli2 Rescues Delays in Brain Development Induced by Kif3a Dysfunction.Cereb Cortex,2019,29:751-764.
15 Tian H,Feng J,Li J,et al.Intraflagellar transport 88 (IFT88) is crucial for craniofacial development in mice and is a candidate gene for human cleft lip and palate.Hum Mol Genet,2017,26:860-872.
16 Wheway G,Abdelhamed Z,Natarajan S,et al.Aberrant Wnt signalling and cellular over-proliferation in a novel mouse model of Meckel-Gruber syndrome.Dev Biol,2013,377:55-66.
17 Chen ZZ,Lei YP,Cao XY,et al.Genetic analysis ofWnt/PCP genes in neural tube defects.BMC Medical Genomics,2018,11:38.
18 Humphries AC,Narang S,Mlodzik M.Mutations associated with human neural tube defects display disrupted planar cell polarity in Drosophila.Elife,2020,1;9:e53532.
19 Wu CQ,Li J,Peterson A,et al.Loss of dynein-2 intermediate chain Wdr34 results in defects in retrograde ciliary protein trafficking and Hedgehog signaling in the mouse.HumMol Genet,2017,1;26:2386-2397.
20 Yin HL,Peng R,Chen ZZ,et al.WDR34 mutation from anencephaly patients impaired both SHH and PCP signaling pathways.J Hum Genet,2020,65:985-993.
21 Xie JL,Han M,Zhang MJ,et al.PP5 (PPP5C) is a phosphatase of Dvl2. Sci Rep,2018,8:2715.
22 Tian T,Lei YP,Chen YY,et al.Rare copy number variations of planar cell polarity genes are associated with human neural tube defects.Neurogenetics,2020,21:217-225.
23 Vilboux T,Malicdan MCV,Roney JC,et al.CELSR2,encoding a planar cell polarity protein,is a putative gene in Joubert syndrome with cortical heterotopia,microophthalmia,and growth hormone deficiency.Am J Med Genet A,2017,173:661-666.
24 Sheng X,Sheng Y,Liu YH,et al.Effects of FSS on the expression and localization of the core proteins in twoWnt signaling pathways,and their association with ciliogenesis.Int J Mol Med,2018,42:1809-1818.
25 Song P,Dudinsky L,Fogerty J,et al.Arl13b Interacts With Vangl2 to Regulate Cilia and Photoreceptor Outer Segment Length in Zebrafish.Invest Ophthalmol Vis Sci,2016,57:4517-4526.
26 Zucco AJ,Pozzo VD,Afinogenova A,et al.Neural progenitors derived from Tuberous Sclerosis Complex patients exhibit attenuated PI3K/AKT signaling and delayed neuronal differentiation.Mol Cellular Neurosci,2018,92:149-163.
27 Luo N,Lu JP,Sun Y.Evidence of a role of inositol polyphosphate 5-phosphatase INPP5E in cilia formation in zebrafish.Vision Res,2012,75:98-107.
28 Khan S,Lin S,Harlalka GV,et al.BBS5 and INPP5E mutations associated with ciliopathy disorders in families from Pakistan.Ann Hum Genet,2019,83:477-482.
29 Soto X,Li J,Lea R,et al.Inositol kinase and its product accelerate wound healing by modulating calcium levels,RhoGTPases,and F-actin assembly.Proc Natl Acad Sci U S A,2013,110:11029-11034.
30 Wang B,Zhang YY,Dong HL,et al.Loss of Tctn3 causes neuronal apoptosis and neural tube defects in mice.Cell Death Dis,2018,9:520.