自1983年,世界首例冻融胚胎成功妊娠以来,冻融胚胎移植技术(frozen embryo transfer, FET)已成为辅助生殖的重要组成部分。胚胎的成功种植不仅取决于优质胚胎,同时也需要具有“容受性”的子宫内膜。子宫内膜对胚胎着床起到密切作用,薄型子宫内膜的胚胎种植率明显低于非薄型子宫内膜[1]。子宫内膜厚度对胚胎种植至关重要,厚度<7~8 mm不利于胚胎着床。本研究回顾性分析了在江苏省南京市妇幼保健院生殖医学中心采用人工周期(hormone replacement cycle,HRT组)、降调节+人工周期 (hyporegulation + hormone replacement cycle, DRC组)及自然周期(natural cycle, NC组)方案准备内膜,行冷冻胚胎移植的临床资料,探讨子宫内膜小于8 mm的薄型子宫内膜患者三种不同的内膜准备方案的临床结局有无差异。
材料与方法
一、 研究对象
回顾性分析南京医科大学附属南京市妇产医院生殖医学中心2018年08月至2019年07月子宫内膜厚度小于8 mm,行HRT、降调节+HRT(DRC组)及NC冻融胚胎移植的患者的临床资料。患者年龄23~45岁,平均年龄(32.8±5.2)岁;不孕年限1~17年,平均不孕年限(3.4±2.6)年。
纳入标准:目前,对于薄型内膜的定义无统一标准,通常认为内膜在7~8 mm以下不适宜胚胎移植,妊娠率降低[2]。结合本中心B超测量内膜的标准,本文将FET周期内膜转化日内膜厚度<8 mm定义为薄型子宫内膜。
排除标准:重度子宫内膜异位症、子宫腺肌症、中-重度宫腔粘连和子宫畸形均不纳入研究范围。
本研究经过本院医学伦理委员会同意认可,所有患者均签署知情同意书。
二、方法
1.用药方案:
(1)HRT组。月经第2~3天始予口服戊酸雌二醇(补佳乐,德国拜耳医药保健有限公司)6~8 mg/d或17β雌二醇片(芬吗通红片,美国雅培制药有限公司)4~6 mg/d,期间根据内膜发育情况调整用药,雌激素使用时间不少于12 d,不超过28 d。当E2≥200 mg/mL同时结合 B 超监测内膜厚度、形态、P值决定是否用孕激素转化内膜。自转化日起肌注射黄体酮,第4天行卵裂期胚胎移植或第6天行囊胚移植。
(2)降调节+HRT组(DRC组)。月经第2~3天注射长效曲普瑞林(达菲林,法国益普生生物制药公司)1.875 mg,14 d后开始检测血性激素直至达到降调节标准,血清FSH<5 U/L,血清 LH<5 U/L,血清E2<50 pg/mL,B超提示双侧卵巢卵泡最大直径<10 mm,内膜厚度<5 mm,开始口服戊酸雌二醇/17β雌二醇片,后续治疗同HRT方案。
(3)NC组。有自然排卵的患者,在月经第9天第一次B超监测,此后按卵泡发育速度监测卵泡发育,排卵后第3天移植第3天(D3)卵裂期胚胎,排卵后第5天移植第 5天(D5)囊胚。
2. 胚胎评分:第3天胚胎按照Peter卵裂期胚胎评分系统[3]进行卵裂期胚胎评分。第5~6天胚胎根据Garnder等囊胚分级法[4]对形成的囊胚进行分级和评分,并将第5~6天≥3BB的囊胚定为优质囊胚。
3. 胚胎移植及黄体支持:所有胚胎均采用玻璃化冷冻,复苏后16 h观察,选择复苏后50%以上卵裂球存活的卵裂期胚胎或评分在3BC以上的囊胚移植,移植后予黄体酮(注射用黄体酮,广州白云山医药有限公司)40 mg肌注射或雪诺同90 mg(黄体酮阴道缓释凝胶,英国默克雪兰诺公司)阴道用药加强黄体支持。
4. 监测指标:冻胚移植后 14 d检测血 hCG阳性确定为生化妊娠,阳性者14 d后行B超检查,以下两种情况均诊断为临床妊娠,即(1)宫腔内有妊娠囊及胚芽、胎心搏动良好;(2)流产、异位妊娠、宫内外多部位同时妊娠,病理检查见绒毛。各种率的计算参考季慧等[5]研究报道,观察比较两组患者胚胎着床率(着床胚胎总数/移植胚胎总数 × 100%) 、临床妊娠率( 临床妊娠数/移植周期数 ×100%)、流产率( 流产数/妊娠数 × 100%) 、宫外孕率( 宫外孕数/妊娠数 ×100%) 的差异。
5. 统计学处理:计量资料符合正态分布采用均数±标准差表示,计量资料不符合正态分布采用中位数(四分位间距)表示。成组四格表计数资料符合条件采用Pearson卡方检验,不符合条件采用Pearson连续校正卡方或Fisher确切概率法;对FET妊娠结局影响有意义的变量进行二元Logistic回归分析。预测妊娠指标评价采用受试者工作特征曲线(ROC曲线) ,当P<0. 05 时,认为差异有统计学意义。
结 果
一、三组患者基本情况比较
三组患者年龄、体重指数(BMI)、不孕年限、基础FSH、基础LH、基础E2、移植胚胎数目及移植胚胎类型,差异均无统计学意义。见表1。
二、临床结局
三组患者内膜转化日日子宫内膜厚度、黄体酮转化日当天内膜分型比较,差异均无统计学意义;临床妊娠率NC组略高于HRT组及降调节+HRT组(DRC组),但差异无统计学意义。三组患者胚胎种植率分别为32.7%、35.2%及40.0%,NC组高于HRT组及DRC组,但差异无统计学意义。三组患者生化妊娠率、流产率及宫外孕率比较,差异均无统计学意义。见表2。
表1 三组患者基本情况比较
Table 1 Basic characteristics of patients of the 3 groups

GroupNAge(year)BMI(kg/m 2)Basal FSH(U/L)Basal LH(U/L)Basal E2(pg/mL)Number of transferred embryosDuration of infertility (y)HRT11433.4±5.422.5±2.87.8±3.44.2(3.0,5.9)51.2±41.31.9±0.43.6±3.0DRC10932.2±5.122.4±3.67.5±2.45.0(3.3,7.2)48.4±34.21.8±0.53.4±2.2NC 7232.9±5.221.7±2.57.8±3.04.1(2.9,5.2)62.3±62.91.8±0.63.2±2.5GroupNType of transplanted embryoCleavage stage embryon%D5 blastocystn%D6 blastocystn%HRT 1144640.35750.0119.7DRC1093834.96256.998.3NC 723650.03143.156.9
表2 三组患者妊娠结局比较
Table 2 Pregnancy outcomes of patients in the 3 groups

GroupNEndometrial thickness(mm)Endometrial pattern[n(%)]ABCHRT 1147.2±0.65(4.4)95(83.3)14(12.3)DRC1097.2±0.65(4.6)80(73.4)24(22.0)NC727.2±0.56(8.3)54(75.0)12(16.7)GroupNPregnancy outcomesClinical pregnancy raten%Biochemical pregnancy raten%Ectopic pregnancy raten%Number of clinical pregnancyPregnancy loss raten%Number of transplanted embryoEmbryo implantation raten%HRT 1145144.77162.300481020.82147032.7DRC1095550.57871.623.6551018.22027135.2NC 724156.95373.60041717.11305240.0
三、不同内膜准备方案对薄型子宫内膜妊娠结局的影响
单因素回归分析显示,对于薄型子宫内膜患者,降调节+HRT组(DRC组)出现临床妊娠的概率是HRT组的1.35倍,NC组出现临床妊娠的概率是HRT组的1.75倍,但差异无统计学意义。见表3。
表3 薄型子宫内膜患者不同内膜准备方案
临床妊娠结局单因素回归分析
Table 3 Univariate regression analysis of pregnancy
outcomes in patients with thin endometrium with
different endometrial preparation
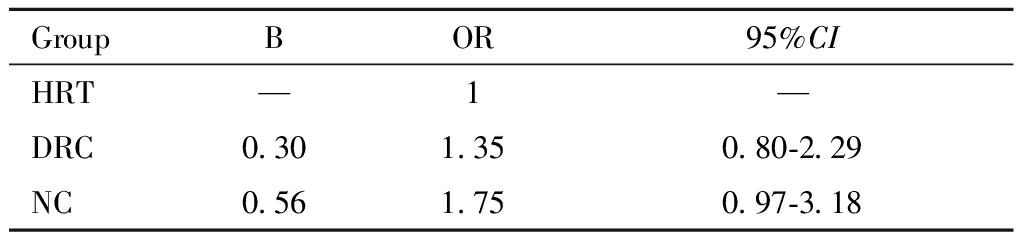
GroupBOR95%CIHRT —1—DRC0.301.350.80-2.29 NC0.561.750.97-3.18
四、 影响薄型子宫内膜妊娠结局的多因素分析
在三组患者中,以临床妊娠率为因变量,经校正年龄、不孕年限、BMI、基础LH、基础FSH、基础E2、移植胚胎数,不同内膜准备方案和临床妊娠率存在相关性(P<0.05),NC组患者临床妊娠率显著高于HRT组(P<0.05)。见表4。
表4 薄型子宫内膜患者不用内膜准备方案
临床妊娠结局多因素回归分析
Table 4 Multivariate regression analysis of pregnancy
outcomes in patients with thin endometrium
with different endometrial preparation
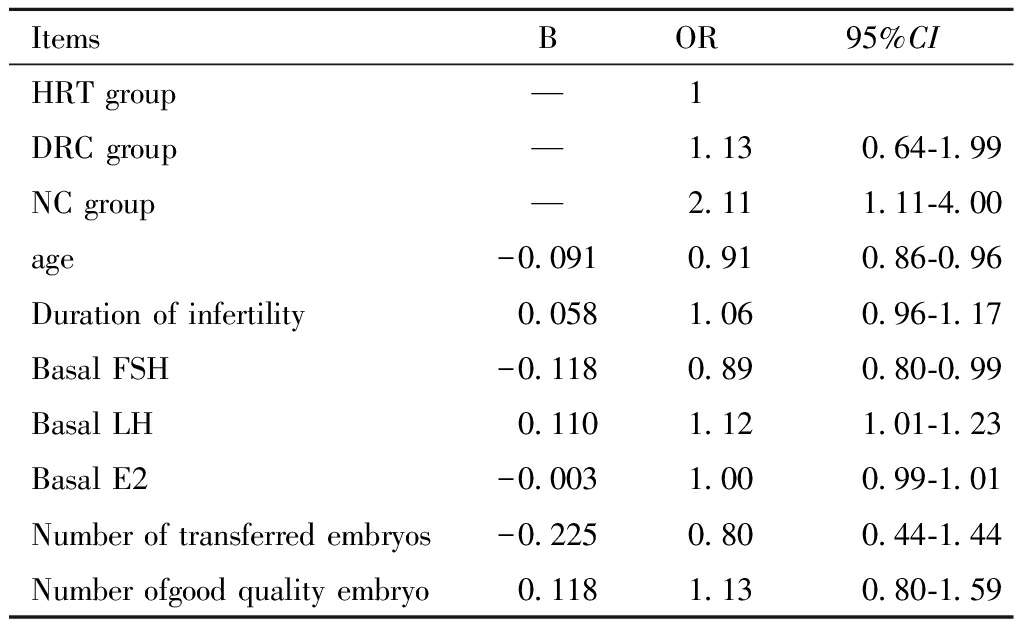
ItemsBOR95%CIHRT group—1DRC group—1.130.64-1.99 NC group—2.111.11-4.00 age-0.0910.910.86-0.96Duration of infertility0.0581.060.96-1.17 Basal FSH-0.1180.890.80-0.99 Basal LH0.1101.121.01-1.23 Basal E2-0.0031.000.99-1.01Number of transferred embryos-0.2250.80 0.44-1.44 Number ofgood quality embryo0.1181.130.80-1.59
五、薄型子宫内膜妊娠结局子宫内厚度的ROC曲线分析
以薄型子宫内膜厚度作为检验变量,临床妊娠结局(0为未妊娠,1为妊娠)为状态变量,作ROC曲线(受试者工作曲线),发现子宫内膜厚度的ROC曲线下面积为0.579,差异有统计学意义。见图1。

图1 不同妊娠结局的子宫内膜厚度的ROC曲线
Figure 1 ROC curves of endometrial thickness for
different pregnancy outcomes
根据SPSS23.0 ROC曲线统计输出结果中可能诊断界点灵敏度(SE)和特异度(SP),计算 Youden指数。Youden指数最大为0.160,本组资料显示,薄型子宫内膜获得较好临床妊娠结局Cut-off 值为0.705 cm。对应敏感性为60%,特异性为 56%。
讨 论
试管婴儿治疗中出现薄型子宫内膜的概率大约为2.4%[6],目前尚无关于薄型子宫内膜的统一定义,临床上多认为薄型子宫内膜是指超声下hCG日子宫内膜厚度<7 mm或 8 mm[7]。现尚未发现薄型子宫内膜的确切病因,目前的研究表明,薄型子宫内膜的形成可能与以下几点相关,即(1)全身因素:内分泌因素[8];(2)局部因素:异常宫腔操作等[9];(3)外在因素:基础疾病(包括糖尿病、糖耐量异常等),不良生活习惯(饮酒、吸烟);(4)不明原因[7,10]。目前针对薄型子宫内膜,治疗方法包括大剂量雌激素、针灸、生物电刺激等。
冷冻胚胎移植成功率决定于两大因素,即胚胎的质量和子宫内膜容受性。子宫内膜容受性与其厚度密切相关,在一定情况下,妊娠率随着内膜厚度增加而增加,薄型子宫内膜明显降低冷冻胚胎妊娠率,子宫内膜<7 mm的妊娠率、种植率明显降低[6, 11],考虑薄型子宫内膜患者的子宫动脉血流阻力更高、内膜血管内皮生长因子蛋白表达量降低及血管发育不良,这些变化均可导致内膜容受性下降。但也有研究认为,不同子宫内膜厚度之间的临床妊娠率无显著差异[12]。
子宫内膜准备是FET成功的重要环节之一,内膜准备方案众多,临床上根据患者病情及工作安排灵活选择,主要包括NC、HRT和降调节+HRT,刺激周期等。多项研究认为,FET内膜准备方案中,尚无证据说明任何一种方案的优势[13-16];但以上研究并不是针对薄型子宫内膜进行的探讨。本文回顾性比较了薄型子宫内膜患者常用的三种方案的临床结果,探寻适合薄型子宫内膜患者的内膜准备方案。容受性子宫内膜不可或缺的成分为雌孕激素[17]。子宫内膜制备方案的原理是通过内源性或外源性雌激素促进子宫内膜生长,后期在孕激素的作用下转化,模拟植入窗口以使其能够容受胚胎。HRT周期主要通过外源性雌孕激素达到促进内膜生长、转化的目的。因其使用方便,效果明显,且便于工作安排,在临床上广泛应用。HRT主要机制是雌激素与子宫内膜的ERα结合促进子宫内膜上皮细胞的增殖,并且可使子宫内膜上皮细胞血管内皮生长因子(VEGF)表达上调、增加子宫内膜微血管血流,达到改善子宫内膜容受性的目的,并让患者获得较高的临床妊娠率 [18]。HRT周期使用的雌激素类药物为戊酸雌二醇,口服的戊酸雌二醇仅有3%转化成可被机体利用的17β-雌二醇。NC是内膜准备方案中较为简单、经济的一种,其作用机制是依靠患者体内自然成熟卵泡分泌雌激素促进子宫内膜增殖,确定排卵后即可选择合适的移植时间,但该方案的局限性是仅适用于排卵正常的患者并需要定期监测卵泡[19]。降调节方案可抑制垂体和内源性甾体激素及有损内膜容受性细胞因子的分泌,改善盆腔炎症免疫反应,可以改善子宫内膜异位症患者的FET结局。目前,在这三种内膜准备方案中,哪一种方案比较适合FET的薄型子宫内膜患者仍有争议。2016年一项Meta分析[20]结果表明,NC 周期患者的临床妊娠率显著高于HRT周期,HRT周期临床妊娠率降低可能与子宫内膜容受性受损、种植窗提前关闭有关。但是该文章研究的人群并非薄型子宫内膜的患者。另有研究报道HRT周期、降调节+HRT周期及NC周期的临床妊娠结局并无差别[20]。
本研究目的是探讨薄型子宫内膜患者FET三种内膜准备方案(HRT、降调节+HRT、NC)临床妊娠结局是否存在差异。本研究发现,薄型子宫内膜患者行冻融胚胎内膜准备时,比较HRT组、降调节+HRT组、NC组解冻日子宫内膜厚度,差异不具有统计学意义;比较三组间胚胎种植率、临床妊娠率、流产率、生化妊娠率及宫外孕率,差异无统计学意义。单因素分析显示,NC组出现临床妊娠的概率是HRT组的1.75倍,降调节+HRT组出现临床妊娠的概率是HRT组的1.35倍,但是差异无统计学意义。多因素分析显示,校正年龄等混杂因素,NC组出现临床妊娠的概率显著高于HRT组,差异有统计学意义。薄型子宫内膜妊娠结局子宫内厚度的ROC曲线分析,曲线下面积为0.579,Youden指数最大为0.160,薄型子宫内膜获得较好临床妊娠结局Cut-off 值为0.705 cm。对应敏感性为60%,特异性为 56%。虽然AUC值偏低,预测意义不大,但是可以作为考虑,即若薄型子宫内膜患者内膜厚度<0.705 cm,获得临床妊娠的概率将会降低,这与既往研究相一致[16]。本研究结果提示,薄型子宫内膜患者冻融胚胎内膜准备选择 HRT方案或降调节方案或NC方案,临床妊娠率基本一致,排除混杂因素后,NC方案有获得更高妊娠概率的可能。但考虑本研究属于回顾性研究,具有一定局限性,因此,薄型子宫内膜患者选哪种方案可获得更高的临床妊娠率还有待商榷,需要将来更进一步研究。
综上所述,对于FET的薄型子宫内膜患者, HRT周期、降调节+HRT周期、NC周期三种内膜准备方案的临床妊娠结局无明显差异,临床上可根据患者自身特点并权衡利弊后选择合适的内膜准备方案。
1 Zenke U,Chetkowski RJ.Transfer and uterine factors are the major recipient-relateddeterminants of success with donor eggs.Fertil steril,2004,82:850-856.
2 Gridelet V,Gaspard O,Polese B,et al.The actors of human implantation:gametes,embryo,endometrium//Embryology-Updates and Highlights on Classic Topics.Intech Open,2012.
3 Nagler HM,Virji N.A Textbook of In Vitro Fertilization and Assisted Reproduction:The Bourn Hall Guide to Clinical and Laboratory Practice,2nd ed.J Urol,2000,164:264-265.
4 Gardner DK,Lane M,Stevens J,et al.Blastocyst score affects implantationand pregnancy outcome:towards a single blastocyst transfer.Fertil steril,2000,73:1155-1158.
5 季慧,陈梦茜,赵纯,等.拮抗剂方案促排卵过程中促黄体生成素水平对体外受精妊娠结局的影响.生殖医学杂志,2017,26:972-977.
6 Kasius A,Smit JG,Torrance HL,et al.Endometrial thickness and pregnancy rates after IVF:a systematic review and meta-analysis.Hum Reprod Update,2014,20:530-541.
7 Mahajan N,Sharma S.The endometrium in assisted reproductive technology:How thin is thin?.J Hum Reprod Sci,2016,9:3-8.
8 Casper RF.It′s time to pay attention to the endometrium.Fertil Steril,2011,96:519-521.
9 Okogbo FO,Ezechi OC,Loto OM,et al.Uterine Leiomyomata in South Western Nigeria:a clinical study of presentations and management outcome.Afr Health Sci,2011,11:271-278.
10 Gonzalez NLG,Davila EG,Castro A,et al.Effect of pregestational diabetes mellitus on first trimester placental characteristics:three-dimensional placental volume and power Doppler indices.Placenta,2014,35:147-151.
11 Groenewoud ER,Cantineau AEP,Kollen BJ,et al.What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles? A systematic review and meta-analysis.Hum Reprod Update,2013,19:458-470.
12 王心怡,李东,辛喜艳.冻融胚胎移植结局相关影响因素的研究进展.生殖医学杂志,2019,28:444-449.
13 Ghobara T,Gelbaya TA,Ayeleke RO.Cycle regimens for frozen-thawed embryo transfer.Cochrane Database Syst Rev,2017,7:Cd003414.
14 Kalem Z,Kalem MN,Gürgan T.Methods for endometrial preparation in frozen-thawed embryo transfer cycles.J Turk Ger Gynecol Assoc,2016;17:168-172.
15 Casper RF,Yanushpolsky EH.Optimal endometrial preparation for frozen embryo transfer cycles:window of implantation and progesterone support.Fertil Steril,2016,105:867-872.
16 Baker VL,Iko I,Segars JH,et al.Is a frozen embryo transfer in a programmed cycle really the best option.J Assist Reprod Genet,2019,36:935-937.
17 Sauer MV.Reproduction at an advanced maternal age and maternal health.Fertil Steril,2015,103:1136-1143.
18 李华,李蓉,刘洋,等.芬吗通改善反复胚胎移植失败患者子宫内膜血流和提高妊娠率的研究.生殖医学杂志,2014,23:37-41.
19 Groenewoud ER,Cantineau AE,Kollen BJ,et al.What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles? A systematic review and meta-analysis.Hum Reprod Update,2017,23:255-261.
20 Yarali H,Polat M,Mumusoglu S,et al.Preparation of endometrium for frozen embryo replacement cycles:a systematic review and meta-analysis.J Assist Reprod Genet,2016,33:1287-1304.