儿童湿疹给患儿本身及家庭生活带来了严重的影响。湿疹由于剧烈的夜间瘙痒,会严重影响儿童睡眠的连续性、睡眠质量和生活质量[1-3]。婴儿期湿疹,在儿童年龄逐渐增长的过程中,会逐渐转向以呼吸道症状为主的过敏性疾病,如哮喘和变应性鼻炎[4-5]等。健康与疾病发育起源(DOHaD)假说提示生命早期暴露可能对个体疾病易感性产生影响[6]。而怀孕期间母体的炎性因子水平可能会影响子代的免疫系统发展[7]。干扰素诱导蛋白10(IFN-yinducible protein 10,IP10)与炎症和免疫反应密切相关,可趋化中性粒细胞和活化的淋巴细胞[8]。从而假设妊娠期母体IP10水平可能影响子代婴儿期湿疹的发生。同时有研究提示剖宫产与婴儿的短期免疫反应异常相关,会增加子代发生免疫疾病(如哮喘,过敏)的风险[9],但是分娩方式是否会影响IP10与子代婴儿期湿疹的作用目前尚无研究。因此,本研究假设分娩方式对IP10与子代婴儿期湿疹的作用中存在交互作用,拟采用前瞻性队列研究探讨妊娠期炎性因子IP10对子代婴儿湿疹影响及分娩方式在其中的作用。
对象与方法
一、研究对象
2015年1月至2016年12月加入广州出生队列研究的孕妇及其子代作为研究对象。纳入标准:(1)入组时孕周<20周;(2)在广州市妇女儿童医疗中心进行产前检查及分娩;(3)随访孕妇及子代至分娩后1年。排除标准:(1)缺少孕妇基线特征信息;(2)孕妇在怀孕前被诊断为甲状腺功能障碍,1型或2型糖尿病,高血压,肾脏疾病和病毒性肝炎;(3)无法在妊娠14~27周内获得孕妇的血液样本;(4)双胎或多胎; (5)儿童死亡;最后,共有890对母子对纳入本研究。
二、方法
1. 资料收集:研究对象入组时(孕周<20周)通过填写纸质版结构式自填问卷的形式来收集研究对象妊娠期相关信息。在婴儿42 d、6月龄、12月龄时收集父母自填国际儿童哮喘和过敏性疾病研究问卷(International Study of Asthma and Allergies in Childhood,ISAAC),以任何一次问卷中“孩子是否被医生诊断患过湿疹?”这一问题回答为“是”判定为婴儿期湿疹。本研究获得广州市妇女儿童医疗中心伦理委员会的批准。
2. 标本采集与IP10检测:医护人员于孕14~27周内由采集孕妇空腹外周静脉血7 mL,非抗凝管(BD公司,6 mL)低温运送至生物库,经4℃离心(北京白杨)后血清存储在-80℃的冰箱。统一出库后,采用bio-rad bioplex悬浮液态芯片系统检测IP10的水平。
3. 统计学处理:计量资料的描述采用均数±标准差或中位数(四分位数间距),分类变量的描述采用频数和百分比。分类变量的组间差异比较采用χ2检验,计量资料的组间差异比较采用t检验。对孕期母血IP10进行对数转换后,采用限制性立方样条分析(restricted cubic spline)对孕期母血IP10水平与子代1岁内湿疹之间的关联进行曲线拟合。因限制性立方样条分析显示不存在非线性关联,则将IP10水平首先进行对数转换以连续变量纳入分析,再按四份位数浓度进行分组(Q1-低水平,Q2-较低水平,Q3-中等水平,Q4-高水平;IP10 四组的浓度分别为Q1≤62.94 pg/mL ,Q2:62.95~104.53 pg/mL,Q3:104.54~184.06 pg/mL,Q4>184.06 pg/mL),以分类变量纳入分析。采用Log-binomial回归分析,探讨孕期母血IP10水平与子代湿疹之间的关联及IP10与分娩方式在婴儿湿疹中的交互作用,根据本研究分析以及对既往研究所提示的潜在混杂因素(妊娠期糖尿病、妊娠期高血压、孕妇过敏史、孕期烟草暴露、孕前BMI)进行调整,采用多重插补(multiple imputation,MI)方法对缺失的孕前BMI(4.79%)进行填补。数据分析软件为SPSS 20.0、SAS 9.2,双侧检验,检验水准α=0.05。
结 果
一、人群基本特征
本研究纳入了来自于广州出生队列研究2015年1月—2016年12月在广州市妇女儿童医疗中心分娩的孕妇890名,孕妇的平均年龄为(29.7±3.4)岁,其中阴道分娩孕妇为(29.6±3.3)岁,剖宫产孕妇为(30.5±3.9)岁。在1岁内发生湿疹的子代有178名(20.0%),其中阴道分娩中发生湿疹的子代占20.6%(150/729),剖宫产中发生婴儿期湿疹的子代占17.6%(28/159)。孕妇是否患有妊娠期糖尿病及不同孕前BMI水平的婴儿期湿疹发生情况的差异有统计意义(P值均小于0.01)。见表1。
孕期母体外周血IP10在人群中呈偏态分布(N=890),用中位数(P25, P75)描述孕期母体外周血IP10的平均水平和变异程度, IP10为104.53(62.94, 184.06)pg/mL。阴道分娩与剖宫产人群中的母血IP10水平差异无统计学意义[(阴道分娩:103.57(62.48,177.14)pg/mL;剖宫产:117.11(63.05,218.60)pg/mL]。由于IP10在人群中呈偏态分布,因此,在下面分析孕期母血IP10水平与子代湿疹关系时,把 IP10水平进行对数转换后再以连续变量纳入分析。见图1。
二、孕期母血IP10与婴儿湿疹的关系
采用限制性立方样条分析对孕期母体外周血log10IP10与子代1岁内湿疹的关联进行曲线拟合,调整妊娠期糖尿病、妊娠期高血压、孕妇过敏史、孕期烟草暴露、孕前BMI等变量之后,发现孕期母体外周血log10IP10与子代1岁内湿疹的发生风险不存在非线性关联(非线性P=0.64)。见图2。
Log-binomial结果显示,log10IP10与婴儿湿疹发生风险增加相关(校正RR:1.51,95% CI:1.02~2.24)。把IP10按浓度四分位数进行分组后,与低水平IP10组(Q1,≤62.94 pg/mL)相比,IP10高水平组(Q4,>184.06 pg/mL)与婴儿湿疹发生风险升高有关(校正RR:1.58,95% CI:1.09~2.29)。见表2。
表1 研究对象的基本信息
Table 1 Baseline characteristics of the study population

CharacteristicsOverallOffspring with infants′ eczema(N=178)Offspring without infants′ eczema(N=712)Maternal age(x±s,year)89029.7±3.329.7±3.4Gestational diabetes mellitus [n(%)] Yes10042(42.0)58(58.0) No790136(17.2)654(82.8)Gestational hypertension [n(%)]∗ Yes278(29.6)19(70.4) No863170(19.7)693(80.3)Maternal allergy history [n(%)] Yes15632(20.5)124(79.5) No734146(19. 9)588(80.1)Tobacco exposure during pregnancy [n(%)] Yes27563(22.9)212(77.1) No614115(18.7)499(81.3)Pre-pregnancy BMI[kg/m2,n(%)]∗ <18.520130(14.9)171(85.1) 18.5≤-<24580120(20.7)460(79.3) 24≤-<288017(21.3)63(78.8) ≥28148(57.1)6(42.9) Missing value153(20.0)12(80.0)Delivery mode [n(%)] Vaginal delivery729150(20.6)579(79.4) Cesarean delivery15928(17.6)131(82.4)Offspringgender [n(%)] Male492108(22.0)384(78.1) Female39870(17.6)328(82.4)
*P<0.05
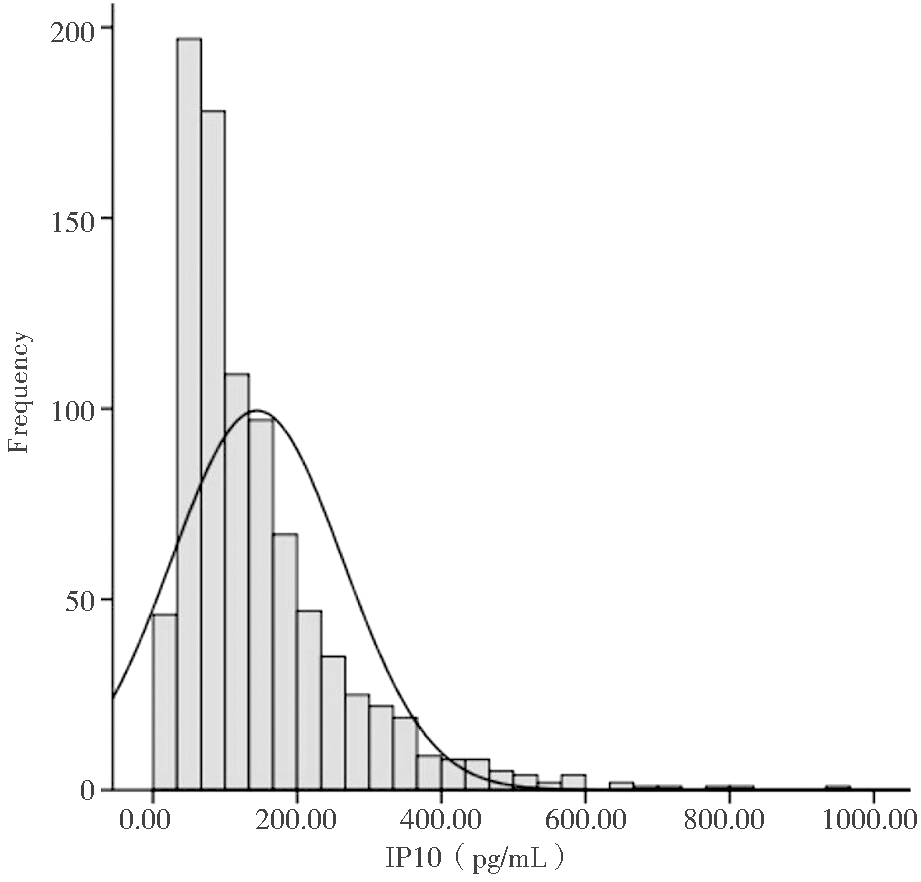
图1 孕期母体外周血IP10在人群中的
分布直方图(N=890)
Figure 1 Histogram of the distribution of IP10
in maternal peripheral blood during pregnancy (N=890)
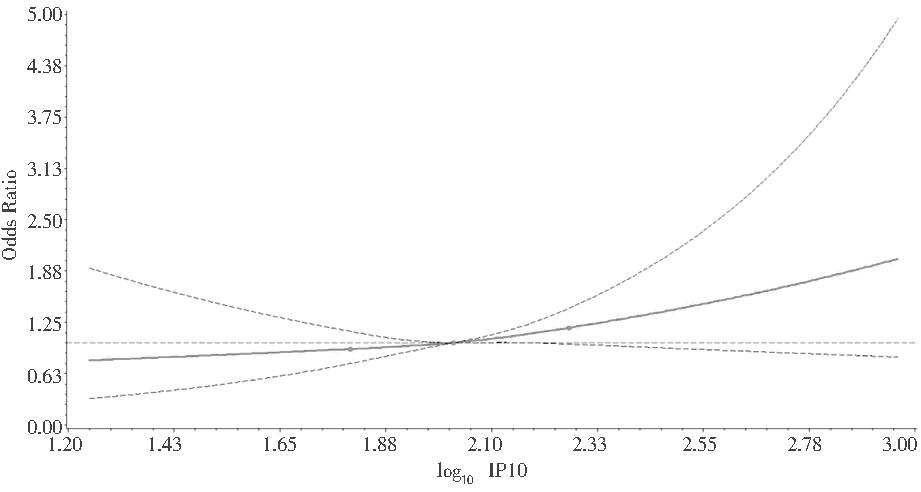
图2 孕期母体外周血IP10与婴儿湿疹的
限制性立方样条分析(N=890)
Figure 2 Restricted cubic spline analysis of IP10
in maternal peripheral blood during pregnancy
and infants′ eczema (N=890)
表2 孕期母血IP10与婴儿湿疹的关联(N=890)
Table 2 The relationship between IP10 in maternal
blood during pregnancy and infants′ eczema (N=890)

IP10Offspring with infants′ eczema[n(%)]RR(95% CI)RRa(95% CI)log10IP10178(20.00)1.59(1.07-2.36)1.51(1.02-2.24)Q137(16.67)1(reference)1(reference)Q241(18.39)1.10(0.74-1.65)1.06(0.71-1.59)Q339(17.57)1.05(0.70-1.59)1.11(0.74-1.67)Q461(27.48)1.65(1.15-2.37)1.58(1.09-2.29)
aAdjusted for gestational diabetes mellitus, gestational hypertension, maternal allergy history, tobacco exposure during pregnancy, pre-pregnancy BMI
以子代是否发生湿疹为因变量,以分娩方式、孕期母血IP10四分位水平组为自变量进行交互作用分析,调整妊娠期糖尿病、妊娠期高血压、孕妇过敏史、孕期烟草暴露、孕前BMI等因素后,结果显示分娩方式与IP10水平对婴儿期湿疹发生不具有相乘交互作用(P=0.06)。
讨 论
本研究发现,孕期母血IP10水平与子代婴儿期湿疹的发生存在关联。炎症水平高子代发生湿疹的风险相应增加,推测可能由于过敏性疾病的发展与Th1免疫和Th2免疫之间的不平衡有关。IP10是干扰素和脂多糖刺激的细胞分泌的一种趋化因子,对T淋巴细胞、单核细胞等炎症细胞具有趋化作用[10]。IP10的唯一受体是CXCR3(C-X-C motif receptor 3),IP10可以与之结合将活化的T细胞募集到组织炎症部位,并且通过级联反应介导Th1炎症反应[11]。Szegedi等[12]通过Luminex和ELISA测定了来自16名湿疹患者和12名健康个体的组织液和血浆中33种细胞因子的水平,发现湿疹患者病变和皮肤组织液与血液中的IP10水平升高,并且IP10水平与湿疹严重程度(SCORAD)相关,提示IP10可能在湿疹发生中发挥作用。由于孕期母体免疫水平并不是一成不变的,本研究只选取了孕妇14~27周母血IP10水平进行分析,有可能并不能全面反映母体的炎症状态。
此外,本研究并未观察到不同分娩方式与IP10水平对婴儿期湿疹的交互作用。目前,尚未查讯到分娩方式与妊娠期炎症因子对子代过敏性疾病发生的交互作用的相关文献,从本研究的结果来看,分娩方式并未对妊娠期炎症因子IP10与婴儿期湿疹的关联产生影响。但是有研究提示,孕妇分娩方式会对围产期循环细胞因子浓度产生影响。阴道分娩是自然的炎症过程,会导致母体和脐带血浆中细胞因子如白细胞介素6(IL-6),白细胞介素8(IL-8)的水平升高[13],并且可以促进多种细胞因子以及相应受体的产生,例如干扰素γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(Tumor necrosis factor α,TNF-α)等,它们通过不同的机制(例如白细胞作用和细菌定植),从而对新生儿免疫系统产生影响[14]。而剖宫产与婴儿的短期免疫反应异常则会增加子代发生免疫疾病风险[8], Jakobsson等[15]提示剖宫产婴儿的微生物多样性以及IP10的循环水平较低从而容易导致子代过敏性疾病的发生。上述研究均提示了分娩方式与妊娠期炎症存在关联,并且可能通过炎症途径影响子代过敏性疾病的发生。然而,本研究未能发现妊娠期炎症因子IP10与分娩方式对婴儿期湿疹的作用,本研究剖宫产比例为17.9%,剖宫产人数相对较少,可能并不足以发现IP10与分娩方式在婴儿期中的作用,未来待进一步扩大样本量,分析不同分娩方式在孕期炎症因子对子代湿疹影响中的作用。
综上所述,本研究发现孕期母血IP10水平与子代婴儿期湿疹发生风险有关,但并未观察到分娩方式与IP10水平对子代婴儿期湿疹的作用,关于炎症与湿疹的关系还需进一步研究。
1 Chernyshov PV.Gender differences in health-related and family quality of life in young children with atopic dermatitis.Int J Dermatol,2012,51:290-294.
2 Fishbein AB,Vitaterna O,Haugh IM,et al.Nocturnal eczema:Review of sleep and circadian rhythms in children with atopic dermatitis and future research directions.J Allergy Clin Immunol,2015,136:1170-1177.
3 Ramirez FD,Chen S,Langan SM,et al.Association of Atopic Dermatitis With Sleep Quality in Children.JAMA Pediatr,2019,173:e190025.
4 Nissen SP,Kjaer HF,Høst A,et al.The natural course of sensitization and allergic diseases from childhood to adulthood.Pediatr Allergy Immunol,2013,24:549-555.
5 Spergel JM,Paller AS.Atopic dermatitis and the atopic march.J Allergy Clin Immunol,2003,112:S118-127.
6 Baird J,Jacob C,Barker M,et al.Developmental Origins of Health and Disease:A Lifecourse Approach to the Prevention of Non-Communicable Diseases.Healthcare (Basel),2017,5.
7 Gaunt G,Ramin K.Immunological tolerance of the human fetus.Am J Perinatol,2001,18:299-312.
8 Taub DD,Lloyd AR,Conlon K,et al.Recombinant human interferon-inducible protein 10 is a chemoattractant for human monocytes and T lymphocytes and promotes T cell adhesion to endothelial cells.J Exp Med,1993,177:1809-1814.
9 Cho CE,Norman M.Cesarean section and development of the immune system in the offspring.Am J Obstet Gynecol,2013,208:249-254.
10 Doron H,Amer M,Ershaid N,et al.Inflammatory Activation of Astrocytes Facilitates Melanoma Brain Tropism via the CXCL10-CXCR3 Signaling Axis.Cell Rep,2019,28:1785-1798.e1786.
11 Karin N,Razon H.Chemokines beyond chemo-attraction:CXCL10 and its significant role in cancer and autoimmunity.Cytokine,2018,109:24-28.
12 Szegedi K,Lutter R,Res PC,et al.Cytokine profiles in interstitial fluid from chronic atopic dermatitis skin.J Eur Acad Dermatol Venereol,2015,29:2136-2144.
13 Chan CJ,Summers KL,Chan NG,et al.Cytokines in umbilical cord blood and the impact of labor events in low-risk term pregnancies.Early Hum Dev,2013,89:1005-1010.
14 Malamitsi-Puchner A,Protonotariou E,Boutsikou T,et al.The influence of the mode of delivery on circulating cytokine concentrations in the perinatal period.Early Hum Dev,2005,81:387-392.
15 Jakobsson HE,Abrahamsson TR,Jenmalm MC,et al.Decreased gut microbiota diversity,delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by caesarean section.Gut,2014,63:559-566.