妊娠滋养细胞疾病(gestational trophoblastic disease, GTD)是一组来源于胎盘绒毛滋养细胞的疾病[1]。葡萄胎(hydatidiform mole, HM)虽为一种良性妊娠滋养细胞疾病,但有潜在恶变可能,多发生于经济落后地区。由于医疗条件差、随访困难等原因,迫使一部分HM患者接受不必要的预防性化疗,既造成医疗资源的浪费,又给患者带来潜在的身体和心理伤害及经济负担。Guzel等[2]研究了中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)与葡萄胎侵袭性的关系,发现妊娠滋养细胞肿瘤(gestational trophoblastic neoplasms, GTN)组的NLR值明显高于HM组(P<0.05)。清宫后的NLR及血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)值预测HM的恶变研究尚未见报道,本研究首次探讨了清宫后的NLR、PLR值与HM恶变的关系。本研究也是首次分析了地处青藏高原高海拔地区妇女NLR、PLR与HM恶变的关系。
资料与方法
一、一般资料
选择2015年1月1日至2017年12月31日来自青海省各地区就诊于青海大学附属医院及青海省红十字医院妇科、全程行规范化诊治及定期随访的HM患者进行研究。初筛患者228例,排除随访失败或未规范化诊治的患者后,最终纳入175例符合标准病例。其中38例在随访期间进展为GTN,定义为恶变组。另外137例未在2年随访时间内进展为GTN,被定义为治愈组。
二、方法
1. 研究指标:从电子病历系统中收集纳入患者基线资料(年龄、孕次、产次、流产次数、孕周)和首次清宫术前1 d内、术后第1天的血常规检查结果,主要包括白细胞计数(WBC)、中性粒细胞绝对值(N)、淋巴细胞绝对值(L)、血小板计数(PLT)和β人绒毛膜促性腺激素(β-hCG)值。计算首次清宫前及后NLR和PLR值。
2. 诊断标准:HM后GTN的诊断基于2018版FIGO标准[3],即(1)血β-hCG呈高水平平台期连续4次(±10%),持续3周或更长时间;即第1、7、14、21天。(2)在至少两周或更长的时间内,连续三次测量β-hCG升高(>10%);即第1、7、14天。(3)有绒毛膜癌的组织学诊断。
3. 统计学处理:采用SPSS 21.0及Medcalc软件建立原始数据。K-S法进行正态性检验,呈正态分布的单因素分析采用t检验,以均数±标准差表示,非正态性分布数据采用秩和检验,以中位数(四分位数范围)即[Median(Q1,Q3)]表示。由于血β-hCG值呈非正态分布,故采用对数变换对其进行校正。受试者工作特征曲线(ROC)表示预测效能并计算曲线下面积(AUC),评估各个预测指标的实际临床价值。AUC>0.5且越接近于1时,表示预测效能越佳,P<0.05为差异有统计学意义。
结 果
一、患者临床基线资料特征
175例符合条件的患者中,38例清宫后发展为GTN(21.7%),137例治愈(78.3%)。两组患者年龄、孕产次、流产史及孕周之间比较,差异无统计学意义。见表1。
二、不同预后葡萄胎患者外周血相关指标的分析
首次清宫前外周血中WBC、PLT,组间差异无统计学意义。首次清宫后外周血中WBC、N、L、PLT及NLR,组间差异无统计学意义。恶变组首次清宫前的N、NLR、PLR及lgβ-hCG值显著高于治愈组(P<0.05),治愈组首次清宫前外周血中的L计数明显高于恶变组(P<0.05)。恶变组清宫后PLR值及lgβ-hCG显著高于治愈组(P<0.05)。见表2。
三、不同标志物在预测葡萄胎清宫后GTN发生的预测效能
预测葡萄胎清宫后发生恶变,血液中单独和(或)联合标志物的AUC值见表3,ROC曲线见图1~图2。当Youden指数取最大时,兼顾灵敏度与特异度,计算得出清宫前N、L、NLR、PLR、lgβ-hCG的临界值分别为4.1×109/L、1.2×109/L、3.2、159.4、5.0,清宫后PLR和lgβ-hCG的临界值分别为129.2、4.6。
表1 治愈组与恶变组的基线资料对比
Table 1 Clinical characteristics of patients in malignant and cured groups

GroupsNumbers of casesAge(years)Gravidity[M(P25, P75)] Parity[M(P25, P75)]Abortion[M(P25, P75)]GestationalweeksMalignant group3828.9±9.43(1,4)1(0,1)0(0,1)10.2±2.3Cured group13728.0±7.82(1,3)0(0,1)0(0,1)10.5±3.9
表2 恶变组与治愈组清宫前后外周血相关指标分析
Table 2 Summary of blood testing markers by the malignant and cured groups

GroupsNumbers of casesWBC(×10 9 /L)N(×10 9 /L)L(×10 9 /L)PLT(×10 9 /L)NLRPLRlgβ-hCGMalignant group Before curettage386.8±1.74.9±1.5∗1.5±0.6∗207.0±43.13.7±1.5∗155.2±54.4∗5.2±0.3∗ Aftercurettage388.4±1.27.1±0.91.5±0.5197.9±52.74.3±0.6143.4±44.3∗4.8±0.4∗Cured group Beforecurettage1376.3±1.54.2±1.31.7±0.4198.0±57.32.7±1.1124.2±45.64.9±0.4 After curettage1378.3±0.76.5±0.71.6±0.4187.9±53.04.1±0.5124.6±49.34.3±0.6
*P<0.05 for the test of between-group comparison.
表3 外周血液中单独和(或)联合标志物预测葡萄胎清宫后发生恶变的价值
Table 3 Estimated AUC values for the blood testing markers or their combinations
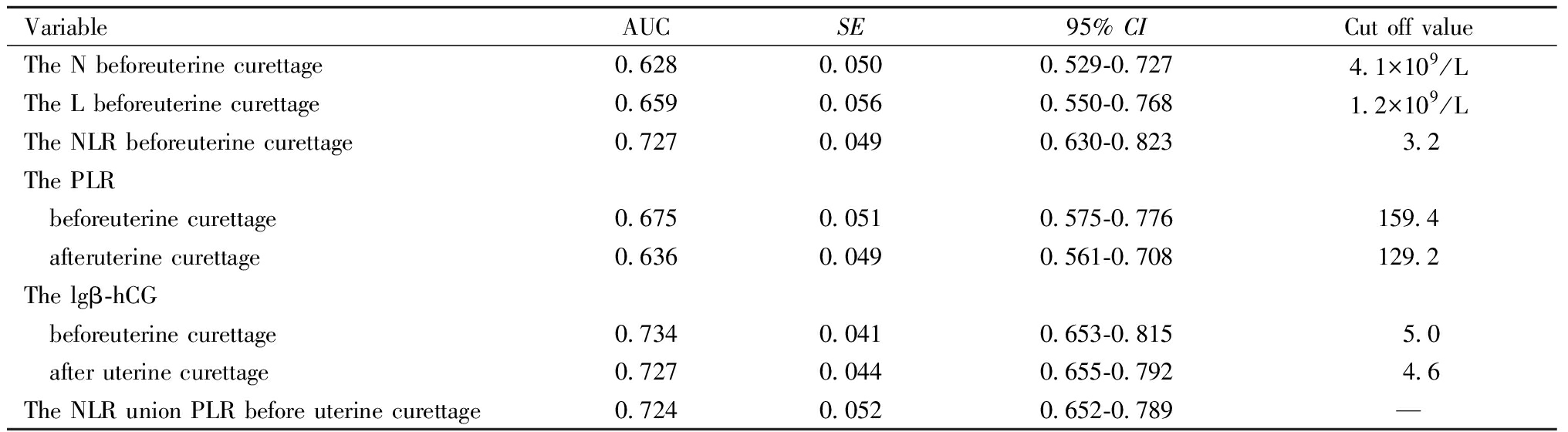
VariableAUCSE95% CICut off valueThe N beforeuterine curettage0.6280.0500.529-0.7274.1×109/LThe L beforeuterine curettage0.6590.0560.550-0.7681.2×109/LThe NLR beforeuterine curettage0.7270.0490.630-0.823 3.2The PLR beforeuterine curettage0.6750.0510.575-0.776159.4 afteruterine curettage0.6360.0490.561-0.708129.2The lgβ-hCG beforeuterine curettage0.7340.0410.653-0.815 5.0 after uterine curettage0.7270.0440.655-0.792 4.6The NLR union PLR before uterine curettage0.7240.0520.652-0.789—
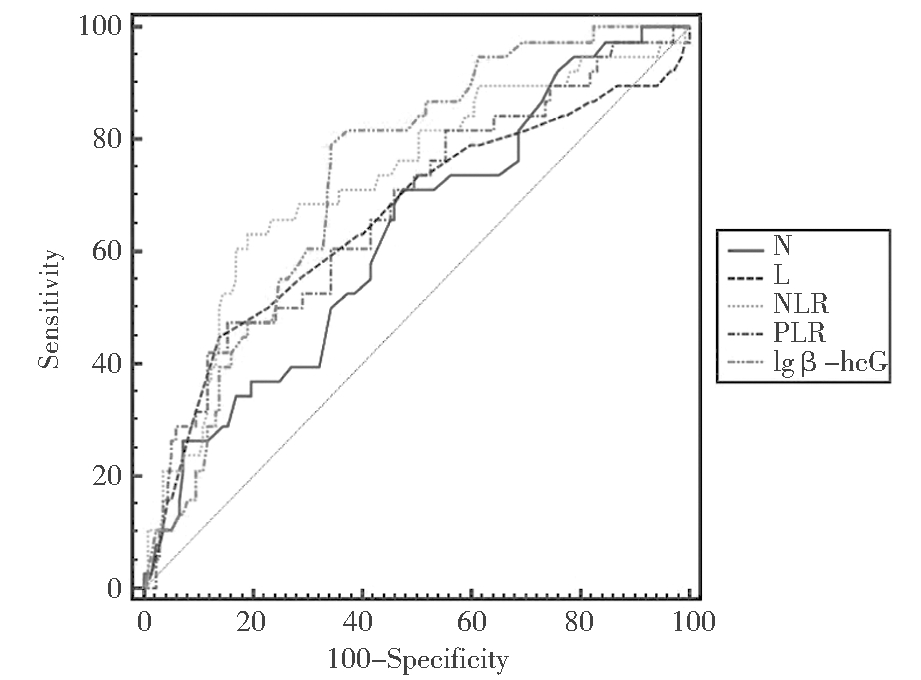
图1 清宫前外周血相关指标预测
葡萄胎恶变的ROC曲线图
Figure 1 ROC curves for different blood testing markers
measured before first curettage to distinguish
between malignant and cured groups

图2 清宫后外周血相关指标预测
葡萄胎恶变的ROC曲线图
Figure 2 ROC curves for different blood testing markers
measured after curettage to distinguish
between malignant and cured groups
讨 论
HM是一种因异常受精而形成的良性妊娠滋养细胞疾病,其特征为胎盘绒毛滋养细胞和间质水肿[4]。虽然80%的HM患者在清宫术后可达到临床治愈,但仍有部分HM患者可能恶变为GTN[5]。目前,预测高危HM恶变主要依靠临床高危因素,如血β-hCG、子宫大小明显大于相应孕周、卵巢黄素化囊肿直径、年龄及重复HM,国内外学者也在积极寻找相关指标预测HM恶变。通过妇科检查判断子宫大小,与检查者临床经验及主观性有关。青海省卫生医疗服务半径大,约为39公里,是全国平均水平的13.9倍[6]。同时受社会经济发展、历史文化及高原特殊气候等多因素的制约,医疗人才缺乏,超声辅助检查水平落后,患者就医依从性差,随访困难。完全性和部分性葡萄胎恶变率约为15%~20%和0.5%~5%[3],如果对依从性差随访困难的患者毫无选择地进行预防性化疗,会使部分患者接受不必要治疗。不仅造成医疗资源的浪费,也使患者暴露于药物的毒副作用之下。因此,寻找经济、便捷预测指标完善HM恶变的评分系统,帮助临床医生判定HM高危患者,对高危人群进行精准地预防性化疗显得尤为迫切。
机体的免疫状态与炎症状态之间存在动态平衡。多种实体肿瘤中,免疫与炎症失衡,在肿瘤细胞所处的微环境中,中性粒细胞反应性增加,致淋巴细胞凋亡增加并抑制其功能,从而促进肿瘤细胞的侵袭[7]。母体妊娠时,中性粒细胞计数和NLR值增加与多种妊娠并发症有关,如先兆子痫、HELLP综合征、妊娠期糖尿病等,这些都会影响妊娠结局[8]。证据表明,如N、NLR及单核细胞与淋巴细胞比值多种炎症指标,可能有助于预测GTD的侵袭[9]。既往研究证实,恶性GTN组NLR值明显高于良性HM。而本研究是对比首次清宫前后的血常规相关数据预测HM恶变,在预测HM恶变方面有一定意义。目前尚无文献研究HM患者首次清宫后的NLR及PLR值在预测HM恶变中的价值。本研究收集既往病例,以确定清宫前后的NLR及PLR值能否作为GTD侵袭性的预测指标,这也是第一次研究高海拔地区HM恶变与炎症指标的关系。本次研究发现,HM的恶变率略高于既往报道数据,可能是在低氧微环境下诱导滋养细胞间的血管内皮生长因子(vascular endothelial growth factor,VEGF)表达增多,使HM更易发生恶变[6]。另外,青海地区医疗水平不发达,患者诊疗意识薄弱,就诊较晚,可能造成HM的恶变率略高。
一、清宫前NLR在葡萄胎恶变中的预测价值
研究显示,慢性炎症与肿瘤细胞的发生及浸润转移有关[10-11]。NLR作为机体炎症反应的指标,可反映机体的炎症和全身免疫状态之间的动态平衡。NLR是外周血常规中的中性粒细胞绝对值与淋巴细胞绝对值的比值,是一种简单易得的实验室指标。研究发现[12-14],NLR是影响包括宫颈癌、卵巢癌、阴茎癌在内的多种恶性肿瘤预后的独立危险因素,其机制可能为生长因子和白细胞介素等多种细胞因子促进中性粒细胞的积累。增多的中性粒细胞增加淋巴细胞凋亡并抑制其活性,降低机体的免疫功能[7,15-16]。除了免疫抑制,中性粒细胞可能还有促进肿瘤细胞增长的能力,其具体机制可能与趋化因子C-X-C基序配体 1(chemokine C-X-C motif ligand1,CXCL1)有关。CXCL1是一种血管生成趋化因子,促进中性粒细胞募集并诱导其产生VEGF,肿瘤细胞周围新生血管又反过来刺激中性粒细胞募集,如此形成一个恶性循环[17]。这些研究结果支持中性粒细胞可能参与GTN的侵袭、血管生成和转移,也反映了NLR与GTD侵袭的免疫学发病机制之间的潜在联系。Guzel等[2]收集了127例GTD患者,分为恶性GTN组(n=8)与良性HM组(n=119),发现GTN组的NLR比值明显高于HM组(P<0.05) 。该文献研究的是恶性GTN组与良性HM组的之间NLR比值的差异,而本研究是NLR在预测HM恶变中的价值。本研究清宫前NLR的诊断界值为3.2,与既往文献报道大致相同[18]。进一步证实NLR在预测HM恶变中的价值。
二、清宫前PLR在预测HM恶变中的价值
PLR同样来自于外周血常规,是由血小板计数与淋巴细胞绝对值计算所得,间接反映机体免疫与凝血功能之间的动态平衡。清宫前PLR在预测葡萄胎恶变的价值存在争议。本研究发现,恶变组清宫前的PLR值明显大于治愈组(P<0.05),清宫前PLR的临界预测值为159.4,与既往报道不同。原因可能是本研究收集的病例来自于青海各州县,平均海拔3 000米以上,属于高原缺氧地区;低氧刺激骨髓巨核细胞胞质发生改变,血小板产生减少,数量低;久居高原人群代偿性血红蛋白及红细胞增多,脾适应性增大,血小板破坏增多;血液黏稠度增高,消耗大量的血小板及凝血因子,这些因素均导致久居高原的人群血小板计数绝对值减少[6]。由于不同研究之间的报道存在争议,清宫前的PLR在预测HM恶变中的诊断价值需要更多的前瞻性试验及荟萃分析来进一步证实。
三、清宫前PLR联合NLR或单独预测HM恶变中的价值
清宫前的NLR值、PLR值在单独预测HM恶变方面均存在意义。首次清宫前的NLR与PLR联合预测HM恶变的诊断价值大于单独的清宫前PLR值,提高了诊断特异度。由于清宫前的PLR及NLR值均来自外周血常规,简单易得,因此可联合预测HM恶变。
四、清宫后的NLR在HM恶变的预测价值
既往有研究证实清宫前的NLR与HM恶变的关系,本研究证实了清宫后的NLR值在预测葡萄胎恶变方面无统计学意义,可能与清宫手术属于一项侵袭性操作有关,接受清宫治疗的患者,中性粒细胞应激性增高,导致恶变组与治愈组之间无差异。
五、清宫后PLR在HM恶变的预测价值
本研究清宫后的PLR的诊断界值为129.2,AUC为0.636。在预测HM恶变方面存在一定价值,但由于其AUC值不高,诊断价值不高。
六、不足之处
本研究不足之处在于收集既往病例是本次研究最大的限制。只收集了外周血中PLT、N及L的绝对值计数进行进一步计算,未收集反应PLT、N及L功能相关指标。因为高原地区低氧对机体的影响不仅对其计数,还可能影响其功能。研究报道,低氧能诱导小鼠外周血中性粒细胞吞噬功能降低,在一定程度上也能抑制T淋巴细胞功能[6]。另外,未收集血液中反应炎症的一些其他指标,比如单核细胞、嗜酸性粒细胞及嗜碱性粒细胞。只收集首次清宫后第1天的血常规值,受清宫这项侵袭性操作影响较大,可考虑收集首次清宫后第3~5天的血常规指标预测HM清宫恶变的倾向。
综上所述,在首次清宫前及后从血常规结果中获得的NLR及PLR对于葡萄胎患者未来发生恶变有一定的临床预测价值。本研究对于高原地区妊娠滋养细胞肿瘤的诊治有一定意义。为进一步研究炎症与葡萄胎恶变的发生之间的关系提供了宏观依据,为建立炎症介导的葡萄胎恶变评分系统提供了科学依据,也为血液中NLR、PLR动态变化预测葡萄胎恶变的模型的建立奠定一定的基础。
1 向阳,尹如铁.妊娠滋养细胞疾病诊断与治疗指南(2021年版).中国癌症杂志,2021,31:520-532.
2 Guzel AI,Kokanali MK,Erkilinc S,et al.Predictive role of the neutrophil lymphocyte ratio for invasion with gestational trophoblastic disease.Asian Pac J Cancer Prev,2014,15:4203-4206.
3 Ngan HYS,Seckl MJ,Berkowitz RS.Update on the diagnosis and management of gestational trophoblastic disease.Gynecol Oncol,2018,143:79-85.
4 王丽娟,林海雪,林仲秋.《2022 NCCN妊娠滋养细胞肿瘤临床实践指南(第1版)》解读.中国实用妇科与产科杂志,2022,38:78-84.
5 Seckl MJ,Sebire NJ,Berkowitz RS.Gestational trophoblastic disease Lancet,2010,376:717-729.
6 格日力,主编.高原医学.第1版.北京:北京大学医学出版社,2014:1-312.
7 Yoon NB,Son C,Um SJ.Role of the neutrophil-lymphocyte count ratio in the differential diagnosis between pulmonary tuberculosis and bacterial community-acquired pneumonia.Ann Lab Med,2013,33:105-110.
8 Wang Q,Liu F,Zhao Y,et al.Can neutrophil-to-lymphocyte and monocyte-to-lymphocyte ratios be useful markers for predicting missed abortion in the first trimester of pregnancy?.J Obstet Gynaecol Res,2020,46:1702-1710.
9 刘睿,张涛红,胡娇娇,等.外周血系统性炎症标志物预测完全性葡萄胎恶变的价值研究.实用妇产科杂志,2020,36:31-36.
10 Tas M,Yavuz A,Ak M,et al.Neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio in discriminating precancerous pathologies from cervical cancer.J Oncol,2019,2019:1-6.
11 Lochowski M,Lochowska B,Zawadzka I,et al.Prognostic value of neutrophil-to-lymphocyte,platelet-to-lymphocyte and lymphocyte-to-monocyte ratio ratios in patients operated on due to non-small cell lung cancer.J Thorac Dis,2019,11:3377-3384.
12 Zhu ML,Feng M,He F,et al.Pretreatment neutrophil-lymphocyte and platelet-lymphocyte ratio predict clinical outcome and prognosis for cervical Cancer.Clin Chim Acta,2018,483:296-302.
13 Hu C,Bai Y,Li J,et al.Prognostic value of systemic inflammatory factors NLR,LMR,PLR and LDH in penile cancer.BMC Urology,2020,20:57.
14 Yin X,Wu L,Yang H,et al.Prognostic significance of neutrophil-lymphocyte ratio (NLR) in patients with ovarian cancer:A systematic review and meta-analysis.Medicine,2019,98:e17475.
15 Hotchkiss RS,Karl IE.The pathophysiology and treatment of sepsis.N Engl J Med,2003,348:138-150.
16 Movahedi K,Guilliams M,Bossche JVD,et al.Identification of discrete tumor-induced myeloid-derived suppressor cell subpopulations with distinct T cell-suppressive activity.Blood,2008,111:4233-4244.
17 Scapini P,Morini M,Tecchio C,et al.CXCL1/macrophage inflammatory protein-2-induced angiogenesis in vivo is mediated by neutrophil-derived vascular endothelial growth factor-A.J Immunol,2004,172:5034-5040.
18 陈雨薇,张虹.清宫前中性粒细胞-淋巴细胞比值对葡萄胎恶变的预测价值.实用妇产科杂志,2016,32:294-297.