随着社会的发展和生活环境的变化,不孕不育已经成为了重要的公共卫生问题,据 WHO 的统计,全球大约有15%的夫妇受此困扰,其中约40%~56%是由男性原因导致的不孕不育,并有持续增长的趋势[1-5],其中男性精液质量异常属于主要原因[6]。据报道约24%的低生育率与弱精子症直接相关[7-9]。目前,认为男性低生育率的产生多数由参与精子发生过程的相关基因的突变而导致[10]。研究发现,ESR2基因多态性与男性不育相关,但众多学者研究结论尚不完全一致,在伊朗人群[11]和日本人群[12]中rs4986938位点的等位基因频率差异都没有统计学意义,在中国台湾人群[13]中与精液浓度有关,而在中国河南汉族人群[14]中可能与男性不育的发生相关。针对男性弱精子症情况,本研究通过测定中国内蒙古包头地区弱精男性不育患者ESR2基因rs4986938的多态性,探讨ESR2基因多态性与弱精子症男性不育的关系。
资料与方法
1.一般资料:收集包头医学院第一附属医院2018—2019年202名男性就诊者资料,由有经验的流行病学专家设计统一调查问卷,由经过培训的调查员逐一询问获得详细的人口统计资料及出行方式、睡眠时间、吸烟、体育锻炼时间、工作地点、家装木地板及板材家具装修状况等,其中包括文献报道对男性生殖有影响的消毒剂[15]等内容。
2.研究对象确定:选取2018年1月—2019年3月期间于包头医学院第一附属医院就诊的弱精症患者标本78例作为弱精组,年龄范围26~44岁,平均年龄(31.2±4.9)岁。正常精液患者标本124例为对照,年龄23~49岁,平均年龄(30.3±5.2)岁。两组年龄差异无统计学意义,具有可比性。其中至少2次精液常规分析确定为弱精子症的入组(参照WHO第5版手册标准)[16]前向运动精子(PR)+非前向运动精子(NP)< 40% 或 PR< 32%,所有标本均排除生殖道感染、精索静脉曲张、激素水平异常及系统性疾病等。
3.血样收集和DNA提取:抽取静脉血,置于EDTA抗凝管中,-20℃保存,采用基因组DNA提取试剂盒(天根血液基因组DNA提取试剂盒)提取全血基因组DNA,具体步骤按试剂盒说明书操作。
4. PCR扩增,基因型检测:PCR扩增引物(rs4986938)(F:5′-GGTCCCAGTGTATGACCTGC-3′,R:5′-AAGGTGGAGGGAAGGATGGT-3′)。PCR反应体系中含有2.5 μM上游引物1.0 μL,2.5 μM下游引物1.0 μL,DNA 1 uL,TaKaRa LA Taq 0.5 μL,dNTP mixture 2.0 μL,10×PCR Buffer 2.5 μL,加ddH2O至25 uL。PCR反应条件为94℃,5 min;94℃,30 sec;60℃,30 sec;72℃,40 sec;循环35次,最后一次72℃延伸5 min。经1.5%琼脂糖凝胶电泳分离PCR产物。rs4986938位点的PCR产物片段是291 bp。PCR产物送通用生物技术有限公司采用Sanger双脱氧测序法进行测序,有三种基因型,即GG、GA、AA。
5.统计学处理:采用SPSS19.0统计软件对数据进行统计分析,以百分比表示计数资料;各基因型的分布、等位基因频率的组间比较采用χ2检验,并计算比值比(OR)及95%可信区间(CI),评估基因突变对该疾病发生的相对危险度;非正态计量资料用秩和检验;采用Logistic回归法排除混杂因素,分析ESR2基因型多态性与弱精子症男性不育的关系。
结果
1.一般特征比较:在202例研究对象中,弱精症患者78名、正常精液男性体检者124名。χ2检验显示,两组在工作地点和吸烟方面差异有统计学意义,见表1。
弱精组和正常组比较,精子总活力、前向运动力、精子活力、精子浓度、前向运动精子、非前向运动精子、不动精子等指标经秩和检验有显著性差异,见表2。
表1 研究对象的一般情况比较 [例(%)]
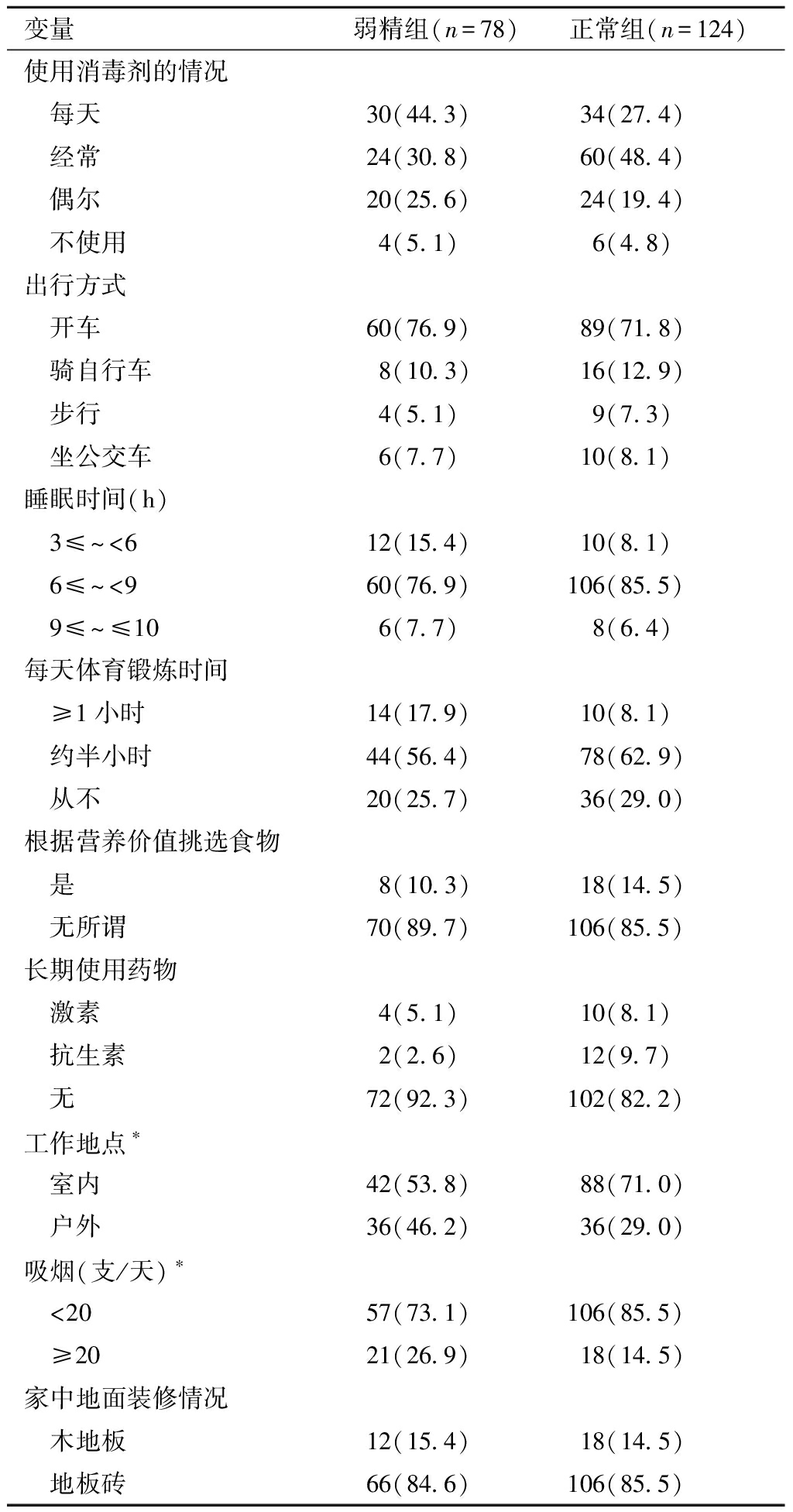
变量弱精组(n=78)正常组(n=124)使用消毒剂的情况 每天30(44.3)34(27.4) 经常24(30.8)60(48.4) 偶尔20(25.6)24(19.4) 不使用4(5.1) 6(4.8)出行方式 开车60(76.9)89(71.8) 骑自行车8(10.3)16(12.9) 步行4(5.1) 9(7.3) 坐公交车6(7.7)10(8.1)睡眠时间(h) 3≤~<6 12(15.4)10(8.1) 6≤~<960(76.9)106(85.5) 9≤~≤106(7.7) 8(6.4)每天体育锻炼时间 ≥1小时 14(17.9)10(8.1) 约半小时44(56.4)78(62.9) 从不20(25.7)36(29.0)根据营养价值挑选食物 是8(10.3)18(14.5) 无所谓70(89.7)106(85.5)长期使用药物 激素4(5.1)10(8.1) 抗生素2(2.6)12(9.7) 无72(92.3)102(82.2)工作地点∗ 室内42(53.8)88(71.0) 户外36(46.2)36(29.0)吸烟(支/天)∗ <2057(73.1)106(85.5) ≥20 21(26.9)18(14.5)家中地面装修情况 木地板12(15.4)18(14.5) 地板砖66(84.6)106(85.5)
两组比较,*P<0.05
表2 研究对象的精子情况比较

组别例数精液量精子总活力前向运动力精子活力精子浓度前向运动精子非前向运动精子不动精子弱精组782.50±1.3027.83±49.53∗23.48±44.20∗25.46±42.00∗14.32±16.73∗ 1.80±4.48∗0.45±1.35∗6.06±10.91∗正常组1243.00±1.5060.79±30.5348.72±25.85277.76±308.37122.46±92.0360.30±75.699.27±16.4937.11±28.48
与正常组比较,*P<0.05
2. ESR2基因rs4986938位点PCR产物:下图是ESR2基因rs4986938位点的PCR产物,扩增片段是291 bp,见图1。
图1 ESR2 rs4986938 PCR产物琼脂糖凝胶
电泳图(扩增产物291 bp)
3. ESR2基因rs4986938位点等位基因及基因型频率分布:ESR2基因rs4986938位点多态性有三种基因型,即GG、AG、AA。弱精组ESR2基因rs4986938位点GG基因型频率为73.1%,低于对照组(87.1%),差异有统计学意义。弱精组中AA 基因型频率为5.1%,与对照组(1.6%)无显著差异。此外,弱精组患者 AG基因型频率为 21.8%,高于对照组(11.3%),差异有统计学意义;在弱精组中,ESR2 基因rs4986938的A等位基因频率为16.0%,高G等位基因频率为84.0%。A等位基因频率高于对照组(7.3%),差异具有统计学意义,见表3。
表3 两组患者rs4986938位点基因
及基因型频率分布 [例(%)]
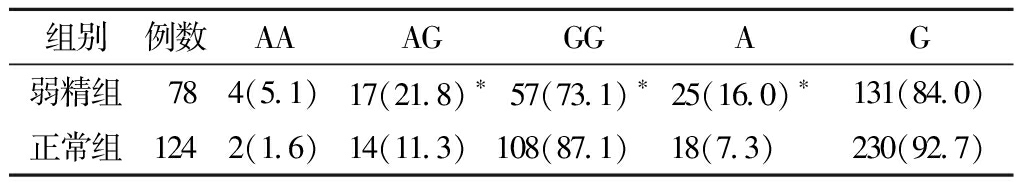
组别例数AAAGGGAG弱精组784(5.1)17(21.8)∗57(73.1)∗25(16.0)∗131(84.0)正常组1242(1.6)14(11.3)108(87.1)18(7.3) 230(92.7)
与正常组比较,*P<0.05
弱精症杂合子基因测序图灰色区域代表突变碱基,见图2。
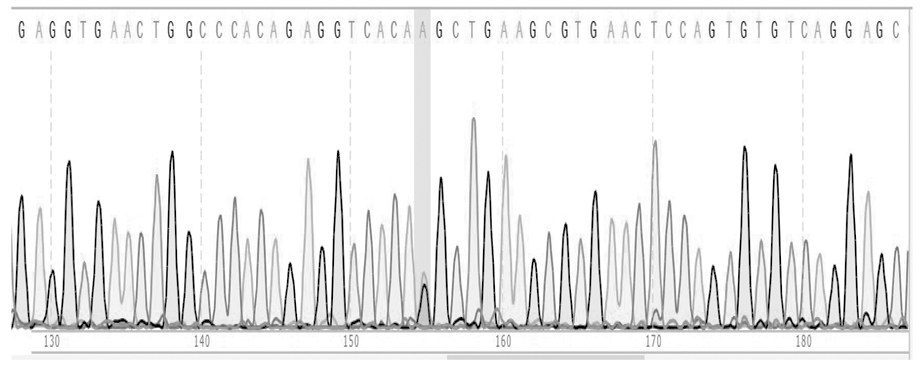
图2 ESR2基因rs4986938位点杂合子基因测序图
4. ESR2基因rs4986938位点多态性与弱精男性不育的关系分析结果:在调整吸烟、工作地方等影响因素后,GA+AA基因型与GG基因型比较,差异有统计学意义;具有GA和AA基因型者,男性不育的发病风险降低(OR=0.41,95% CI:0.20~0.86),结果见表4。
表4 ESR2基因rs4986938位点多态性
与弱精男性不育的关系 [例(%)]
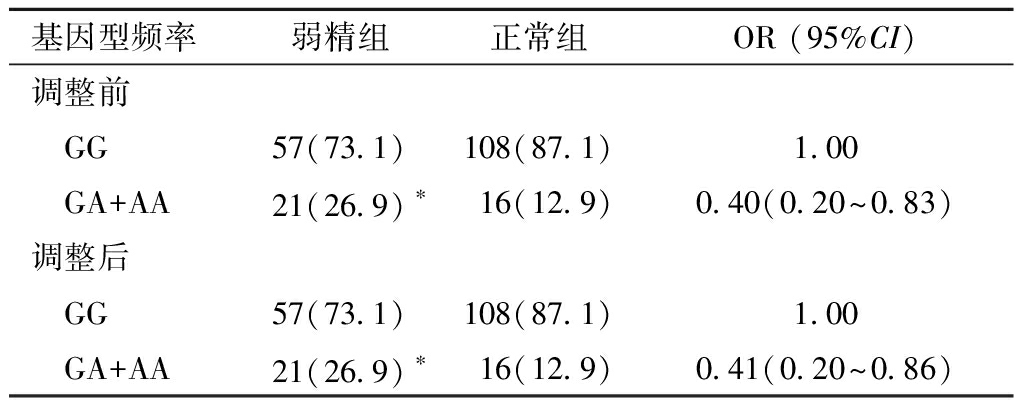
基因型频率弱精组正常组OR (95%CI)调整前 GG57(73.1)108(87.1)1.00 GA+AA21(26.9)∗16(12.9)0.40(0.20~0.83)调整后 GG57(73.1)108(87.1)1.00 GA+AA21(26.9)∗16(12.9)0.41(0.20~0.86)
调整因素:吸烟、工作地方等。*P<0.05
讨论
男性的优势激素为雄激素,但是男性体内雌激素的水平会直接影响雄激素的水平,雌激素主要是通过雌激素受体来实现其作用[17]。雌激素受体有两种,ESR1和ESR2。其中ESR2主要分布在睾丸、前列腺、卵巢、松果体、甲状腺、淋巴组织、尿道中[18-19],研究显示,ESR2是卵泡发育和精子发育过程中的雌激素发挥功能的介导物[20],所以,ESR2与男性不育相关研究较多[21-22]。雌激素受体2是由ESR2基因编码的,ESR2基因定位于14q22-24,全长约40 kb,包括8个外显子和7个内含子,编码530个氨基酸组成的蛋白质。ESR2基因rs4986938位点位于ESR2基因的第8外显子的3′非编码区第1730号核苷酸,rs4986938位点由G突变为A,因其处于非编码区,可能会影响ESR2的表达和功能,进而影响雌激素的生理功能[23]。
本文分析了近年中国内蒙古包头地区弱精症男性不育患者的ESR2基因SNPrs4986938多态性位点,发现A等位基因频率显著高于对照组。本实验由于AA基因型数量较少,故将GA基因型与AA基因型数量合并后进行统计。经Logistic回归分析,GA+AA基因型频率显著高于对照组,差异具有统计学意义;在调整有影响的混杂因素后,结果提示GA+AA基因型与GG基因型比较可以降低包头地区弱精症男性的不育风险,这与其他学者的相关研究有一定的不同。2010年,有学者[11]发现伊朗人群此位点的等位基因在对照组与病例组中的频率差异无统计学意义;2011年中国台湾学者[13]发现此位点的多态性与精液浓度有关。而本文所得结果可能与种族、生活的环境以及生活的方式不同等因素造成。另外,本研究统计发现,弱精人群和正常组比较户外和室内的工作地点有差异,可能因长期接受紫外线照射可造成DNA的损伤;其次,这可能与包头是一座重工业城市有关。本研究发现每天吸烟大于20支在弱精组和正常组之间有显著性差异,这与多数学者研究相符[24-26]。
本研究提示,ESR2基因SNPrs4986938位点GA+AA基因型可降低弱精症男性不育风险,ESR2基因rs4986938位点多态性可能与包头地区汉族人群中弱精子症发病风险相关,由于本研究实验样本数量有限,可能导致本研究结果具有一定的局限性。更多有利于临床研究的数据还需进一步加大样本量研究并验证,以阐明ESR2基因多态性在弱精男性不育中的作用机制,为男性不育提供理论依据。
1 Crosnoe-Shipley LE,Elkelany OO,Rahnema CD,et al.Treatment of hypogonadotropic male hypogonadism:Case-based scenarios.World J Nephrol,2015,4:245-253.
2 Louie K,Minor A,Ng R,et al.Evaluation of DNA methylation at imprinted DMRs in the spermatozoa ofoligozoospermic men in association with MTHFR C677T genotype.Andrology,2016,4:825-831.
3 魏文清,宋秀宇.精浆果糖定量联合精液常规测定在无精症病因诊断中的应用.福建医药杂志,2018,34:77-78.
4 陈伟辉,方小武,陈捷,等.中山地区男性不育患者精液质量分析.中国优生与遗传杂志,2017,37:137-138.
5 张其杰,许洁.男性不育症的表观遗传学研究进展.中华男科学杂志,2017,23:566-569.
6 陶明荣,李学德,何庆鑫.精液常规检验在男性不育患者诊疗中的价值体会.临床检验杂志,2019,8:129-130.
7 颜秋霞,漆正宇,赵晓英,等.ACRV1在正常男性和弱精子症患者精液精子中的表达差异.中国男科学杂志,2015,29:12-16.
8 Luconi M,Forti G,Baldi E.Pathophysiology of sperm motility.Front Biosci,2006,11:1433-1447.
9 曹祺,靳宝军,程洁,等.高效液相色谱-串联质谱多反应监测鉴定人精浆脂质成分.兰州大学学报(医学版),2018,44:23.
10 刘绍明,张岳阳,郭军,等.现代医学对弱精子症的研究概况.中国性科学,2018,27:5-8.
11 Safarinejad MR,Shafiei N,Safarinejad S.Association of polymorphisms in the estrogen receptors alpha,and beta with the occurrence of male infertility and semen parameters.J Steroid Biochem Mol Biol,2010,122:193-203.
12 Lee IW,Kuo PH,Su MT,et al.Quantitative trait analysis suggests polymorphisms of estrogen-related genes regulate human sperm concentrations and motility.Hum Reprod,2011,26:1585-1596.
13 Ogata T,Fukami M,Yoshida R,et al.Haplotype analysis of ESR2 in Japanese patients with spermatogenic failure.J Hum Genet,2012,57:449-452.
14 马宇飞.ESR2基因多态性与河南汉族人群男性不育的相关性分析.河南:郑州大学.2014.
15 Melin VE,Melin TE,Dessify BJ,et al.Quaternary ammonium disinfectants cause subfertility in mice by targeting both male and female reproductive processes.Reprod Toxicol,2016,59:159-166.
16 Shen S,Wang J,Liang J,et al.Low-expressed testis-specific calcium-binding protein CBP86-Ⅳ(CABYR) is observed in idiopathic asthenozoospermia.World J Urol,2015,33:633-638.
17 Lazaros L,Xita N,Kaponis A,et al.Evidence for association of sex hormone-binding globulin and androgen receptor genes with semen quality.Andrologia,2008,40:186-191.
18 Kuiper GG,Enmark E,Pelto-huikko M,et al.Cloning of a novel receptor expressed in rat prostate and ovary.Proc Natl Acad SCI U S A,1996,93:5925-5930.
19 李艳杰,龙火生,李影,等.单核苷酸多态性(SNP)的研究进展和应用.畜牧兽医杂志,2003,22:16-18.
20 黄宝峰,刘智皓,吴风瑞.雄激素受体的结构和功能.四川动物.2008,27:307-310.
21 Jereva D,Fratev F,Tsakovska I,et al.Molecular dynamics simulation of the human estrogen receptor alpha:contribution to the pharmacophore of the agonists.Math Comput Simul,2017,133:124-134.
22 Sunakawa Y,Cao S,Berger MD,et al.Estrogen receptor-beta genetic variations and overall survival in patients with locally advanced gastric cancer.Pharmacogenomics J,2017,17:36-41.
23 Massart F,Becherini L,Marini F,et al.Analysis of estrogen receptor(ERalpha and ERbeta)and progesterone receptor(PR) polymorphisms in uterine leiomyomas.Med Sci Monit,2003,9:25-30.
24 曾育鑫,钟达财.不育男性患者精液常规检测及影响精液质量下降的相关因素分析.临床医学研究与实践,2020,5:27-28,31.
25 Niederberger C.Re:Metabolic Syndrome and Smoking are Independent Risk Factors of Male Idiopathic Infertility.J Urol,2020,203:449-450.
26 Asare-Anane H,Bannison SB,Ofori EK,et al.Tobacco smoking is associated decreased semen quality.Reprod Health,2016,13:90-96.