病例资料
患儿,男,12 d,足月顺产,否认宫内窘迫及复苏史,羊水、脐带、胎盘否认异常。生后人工喂养,因“生后反复左鼻孔溢奶、呛咳”入院。病程中无发热、气促、呻吟,无抽搐、尖叫。精神可,哭声低哑,二便正常。父母非近亲婚配,否认遗传性疾病家族史,无孕期感染、毒物、放射线接触史。查体:特殊面容,前额隆起凸出,毛发浓密,发际线低,弓形眉,口腔黏膜光滑、完整,高颚,双侧乳房肥大,乳头内陷,断掌,手足指趾端宽大,见图1。双肺呼吸音粗糙,可闻及痰鸣音,隐睾,四肢肌张力正常,吸吮、觅食反射正常。听力筛查:双耳未通过;消化道造影:会厌功能紊乱、胃食管反流;超声心动图:房间隔缺损;肺部CT加三维重建:右肺少许炎症、右肺上叶奇叶;头颅磁共振:蛛网膜下腔出血。经管饲喂养、抗感染、雾化吸入等处理,日龄20 d时肺炎治愈出院。出院时奶量70毫升(管饲喂养为主),吸吮吞咽功能较差,仍易呛咳。在院外指导下,患儿1.5月龄达全经口喂养80~90 毫升/次,并逐渐增至120~150毫升/次,呛奶减少。3月龄时体重增长至5.3 kg,可追视、逗笑,偶可笑出声,可俯卧位抬头数分钟,但循声及主动抓握偏差。
该病例疑似Rubinstein-Taybi综合征(Rubinstein-Taybi syndrome,RSTS),行家系全外显子组测序分析和低深度全基因组测序(CNVseq)检查,于患儿日龄36 d时获得检查结果,证实为CREBBP基因外显子10存在c.2063delC杂合缺失突变(见图2 B)。此为新发突变,其父母未携带该突变(见图2 C、D)。

A:前额隆起凸出,毛发浓密,发际线低,弓形眉; B:眼睑裂隙向下延伸,高颚;C:断掌; D:手足指趾端宽大; E:双侧乳房肥大、乳头内陷; F:肺部CT提示右上肺奇叶
图1 Rubinstein-Taybi综合征患儿特征性面容、体征及影像学表型
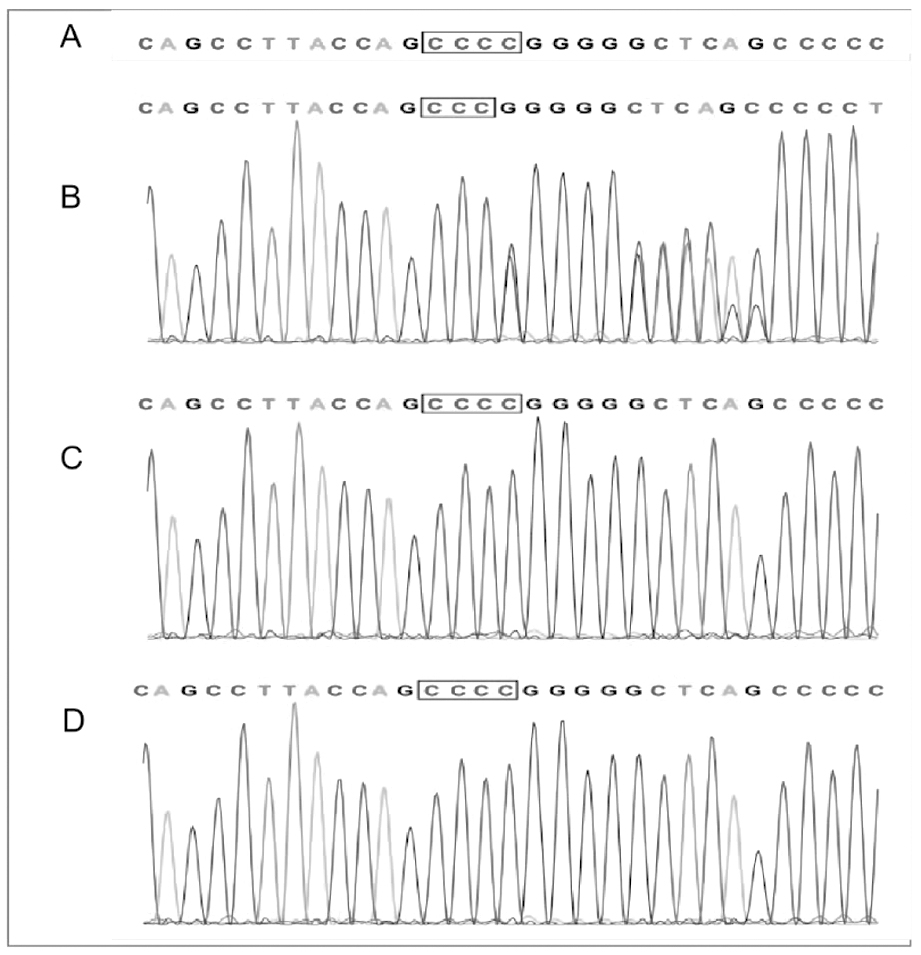
A:标准序列;B:患者、先证者、杂合;C:父亲、正常、野生型; D:母亲、正常、野生型
图2 Rubinstein-Taybi综合征患儿
及其父母基因检测结果
讨论
Rubinstein-Taybi综合征(Rubinstein-Taybi syndrome,RSTS)是一种罕见(1/125 000)的常染色体显性遗传病,以智力低下、生长缺陷、指趾宽大、特殊面容为特征。其面部特征为弓形眉、宽鼻梁、长睫毛、眼睑裂隙向下延伸、鼻中隔呈喙状、上颚高拱、小颌畸形、特征性的鬼脸或不正常的微笑。大多数RSTS是家族中唯一受影响的成员,父母并无异常。目前研究发现[1],只有65%~70%的RSTS遗传学基础是已知的,主要提示是CREBBP或EP300基因的微缺失或突变;CREBBP基因发生突变约占RSTS中的60%,被定义为RSTS1型;EP300基因突变约占RSTS的8%,被定义为RSTS 2型。这两种基因的突变通常是杂合、罕见、新发突变[2]。还有大约1/3的RSTS患者的分子遗传学病因仍然未知[3]。RSTS 1型的特征比RSTS 2型更显著[1]。RSTS 1型和RSTS 2型存在指趾发育异常的比例分别为96%和69%,面部异常如鬼脸微笑分别为94%和47%,智力残疾分别为99%和94%[1]。RSTS的平均智商在25到79之间,有一些RSTS2型患者智力正常[4]。
既往认为,RSTS在胎儿期一般无异常表现。但2019年Van-Gils等报道9例胎儿RSTS,都有大拇指和/或面部畸形,均被证实为CREBBP基因异常[2]。因此,若已知家族中成员存在致病性变异,应对高风险的孕妇进行产前诊断,如产前基因检测和胚胎植入前遗传学诊断。RSTS患儿很少在新生儿期即被诊断,大多数患儿随年龄增长其他系统出现异常才被发现,如(1)眼睛:斜视、上睑下垂、鼻泪管阻塞等。(2)听力损失。(3)呼吸系统:吸入性肺炎、哮喘和复发性上呼吸道感染等。(4)约1/3的患儿存在先天性心脏缺陷。(5)泌尿系统:隐睾、肾积水和重复肾均常见。(6)消化系统:胃食管反流和便秘常见[5]。(7)牙齿:牙齿拥挤、错牙合、缺牙、多牙等。(8)神经系统:发育迟缓多见,头颅MRI最常见特征是胼胝体形态异常(73.6%)[6],癫痫发作或脑电图异常也常有报道[7],脑膜瘤和毛基质瘤的发病率显著升高[8]。(9)精神心理问题:成年后的情绪障碍、强迫症、焦虑症和自残行为等[9-10]。
本例系临床罕见的新生儿RSTS病例,除具典型的临床表型外,还存在目前尚无文献报道的新发现的临床表型——肺奇叶。肺奇叶发生率约为0.4%~1.0%[11],目前国内尚无新生儿肺奇叶病例报道。
该病例扩展了RSTS的基因突变谱和表型谱,对于有典型外貌特征或存在呼吸困难、进食问题、体重增加不良、反复感染等表现的新生儿,应高度怀疑RSTS。根据情况选择基因靶向检测或全基因组测序检测,以尽早诊断。
1 López M,García-Oguiza A,Armstrong J,et al.Rubinstein-Taybi 2 associated to novel EP300 mutations:deepening the clinical and genetic spectrum.BMC Med Genet,2018,19:36.
2 Korzus E.Rubinstein-Taybi Syndrome and Epigenetic Alterations.Adv Exp Med Biol,2017,978:39-62.
3 Van-Gils J,Naudion S,Toutain J,et al.Fetal phenotype of Rubinstein-Taybi syndrome caused by CREBBP mutations.Clin Genet,2019,95:420-426.
4 Fergelot P,van Belzen M,van Gils J,et al.Phenotype and genotype in 52 patients with Rubinstein-Taybi syndrome caused by EP300 mutations.Am J Med Genet A,2016,170:3069-3082.
5 Stevens CA.Intestinal malrotation in Rubinstein-Taybi syndrome.Am J Med Genet A,2015,167A:2399-2401.
6 Ajmone PF,Avignone S,Gervasini C,et al.Rubinstein-Taybi syndrome:New neuroradiological and neuropsychiatric insights from a multidisciplinary approach.Am J Med Genet B Neuropsychiatr Genet,2018,177:406-415.
7 Giacobbe A,Ajmone PF,Milani D,et al.Electroclinical phenotype in Rubinstein-Taybi syndrome.Brain Dev,2016,38:563-570.
8 Boot MV,van Belzen MJ,Overbeek LI,et al.Benign and malignant tumors in Rubinstein-Taybi syndrome.Am J Med Genet A,2018,176:597-608.
9 Waite J,Beck SR,Heald M,et al.Dissociation of cross-sectional trajectories for verbal and visuo spatial working memory development in Rubinstein-Taybi syndrome.J Autism Dev Disord,2016,46:2064-2071.
10 Crawford H,Waite J,Oliver C.Diverse profiles of anxiety related disorders in fragile X,Cornelia de Lange and Rubinstein-Taybi syndromes.J Autism Dev Disord,2017,47:3728-3740.
11 Moawad CM,Griepp DW,Moawad KA,et al.The azygos lobe of the lung.Pulmonology,2022,28:241-242.