自1983年首例冷冻胚胎移植后获得临床妊娠,体外胚胎冷冻保存越来越多地用于辅助生殖技术(ART)[1]。这项技术的使用不仅提高了累计活产率,还降低了卵巢过度刺激综合征(OHSS)的风险,并将多胎妊娠率降至最低[2-3]。此外,它还可用于因子宫容受性或植入前基因诊断而不适合进行新鲜胚胎移植的患者,以及与某些妇科疾病或衰老相关的癌症或卵巢储备减少患者的生育能力保存[4]。胚胎冷冻技术主要分为两类:程序化冷冻和玻璃化冷冻,玻璃化冷冻具有更高的存活率和更好的临床妊娠结局,近年来胚胎玻璃化冷冻已成为ART治疗的基本工具,逐渐取代传统的程序化冷冻[5-6]。然而,玻璃化冷冻中胚胎暴露于有一定胚胎毒性的高浓度冷冻保护剂和接触液氮造成的潜在污染等安全性问题也引起关注[2,7]。玻璃化冷冻是否会影响胚胎的生存能力和随后的着床潜力仍有争议。本研究将本中心在2018年1月—2020年12月期间进行的玻璃化胚胎解冻周期进行回顾性分析,探讨单囊胚冻融移植周期中玻璃化冷冻保存时间对胚胎存活率、妊娠结局的影响,更好地为临床工作提供参考。
资料与方法
一、临床资料
回顾性分析本生殖中心2018年1月—2020年12月9 462例玻璃化冷冻解冻单囊胚移植周期的患者资料。排除继培移植、胚胎植入前遗传学检测(PGT)、未成熟卵体外成熟(IVM)冷冻胚胎以及解冻的复冻胚胎。根据玻璃化冷冻保存时间分四组,保存时间0 ~ <2月组有3 350例;2 ~ <6月组有3 224例,6 ~ <12月组有1 448例;≥12月组有1 440例。
二、研究方法
1.胚胎评分和冷冻:卵母细胞通过常规体外受精(IVF)或卵胞浆内单精子显微注射技术(ICSI)进行授精。在受精的第3天,根据患者该周期的具体情况移植或冷冻一至两个符合标准的卵裂期胚胎,余下胚胎继续培养至第五天(D5)或第六天(D6)。囊胚选用 Gardner 的评级标准[8],首先根据囊胚腔扩张等级分为1~6期;3期及以上胚胎根据内细胞团和滋养层分别评级。内细胞团分为A:细胞数多,紧密成团,清晰可见;B:细胞数少,排列松散;C:细胞数极少,几乎没有,不清晰。滋养层分为A:细胞数多,呈镰刀形连续平铺;B:细胞数少,排列松散;C:细胞数极少,几乎没有,不清晰。冷冻标准为D5和D6形成≥3BC以上可利用囊胚。囊胚冷冻前人工皱缩:使用激光照射,在远离内细胞团的滋养层细胞连接处打孔,待其囊腔皱缩;6期囊胚需适当调小激光作用时间。冷冻前将玻璃化冷冻液(日本加藤,其中包括1号液Equilibration Solution和2号液Vitrification Solution)置常温预温。根据冷冻试剂盒说明将待冷冻胚胎放入1号液中并开始计时,5~8 min后(观察胚胎卵裂球状态)将胚胎移入2号液体(约0.2 mL)。在2号液内将胚胎清洗数次,1 min内将胚胎放置于冷冻载杆前端近黑色标记处,将装载胚胎的冷冻载杆迅速放入液氮中,在液氮中套上外套管。
2. 胚胎复苏和移植:复苏前将玻璃化复苏试剂盒(KITAZATO,日本)置常温预温。根据复苏试剂盒说明将冷冻胚胎依次经过试剂1号液、2号液、3号液清洗各1 min、3 min、5 min,转入4号液后将培养皿放于37 ℃热台,5 min后将胚胎转移至囊胚培养液中,观察囊胚形态及细胞色泽,囊胚腔全部或部分扩张为存活,培养箱培养待移植。复苏存活率=复苏胚胎数/存活胚胎数×100%,本中心非全部胚胎单管单冻,故复苏及存活胚胎数≥移植胚胎数。移植前等待临床医生在B超引导下植入外套管进入宫腔后,从培养箱取出移植皿并核对姓名,三段法将胚胎移至移植内芯管(cook,美国)中,由临床医生将胚胎置于距宫底1~1.5 cm 处。
3. 移植前内膜准备:(1)人工周期。月经第2~4天口服补佳乐(拜耳制药,德国)2 mg/d,第5~8天 2 mg/d bid,第9 ~12 天 3 mg/d bid。当内膜厚度≥7 mm且雌激素作用时间≥10 d时,肌肉注射黄体酮,在黄体支持第6天进行囊胚解冻。(2)降调人工周期。在早卵泡期肌内注射长效促性腺激素释放激素激动剂(GnRH-a),28 d后给予补佳乐处理,后续方案同人工周期。(3)自然周期。根据患者月经周期选择从月经第 10 ~12 天起B超监测卵泡大小与子宫内膜发育情况,于排卵后4~5 d进行囊胚解冻。
4. 妊娠及新生儿结局判断:(1)临床妊娠。囊胚移植12 d后抽血检测人绒毛膜促性腺激素(hCG),阳性者在移植后28 d进行B超检测,以B超见到宫腔内妊娠囊且有胎心搏动;(2)流产。临床妊娠后胎儿丢失,终止妊娠;(3)活产。胎儿娩出后至少具有以下一项生命体征,包括心跳、呼吸、脐带搏动、随意肌收缩;(4)早产。活产周期中,满20周至37周前分娩;(5)巨大儿。出生体重大于4 000 g者;(6)低出生体重儿。出生体重小于2 500 g者;(7)极低出生体重儿。出生体重小于 1 500 g者。临床妊娠率=临床妊娠周期数/移植周期数×100%;流产率=流产周期数/临床妊娠周期数×100%;活产率=活产周期数/移植周期数×100%。
三、统计学处理
采用SPSS 26.0统计软件包,正态分布数据以均数±标准差描述,组间均数比较采用单因素方差分析;计数资料采用率进行描述,组间比较采用卡方检验,当基线资料不齐时,采用Logistic回归分析或线性回归分析调整混杂因素对应变量的影响。P<0.05为差异有统计学意义。
结 果
一、一般情况
不同冷冻保持时间组患者的一般资料见表1。与保存时间0~<2月组患者比较,其他三组移植时母亲年龄较高,原发性不孕比例较低,差异有统计学意义,四组间的复苏方案存在统计学差异, 其他指标如患者BMI、内膜厚度、不孕年限等均无统计学差异。
表1 不同冷冻保持时间组患者的一般资料比较![]()
Table 1 General information of patients with different cryopreservation times ![]()
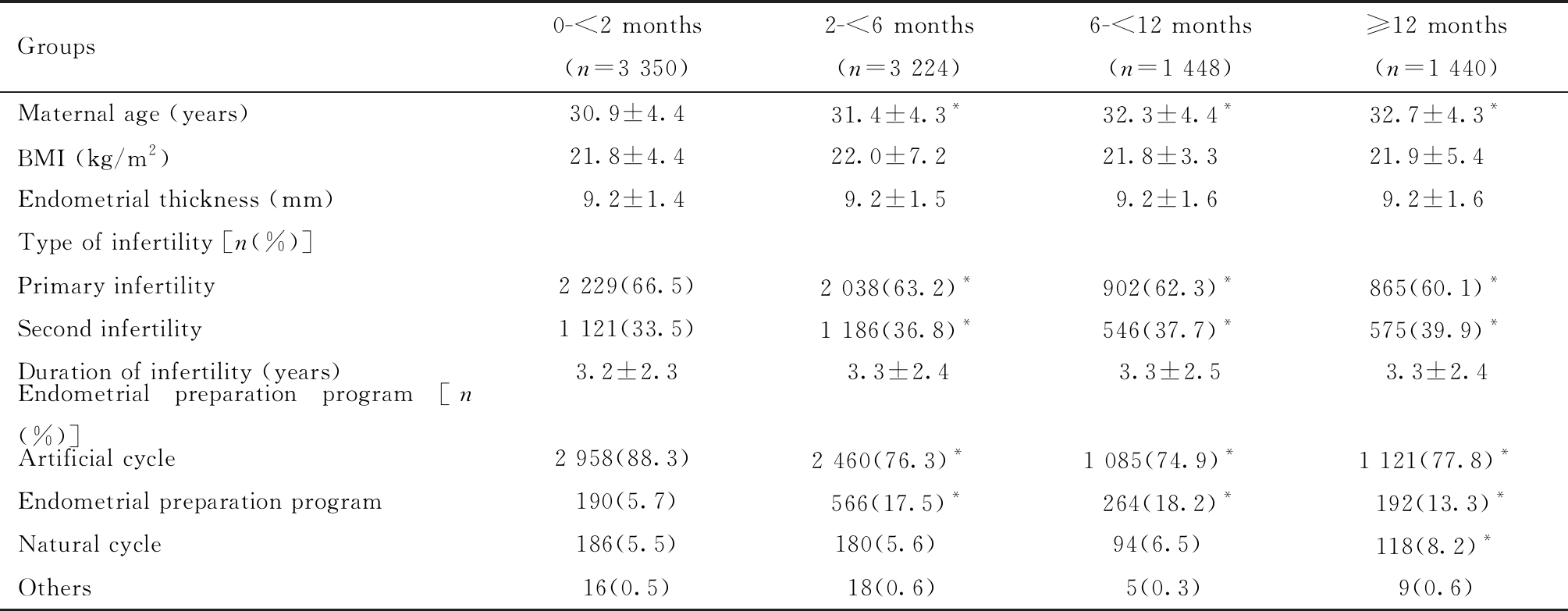
Compared with the group of 0-<2 months, *P<0.05
Groups0-<2 months(n=3 350)2-<6 months(n=3 224)6-<12 months(n=1 448)≥12 months(n=1 440)Maternal age (years)30.9±4.431.4±4.3*32.3±4.4*32.7±4.3*BMI (kg/m2)21.8±4.422.0±7.221.8±3.321.9±5.4Endometrial thickness (mm)9.2±1.49.2±1.59.2±1.69.2±1.6Type of infertility [n(%)]Primary infertility2 229(66.5)2 038(63.2)*902(62.3)*865(60.1)*Second infertility1 121(33.5)1 186(36.8)*546(37.7)*575(39.9)*Duration of infertility (years)3.2±2.33.3±2.43.3±2.53.3±2.4Endometrial preparation program [n(%)]Artificial cycle2 958(88.3) 2 460(76.3)* 1 085(74.9)* 1 121(77.8)*Endometrial preparation program190(5.7)566(17.5)*264(18.2)*192(13.3)*Natural cycle186(5.5)180(5.6) 94(6.5) 118(8.2)*Others16(0.5)18(0.6) 5(0.3) 9(0.6)
二、妊娠结局
四组患者的妊娠率分别为58.6%、56.3%、56.0%及55.7%,妊娠率略有下降趋势,但差异无统计学意义,四组活产率分别为46.8%、45.0%、43.4%及43.7%,与0 ~ <2月组相比,6 ~ <12月组及≥12月组活产率下降,差异有统计学意义,四组间复苏胚胎存活率、流产率无统计学差异。调整女方年龄、BMI、内膜厚度、不孕类型、不孕年限及复苏方案等混杂因素的影响后,四组患者的上述指标均无统计学差异(见表2)。
表2 玻璃化冷冻不同保存时间单囊胚复苏移植后妊娠结局比较
Table 2 Pregnancy outcomes of frozen single blastocyst transfer with different cryopreservation time
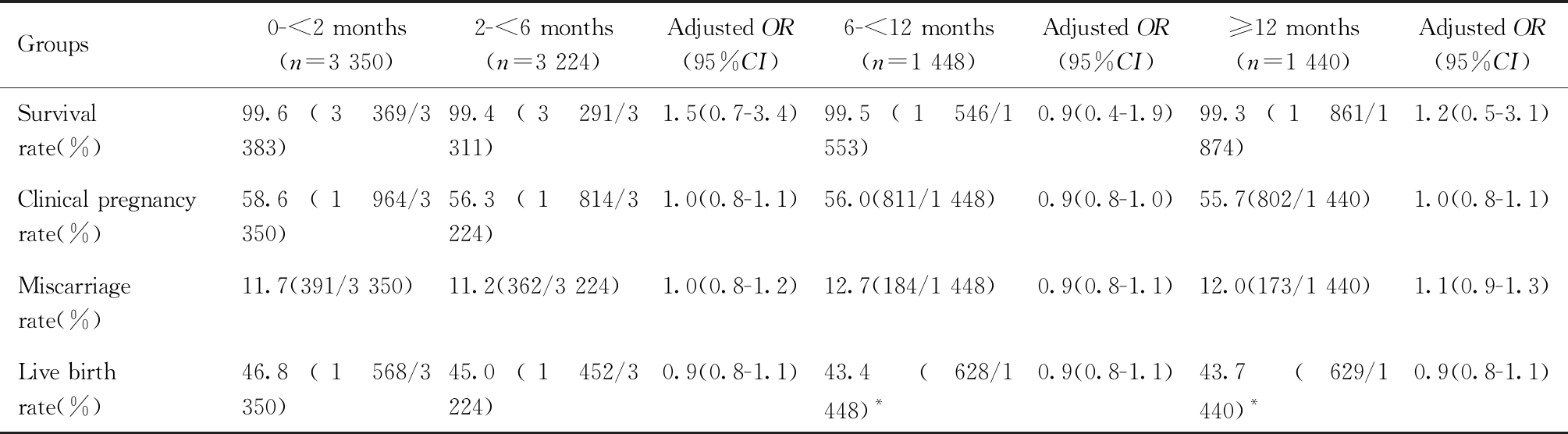
Compared with the group of 0- < 2 months, *P<0.05
Groups0-<2 months(n=3 350)2-<6 months(n=3 224)Adjusted OR(95%CI)6-<12 months(n=1 448)Adjusted OR(95%CI)≥12 months(n=1 440)Adjusted OR(95%CI)Survivalrate(%)99.6(3 369/3 383)99.4(3 291/3 311)1.5(0.7-3.4)99.5(1 546/1 553)0.9(0.4-1.9)99.3(1 861/1 874)1.2(0.5-3.1)Clinical pregnancyrate(%)58.6(1 964/3 350)56.3(1 814/3 224)1.0(0.8-1.1)56.0(811/1 448)0.9(0.8-1.0)55.7(802/1 440)1.0(0.8-1.1)Miscarriagerate(%)11.7(391/3 350)11.2(362/3 224)1.0(0.8-1.2)12.7(184/1 448)0.9(0.8-1.1)12.0(173/1 440)1.1(0.9-1.3)Live birthrate(%)46.8(1 568/3 350)45.0(1 452/3 224)0.9(0.8-1.1)43.4(628/1 448)*0.9(0.8-1.1)43.7(629/1 440)*0.9(0.8-1.1)
三、新生儿结局
四组新生儿出生体重分别为(3 308.3±538.4)g,(3 301.9±563.1)g,(3 269.6±530.6)g以及(3 357.7±525.6)g,冻存时间0~<2月、2~<6月及6~<12月三组间新生儿出生体重无统计学差异,而冻存时间≥12月组出生体重高于其余三组,差异有统计学意义。≥12月组的低出生体重儿比例高于0~<2月组(P<0.05),调整女方年龄、BMI、内膜厚度、不孕类型、不孕年限及复苏方案等混杂因素的影响后,差异依然存在,调整后OR =1.6,95%CI为1.0~2.6。其他新生儿结局,包括多胎比例、新生儿性别比例、分娩方式、出生时孕周、早产儿比例、低出生体重儿比例、极低出生体重儿比例以及巨大儿比例比较,差异均无统计学意义(见表 3)。
表3 玻璃化冷冻不同保存时间单囊胚复苏移植后新生儿结局比较[例(%)]
Table3 Neonatal outcomes of frozen single blastocyst transfer with different cryopreservation time [n(%)]
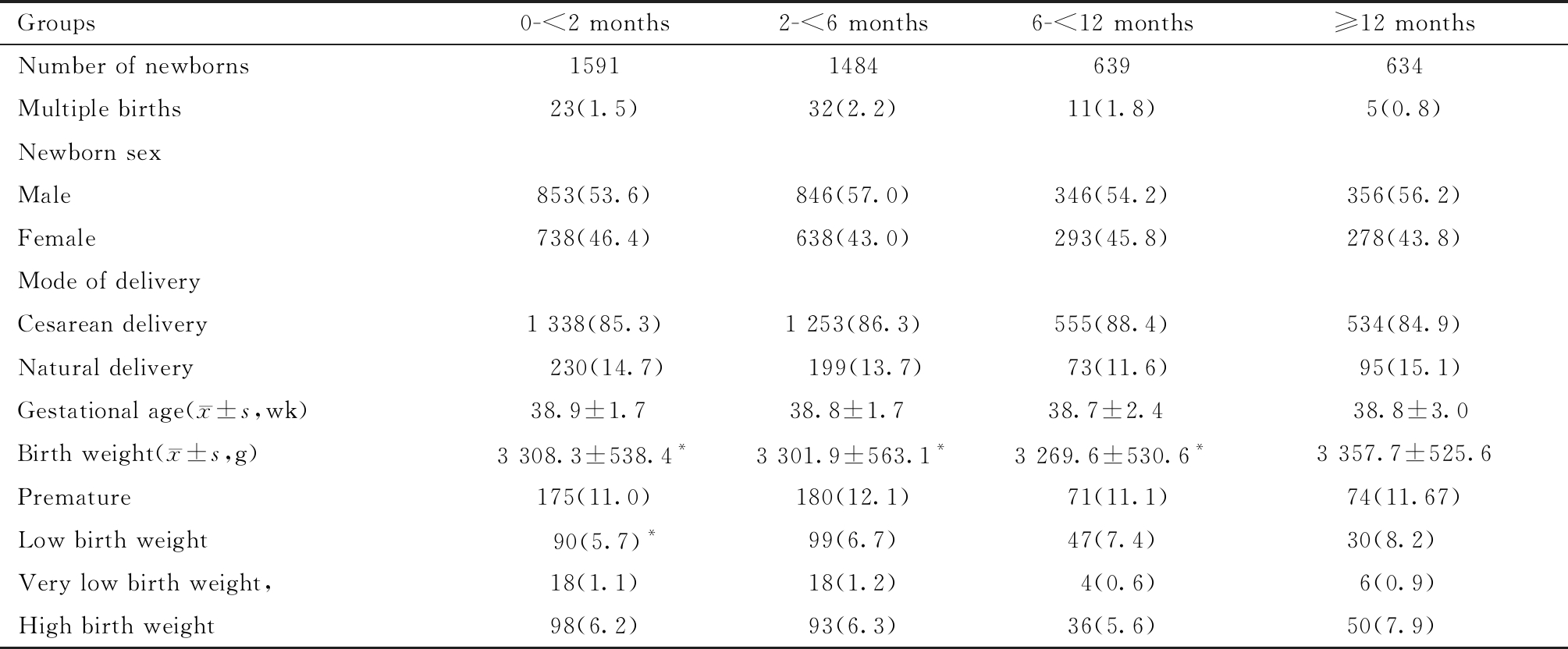
Compared with the group of≥12 months, *P<0.05
Groups0-<2 months2-<6 months6-<12 months≥12 monthsNumber of newborns15911484639634Multiple births23(1.5)32(2.2)11(1.8)5(0.8)Newborn sexMale853(53.6)846(57.0)346(54.2)356(56.2)Female738(46.4)638(43.0)293(45.8)278(43.8)Mode of deliveryCesarean delivery1 338(85.3)1 253(86.3)555(88.4)534(84.9)Natural delivery 230(14.7) 199(13.7)73(11.6)95(15.1)Gestational age( x±s,wk)38.9±1.7 38.8±1.7 38.7±2.4 38.8±3.0Birth weight( x±s,g)3 308.3±538.4*3 301.9±563.1*3 269.6±530.6*3 357.7±525.6Premature175(11.0)180(12.1)71(11.1)74(11.67)Low birth weight 90(5.7)*99(6.7)47(7.4)30(8.2) Very low birth weight,18(1.1)18(1.2)4(0.6)6(0.9) High birth weight98(6.2)93(6.3)36(5.6)50(7.9)
讨 论
近年来,随着人类辅助生殖技术的飞速发展,医源性多胎妊娠已成为辅助生殖技术最常见的并发症之一,单囊胚移植可以显著降低多胎妊娠的发生,减少产科和子代风险。胚胎冷冻保存技术可将多胎妊娠率降至最低,提高累积活产率,同时降低卵巢过度刺激综合征(OHSS)的风险[2-3]。胚胎冷冻技术主要分为两类:程序化冷冻和玻璃化冷冻,玻璃化冷冻具有更高的存活率和更好的临床妊娠结局,近年来胚胎玻璃化冷冻已成为ART治疗的基本工具,逐渐取代传统的程序化冷冻[5-6]。
随着玻璃化冷冻技术的广泛应用,延长玻璃化冷冻胚胎保存时间的安全性引起了全世界的关注。评估冷冻保存时间对胚胎质量和妊娠结局的影响已有文献报道,但结果相互矛盾。
2011年赵庆红等[9]及2015年赵静等[10]的研究均表明,胚胎玻璃化冷冻保存时间不影响解冻后胚胎质量与妊娠结局。Ueno等人2018年进行的一项研究表明,玻璃化冷冻囊胚的冷冻保存时间与妊娠和新生儿结局没有显著关系[11]。Wirleitner等人于2013年进行了一项回顾性研究,调查了603个胚胎移植周期中玻璃化冷冻囊胚的保存时间对存活率、植入率和新生儿结局的影响,他们的研究结果表明,延长储存时间对胚胎或后代都没有明显的负面影响[12]。然而唐永梅等[13]的研究表明随着卵裂期胚胎玻璃化冻存时间的延长,临床妊娠率有下降趋势,而囊胚期胚胎冻存时间>721 d 将出现临床妊娠率、胚胎种植率的明显下降。Li等人2020年分析了24 698个冷冻移植周期中玻璃化冷冻囊胚和卵裂期胚胎保存时间的影响,他们的研究结果表明玻璃化冷冻胚胎的长期保存对妊娠和活产结局有负面影响,但对新生儿结局没有显著影响[14]。
本文回顾性分析了近3年单囊胚解冻周期的结果表明,囊胚冻融胚胎临床妊娠率、流产率、活产率以及新生儿结局无明显差异,而≥12月组,新生儿体重及低出生体重儿比例增加。但受样本量限制,本结论需要更近一步的观察。一项包括337 431名参与者的北欧队列研究显示,冷冻ET导致的早产和低出生体重率明显低于新鲜ET,而巨大儿的产后发生率明显较高[15]。此外有多篇文献报告玻璃化冷冻胚胎移植后出生体重的增加,并推测这种增加与胚胎表观基因组的改变有关[16-18]。后来的一项队列研究表明,考虑到3年随访后的身体健康指数,冷冻和新鲜ET组之间没有差异[19]。故本研究仍需对长期保存胚胎种植后出生婴儿进一步跟踪研究。
比起程序冷冻法,玻璃化冷冻保存胚胎的复苏存活率、妊娠率、活产率明显提高,增加了胚胎累计妊娠率,降低了多胎妊娠率,同时也成为PGT、预防OHSS 的重要手段。普遍认为玻璃化冷冻是安全、有效的技术。本研究结果表明,一定时间内,不同囊胚冷冻保存时间的存活率、妊娠率和新生儿结局无统计学差异,然而玻璃化冷冻采用的是高浓度保护剂,其是否具有胚胎毒性尚无定论,同时冷冻载体是否接触液氮、胚胎存储的环境等都应被综合考虑,冷冻胚胎应该尽早移植,以便改善玻璃化冻融胚胎的临床结局,保障后代的出生健康。
1 Trounson A,Mohr L.Human pregnancy following cryopreservation,thawing and transfer of an eight-cell embryo.Nature,1983,305:707-709.
2 Wong KM,van Wely M,Mol F,et al.Fresh versus frozen embryo transfers in assisted reproduction.Cochrane Database Syst Rev,2017,3:p.CD011184.
3 Zhu Q,Wang N,Wang B,et al.The risk of birth defects among children born after vitrified blastocyst transfers and those born after fresh and vitrified cleavage-stage embryo transfers.Arch Gynecol Obstet,2018,298:833-840.
4 Liebermann J.Chapter 11 Human embryo vitrification.Methods Mol Biol 2017,1568:141-159.
5 Edgar DH,Gook DA.A critical appraisal of cryopreservation(slow cooling versus vitrification) of human oocytes and embryos.Hum Reprod Update,2012,18:536-554.
6 Nagy ZP,Shapiro D,Chang C.Vitrification of the human embryo:a more efficient and safer in vitro fertilization treatment.Fertil Steril,2020,113:241-247.
7 Gosden R.Cryopreservation:a cold look at technology for fertility preservation.Fertil Steril,2011,96:264-268.
8 Gardner DK,Lane M,Stevens J,et al.Blastocyst score affects implantation and pregnancy outcome:towards a single blastocyst transfer.Fertil Steril,2000,73:1155-1158.
9 赵庆红,杨菁,尹太郎,等.玻璃化冻融胚胎保存时间对胚胎复苏结局的影响.生殖医学杂志,2011,20:257-260.
10 赵静,吴晓云,朱玉蓉,等.941例胚胎玻璃化冷冻保存不同时间复苏后临床结局分析.生殖医学杂志,2015,24:906-910.
11 Ueno S,Uchiyama K,Kuroda T,et al.Cryostorage duration does not affect pregnancy and neonatal outcomes:a retrospective single-centre cohort study of vitrified-warmed blastocysts.Reprod Biomed Online,2018,36:614-619.
12 Wirleitner B,Vanderzwalmen P,Bach M,et al.The time aspect in storing vitrified blastocysts:its impact on survival rate,implantation potential and babies born.Hum Reprod,2013,28:2950-2957.
13 唐永梅,韦立红,唐妮.玻璃化冷冻保存时间对冻融胚胎移植结局的影响.现代中西医结合杂志,2017,26:474-476.
14 Li J,Yin M,Wang B,et al.The effect of storage time after vitrification on pregnancy and neonatal outcomes among 24 698 patients following the first embryo transfer cycles.Hum Reprod,2020,35:1675-1684.
15 Wennerholm UB,Henningsen AK,Romundstad LB,et al.Perinatal outcomes of children born after frozen-thawed embryo transfer:a Nordic cohort study from the CoNARTaS group.Hum Reprod,2013,28:2545-2553.
16 Wikland M,Hardarson T,Hillensjo T,et al.Obstetric outcomes after transfer of vitrified blastocysts.Hum Reprod,2010,25:1699-1707.
17 Litzky JF,Boulet SL,Esfandiari N,et al.Effect of frozen/thawed embryo transfer on birthweight,macrosomia,and low birthweight rates in US singleton infants.Am J Obstet Gynecol,2018,218:431-433.
18 Ginstrom EE,Wennerholm UB,Khatibi A,et al.Neonatal and maternal outcome after frozen embryo transfer:Increased risks in programmed cycles.Am J Obstet Gynecol,2019,221:121-126.
19 Pelkonen S,Gissler M,Koivurova S,et al.Physical health of singleton children born after frozen embryo transfer using slow freezing:a 3-year follow-up study.Hum Reprod,2015,30:2411-2418.