神经管畸形(neural tube defects,NTDs)是一类出生缺陷,对中国出生人口素质造成巨大影响,NTDs主要包括无脑畸形、脊柱裂和脑膨出[1]。近年来,NTDs的发病机制受遗传基因严格的调控以及环境交互作用共同决定,神经管发育关键时期对孕妇体内生化代谢物质的变化极为敏感[2-3]。维生素A是胚胎发育过程中重要的成形素, 在体内的分布对胚胎发育具有重要调节作用。孕妇如果在孕期摄入较多的维生素A,或者摄入其衍生物维甲酸(retinoic acid,RA) ,那么当其体内代谢平衡被打破时可导致胚胎发育异常,可致一系列发育缺陷发生,包括NTDs的发生[4]。小鼠是用来研究NTDs发生机制的一种较为理想的模型,这是源于小鼠神经管的发育过程和人类十分相似。而如何构建小鼠的NTDs模型,目前已知的方法包括某种药剂干预、高糖、高温等[5],而RA干预是经典的有效的NTDs造模方式[6]。前期研究课题组发现,过量RA的致畸作用导致组蛋白单泛素化H2AK119ub修饰异常变化,进一步协同通过表观作用调控肢节发育基因Hox[7]。本研究对RA诱导的小鼠NTDs模型进行免疫印记实验,从而检测组蛋白泛素化H2BK120ub1的表达以及神经管发育基因Pax6、Nestin表达变化,从而探究RA导致NTDs的可能机制,进而为该病的防范提供可能。
对象与方法
一、研究对象
本研究对象为雄性和雌性的SPF级8~12周的C57BL/6小鼠,均从北京维通利华动物有限公司购入,体重为19~23 g。小鼠安置在动物房内,为单笼饲养,自由饮水、摄食,环境温度为(22±2)℃,湿度50%~60%,光照24 h完成一次昼夜交替。
二、方法
1.RA诱导NTDs胎鼠标本制备:SPF级C57BL/6小鼠单笼饲养,饲喂繁殖饲料以及常规自由饮食饮水。于20:00点将小鼠按雌雄比例2∶1进行合笼(交配),并于第2日早晨8:00检查阴栓,将12:00点定为孕0.5 d(E0.5),随机将孕鼠分成对照组及实验组。在孕7.5 d对怀孕小鼠采取RA 25 mg/kg灌胃处理,并将其作为实验组,对照组则给予同等剂量香油灌胃,孕鼠E9.5、E10.5脱颈处死,解剖出子宫,放置在PBS皿中,仔细分离出胚胎,每组各8只,并保证胚胎完整。观察对照组及实验组小鼠胚胎以及神经管发育,拍照记录。E10.5 d小鼠分离出脑泡及脊髓组织分别混样,将样品均分为三管,即实验组和对照组各三管样品,液氮保存进行后续相关实验[7]。
2. 维生素A、维甲酸浓度测定:标本准备采用PBS反复冻融法,将小鼠组织从-80 ℃冰箱取出,称取组织重量,将配好的1×PBS溶液(1 mL)加入组织(100 mg)中,充分匀浆后放置-20℃冰箱过夜。第2天取出组织,放室温1 h,使组织充分融化后,再次放置-20℃过夜。第3天取出组织,放室温1 h,待充分融化后,4℃,5 000 g离心5 min,取上清。用样本稀释剂将标本稀释100倍;维生素A的样本浓度测定按照武汉华美Human Vitamin A,VA ELISA Kit(CSB-E07889h)操作步骤进行[8]。维甲酸的样本浓度测定按照武汉华美Human Retinoic Acid ELISA Kit(CSB-E16712h)操作步骤进行[9]。最后应用多功能酶标仪(波长设置450nm) 测定每孔光密度,波长设置450 nm,将所测浓度用Curve Expert软件绘制成标准曲线。
3. 组蛋白提取:称量样品,用手术刀或剪刀将样品切成小块(1~2 mm3),将组织块转移到Dounce均质器中;用蒸馏水以1∶10的比例将10×的预裂解缓冲液稀释到1×的预裂解缓冲液中(例如,1 mL的10×裂解前缓冲液+9 mL水);加入稀释后的1×裂解前缓冲液,每200 mg组织加入1 mL裂解前缓冲液,50~60 strokes以分解组织碎片;将裂解后混合物匀浆后,置于离心管(15 mL)中,离心5 min(4 ℃,3 000 rpm)。如果总混合液较少(<2 mL),则用EP管(2 mL)收集混合液,离心1 min(4℃,10 000 rpm)后弃上清。
4. Western blot检测:制备好的胚鼠脑、脊髓组织的组蛋白加样量为20 ug,用15%的SDS-PAGE 进行电泳,样品经分离电泳后,再用PVDF膜电转,电转结束后取出膜,5%脱脂牛奶封闭1 h后取模,将膜用H2BK120ub1(1:500)、H2B(1:500)一抗4 ℃孵育过夜;第二日上午取出膜,将其放入PBST溶液中,放置在摇床上洗膜3次,每次10 min。再将膜浸入孵育辣根过氧化物酶(HRP)标记的羊抗兔二抗中,室温放置1h,然后继续用 PBST洗膜3次,每次10 min。最后,化学发光试剂显影,全自动化学发光成像系统扫描,计算条带丰度、统计分析,生物学重复独立实验三次。
5. RT-PCR 检测:Trizol试剂分别提取胚鼠鼠脑、脊髓组织中总RNA,反转录 cDNA 试剂盒将 RNA逆转录为cDNA, 反应体系:4 μL的5×mix 缓冲液,1 μL的RNA酶抑制剂(20 U/μL),2 μL的10 mM dNTP Mix,1 μL的RevertAid M-MuLV RT(200 U/μL),以及1 μL的Oligo(dT)引物,1 μg的RNA,再加入去离子水补齐至20 μL,混匀瞬时离心;将PCR的反应条件设置为42 ℃,60 min;70 ℃,5 min。SybrGreen 染料进行反应,反应体系为:5 μL的PCR Mix 缓冲液(2×),各0.5 μL的正向引物(10 μmol/L)和反向引物(10 μmol/L),各2 μL的cDNA及去离子水,最后的总体积为10 μL;反应条件为:(94 ℃,5 min)×1 循环;(94 ℃,30 s;58 ℃,30 s;72 ℃,1 min)×35 循环;(72 ℃,10 min)×1 循环。进行反应扩增。 Pax6 正向引物:GCACTCGAGGCAACCAATGAGGGCATT,Pax6 反向引物:ACCAAGCTTGACAACCGGGTTCTACGCGAGGA;Nestin正向引物:GCAGAGAAGACAGTGAGGCAGATG,Nestin反向引物:GGAGGCAGGAGACTTCAGGTAGAG
6. ChIP 实验:加入270 μL的浓度为37%的甲醛(终浓度为1%),放置室温10 min,然后加入10×甘氨酸1 mL,室温放置5 min,停止交联后预冷的PBS洗涤沉淀3次,加入1mL的1×PBS+PIC(protease inhibitor cocktail),离心5 min(4 ℃,1 500 rpm);利用CST ChIP试剂盒加入1mL缓冲液B+DTT进行重悬;利用CST ChIP试剂盒中缓冲液C加入1 mL将细胞进行重悬,4 ℃,3 000 rpm,5 min离心,弃上清液;加入3 μL的Micrococcal Nuclease,将其充分颠倒混匀,放置37 ℃孵育20 min,从而把 DNA消化为200~500 bp的片段;加入0.5 M的EDTA 50 μL以终止反应,然后离心1 min(4℃,13 000 rpm),弃上清液;加入CST ChIP试剂盒中60 μL Solution D以重悬细胞,然后放在冰盒上静置10 min;在交联后的染色质样品中加入ChIP缓冲液400 μL(包含2 μL蛋白酶抑制剂),混匀后放在冰盒上;吸取样品10~20 μL作为2% Input,剩余样品中加入H2BK120ub1抗体,阴性对照组加入IgG,然后放在摇床上,4 ℃孵育过夜;第二天向样品中加入ChIP-Grade蛋白G琼脂糖微球,在4 ℃摇床上2 h,以富集免疫沉淀的DNA结合片段;解交联后对目的DNA进行纯化。
7.ChIP-qPCR:10 μL的EvaGreen Express 2X qPCR MasterMix-Low ROX, 各0.6 μL 的Forward Primer(10 μM)及 Rorward Primer(10 μM),2 μL的ChIP DNA 模板,6.8 μL的 Nuclease-free Water;机器的反应条件设置:95 ℃,30 s,1 cycle;95 ℃,5 s,40 cycles;60 ℃,30 s,40 cycles。Nestin-ChIP正向引物:GTGAGCCACCGCAGACCACC,Nestin-ChIP反向引物:TGGACCCCCGGACAAGCACA,Pax6-ChIP正向引物:ATGCCCCCAGCGCCACTCTA,Pax6-ChIP反向引物:TCAACCCGTCGGAGGCCCAT。
8. 统计学处理:利用SPSS 12.0分析软件进行Student′s t检验、单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
结 果
一、RA诱导C57BL/6小鼠NTDs模型的建立
结果显示,正常小鼠胚胎外观结构完整尾部细长弯曲,较为圆润饱满,神经管发育较好并且闭合完全(图1A)。相比对照组,NTDs组小鼠畸形胚胎体积较小伴有不同程度的发育迟缓, 以脑部畸形端脑、后脑发育形态异常为主要表现,主要表型为NTDs(图1B、图1C)。
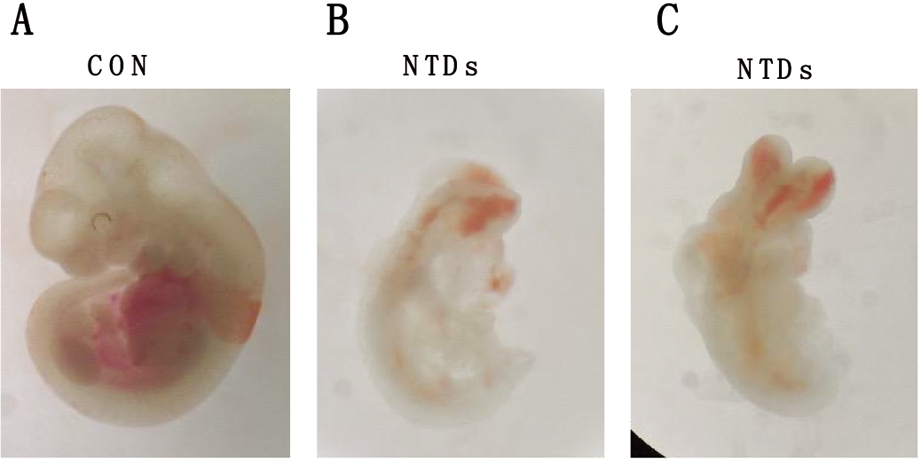
图1 RA诱导的C57BL/6小鼠NTDs模型
Figure 1 C57BL/6 mouse model of retinoic acid-induced neural tube defects
A:Normal Control E10.5 Mouse Embryos; B:RA-induced NTDs E10.5 mouse embryos(schizencephaly); C:RA-induced NTDs E10.5 mouse embryos(exencephalia)
二、RA诱导的NTDs胎鼠,维生素A和维甲酸表达变化
用ELLISA方法检测E10.5d的正常对照和NTDs小鼠脑和脊髓组织中维甲酸和维生素A的浓度。结果显示,脑和脊髓组织中,维甲酸浓度分别为:(12.96±0.09)vs.(40.53±1.18),(17.23±0.91)vs.(33.89±5.41),见图2A,维甲酸浓度显著升高有统计学差异(P<0.05)。维生素A分别为:(14.07±0.27)vs.(24.13±1.14),(11.53±0.07)vs.(30.73±2.29),见图2B,维生素A浓度显著升高有统计学差异(P<0.05)。
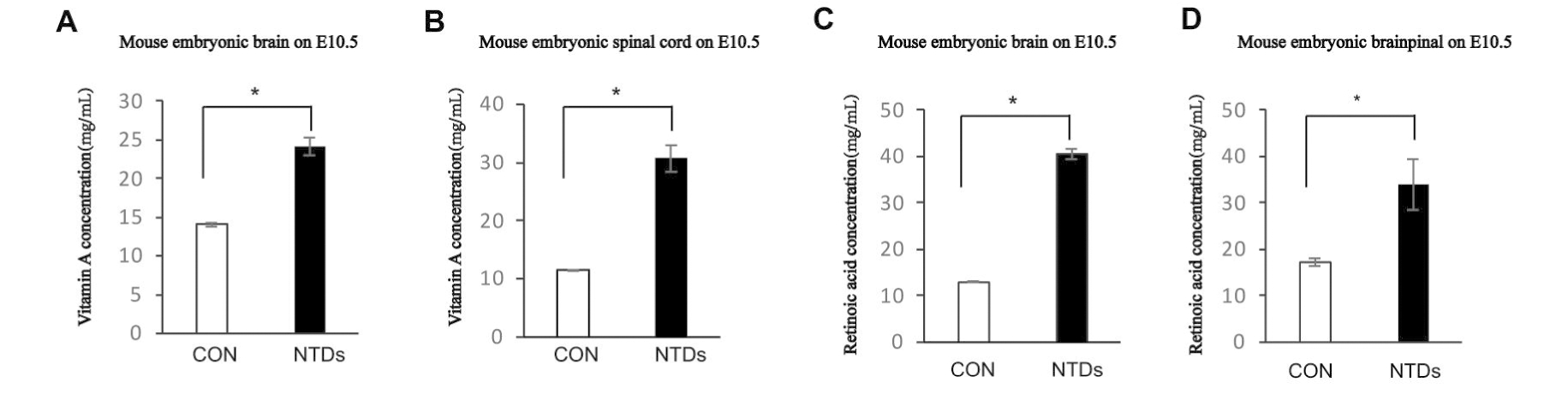
图2 RA诱导E10.5 NTDs小鼠维生素A和维甲酸表达变化
Figuer 2 Expression of Vitamin A and retinoic acid in C57BL/6 mouse of retinoic acid-induced neural tube defects, E10.5
A:Vitamin A in brain; B:Vitamin A in spinal cord; C:retinoic acid in brain; D:retinoic acid in spinal cord Data aremean±SD.(n=3), *P<0.05
三、RA诱导NTDs小鼠胚脑、脊髓组织,H2BK120ub1蛋白水平表达变化
对E10.5的NTDs小鼠胚胎解剖,取脊髓组织和脑组织,行免疫印迹实验,结果显示:NTDs组小鼠胚胎相较于阴性对照组的小鼠胚胎,其脊髓和脑中H2BK120ub1表达均显著升高(P<0.05),进行生物学重复独立实验三次(n=3),认为有统计学差异,见图3A、图3B。
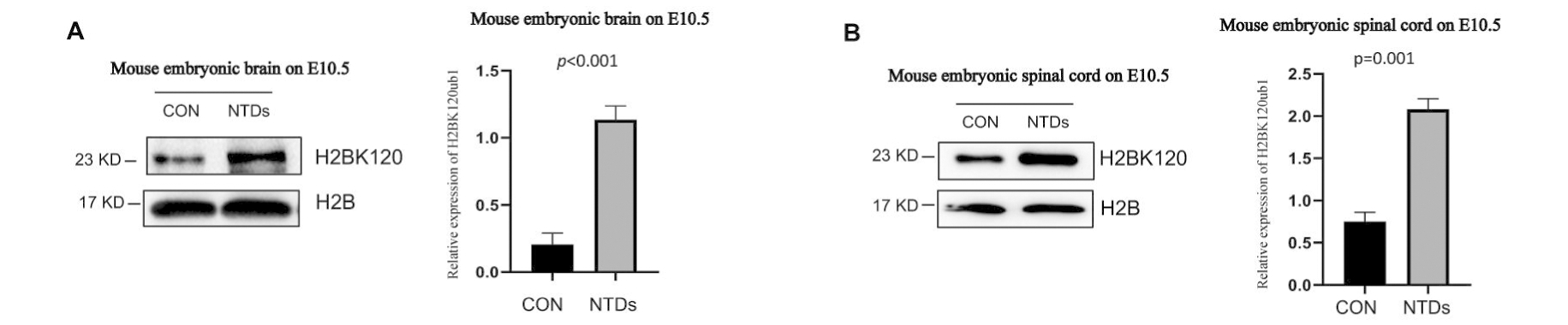
图3 RA诱导E10.5的NTDs小鼠H2BK120ub1蛋白表达
Figure 3 Expression of H2BK120ub1 protein in C57BL/6 mouse of retinoic acid-induced neural tube defects, E10.5
A:H2BK120ub1 protein in brain; B:H2BK120ub1 protein in brain by control and NTDs; C:H2BK120ub1 protein in spinal cord; D:H2BK120ub1 protein in spinal cord by control and NTDs Data aremean±SD.(n=3)
四、RA诱导的NTDs胚脑、脊髓组织,神经管发育基因表达变化
利用RA干预的E10.5小鼠NTDs模型验证分化基因在异常生理状态下的变化。小鼠胚胎脑和脊髓组织qPCR结果示:神经管发育基因Pax6、Nestin的mRNA水平明显升高(P<0.05),进行生物学重复独立实验三次(n=3),有统计学差异 ,见图4A、图4B。
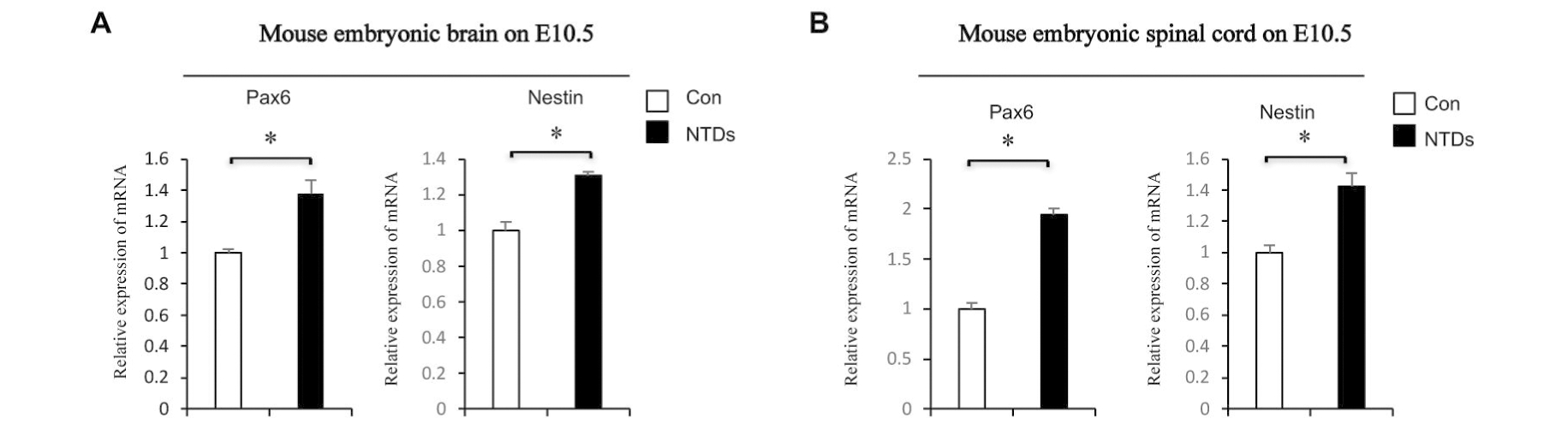
图4 RA诱导E10.5的NTDs小鼠,Pax6、Nestin mRNA表达变化
Figure 4 Expression of Pax6、Nestin mRNA in C57BL/6 mouse of retinoic acid-induced neural tube defects, E10.5
A:Pax6 and Nestin mRNA in brain; B:Pax6 and Nestin mRNA in spinal cord; Data aremean±SD.(n=3), *P<0.05
五、RA诱导的NTDs胚脑、脊髓组织,神经管发育基因与H2BK120ub结合变化
ChIP -qPCR 结果显示,RA诱导的NTDs胚脑、脊髓组织H2BK120ub1与Pax6、Nestin基因启动子区域的结合能力增强,Normal Rabbit IgG 抗体做阴性对照,进行生物学重复独立实验三次(n=3),有统计学差异(P<0.05),见图5A、图5B。

图5 RA诱导E10.5的NTDs小鼠,H2BK120ub1蛋白和Pax6、Nestin基因启动子区域结合的变化
Figure 5 The enrichment of H2BK120ub1on the promoter ofPax6、Nestin in in RA induced of C57BL/6 mouse
A:H2BK120ub1 protein, Pax6 and Nestin mRNA in brain; B:H2BK120ub1 protein, Pax6 and Nestin mRNA in spinal cord Data aremean±SD.(n=3), *P<0.05
讨 论
NTDs主要是由于胚胎受精后3~4周时神经管闭合不完全导致的。NTDs由遗传、外环境共同作用造成[7]。孕期叶酸缺乏、高糖高热、酒精及药物致畸均可引起NTDs[1]。外环境因素可以通过表观遗传调控机制影响NTDs的易感性[7]。然而其具体机制未阐明。因此,研究 NTDs发生的表观遗传机制有重要意义。组蛋白泛素化修饰作为常见的表观遗传修饰方法,对基因转录、染色质重塑有关键作用[7]。
RA参与神经细胞增殖分化,在视力、器官生成方面有调控作用。在发育过程中,RA剂量紊乱能导致严重畸形,如NTDs[10-11]。本研究发现RA诱导NTDs胎鼠的脑和脊髓组织中,维生素A和维甲酸浓度显著升高,提示胚胎期过量RA注射会引起脑、脊髓等重要器官维生素A、维甲酸过量表达,导致NTDs。
组蛋白H2AK119、H2BK120是常见单泛素化位点,这种修饰会作为染色质状态的信号存在。前期研究发现,RA诱导NTDs小鼠模型中,胚胎脑组织组蛋白H2AK119ub泛素化水平下调,会调控 Hox基因表达[7]。在本研究中,Western blot显示:RA诱导NTDs小鼠模型中,其脑组织H2AK120ub1水平显著上调。同时,RA会引起组蛋白甲基化H3K27me3,H3K4me3、组蛋白乙酰化H3K27ac水平发生改变[12]。研究发现,RA可结合核受体复合物,促使组蛋白N端尾部产生共价修饰,从而激活转录复合物[13]、促进细胞分化,进而发挥表观遗传修饰作用。
表观遗传调控,特别是组蛋白修饰调控,是干细胞研究领域焦点。表观遗传能调节多能干细胞的自我更新和多向分化之间的平衡[14]。多潜能的原始外胚层细胞通过一系列发育调控因子进一步发育分化为神经干细胞,如原始外胚层细胞分化基因Cdx2、中胚层分化基因Nestin、Pax6[15]。早期胚胎发育信号通路调控受上述胚层分化基因调控,保证胚胎组织精细化形成,包括神经管的发生和闭合[16]。其中Pax6、Nestin基因是神经管发育相关基因[17]。既往研究发现,RA诱导人畸胎瘤细胞NT2细胞系中,Nestin、Pax6被显著激活[18],本研究中RA诱导小鼠NTDs模型,其脑和脊髓组织的分化基因显著上调,进一步验证RA诱导对于胚层分化基因的影响。研究显示H2BK120ub1在胚胎干细胞的分化中发挥关键作用[15]。前期研究人员利用ChIP等方法,发现小鼠胚胎干细胞分化到E7时,H2BK120ub1与Nestin、Pax6结合显著增强,Nestin、Pax6 mRNA水平增高[15]。本研究发现,RA诱导NTDs小鼠胚脑,H2BK120ub1与Nestin、 Pax6结合显著增强,Nestin、 Pax6表达增高,这和小鼠胚胎干细胞的实验结果一致。Pax基因是否突变与神经管闭合相关信号通路有密切关联[19],研究发现该基因存在纯合突变时,鼠胚会存在严重脑畸形,而该基因发生杂合突变时,小鼠脑异常会显著减轻。Nestin基因对于早期神经管发育发挥重要作用,敲除小鼠在胚胎E10.5死亡,神经管发育受阻。神经胚形成时,在E7.5,Nestin基因开始广泛高表达;当神经细胞迁移基本完成后, Nestin基因的表达量呈减少状态;当神经细胞迁移完成,E10.5时在头尾部分神经管区域表达,随着停止细胞分裂,Nestin基因表达量降到最低[20-21]。因此,可用Nestin鉴定神经干细胞以及用作早期原始神经细胞标志分子[22]。选择RA诱导E10.5小鼠NTDs胚脑、脊髓组织,Nestin基因的异常增高可能与RA导致H2BK120ub1的转录活化水平增强有关,可能是导致NTDs发生的原因之一。
综上所述,RA诱导的NTDs小鼠模型,脑、脊髓组织组蛋白单泛素化H2BK120蛋白表达水平增加,导致神经管发育基因Nestin、Pax6异常激活可能是引起NTDs发生的原因之一。
1 Greene ND,Copp AJ.Neural tube defects.Annu Rev Neurosci,2014,37:221-242.
2 van Gool JD,Hirche H,Lax H,et al.Folic acid and primary prevention of neural tube defects:A review.Reprod Toxicol,2018,80:73-84.
3 Dong N,Gu H,Liu D,et al.Complement factors and alpha-fetoprotein as biomarkers for noninvasive prenatal diagnosis of neural tube defects.Ann N Y Acad Sci,2020,1478:75-91.
4 Sahin Inan ZD,Unver Saraydin S.Immunohistochemical profile of CD markers in experimental neural tube defect.Biotech Histochem,2019,94:617-627.
5 Rhinn M,Dollé P.Retinoic acid signalling during development.Development,2012,139:843-858.
6 Yu J,Wang L,Pei P,et al.Reduced H3K27me3 leads to abnormal Hox gene expression in neural tube defects.Epigenet Chromatin,2019,12:76.
7 Lin Y,Yu J,Wu J,et al.Abnormal level of CUL4B-mediated histone H2A ubiquitination causes disruptive HOX gene expression.Epigenet Chromatin,2019,12:22.
8 Makwe CC,Soibi-Harry AP,Rimi GS,et al.Micronutrient and trace element levels in serum of women with uterine fibroids in lagos.Cureus,2021,13:1-8.
9 Wu H,Zhao D,Wang C,et al.All-trans retinoic acid prevents the progression of gastric precancerous lesions by regulating disordered retinoic acid metabolism.Nutrition and Cancer,2022:1-12.
10 Swann-Thomsen HE,Mendez-Gallardo V,Kollmeyer LR,et al.A preliminary investigation of high retinoic acid exposure during fetal development on behavioral competency and litter characteristics in newborn rats.Brain Behav,2021,e2253.
11 Ca ete A,Cano E,Mu
ete A,Cano E,Mu oz-Chápuli R,et al.Role of vitamin A/retinoic acid in regulation of embryonic and adult hematopoiesis.Nutrients,2017,9:159.
oz-Chápuli R,et al.Role of vitamin A/retinoic acid in regulation of embryonic and adult hematopoiesis.Nutrients,2017,9:159.
12 Kashyap V,Gudas LJ,Brenet F,et al.Epigenomic reorganization of the clustered Hox genes in embryonic stem cells induced by retinoic acid.J Biol Chem,2011,286:3250-3260.
13 Shahhoseini M,Taghizadeh Z,Hatami M,et al.Retinoic acid dependent histone 3 demethylation of the clustered HOX genes during neural differentiation of human embryonic stem cells.Biochem Cell Biol,2013,91:116-122.
14 Gan Q,Yoshida T,McDonald OG,et al.Concise review:epigenetic mechanisms contribute to pluripotency and cell lineage determination of embryonic stem cells.Stem Cells,2007,25:2-9.
15 Chen S,Li J,Wang DL,et al.Histone H2B lysine 120 monoubiquitination is required for embryonic stem cell differentiation.Cell Res,2012,22:1402-1405.
16 Copp AJ,Greene ND.Neural tube defects-disorders of neurulation and related embryonic processes.Wiley Interdiscip Rev Dev Biol,2013,2:213-227.
17 Desai D,Khanna A,Pethe P.PRC1 catalytic unit RING1B regulates early neural differentiation of human pluripotent stem cells.Exp Cell Res,2020,396:112294.
18 Park D,Xiang AP,Mao FF,et al.Nestin is required for the proper self-renewal of neural stem cells.Stem Cells,2010,28:2162-2171.
19 Sanders K,Jung JH,Loeken MR.Use of a murine embryonic stem cell line that is sensitive to high glucose environment to model neural tube development in diabetic pregnancy.Birth Defects Res A Clin Mol Teratol,2014,100:584-591.
20 Turner CG,Klein JD,Wang J,et al.The amniotic fluid as a source of neural stem cells in the setting of experimental neural tube defects.Stem Cells Dev,2013,22:548-553.
21 Wojcinski A,Lawton AK,Bayin NS,et al.Cerebellar granule cell replenishment postinjury by adaptive reprogramming of Nestin+ progenitors.Nat Neurosci,2017,20:1361-1370.
22 Hu Z,Tao L,Liu Z,et al.Identification of neural stem cells from postnatal mouse auditory cortex in vitro.Stem Cells Dev,2019,28:860-870.