在辅助生殖技术(assisted reproductive technology,ART)临床治疗中,精子的冷冻保存技术推动了供精的使用,供精(donor sperm,DS)来源的体外授精胚胎移植技术(in vitro fertilization and embryo transfer,IVF-ET)给男性不可逆的男方无精子、不宜生育的严重遗传性疾病等类型的患者带来了福音。随着ART技术的发展,供精的使用越发广泛,但是使用供精后的随访和围产期结局的信息仍然有限,本研究回顾性分析本中心采用长方案促排卵行供精及夫精来源的IVF-ET助孕患者的周期临床资料,旨在探讨精子冷冻保存对辅助生殖临床结局的可能影响,为临床供精使用提供理论参考。
对象与方法
1. 研究对象
收集2016年至2019年间在本中心行供精及夫精来源的IVF助孕治疗患者的临床资料。纳入标准:(1)长方案促排卵;(2)行IVF-ET助孕治疗:女方因输卵管因素导致的配子运输障碍;(3)行第3天新鲜双胚胎移植;(4)供精IVF的入组条件:使用供精且满足条件(1)(2)(3);排除标准:(1)患有严重子宫内膜异位症;(2)患有子宫腺肌症;(3)子宫畸形或多发子宫息肉。由于供精组和夫精组病例数相差悬殊,因此选用了个案匹配的方法,将供精组的病例在夫精组中进行匹配,本研究共纳入240个周期,根据精子来源分成2组:供精组(n=129);夫精组(n=111)。
2.研究方法
(1)体外授精与胚胎移植
夫精,取卵当日男方采集精液,在室温下液化30 min后,密度梯度离心后上游;供精,取卵当日解冻对应供精,供精从液氮中取出后于37℃复温10 min,密度梯度离心后上游。在卵丘卵母细胞复合体取出2~3 h IVF,4~6 h后去除颗粒细胞。通过观察取卵当日第二极体的形成和取卵16~17 h原核的形成判断受精,取卵后48 h后观察是否卵裂,72 h后,选择高质量的胚胎进行移植或冷冻。
(2)黄体支持及妊娠与否的判定
常规阴道给药补充黄体酮(雪诺同,默克雪兰诺,瑞士)60 mg/d至胚胎移植后10周;胚胎移植后4周B超检查见孕囊及原始心管搏动者视为临床妊娠。
(3)观察指标
受精率=受精数/MⅡ卵×100%;卵裂率=卵裂数/受精数×100%;可利用胚胎率=可利用胚胎数/MⅡ卵数×100%;临床妊娠率=临床妊娠周期数/移植周期数×100%;流产率=流产周期数/临床妊娠周期数×100%;活产率=活产周期数/移植周期数×100%;妊娠合并症发生率=妊娠合并症发生周期数/临床妊娠周期数×100%;正常孕周:≥37周;低出生体重:<2 500 g;极低出生体重:<1 500 g;高出生体重:> 4 000 g。
3.统计学方法:应用统计软件SPSS 25.0进行统计分析。计量资料采用![]() 表示,组间比较采用单因素方差分析;P<0.05为差异有统计学意义。
表示,组间比较采用单因素方差分析;P<0.05为差异有统计学意义。
结果
1.两组患者的一般资料:两组患者基本资料比较中,女方年龄、女方BMI差异无统计学意义,获卵数和移植日内膜厚度供精组均大于IVF组,组间差异均无统计学意义(P>0.05)(表1)。
表1 各组患者的基本情况比较![]()

组 别例数女方年龄女方BMI(kg/m2)获卵数移植日内膜厚度(mm)IVF组11128.50±3.1322.90±3.1010.65±3.4712.07±2.07IVF-DS组12928.16±3.2422.94±3.2810.98±3.6412.41±2.84
2.两组患者的受精及胚胎发育情况:两组患者的卵裂率、可利用胚胎率比较,差异均无统计学意义(P>0.05)(表2),但是供精组受精率为86.7%,低于IVF组(91.1% ),差异有统计学意义。
表2 各组患者受精及胚胎发育情况比较 ,例(%)

注:IVF组和IVF-DS组比较,*P<0.05
组别例数MⅡ卵数受精卵子数受精率%*卵裂可利用胚胎IVF组1111 1431 04191.081 013(97.3)565(49.4)IVF-DS组1291 2011 04186.681 025(98.5)603(50.2)
3.两组患者临床结局比较:供精组临床妊娠率、活产率、流产率均低于IVF组,差异无统计学意义;妊娠合并症发生率为5.0%,高于IVF组(4.6%),差异无统计学意义,供精的使用并未影响患者的临床妊娠、活产、流产和妊娠合并症的发生(表3)。
表3 两组患者妊娠结局比较,例(%)
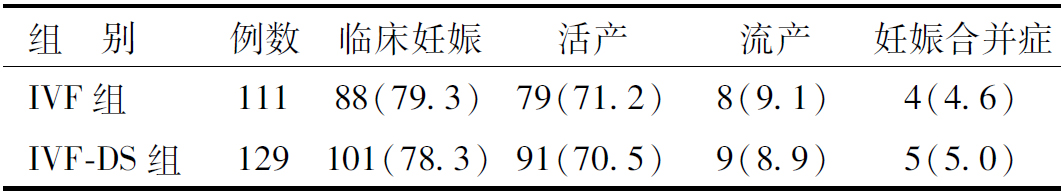
组 别例数临床妊娠活产流产妊娠合并症IVF组11188(79.3)79(71.2)8(9.1)4(4.6)IVF-DS组129101(78.3)91(70.5)9(8.9)5(5.0)
4.两组患者围产期结局结局比较:比较两组患者的单胎妊娠的围产期结局,IVF组共有111例患者入组,其中单胎妊娠48例,平均孕周为38.4±1.7周,IVF-DS组共有129例患者入组,其中单胎妊娠51例,平均孕周为38.8±1.2周,差异无统计学意义,此外两组患者的正常孕周、早产孕周、正常出生体重比率无统计学差异,低出生体重比率、极低出生体重比率、高出生体重比率在两组患者中均无统计学差异。
表4 两组患者围产期结局比较,例(%)

组别例数单胎妊娠例数孕周(周数)正常孕周(≥37周)早产(<37周)极早产(<32周)平均出生体重(g)正常出生体重(2 500~4 000 g)低出生体重(<2 500 g) 极低出生体重(<1 500 g)高出生体重(>4 000 g)IVF组1114838.4±1.747(97.9)1(2.1)03 289.5±480.344(91.7)2(4.2)02(4.2)IVF-DS组1295138.8±1.249(96.1)2(3.9)03 375.5±421.645(88.2)1(2.0)05(9.8)
讨论
在ART临床治疗中,精子冷冻保存技术已被广泛应用,为治疗某些类型的男性不育症提供了巨大的潜力。1953年,Bunge首次报道了使用储存在干冰中的冷冻精子成功活产[1]。1963年,液氮被引入作为一种长期冷冻保存精子的方法,这使得精子冷冻保存技术在辅助生殖领域迅猛发展,即使经过40多年的低温保存,精子仍然可以成功地用于生育治疗[2-4]。但是在精子的冷冻保存可能会导致精子膜脂质组成和顶体状态的改变,以及精子活率和活力的降低[5]。此外在生理的的生殖过程中来自父方的精子会被母方的免疫系统识别为外来抗原,因此成功的胚胎植入和妊娠需从改变母体的免疫反应开始[6]。如果母方对来自父方的抗原免疫耐受不足则可能植入失败、胎盘发育障碍,导致不良的妊娠结局如先兆子痫、早产、自然流产和低体重儿的出生[6-9]。人工授精和供卵周期会显著增加子痫前期和早产的风险,这可能与孕妇之前没有接触过捐赠者抗原有关[10-12]。
近年来,随着ART的发展,使用供精进行生育治疗的需求逐渐增加[13-15]。供精治疗不孕不育被广泛应用,对男性不可逆的无精子,不宜生育的严重遗传性疾病等类型的患者意义重大,但目前关于供精随访信息仍然有限,供精使用的安全性成为人们关注的重点。供精在捐赠者采集后需要进行冷冻保存,但精子冷冻保存中产生的热冲击、渗透压变化、冰晶、DNA片段和活性氧等,降低了精子质量[16-18]。同时一些与精子质量相关的蛋白丢失可能是精子冷冻保存中生育力下降的原因,例如热休克蛋白90和Enolase1(ENO1)[19]。Fu等利用蛋白质组学技术发现精子冷冻保存后在蛋白质水平发生了大量的改变[20]。Nusbaume发现在鱼类中冷冻精子虽然不影响受精率,但是会影响子代的生长,使得后代生长发育缓慢[21]。Schachter等报道在隐睾症的情况下,冻融的射精精子的受精率低于新鲜的射精精子;然而,在非阻塞性无精子症中,新鲜和冻融的睾丸精子之间没有发现差异[22]。Karacan等也认为在无精子症患者中使用新鲜或冻融的睾丸精子都不会影响ICSI-ET周期的结果[23]。我们的研究显示供精组的受精率偏低。
Porreco等研究表明,使用供精会增加子痫前期的风险,对这一发现的解释是,在供精辅助技术过程中母体只接触供者处理过的精子,因而母方的免疫系统适应父方遗传物质的机会非常有限,子痫前期的免疫学理论提出,母体免疫系统对供体精子的不适应导致了胎盘的异常发育和子痫前期的发生[24]。我们发现两组的妊娠并发症的发生率均无统计学意义。
有研究报告发现与具有同一伴侣生育的女性相比,在两次生育之间有不同伴侣的女性患早产(preterm birth,PTB)和低出生体重(low birthweight,LBW)的风险更高[25]。然而,其他研究表明,改变伴侣不会增加PTB和LBW的风险,也有研究认为会降低早期PTB的风险[26-27]。因此,使用供精的ART是否与较高的不良围产期结局风险有关有待继续研究。Kamath等报道夫精与供精IVF/ICSI相比,供精来源的婴儿高出生体重风险更高,低出生体重儿的风险降低[28]。本研究结果提示与使用伴侣精子相比,在新鲜IVF-ET周期中使用捐赠精子与流产、早产或异常出生体重无关。
综上所述,本研究结果表明在IVF-ET鲜胚移植周期中,供精的使用虽然会影响受精率,但对其他指标无影响,是解决不可逆的男方无精子,男方因素不宜生育的严重遗传性疾病等类型的患者生育问题的有效办法。这一信息可用于患者咨询,以消除ART周期中使用捐献精子的患者的疑虑。但鉴于本研究围产期随访数据有限,使用供精对孕产妇及子代健康的影响还需要进行更多的后续研究。同时供精面临着特殊的伦理和社会问题,在临床实践中要严格掌握好供精的适应症,严格按照国家规定开展使用。
1 Bunge RG,Sherman JK.Fertilizing capacity of frozen human spermatozoa.Nature,1953,172:767-768.
2 Perloff WH,Steinberger E,Sherman JK.Conception with human spermatozoa frozen by nitrogen vapor technic.Fertil Steril,1964,15:501-504.
3 Sherman JK.Improved methods of preservation of human spermatozoa by freezing and freeze-drying.Fertil Steril,1963,14:49-64.
4 Szell AZ,Bierbaum RC,Hazelrigg WB,et al.Live births from frozen human semen stored for 40 years.J.Assist Reprod Genet,2013,30:743-744.
5 Le MT,Nguyen TTT,Nguyen TT,et al.Does conventional freezing affect sperm DNA fragmentation.Clin Exp Reprod Med,2019,46:67-75.
6 Tafuri A,Alferink J,Moller P,et al.T cell awareness of paternal alloantigens during pregnancy.Science,1995,270:630-633.
7 Li X,Zhou J,Fang M,et al.Pregnancy immune tolerance at the maternal-fetal interface.Int Rev Immunol,2020,39:247-263.
8 Chighizola CB,Lonati PA,Trespidi L,et al.The complement system in the pathophysiology of pregnancy and in systemic autoimmune rheumatic diseases during pregnancy.Front Immunol,2020,11:2084.
9 Burton GJ,Jauniaux E.Pathophysiology of placental-derived fetal growth restriction.Am J Obstet Gynecol,2018,218(2S):S745-S761.
10 Robertson SA.Seminal plasma and male factor signalling in the female reproductive tract.Cell Tissue Res 2005,322:43-52.
11 Schjenken JE,Robertson SA.The female response to seminal fluid.Physiol Rev,2020,100:1077-1117.
12 Levron Y,Dviri M,Segol I,et al.The ‘immunologic theory’ of preeclampsia revisited:a lesson from donor oocyte gestations.Am J Obstet Gynecol,2014,211:383.e1-5.
13 Fang YY,Wu QJ,Zhang TN,et al.Assessment of the development of assisted reproductive technology in Liaoning province of China,from 2012 to 2016. BMC Health Serv Res,2018,1:873.
14 Gerkowicz SA,Crawford SB,Hipp HS,et al.Assisted reproductive technology with donor sperm:national trends and perinatal outcomes.Am J Obstet Gynecol,2018,4:421.e1-421.e10.
15 Allen CP,Marconi N,McLernon DJ,et al.Outcomes of pregnancies using donor sperm compared with those using partner sperm:systematic review and meta-analysis.Hum Reprod Update,2021,27:190-211.
16 Zandiyeh S,Shahverdi A,Ebrahimi B,et al.A novel approach for human sperm cryopreservation with AFPIII.Reprod Biol,2020,20:169-174.
17 Raad G,Lteif L,Lahoud R,et al.Cryopreservation media differentially affect sperm motility,morphology and DNA integrity.Andrology,2018,6:836-45.
18 Gomez-Torres MJ,Medrano L,Romero A,et al.Effectiveness of human spermatozoa biomarkers as indicators of structural damage during cryopreservation.Cryobiology,2017,78:90-94.
19 Cao WL,Wang YX,Xiang ZQ,et al.Cryopreservation-induced decrease in heat-shock protein 90 in human spermatozoa and its mechanism.Asian J Androl,2003,5:43-46.
20 Fu L,An Q,Zhang K,et al.Quantitative proteomic characterization of human sperm cryopreservation:using data-independent acquisition mass spectrometry.BMC Urol,2019,16,19:133.
21 Nusbaumer D,Marques da Cunha L,Wedekind C.Sperm cryopreservation reduces offspring growth.Proc Biol Sci,2019,25,286:20191644.
22 Schachter-Safrai N,Karavani G,Levitas E,et al.Does cryopreservation of sperm affect fertilization in nonobstructive azoospermia or cryptozoospermia?Fertil Steril,2017,107:1148-1152.
23 Karacan M,Alwaeely F,Erkan S,et al.Outcome of intracytoplasmic sperm injection cycles with fresh testicular spermatozoa obtained on the day of or the day before oocyte collection and with cryopreserved testicular sperm in patients with azoospermia.Fertil Steril,2013,100:975-980.
24 Porreco RP,Heyborne KD.Immunogenesis of preeclampsia:lessons from donor gametes.J Matern Fetal Neonatal Med,2018,31:1220-1226.
25 Zhang J,Patel G.Partner change and perinatal outcomes:a systematic review.Paediatr Perinat,Epidemiol,2007,21:46-57.
26 Basso O,Christensen K,Olsen J.Higher risk of pre-eclampsia after change of partner.An effect of longer interpregnancy intervals? Epidemiology,1999,12:624-629.
27 Li DK.Changing paternity and the risk of preterm delivery in the subsequent pregnancy.Epidemiology,1999,10:148-152.
28 Kamath MS,Antonisamy B,Selliah HY,et al.Perinatal outcomes following IVF with use of donor versus partner sperm.Reprod Biomed Online,2018,36:705-710.