WFIKKN2(WAP,Kazal,Immunoglobulin,Kunitz and NTR Domain-Containing Protein 2)蛋白是在血清中发现的一种新的转化生长因子-β(transforming growth factor-β,TGF-β)家族因子的胞外结合蛋白,也称为血清生长分化因子相关蛋白(growth and differentiation factor-associated serum protein 1,GASP1),目前已知与之特异性结合的TGF-β家族成员为:肌肉生长抑制素[myostatin,MSTN,也称为生长分化因子8(growth and differentiation factor 8,GDF8)]、生长分化因子11(growth and differentiation factor 11,GDF11)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)、骨形成蛋白4(bone morphogenetic protein 4,BMP4)。WFIKKN2与TGF-β家族成员协同发挥功能,二者密不可分。本文检索了2021年2月份以前PubMed数据库中所有带有以下关键词的英文文献:①WFIKKN2;②TGF-β家族;③雄性生殖细胞;④雌性生殖细胞,就WFIKKN2及以其为分子伴侣的TGF-β家族因子在生殖细胞发生调控机制等方面的研究进展综述。
一、WFIKKN2分子结构
WFIKKN2基因位于人类17号染色体长臂中,高表达于成人卵巢、睾丸、大脑和肌肉组织,小鼠同源基因位于11号染色体中,高表达于小鼠胸腺、大脑、卵巢和肌肉组织。WFIKKN2蛋白在人和小鼠的同源性为92.19%,属于整合蛋白家族成员,包含6个结构域:1个乳清酸性蛋白(whey acidic protein,WAP)结构域、1个卵泡抑素(follistatin,FST)结构域、1个免疫球蛋白C2型结构域(immunoglobulin C2 type domain,IgC2)、2个Kunitz(KU)结构域和1个Netrin(NTR)结构域。
二、WFIKKN2与TGF-β家族成员的结合机理
WFIKKN2作为TGF-β家族因子的胞外结合蛋白发挥作用。WFIKKN2通过FST结构域、KU结构域和/或NTR结构域与TGF-β家族MSTN、GDF11、TGF-β1、BMP2、BMP4 5个因子结合[1,2]。WFIKKN2对MSTN、GDF11生物活性起抑制作用:WFIKKN2与MSTN或GDF11成熟二聚体结合形成WFIKKN2-MSTN或WFIKKN2-GDF11复合物,这是SMAD信号通路的假性信号分子。WFIKKN2-MSTN复合物虽可以与Ⅱ型受体结合但阻断了Ⅰ型受体的募集与磷酸化,从而阻断了受体二聚化,使信号无法下传;而WFIKKN2-GDF11复合物直接阻断了GDF11与II型受体的相互作用。因此WFIKKN2阻断了下游的经典SMAD信号通路传导,而通过激活非经典(non-SMAD)途径调控核基因表达[1](图1)。WFIKKN2与TGF-β1、BMP2及BMP4结合后对他们的生物活性无抑制作用[3,4],其确切作用需要进一步研究揭示。
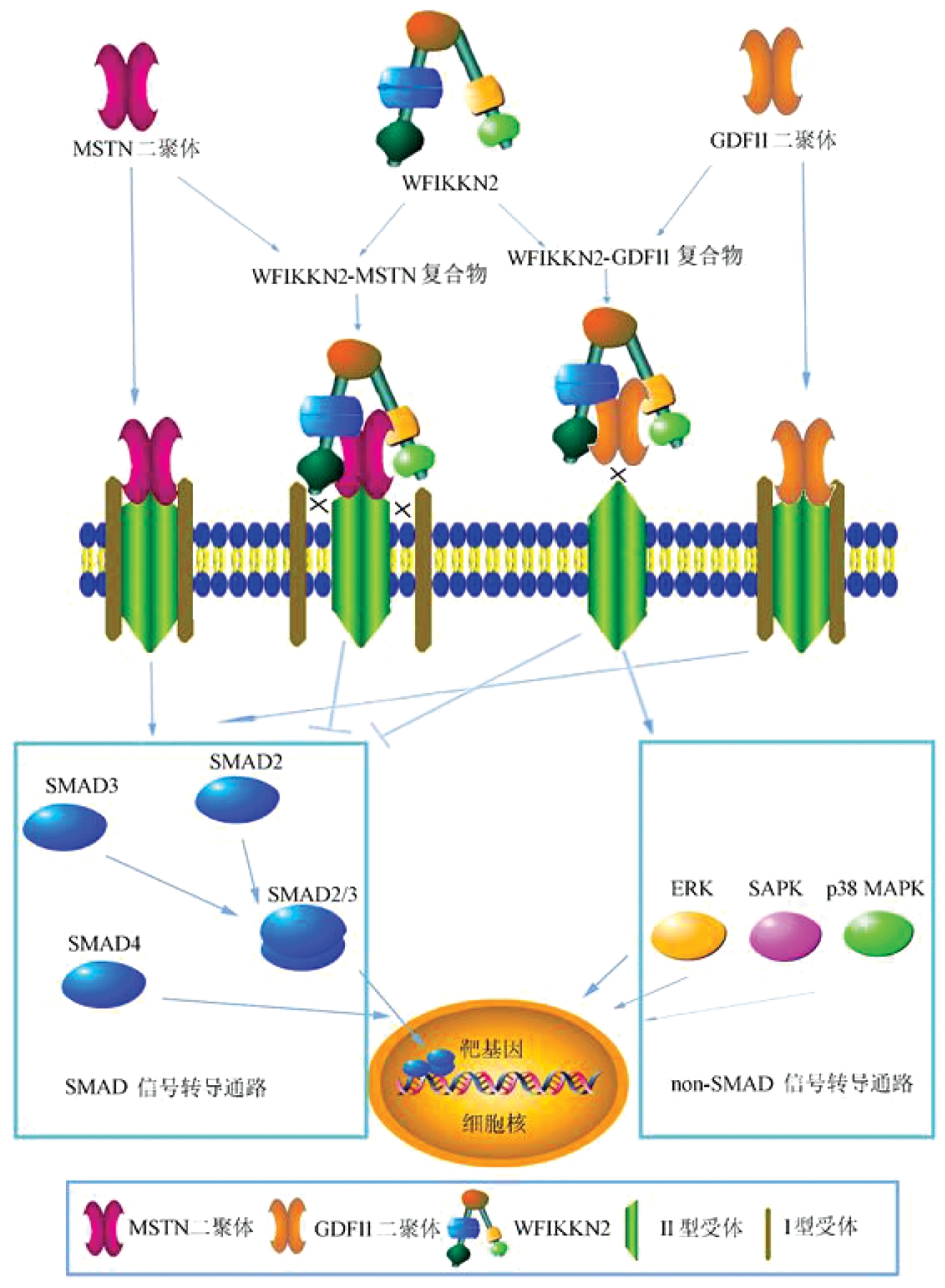
图1 WFIKKN2蛋白与TGF-β家族成员的结合
三、WFIKKN2-TGF-β家族成员在雌性生殖细胞发生与发育中的作用
WFIKKN2是近年来才被研究报道的一种新的TGF-β家族成员的胞外结合蛋白,高表达于人卵巢的原始卵泡阶段卵母细胞内,其在雌性生殖细胞的具体作用尚缺乏研究报道。然而受WFIKKN2调节的TGF-β家族因子BMP2、BMP4、MSTN、TGF-β1在雌性生殖细胞发生中的作用均已得到证实。
1.WFIKKN2-BMP2
BMP2促进胚胎内胎儿卵巢发育,BMP2在人妊娠8周~9周低表达,随妊娠进展增加而增加,其通过Wnt信号通路驱动原始生殖细胞(Primordial germ cell,PGC)向卵原细胞分化[5],促进胎儿卵巢产生。BMP2在成人卵巢中主要在人颗粒细胞中表达,以旁分泌/自分泌方式调节卵泡发育,在卵泡液中的表达水平与卵母细胞质量相关,临床将其列为卵母细胞质量及体外受精能力的预测因子[6]。BMP2具有与MSTN相似的调节激素生成的作用,它可增加卵泡刺激素(follicle-stimulating hormone,FSH)受体合成、促进雌二醇生成,且抑制黄体生成素(luteinizing hormone,LH)受体及甾体生成急性调节蛋白(steroidogenic acute regulatory protein,StAR)合成、抑制孕酮产生[7]。在黄体退化过程中,检测到BMP2基因在黄体颗粒细胞及黄体卵泡膜细胞表达升高,其也作为黄体溶解的调节因子[8]。BMP2还可促进卵泡体外发育,体外培养牛原始卵泡液中添加BMP2,初级卵泡比例增高,促进次级卵泡向窦卵泡发育,BMP2与FSH共同作用更有助于体外原始、次级卵泡培养[9]。
2.WFIKKN2-BMP4
BMP4调控胎儿卵巢与成人卵泡发育过程的作用均有报道。BMP4在人妊娠8周~9周表达最高,后随妊娠增加而降低[10],这种现象机制尚未明确,但已确定的是,在胎儿卵巢产生后,BMP4通过促进细胞凋亡调节胎儿卵巢中原始生殖细胞PGC数量[10]。研究还发现BMP4在成人卵巢间质细胞和卵泡膜前体细胞中表达,通过旁分泌/自分泌方式促进原始卵泡向初级卵泡发育[11]。而在啮齿类动物中,BMP4表达在卵巢所有细胞中,具有促进原始卵泡池激活的作用[12]。在卵泡发育晚期,BMP4抑制CX43基因表达,促进卵母细胞及周围丘颗粒细胞发育同步[13]。BMP4还通过SMAD信号通路促进透明质酸酶2(hyaluronan synthase 2,HAS2)、透明质酸及前列腺素E2合成,为卵泡排卵做好准备[3]。BMP4还参与黄体溶解与退化[8]。BMP4也具有调节激素合成的作用,它通过SMAD信号通路上调类固醇生成酶基因的表达,增加类固醇合成酶量,促进颗粒细胞雌激素合成,抑制颗粒细胞中StAR合成、降低孕酮产生,抑制卵泡膜细胞雄激素的合成[10]。
3.WFIKKN2-MSTN
MSTN及其受体基因ACVR2A、ACVR2B和ALK5在人类卵巢生长卵泡阶段(初级卵泡至成熟卵泡阶段)的颗粒细胞中表达,MSTN通过旁分泌/自分泌方式发挥作用,在人的卵泡液中检测到成熟的MSTN二聚体[4]。MSTN通过间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK) 5活化的SMAD2/3和ERK1/2信号通路介导人颗粒细胞靶基因调控而调节促性腺激素受体基因,进一步调控人颗粒细胞孕酮及雌激素的产生[14]。MSTN下调LH受体(LHCGR)、STAR表达,抑制LHCGR及StAR的合成,抑制LH受体合成,减少颗粒细胞对LH的应答,抑制孕酮的产生。MSTN上调FSH受体(FSHR)表达,促进颗粒细胞中FSHR合成,增大对FSH的应答,促进雌二醇的生成[15],MSTN作为孕酮的负性调节因子,防止在大卵泡阶段过早黄体化,促进卵泡向成熟卵泡发育。MSTN抑制颗粒细胞的增殖,通过与颗粒细胞膜ALK4和ALK5结合,活化SMAD2/3- SMAD4信号通路传导,不仅上调结缔组织生长因子(connective tissue growth factor,CTGF)表达,还诱导LOX的表达及其活性增强,抑制颗粒细胞增殖,其意义在于调控排卵后的颗粒细胞由高增殖状态到非增殖及终末分化状态的转变,促进卵泡的成熟及排卵后的黄体化生成[16]。MSTN还可通过SMAD2/3信号传导下调戊四环素3(pentraxin 3,PTX3)基因表达[17],与卵泡发育障碍相关。MSTN同样在卵母细胞体外成熟培养(in vitro maturation,IVM)中发挥作用:在IVM培养液中添加MSTN,可改变卵母细胞转录模式,降低IVM成熟卵母细胞10%活性氧(reactive oxygen species,ROS)和增加谷胱甘肽水平,促进卵母细胞核质成熟与发育潜能[18]。由此推测WFIKKN2与MSTN结合干扰经典SMAD作用通路,可能作为提高卵母细胞质量的干预手段。
4.WFIKKN2-TGF-β1
TGF-β1及其受体TGFβR2及ALK5均表达于颗粒细胞与卵泡膜细胞上,通过旁分泌/自分泌方式调节类固醇生成、颗粒细胞增殖和分化作用,TGF-β1促进人颗粒细胞中CX43表达,介导卵母细胞与周围丘颗粒细胞之间的缝隙连接和细胞通讯,促进卵泡发育[11]。此外,TGF-β1通过TGFβR2和ALK5结合,激活SMAD2/3-SMAD4信号通路,上调环氧化酶-2(cyclooxygenase-2,COX-2)表达,进而促进前列腺素E2的合成,调控卵泡排卵活动[19] ,并且TGF-β1通过SMAD2/3-SMAD4信号通路对人颗粒叶黄素(human granulosa-lutein cells hGL)细胞中透明质酸的合成发挥作用[11]。
综上所述,根据TGF-β家族成员BMP2、BMP4、MSTN及TGF-β1在雌性生殖细胞发生中的作用,以及WFIKKN2对TGF-β家族因子的分子伴侣作用,可以推测WFIKKN2可能在雌性生殖细胞的发生与发育中发挥重要双向调控作用,但是具体机制值得进一步深入探讨。目前,尚无GDF11在雌性生殖细胞的发生与发育中发挥作用的研究。
四、WFIKKN2-TGF-β家族成员在雄性生殖细胞发生与发育中的作用
WFIKKN2在睾丸中高表达,然而在雄性生殖细胞中的功能尚未报道。但是,以WFIKKN2为分子伴侣的TGF-β1、BMP2、BMP4、GDF11在雄性生殖细胞发生中的作用已有相关研究。
TGF-β1在睾丸间质细胞、精原细胞及早期精子均有表达,参与精子发生。TGF-β1在富含精子区域的精液中浓度较高,参与射精。Tgfβ1基因突变小鼠虽生殖器官、精子形态正常,但血清和睾丸内睾酮和血清内雄烯二酮减少,阴茎勃起反射和射精减少,影响雄鼠交配能力[20]。TGF-β1降低精子发生过程中圆形精子产生,TGF-β1阻断二级精母细胞调节第二次减数分裂、精母细胞胞核及胞质成熟同步,减少圆形精子形成[21]。TGF-β1通过SMAD信号通路抑制睾丸生精细胞NECL2的表达,并促进细胞连接蛋白样分子2(nectin-like molecule-2,Necl2)内吞及溶解,调节Necl2在睾丸中的作用[22]。BMP2表达于人胚胎内胚层,低表达Bmp2小鼠体内显示出原始生殖干细胞数量减少,对7日龄小鼠睾丸组织进行培养,BMP2促进精原细胞和支持细胞增殖,并且Ⅰ型受体基因表达升高[23]。BMP4表达于人胚胎外胚层,低表达Bmp4的小鼠体内也显示原始生殖干细胞数量减少,其机制可能是SMAD1和SMAD5激活减少而影响原始生精细胞的发育,在Smad1、Smad5基因敲除小鼠中发现原始生殖干细胞的缺乏,使用重组BMP4蛋白培养从胚胎外胚层分离出的胚胎干细胞出现原始生精细胞的分化[23]。BMP4在睾丸的精原细胞中表达。Bmp4在出生后小鼠睾丸的支持细胞中表达,其受体基因Alk3和Smad5在增殖的精原细胞均特异性表达,BMP4蛋白培养的精原细胞可检测出细胞核内SMAD4/5复合体增多,有丝分裂及分化作用增强,BMP4通过SMAD信号传导途径促进精原细胞的增殖和分化[24]。GDF11基因在精原细胞瘤中高表达[25],但其功能尚未明确,推测其延缓了肿瘤表型及恶变的发生。
由上可知TGF-β家族因子在雄性生殖细胞发生中的作用,那么根据最近发现的WFIKKN2对TGF-β家族因子的分子伴侣作用,可以推测WFIKKN2在雄性生殖细胞的发生与发育中也发挥一定的作用,亟待今后研究证实。
五、展望
研究证实WFIKKN2是一种新的TGF-β家族因子的胞外结合蛋白,是MSTN、GDF11、TGF-β1、BMP2和BMP4等因子发挥作用必不可少的分子伴侣,但其在生殖细胞发生发育中的具体作用研究较少,推测其作为分泌型因子可能通过旁分泌/自分泌方式,与在生殖细胞内具有功能的TGF-β家族因子结合发挥正向或者负向调控作用,参与调控精/卵原细胞增殖与分化、卵子/精子发生等生物事件,亟待进一步研究和探索。
1 Monestier O,Blanquet V.WFIKKN1 and WFIKKN2:"Companion" proteins regulating TGFB activity.Cytokine Growth Factor Rev,2016,32:75-84.
2 Walker R G,Angerman EB,Kattamuri C,et al.Alternative binding modes identified for growth and differentiation factor-associated serum protein(GASP) family antagonism of myostatin.J Biol Chem,2015,290:7506-7516.
3 Zhang H,Tian S,Klausen C,et al.Differential activation of noncanonical SMAD2/SMAD3 signaling by bone morphogenetic proteins causes disproportionate induction of hyaluronan production in immortalized human granulosa cells.Mol Cell Endocrinol,2016,428:17-27.
4 Chang HM,Fang L,Cheng JC,et al.Growth differentiation factor 8 down-regulates pentraxin 3 in human granulosa cells.Mol Cell Endocrinol,2015,404:82-90.
5 Yao HH,Matzuk MM,Jorgez CJ,et al.Follistatin operates downstream of Wnt4 in mammalian ovary organogenesis.Dev Dyn,2004,230:210-215.
6 Takmaz O,Yozgatli D,Ozaltin S,et al.Can follicular Emmprin and BMP 4 levels predict ICSI outcome?.J Assist Reprod Genet,2019,36:1127-1133.
7 Shi J,Yoshino O,Osuga Y,et al.Bone morphogenetic protein-2(BMP-2) increases gene expression of FSH receptor and aromatase and decreases gene expression of LH receptor and StAR in human granulosa cells.Am J Reprod Immunol,2011,65:421-427.
8 Haas CS,Rovani MT,Ilha GF,et al.Transforming growth factor-beta family members are regulated during induced luteolysis in cattle.Anim Reprod.2019,16:829-837.
9 Rossi RO,Da CE,Portela AM,et al.Influence of BMP-2 on early follicular development and mRNA expression of oocyte specific genes in bovine preantral follicles cultured in vitro.Histol Histopathol,2016,31:339-348.
10 Chang HM,Qiao J,Leung PC.Oocyte-somatic cell interactions in the human ovary-novel role of bone morphogenetic proteins and growth differentiation factors.Hum Reprod Update.2016,23:1-18.
11 Wang F,Chang HM,Yi Y,et al.TGF-β1 promotes hyaluronan synthesis by upregulating hyaluronan synthase 2 expression in human granulosa-lutein cells.Cell Signal.2019 Nov,63:109392.
12 Nilsson EE,Skinner MK.Bone morphogenetic protein-4 acts as an ovarian follicle survival factor and promotes primordial follicle development.Biol Reprod,2003,69:1265-1272.
13 Chen YC,Chang HM,Cheng JC,et al.Transforming growth factor-beta1 up-regulates connexin43 expression in human granulosa cells.Hum Reprod,2015,30:2190-2201.
14 Fang L,Chang HM,Cheng JC,et al.Growth differentiation factor-8 decreases StAR expression through ALK5-mediated Smad3 and ERK1/2 signaling pathways in luteinized human granulosa cells.Endocrinology,2015,156:4684-4694.
15 Chang HM,Fang L,Cheng JC,et al.Effects of growth differentiation factor 8 on steroidogenesis in human granulosa-lutein cells.Fertil Steril,2016,105:520-528.
16 Chang HM,Fang Y,Liu PP,et al.Connective tissue growth factor mediates growth differentiation factor 8-induced increase of lysyl oxidase activity in human granulosa-lutein cells.Mol Cell Endocrinol,2016,434:186-198.
17 Sugiyama R,Fuzitou A,Takahashi C,et al.Bone morphogenetic protein 2 may be a good predictor of success in oocyte fertilization during assisted reproductive technology.Hum Cell,2010,23:83-88.
18 Yoon JD,Hwang SU,Kim M,et al.Growth differentiation factor 8 regulates SMAD2/3 signaling and improves oocyte quality during porcine oocyte maturation in vitrodagger.Biol Reprod,2019,101:63-75.
19 Fang L,Chang HM,Cheng JC,et al.TGF-beta1 induces COX-2 expression and PGE2 production in human granulosa cells through Smad signaling pathways.J Clin Endocrinol Metab,2014,99:E1217-E1226.
20 Ingman WV,Robertson SA.Transforming growth factor-beta1 null mutation causes infertility in male mice associated with testosterone deficiency and sexual dysfunction.Endocrinology,2007,148:4032-4043.
21 Perrard MH,Durand P.Redundancy of the effect of TGFbeta1 and beta-NGF on the second meiotic division of rat spermatocytes.Microsc Res Tech,2009,72:596-602.
22 Gao Y,Lui WY.Transforming growth factor-beta1(TGF-beta1) regulates cell junction restructuring via Smad-mediated repression and clathrin-mediated endocytosis of nectin-like molecule 2(Necl-2).PLoS One,2013,8:e64316.
23 Yang Y,Feng Y,Feng X,et al.BMP4 cooperates with retinoic acid to induce the expression of differentiation markers in cultured mouse spermatogonia.Stem Cells Int.2016,2016:9536192.
24 Khanehzad M,Abbaszadeh R,Holakuyee M,et al.FSH regulates RA signaling to commit spermatogonia into differentiation pathway and meiosis.Reprod Biol Endocrinol.2021,19:4.
25 Tourne M,Radulescu C,Allory Y.Testicular germ cell tumors:Histopathological and molecular features.Bull Cancer,2019,106:328-341.