妊娠期合并亚临床甲状腺功能减退(subclinical hypothyroidism,SCH)是最常见的妊娠期甲状腺功能异常,其患病率因人群、诊断标准、甲状腺功能检查时间和碘营养状况的不同而有较大差异。一项纳入53项研究的荟萃分析发现,妊娠期SCH患病率为5.1%[1],中国的一项研究发现,中国人群妊娠期SCH的患病率为4.0%[2]。
妊娠期糖尿病(gestational diabetes mellitus,GDM)是常见的妊娠合并症之一,不仅增加剖宫产、早产、巨大儿等不良妊娠结局的风险[3],还会增加孕产妇及子代远期疾病的风险[4-5]。甲状腺激素对机体葡萄糖代谢有重要影响,可通过与能量平衡调节网络的相互作用,以及直接参与胰岛素调节和外周组织内葡萄糖处理来影响机体糖代谢[6]。既往研究发现,妊娠期SCH可能会增加GDM的风险,但结果仍不一致,特别是在甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)阴性的SCH孕妇中尚不确定[7-11]。
有研究提示,左旋甲状腺素(Levothyroxine,LT4)治疗可改善SCH孕妇的妊娠结局,但LT4治疗对GDM影响的结论仍不一致。2019年中国《妊娠和产后甲状腺疾病诊治指南(第2版)》进一步依据促甲状腺激素(thyroid stimulating hormone,TSH)升高水平进行治疗推荐[12],新指南中TSH轻度升高(TSH水平大于2.5 mIU/L且低于妊娠期特异性参考范围上限)与GDM的关联及LT4治疗的作用的研究较少,仍有待进一步研究。本研究拟在TPOAb阴性孕妇中,分析孕早期TSH轻度升高和SCH对GDM的影响以及LT4治疗的作用。
资料与方法
一、研究对象
本研究采用出生队列研究设计,选取末次月经在2016年5月至2019年4月之间且在北京市通州区妇幼保健院分娩的孕妇,数据来源于北京市通州区妇幼保健院的电子信息系统。研究对象纳入标准:(1)单胎;(2)首次甲状腺功能检查在孕早期(<14周);(3)年龄在18~49岁之间。共有19 490名单胎孕妇符合入选条件。排除标准:(1)胎儿出生缺陷(n=280);(2)通过辅助生殖技术受孕(n=83);(3)孕前诊断为高血压、心脏病、糖尿病、肾脏疾病、自身免疫性疾病等疾病(n=80);(4)本人或其家庭成员中有甲状腺疾病史(n=50);(5)孕早期诊断为(亚)临床甲状腺功能亢进、临床甲状腺功能减退、TPOAb阳性等其他甲状腺功能异常(n=3 345);(6)孕前服用LT4(n=7);(7)妊娠期间因其他原因服用LT4(n=68);(8)分娩孕周在28~42周范围之外(n=67)。最终纳入本研究的孕妇为15 510名。
二、研究方法
1. 常规临床资料收集:研究对象在孕早期建立围产档案时,由统一培训的医护人员完成研究对象常规资料的收集,包括研究对象的一般人口学资料(出生日期、教育水平、工作情况、孕前身高、体重等)、生育史(孕产次、是否通过辅助生殖技术受孕等)、疾病史(个人和家族疾病史)和末次月经日期。采用末次月经日期计算孕周,如果孕妇月经周期不规律,产科医生会进一步根据孕妇孕早期超声对末次月经日期进行核实,如果与孕妇自报的末次月经日期相差1周以上,则以超声检查报告的孕周为准。孕前体重指数(Body Mass Index, BMI)=孕前体重(kg)/身高2(m2)。
2. 甲状腺功能检查及SCH诊断与治疗:
(1)甲状腺功能检查。在孕妇孕早期第一次产检时,采集清晨空腹静脉血4 mL,分离血清,采用化学发光酶免疫法测定TSH、游离甲状腺素(free thyroxine,FT4)和TPOAb。测定仪器为雅培i2000(美国,伊利诺斯州),试剂盒为雅培试剂,TSH、FT4和TPOAb的批次间和批次内变异系数差异≤10%。根据仪器厂商提供的参考范围,TPOAb水平大于5.6 IU/mL认为TPOAb阳性[13]。
(2)孕早期特异性参考范围的建立。依据美国临床生化研究院的标准[12,14],建立本研究妊娠期孕早期TSH和FT4特异性参考范围。本研究排除TPOAb阳性、有甲状腺疾病个人史和家族史、有可见或者可触及的甲状腺肿者、服用药物者(雌激素类除外)及多胎孕妇,通过计算其余的孕妇妊娠期TSH和FT4水平的95%可信区间,建立妊娠期TSH和FT4的特异性参考范围,即第2.5百分位数为参考范围下限、第97.5百分位数为参考范围上限。通过计算得到本研究人群孕早期血清TSH和FT4的特异性参考范围分别为0.03~2.9 mIU/L、10.9~18.5 pmol/L。
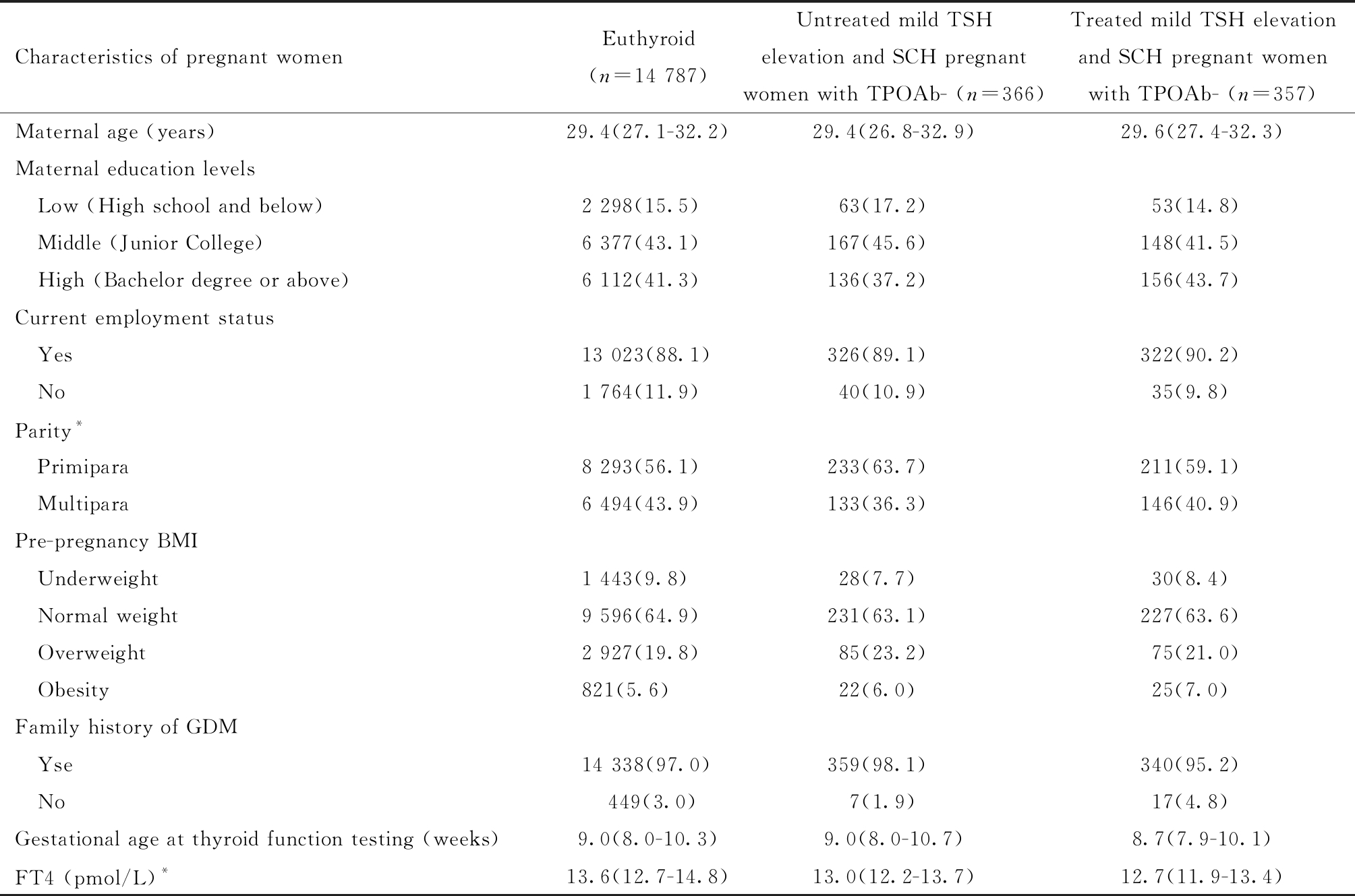
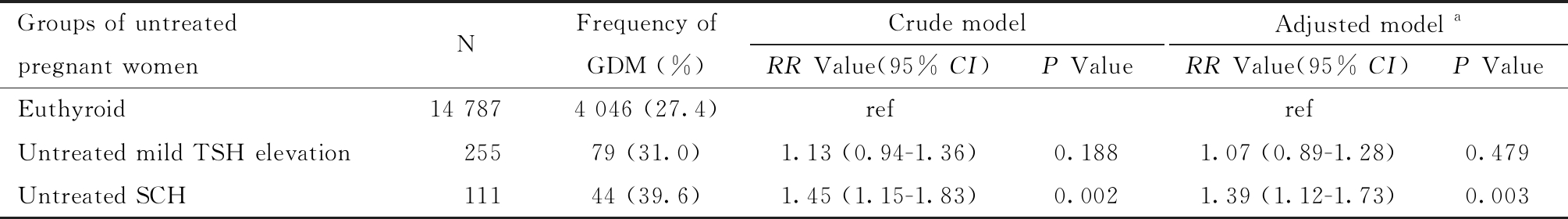
(3)甲状腺疾病诊断及治疗。利用孕妇孕早期首次甲状腺功能检查的血清TSH和FT4水平来判定甲状腺功能,即(1)甲状腺功能正常:0.03≤TSH≤2.5 mIU/L,FT4水平正常(10.9≤FT4≤18.5 pmol/L);(2)TSH轻度升高:2.5 (4)分组。依据甲状腺功能、LT4治疗与否进行分组,即分为甲状腺功能正常组(n=14 787)、TSH轻度升高未治疗组(n=255)、TSH轻度升高治疗组(n=78)、SCH未治疗组(n=111)和SCH治疗组(n=279)。 3. GDM诊断标准:孕妇在24~28周进行75 g葡萄糖耐量试验,空腹及服糖后1 h、2 h的血糖值上限分别为5.1 mmol/L、10.0 mmol/L、8.5 mmol/L,三项血糖值中的任何一项血糖值达到或超过上限即可诊断GDM[15]。 4. 统计学处理:采用R 4.0.3软件进行统计分析(程序包为lmtest、sandwich)。双侧检验P值<0.05表示差异具有统计学意义。研究对象基本特征中的连续变量(孕妇年龄、甲状腺功能检查孕周、TSH水平、FT4水平)均为非正态分布,采用中位数[第1四分位数(P25)-第3四分位数(P75)]进行描述,利用Wilcoxon秩和检验进行组间连续变量的比较;对分类变量,采用例数(百分比)进行描述,利用卡方检验或Fisher确切概率法进行组间比较。 以甲状腺功能正常组为参照组,采用修正泊松回归模型分析TSH轻度升高未治疗组和SCH未治疗组与GDM之间的关联,计算相对危险度(relative risk, RR)和95% 置信区间(confidence interval, CI)[16-17]。以TSH轻度升高未治疗组为参照组,采用修正泊松回归模型分析TSH轻度升高治疗组与未治疗组GDM的差异,计算RR和95% CI。以SCH未治疗组为参照组,采用修正泊松回归模型分析SCH治疗组与未治疗组GDM的差异,计算RR和95% CI。 依据既往文献中纳入的协变量及本研究收集资料的实际情况,将以下因素作为协变量,即孕妇年龄、教育水平、工作情况、产次、孕前BMI分类(按照中国人群营养状况标准对孕妇孕前BMI进行分类[18],BMI<18.5 kg/m2为消瘦、18.5≤BMI<24.0 kg/m2为正常、24.0≤BMI<28.0 kg/m2为超重、BMI≥28.0 kg/m2为肥胖)、GDM家族史、甲状腺功能检查孕周、胎儿性别。研究LT4治疗的作用时,进一步控制TSH水平[19]。 一、研究对象基本情况 研究对象首次甲状腺功能检查的孕周中位数为9.0周(8.0~10.3周),孕周分布的直方图见图1。甲状腺功能正常组、TSH轻度升高和SCH未治疗组、TSH轻度升高及治疗组孕妇的特征见表1。甲状腺功能正常组、TSH轻度升高和SCH未治疗组、TSH轻度升高及治疗组孕妇在年龄、教育水平、工作情况、孕前BMI分类、GDM家族史、首次甲状腺功能检查孕周的差异无统计学意义。甲状腺功能正常组、TSH轻度升高和SCH未治疗组、TSH轻度升高及治疗孕妇组在产次、FT4水平的差异具有统计学意义,这由于样本来自于真实世界资料,而不是临床随机对照实验。TSH轻度升高和SCH治疗孕妇首次LT4治疗处方的孕周中位数为11.1周(9.6~14.4周)。 表1 甲状腺功能正常、TSH轻度升高和SCH未治疗及治疗孕妇的特征 Table 1 Comparison of the maternal characteristics among the 3 groups *P<0.05 Characteristics of pregnant womenEuthyroid (n=14 787)Untreated mild TSH elevation and SCH pregnant women with TPOAb- (n=366)Treated mild TSH elevation and SCH pregnant women with TPOAb- (n=357)Maternal age (years)29.4(27.1-32.2)29.4(26.8-32.9)29.6(27.4-32.3)Maternal education levels Low (High school and below)2 298(15.5)63(17.2)53(14.8) Middle (Junior College)6 377(43.1)167(45.6)148(41.5) High (Bachelor degree or above)6 112(41.3)136(37.2)156(43.7)Current employment status Yes13 023(88.1)326(89.1)322(90.2) No1 764(11.9)40(10.9)35(9.8)Parity* Primipara8 293(56.1)233(63.7)211(59.1) Multipara6 494(43.9)133(36.3)146(40.9)Pre-pregnancy BMI Underweight1 443(9.8)28(7.7)30(8.4) Normal weight9 596(64.9)231(63.1)227(63.6) Overweight2 927(19.8)85(23.2)75(21.0) Obesity821(5.6)22(6.0)25(7.0)Family history of GDM Yse14 338(97.0)359(98.1)340(95.2) No 449(3.0) 7(1.9)17(4.8)Gestational age at thyroid function testing (weeks)9.0(8.0-10.3)9.0(8.0-10.7)8.7(7.9-10.1)FT4 (pmol/L)*13.6(12.7-14.8)13.0(12.2-13.7)12.7(11.9-13.4) 图1 研究对象首次甲状腺功能检查孕周分布 Figure 1 Gestational age distribution for the first thyroid function test of study subjects 二、TSH轻度升高和SCH未治疗组与GDM的关联 以甲状腺功能正常组为参照组,TSH轻度升高和SCH未治疗组与GDM的关联,差异没有统计学意义,SCH未治疗组增加GDM的风险(RR=1.39,95% CI:1.12~1.73,P=0.003)。见表2。 表2 TSH轻度升高和SCH未治疗组与GDM的关联分析 Table 2 Association of untread mild SCH and untreated SCH with GDM a The adjusted model adjusted for all the covariates including maternal age, maternal educational level, current employment status, parity, pre-pregnancy BMI, gestational age of thyroid function testing, family history of GDM and fetal gender. Bold indicated P<0.05 Groups of untreated pregnant womenNFrequency of GDM (%)Crude modelRR Value(95% CI)P ValueAdjusted model aRR Value(95% CI)P ValueEuthyroid14 7874 046 (27.4)refrefUntreated mild TSH elevation25579 (31.0)1.13 (0.94-1.36)0.1881.07 (0.89-1.28)0.479Untreated SCH11144 (39.6)1.45 (1.15-1.83)0.0021.39 (1.12-1.73)0.003 三、LT4治疗的作用 以TSH轻度升高和SCH未治疗组为参照组,TSH轻度升高和SCH治疗组与未治疗组GDM的差异没有统计学意义,见表3。 表3 TSH轻度升高未治疗组与治疗组GDM的差异 Table 3 Comparison of GDM prevalence between untread and treated mild TSH elevation group a Adjusted for all the covariates including maternal age, maternal educational level, current employment status, parity, pre-pregnancy BMI, gestational age of thyroid function testing, family history of GDM, fetal gender and TSH level. Groups of mild TSH elevationNFrequency of GDM (%)Crude modelRR Value(95% CI)P ValueAdjusted model aRR Value(95% CI)P ValueUntreatedmild TSH elevation 25579 (31.0)refrefTreated mild TSH elevation7823 (29.5)0.95 (0.65-1.40)0.8030.82 (0.56-1.20)0.301 以SCH未治疗组为参照组,SCH治疗组降低GDM的风险(RR=0.54,95% CI:0.39~0.76,P<0.001),见表4。 表4 SCH未治疗组与治疗组GDM的差异 Table 4 Comparison of GDM prevalence between untread and treated SCH group a Adjusted for all the covariates including maternal age, maternal educational level, current employment status, parity, pre-pregnancy BMI, gestational age of thyroid function testing, family history of GDM, fetal gender and TSH level. Bold indicated P<0.05 Groups of SCHNFrequency of GDM (%)Crude modelRR Value(95% CI)P ValueAdjusted model aRR Value(95% CI)P ValueUntreated SCH11144(39.6)refrefTreated SCH27961(21.9)0.55(0.40-0.76)<0.0010.54(0.39-0.76)<0.001 一、TSH轻度升高和SCH未治疗组与GDM的关联 本研究发现TSH轻度升高和SCH未治疗组与GDM的关联,差异没有统计学意义,与既往研究结果一致。中国上海和广东的研究均发现,孕早期TSH轻度升高未治疗组与甲状腺功能正常组GDM的差异无统计学意义[20-21]。比利时一项包含1 321名孕妇的前瞻性队列研究,也发现TSH轻度升高未治疗组与甲状腺功能正常组GDM的差异无统计学意义[22]。本研究发现SCH未治疗组增加GDM的风险,与既往部分研究结果一致。中国上海一项包含7 084名孕妇的前瞻性队列研究,发现孕20周内诊断的SCH增加GDM的风险[7]。中国安徽一项包含1 683名孕妇的前瞻性队列研究,发现SCH与GDM的关联没有统计学意义,但该研究SCH的孕妇较少(n=34)[23]。另外一些研究得到的结果也不一致[8, 24-26]。既往研究结果的不一致可能与研究设计、样本量以及人群不同有关。本研究的样本量相对较大,且考虑治疗的影响,结果可靠性较强。SCH与GDM的关联需要更多的研究进行验证。 目前有关SCH与GDM关联的机制的结论仍不明确,多数研究认为胰岛素抵抗可能是SCH与GDM关联的主要机制,临床甲状腺功能减退使胰岛素无法充分维持肌肉组织对葡萄糖的利用,导致胰岛素抵抗,这一现象在SCH中也可能存在,SCH引起的胰岛素抵抗可导致胰岛素敏感性降低,血糖升高,可能增加GDM的风险[27]。 二、LT4治疗的作用 本研究仅发现对SCH孕妇进行LT4治疗降低GDM的风险,目前关于应用LT4治疗TSH轻度升高和SCH孕妇对GDM的影响,尚存争议。中国北京的一项观察性研究[28]利用妊娠期特异性参考范围上限来诊断甲状腺疾病(TSH的97.5th为4.08 mIU/L),以甲状腺功能正常组为对照组(n=2 688),611名TSH轻度升高(2.5 三、本研究的局限性 本研究也存在一些局限性,医院仅对部分孕早期TSH轻度升高和SCH孕妇进行甲状腺功能的随访,无法进一步分析治疗与否对甲状腺功能的后续影响。本研究为观察性研究,TSH轻度升高和SCH孕妇是否接受LT4治疗为非随机分组,但本研究在比较TSH轻度升高和SCH未治疗及治疗组的特征时,发现孕妇年龄、教育水平、工作情况、产次、孕前BMI分类、甲状腺功能检查孕周等特征的差异无统计学意义,且本研究对差异较大的TSH水平进行校正,一定程度上减少了选择偏倚的影响。GDM的发生受到多种影响因素的影响,如GDM的预防方案等,但在医院的电子信息系统中未收集这部分信息,无法对其进行调整,可能存在混杂偏倚。部分孕妇在医院有LT4处方,但其可能依从性不好,未按医嘱服用LT4或者未服用LT4,这部分孕妇被错分为治疗组后,可能只会低估LT4治疗的作用。 综上所述,孕早期SCH且TPOAb阴性未治疗组增加GDM的风险,对这些孕妇进行LT4治疗能减少GDM的发生。不同地区或机构应建立人群妊娠期特异性血清TSH参考范围,对于孕早期SCH孕妇,要依据TPOAb状态进行诊断和治疗。研究结果为阐明SCH且TPOAb阴性对GDM的影响以及LT4治疗的作用提供科学证据。 1 Dong AC,Stagnaro-Green A.Differences in Diagnostic Criteria Mask the True Prevalence of Thyroid Disease in Pregnancy:A Systematic Review and Meta-Analysis.Thyroid,2019,29:278-289. 2 Li C,Shan Z,Mao J,et al.Assessment of Thyroid Function During First-Trimester Pregnancy:What Is the Rational Upper Limit of Serum TSH During the First Trimester in Chinese Pregnant Women?.J Clin Endocrinol Metab,2014,99:73-79. 3 Johns EC,Denison FC,Norman JE,et al.Gestational Diabetes Mellitus:Mechanisms,Treatment,and Complications.Trends Endocrinol Metab,2018,29:743-754. 4 Carr DB,Utzschneider KM,Hull RL,et al.Gestational Diabetes Mellitus Increases the Risk of Cardiovascular Disease in Women With a Family History of Type 2 Diabetes.Diabetes Care,2006,29:2078-2083. 5 Sellers EAC,Dean HJ,Shafer LA,et al.Exposure to gestational diabetes mellitus:Impact on the development of early-onset type 2 diabetes in Canadian first nations and non-first nations offspring.Diabetes care,2016,39:2240-2246. 6 Duntas LH,Orgiazzi J,Brabant G.The interface between thyroid and diabetes mellitus.Clin Endocrinol,2011,75:1-9. 7 Ying H,Tang Y,Bao Y,et al.Maternal TSH level and TPOAb status in early pregnancy and their relationship to the risk of gestational diabetes mellitus.Endocrine,2016,54:742-750. 8 Karakosta P,Alegakis D,Georgiou V,et al.Thyroid Dysfunction and Autoantibodies in Early Pregnancy Are Associated with Increased Risk of Gestational Diabetes and Adverse Birth Outcomes.J Clin Endocrinol Metab,2012,97:4464-4472. 9 Li G,Wei T,Ni W,et al.Incidence and Risk Factors of Gestational Diabetes Mellitus:A Prospective Cohort Study in Qingdao,China.Front Endocrinol,2020,11:636. 10 Cakmak BD,Turker UA,Temur M,et al.Pregnancy outcomes of antibody negative and untreated subclinical hypothyroidism.J Obstet Gynaecol Res,2019,45:810-816. 11 李春仙,陈敏,李美红,等.妊娠妇女亚临床甲状腺功能减退症对妊娠结局的影响.中华内分泌代谢杂志,2015,31:937-940. 12 妊娠和产后甲状腺疾病诊治指南(第2版)编撰委员会,中华医学会内分泌分会,中华医学会围产医学分会.妊娠和产后甲状腺疾病诊治指南(第2版).中华内分泌代谢杂志,2019,35:636-665. 13 La′Ulu SL,Slev PR,Roberts WL.Performance characteristics of 5 automated thyroglobulin autoantibody and thyroid peroxidase autoantibody assays.Clin Chim Acta,2007,376:88-95. 14 Baloch Z,Carayon P,Conte-Devolx B,et al.Laboratory medicine practice guidelines.Laboratory support for the diagnosis and monitoring of thyroid disease.Thyroid,2003,13:3-126. 15 中华医学会妇产科学分会产科学组,中华医学会围产医学分会妊娠合并糖尿病协作组.妊娠合并糖尿病诊治指南(2014).中华妇产科杂志,2014,49:561-569. 16 李克,俞顺章.Poisson模型与队列研究——原理及应用.中国卫生统计,1997,14:46-48. 17 童峰,陈坤.常见结局事件的前瞻性研究中修正Poisson回归模型的应用.中国卫生统计,2006,23:410-412. 18 中国肥胖问题工作组数据汇总分析协作组.我国成人体重指数和腰围对相关疾病危险因素异常的预测价值:适宜体重指数和腰围切点的研究.中华流行病学杂志,2002,23:5-10. 19 Maraka S,Mwangi R,McCoy RG,et al.Thyroid hormone treatment among pregnant women with subclinical hypothyroidism:US national assessment.BMJ,2017,356:i6865. 20 Li M,Ma L,Feng Q,et al.Effects of Maternal Subclinical Hypothyroidism in Early Pregnancy Diagnosed by Different Criteria on Adverse Perinatal Outcomes in Chinese Women With Negative TPOAb.Front Endocrinol,2020,11:580380. 21 Li P,Lin S,Li L,et al.Effect of mildly elevated thyroid-stimulating hormone during the first trimester on adverse pregnancy outcomes.BMC Endocr Disord,2018,18:64. 22 Veltri F,Kleynen P,Grabczan L,et al.Pregnancy outcomes are not altered by variation in thyroid function within the normal range in women free of thyroid disease.Eur J Endocrinol,2018,178:189-197. 23 Huang K,Xu Y,Yan S,et al.Isolated effect of maternal thyroid-stimulating hormone,free thyroxine and antithyroid peroxidase antibodies in early pregnancy on gestational diabetes mellitus:a birth cohort study in China.Endocr J,2019,66:223-231. 24 王小菊,龙燕,蔺莉.不同TSH水平妊娠期亚临床甲减孕妇妊娠结局的前瞻性队列研究.中国妇产科临床杂志,2019,20:410-413. 25 贺译平,贺同强.不同标准诊断的亚临床甲状腺功能减退症及甲状腺过氧化物酶抗体阳性对妊娠的影响.中华妇产科学杂志,2014,49:823-828. 26 杨俊娟,郭华峰,丁书贵,等.孕早期合并亚甲减及其中TPOAb阳性孕妇治疗与否对围产结局的影响.中华妇产科杂志,2015,50:652-657. 27 Maratou E,Hadjidakis DJ,Kollias A,et al.Studies of insulin resistance in patients with clinical and subclinical hypothyroidism.Eur J Endocrinol,2009,160:785-790. 28 Zhang Y,Sun W,Zhu S,et al.The Impact of Thyroid Function and TPOAb in the First Trimester on Pregnancy Outcomes:A Retrospective Study in Peking.J Clin Endocrinol Metab,2020,105:e368-e380. 29 柴丽娅,刘立立,佟玉,等.左旋甲状腺素片治疗孕早期合并亚临床甲状腺功能减退对妊娠结局的影响.中国妇幼保健,2018,33:4866-4869.结 果



讨 论