卵巢储备功能下降(diminished ovarian reserve, DOR)是指卵巢产生卵子的能力减弱,且伴随卵母细胞质量下降,临床主要表现为月经稀发、经量减少,甚至闭经及不孕,若不及时治疗会进一步发展为卵巢早衰(premature ovarian failure, POF)[1]。近年来,随着社会经济、文化、生活环境、工作节奏的改变,DOR发病率有逐年上升的趋势,且年龄愈发趋向年轻化,约占女性卵巢疾病的20%,严重影响广大女性的生殖健康和生活质量[2]。由于DOR患者基础窦卵泡数少,对促排卵药物反应性降低,行体外受精-胚胎移植(in vitro fertilization-embryo transfer, IVF-ET)过程中呈现卵巢反应低下(poor ovarian responder,POR)、卵子质量降低、获卵数及优质胚胎数减少、周期取消率增高、累计妊娠率降低等现象[3]。
近年来,有研究报道氧化应激(oxidative stress,OS)是导致DOR患者生育能力下降的重要原因,显著影响卵泡微环境、卵母细胞成熟、受精和胚胎发育等过程[4-6]。卵泡液是卵母细胞赖以生存的重要微环境,其内含有各种细胞因子和代谢产物、氧化及抗氧化物质[7]。已有相关研究证实卵泡液中存在氧化应激损伤,直接影响卵泡发育、成熟[8],与多囊卵巢综合征(polycystic ovary syndrome, PCOS)[9]、子宫内膜异位症(endometriosis,EM)[10]、POR[11]等密切相关。OS标志物水平能直接反映卵泡液内氧化应激状态,研究显示,POR患者卵泡液内丙二醛(malondialdehyde,MDA)水平增加是对卵母细胞质量产生直接负面影响的关键因素[12]。8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)和4羟基壬烯醛(4-hydroxynonenal,4-HNE)能代表体内DNA、脂质受氧化损伤的程度,也是目前公认的氧化应激标志物[13]。研究显示,EM患者卵泡液中8-OHdG浓度升高可能与受损的卵母细胞质量有关[14]。DOR患者卵泡液中8-OHdG和4-HNE的水平是否与卵母细胞质量下降相关尚未见报道。因此,本研究旨在检测DOR患者卵泡液中8-OHdG、4-HNE的水平,分析其与卵母细胞质量相关参数的相关性,探讨DOR患者卵母细胞质量下降的可能发生机制。
对象与方法
一、研究对象
1.病例来源:本研究所有入组患者资料均来自2020年7月至 2021年7月于同济大学附属第一妇婴保健院生殖医学中心行IVF助孕的79例不孕患者,其中37例 DOR患者作为研究组,另外42例卵巢储备功能正常(normal ovarian reserve, NOR)因输卵管因素行IVF-ET的患者作为对照组。本研究经过上海中医药大学附属曙光医院伦理委员会审批(No.2020-833-40-01),并在中国临床试验注册中心完成注册(ChiCTR2000038182)。
2.诊断标准:(1)年龄20~40岁;(2)至少存在一项卵巢储备功能异常。即①基础卵泡刺激素(basic follicle stimulating hormone,bFSH)在10~25 U/L,伴或不伴bFSH/基础黄体生成素(basic luteinizing hormone,bLH)≥3;②血清抗苗勒管激素(anti müllerian hormone,AMH)水平,20≤~<26岁(AMH≤3.0 ng/mL),26≤~<31岁(AMH≤2.5 ng/mL),31≤~<36岁(AMH≤1.5 ng/mL),36≤~≤40岁(AMH≤1.0 ng/mL);③月经第2~5天基础窦卵泡数(basic antral follicle count,bAFC)≤5个;(3)同时伴有月经稀发,甚至闭经、不孕等临床表现,参考文献拟定[15-16]。符合(1)、(3)及(2)中的任意1条即可诊断DOR。
3.纳入标准:(1)年龄为20~40岁拟行IVF-ET的患者;(2)DOR组患者符合DOR诊断标准,对照组患者符合因输卵管因素所致不孕者;(3)体重指数(body mass index,BMI)在正常范围(18.5 kg/m2
4.排除标准:(1)合并PCOS、免疫因素、EM等其他不孕因素者;(2) 既往有卵巢囊肿剥除术、畸胎瘤剥除术等卵巢手术史;(3)既往有复发性流产、子宫肌瘤、结核病史、肝肾功能异常、心脑血管疾病、造血系统疾病、精神疾病等;(4)夫妻双方有染色体异常的患者;(5)长期应用外源性激素治疗的患者。
二、方法
1.IVF周期促排卵方案:DOR和NOR患者均以同济大学附属第一妇婴保健院生殖医学中心常规促排卵方案进行,DOR组患者采用微刺激方案,月经第3天开始服来曲唑 (江苏恒瑞医药股份有限公司),每日5.0 mg,持续5 d。月经第6天肌注尿促性腺激素(HMG,丽珠集团丽珠制药厂),每次75~150 U,每日或隔日给药。NOR组患者采用长效长方案,月经第18~22天给予长效GnRH-a(醋酸曲普瑞林,德国辉凌公司)3.75 mg皮下注射进行垂体降调节,降调节18~20 d后查性激素水平和阴道B超观察卵泡大小,当窦卵泡直径达5~6 mm时肌注HMG,每次75~150 U,每日或隔日给药。两组患者均根据血清性激素水平和阴道B超定期监测卵泡发育情况来调整促性腺激素(Gn)用量,当B超下发现有1个以上卵泡直径≥18 mm或3个以上卵泡直径≥16 mm时,予以人绒毛膜促性腺激素(hCG,丽珠集团丽珠制药厂)5 000~10 000 IU肌注诱发排卵,注射后34~36 h在阴道B超引导下取卵。
2.卵泡液收集:取卵日收集卵泡液,收集第1个位置最低的直径在20 mm左右的1枚大卵泡的卵泡液,抽吸干净后将无血液污染的卵泡液装入15 mL离心管,4℃下3 000 rpm离心15 min,用一次性吸管将上清液分装至冻存管中,保存在-80℃冰箱备用。
3.胚胎发育:体外受精及胚胎培养按照同济大学附属第一妇婴保健院生殖医学中心实验室常规方法进行,受精后第3 d根据卵裂球均匀度、碎片比例和发育速度等进行胚胎质量评估[17],其中Ⅰ级和Ⅱ级为优质胚胎。
4.观察指标及检测方法:(1)一般情况。包括年龄、不孕年限、不孕类型、BMI、AMH、bAFC及基础性激素[bFSH、bLH、基础雌激素(basic estradiol, bE2)、基础孕酮(basic progesterone, bP)]水平;(2)IVF相关指标。获卵数、MⅡ数、受精数、优质胚胎数;(3)卵泡液中8-OHdG、4-HNE水平及SOD、GSH-Px和CAT活性。采用酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)法检测卵泡液中8-OHdG、4-HNE的水平;人超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、人谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒、人过氧化氢酶(catalase,CAT)试剂盒检测卵泡液中SOD、GSH-Px和CAT的活性,试剂盒均购自南京建成生物工程研究所,严格按照试剂盒说明书的操作步骤进行。
5.统计学处理:采用SPSS 26.0和GraphPad Prism 8.0软件进行数据分析和作图,计量资料符合正态分布采用均数±标准差表示,采用独立样本t检验进行组间分析;不符合正态分布采用中位数及四分位数间距表示,组间比较采用Mann-Whitney U检验;计数资料采用率(%)表示,组间比较采用卡方检验。相关性分析用Spearman相关系数表示,相关系数为正数代表正相关,负数代表负相关,绝对值越大表明相关性越强,P<0.05为差异具有统计学意义。
结 果
一、两组患者一般资料比较
两组患者的一般资料见表1,年龄、bFSH、AMH、bAFC在DOR和NOR组之间差异存在统计学意义,其中DOR患者年龄和bFSH较NOR组高,血清AMH水平及bAFC较NOR组低;不孕类型、不孕年限、BMI、bLH、bE2、bP在两组之间差异无统计学意义。
表1 两组患者一般资料比较
Table 1 Comparison of basic characteristics between DOR and NOR groups
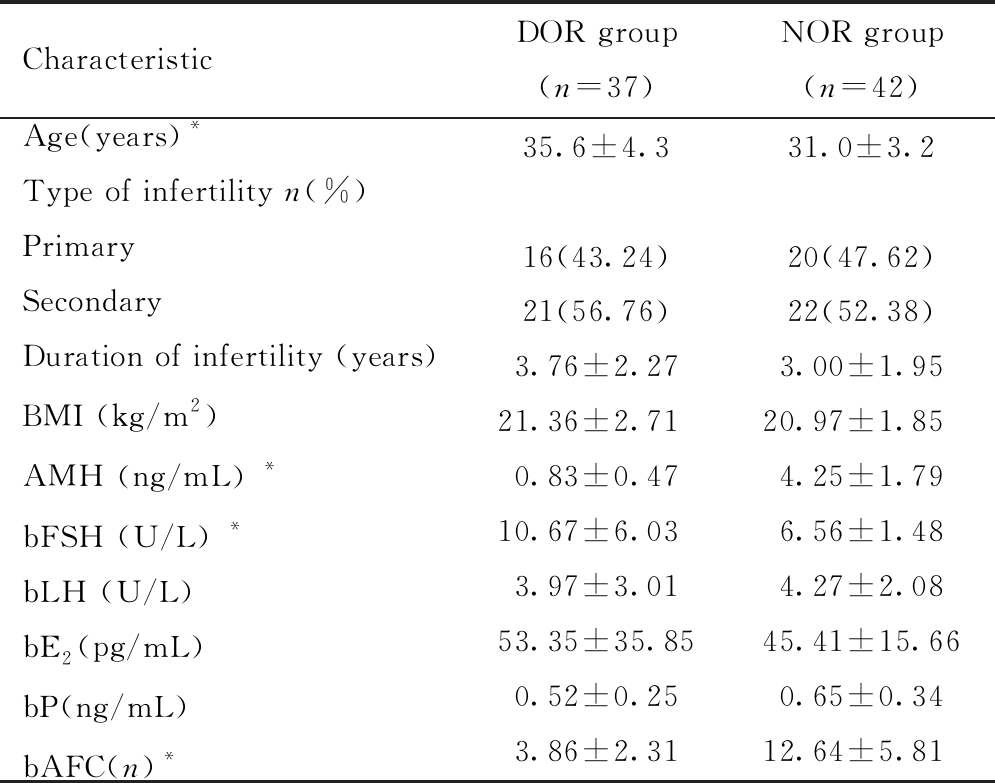
Comparison between two groups, * P<0.05; DOR:diminished ovarian reserve; NOR:normal ovarian reserve
CharacteristicDOR group(n=37)NOR group(n=42)Age(years)*Type of infertility n(%)PrimarySecondaryDuration of infertility (years)BMI (kg/m2)AMH (ng/mL) *bFSH (U/L) *bLH (U/L)bE2 (pg/mL)bP(ng/mL)bAFC(n)*35.6±4.316(43.24)21(56.76)3.76±2.2721.36±2.71 0.83±0.4710.67±6.03 3.97±3.0153.35±35.850.52±0.253.86±2.3131.0±3.220(47.62)22(52.38)3.00±1.9520.97±1.85 4.25±1.796.56±1.484.27±2.0845.41±15.660.65±0.3412.64±5.81
二、两组患者IVF相关指标比较
与NOR组相比,DOR组不孕患者的获卵数、MⅡ数、受精数以及优质胚胎数均显著降低,差异均有统计学意义,见表2。
表2 两组患者IVF相关指标比较
Table 2 Comparison of IVF related indexes between DOR and NOR groups

Compared with the NOR group, * P<0.05;OR (number of oocytes obtained),MⅡ (number of MⅡ),FER (number of fertilization),HQE (number of high-quality embryos); DOR:diminished ovarian reserve; NOR:normal ovarian reserve
GroupsNumber of cases(n)OR(n)MⅡ(n)FER(n)HQE(n)DOR group374.43±2.27*2.59±1.01*2.29±1.83*1.58±1.05*NOR group4213.36±4.639.48±3.699.26±3.296.39±2.57
三、两组患者卵泡液中8-OHdG、4-HNE水平比较
与NOR组相比,DOR组患者卵泡液中8-OHdG和4-HNE水平显著升高,差异具有统计学意义,见图1。

Compared with the NOR group,*P<0.05
图1 两组卵泡液中8-OHdG、4-HNE水平比较
Figure 1 Comparison of levels of 8-OHdG and 4-HNE in follicular fluid between DOR and NOR groups
四、两组患者卵泡液中SOD、GSH-Px和CAT活性比较
结果显示,DOR组患者卵泡液中SOD、GSH-Px和CAT的活性均较NOR组降低,差异均有统计学意义,见图2。

Compared with the NOR group,*P<0.05
图2 两组卵泡液中SOD、GSH-Px和CAT活性比较
Figure 2 Comparison of SOD, GSH-Px and CAT activities in follicular fluid between DOR and NOR groups
五、DOR患者卵泡液8-OHdG、4-HNE水平与相关指标的相关性分析
相关性分析结果显示,DOR组患者卵泡液中8-OHdG水平与年龄、bFSH值呈正相关(r>0,P<0.05),与AMH、受精数、优质胚胎数呈负相关(r<0,P<0.05),与不孕年限、bLH、bE2、bP、bAFC、获卵数、MⅡ数均无明显相关性(P>0.05); 4-HNE水平与年龄、bFSH值呈正相关(r>0,P<0.05),与AMH、MⅡ数、受精数呈负相关(r<0,P<0.05),与不孕年限、bLH、bE2、bP、bAFC、获卵数、优质胚胎数均无相关性(P>0.05),见表3。
表3 DOR患者卵泡液8-OHdG、4-HNE水平与相关指标的关系
Table 3 Relationship between levels of 8-OHdG and 4-HNE in follicular fluid of DOR patients and related indexes
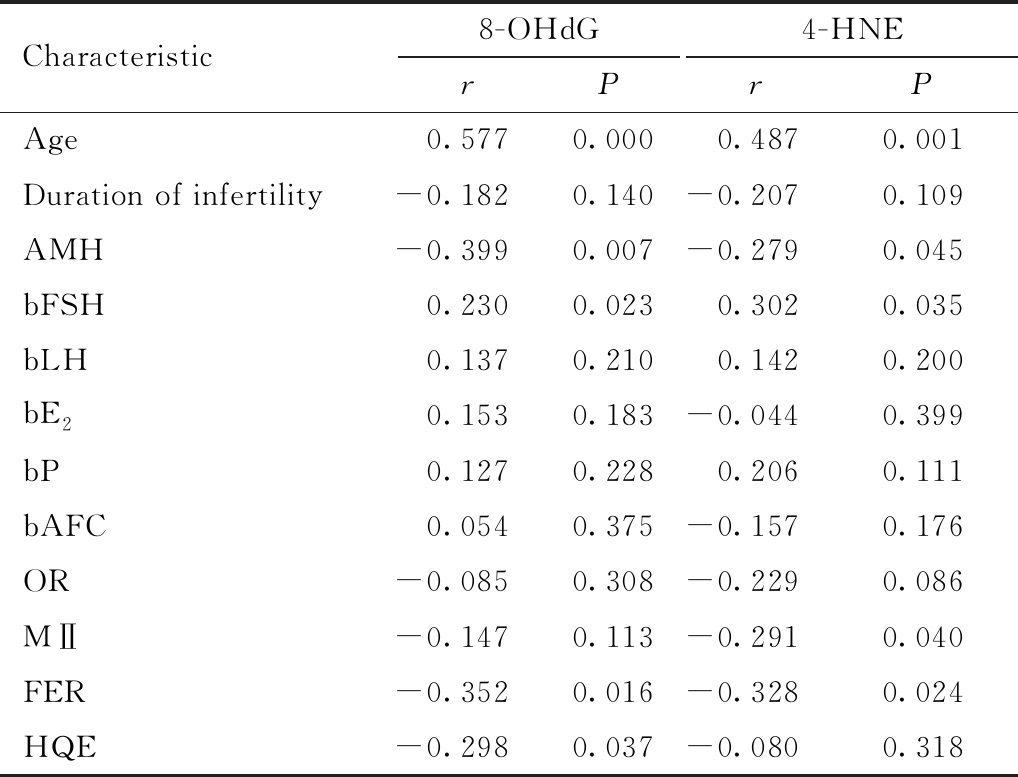
OR (number of oocytes obtained),MⅡ (number of MⅡ),FER (number of fertilization),HQE (number of high-quality embryos)
Characteristic8-OHdGrP4-HNErPAge0.5770.0000.4870.001Duration of infertility-0.1820.140-0.2070.109AMH-0.3990.007-0.2790.045bFSH0.2300.0230.3020.035bLH0.1370.2100.1420.200bE20.1530.183-0.0440.399bP0.1270.2280.2060.111bAFC0.0540.375-0.1570.176OR-0.0850.308-0.2290.086MⅡ-0.1470.113-0.2910.040FER-0.3520.016-0.3280.024HQE-0.2980.037-0.0800.318
讨 论
目前DOR发病原因尚未明确,初步认为与年龄、遗传因素、酶缺乏、促性腺激素及其受体异常、自身免疫损伤、卵巢破坏性因素(放疗、化疗、手术、感染等)、抑制素异常、卵泡生成障碍等有一定的相关性[18]。国内外尚无统一的诊断标准,临床主要采用年龄、FSH、FSH/LH、AFC、AMH、E2、抑制素B(inhibin B,INHB)、卵巢体积和卵巢基质的血流指数等多个指标综合评价[19]。近年来,有研究证实OS可能是引起DOR的因素之一,细胞内活性氧(reactive oxygen species,ROS)主要来源于线粒体,而线粒体DNA因缺乏组蛋白或DNA结合蛋白的保护容易受到ROS的损伤导致线粒体功能障碍,此外,线粒体功能障碍导致ROS产生增加进而加重氧化应激,影响卵泡发育和颗粒细胞功能,以致卵母细胞质量下降,可能是其导致DOR的重要途径[20-21]。研究表明,包括辅酶Q10、褪黑素、葡萄籽提取物、番茄红素等抗氧化剂可改善卵母细胞线粒体功能,从而改善卵巢功能减退[22-23]。
卵泡液是卵母细胞与周围细胞进行物质交换和能量代谢的场所,由周围颗粒细胞产生的分泌物及局部毛细血管扩散的血清组成,作为卵泡生长、发育、成熟的微环境,卵泡液中包含多种生物活性分子,如激素、转化生长因子、生长因子、白介素、活性氧、抗凋亡因子、蛋白质、糖、氨基酸、肽及前列腺素等物质,影响卵母细胞发育、卵泡壁破裂、卵巢细胞发育成为功能黄体、受精、早期胚胎发育等过程[24-26]。有研究发现卵泡液中氧化应激标志物与卵泡的发育、成熟密切相关,ROS水平升高致褪黑素(melatonin ,MLT)降低破坏了内环境的氧化/抗氧化平衡,从而影响卵母细胞质量及胚胎发育潜能[27]。提示卵泡液内氧化/抗氧化失衡可能是卵母细胞质量下降的重要原因。
OS可导致生物大分子如DNA、脂质氧化损伤并分别产生8-OHdG、4-HNE,造成细胞功能改变,因此8-OHdG、4-HNE含量可反应机体OS损害严重程度,是目前公认的氧化损伤标记物[21]。研究表明,控制性超促排卵增加了小鼠卵巢中ROS、MDA、8-OHdG、4-HNE的水平,同时降低了SOD和GSH-Px,提示控制性超促排卵后卵巢处于高氧化应激状态[28]。Liu等[29]研究表明枸杞多糖可修复重复控制性超促排卵引起的卵巢OS损伤,可能通过降低8-OHdG和脂质过氧化产物(lipid peroxidation,LPO)水平,增加AMH蛋白表达,提高卵母细胞质量进而改善卵巢储备功能。ROS引起卵巢中8-OHdG、4-HNE水平增高,且随年龄的增加呈上升趋势,提示年龄相关的氧化损伤可能是卵巢衰老的原因之一[30]。本研究结果显示,DOR患者卵泡液中8-OHdG和4-HNE水平较NOR组升高,提示DOR患者卵泡液中存在氧化应激,可能影响卵母细胞成熟、受精及胚胎发育,故推测卵泡液中8-OHdG、4-HNE的水平可能与DOR不孕的病理过程相关。但目前国内外关于8-OHdG和4-HNE与DOR不孕相关性的报道较少,其在DOR不孕发病机制中的作用还需要进一步探索。
生理状态下,机体内存在完善的抗氧化物酶类抗氧化系统,主要包括SOD、GSH-Px、CAT等抗氧化酶[31]。正常状态下, ROS与内源性抗氧化体系成动态平衡,足量的抗氧化物酶能清除大部分的ROS,病理状态下,当机体产生过量的ROS,或体内抗氧化酶相对缺乏无法清除过量的ROS,导致氧化应激状态。研究发现,小鼠卵巢存在氧化应激,与抗氧化酶基因表达呈反比,进一步发现卵巢内累积过量的ROS会导致内分泌失调[32-33]。杨纪珂等[34]发现DOR大鼠血清SOD、GSH-Px活性下降,补肾疏肝中药能促进SOD、GSH-Px的表达,提示补肾疏肝中药能促进DOR大鼠卵巢内抗氧化酶的表达以缓解OS,进而改善卵巢功能。饶晨晨等[35]研究发现二仙汤防治卵巢早衰的作用机制可能是通过上调SOD、CAT的含量协助机体清除过量的ROS,以缓解OS。李倩等[36]研究发现姜黄素能通过增加卵巢SOD、GSH-Px及CAT的表达和活性,逆转双酚A造成的卵巢OS损伤。本研究结果显示,DOR患者卵泡液中SOD、GSH-Px及CAT活性较NOR组降低,提示DOR患者卵泡液中抗氧化酶活性下降,不能及时清除ROS,导致局部OS影响卵泡发育、成熟及受精,提示卵泡液中抗氧化酶缺乏可能与DOR不孕的病理过程相关。
本研究进一步分析了DOR患者卵泡液中8-OHdG、4-HNE水平与IVF相关指标的相关性,结果显示,DOR患者卵泡液中8-OHdG、4-HNE水平与年龄、bFSH呈正相关,与AMH、MⅡ数、受精数、优质胚胎数呈负相关,提示随着女性年龄增加或卵巢功能下降,DOR患者卵泡液8-OHdG、4-HNE的水平增高,说明衰老或卵巢功能下降机体内抗氧化酶活性下降,清除ROS的能力下降,卵泡微环境内产生氧化应激损伤,影响卵母细胞的发育、成熟及受精等过程,故MⅡ数、受精数及优质胚胎数下降,提示DOR患者卵泡液中增高的8-OHdG、4-HNE水平可能与卵母细胞DNA、脂质氧化应激损伤有关。因此,8-OHdG、4-HNE水平增加对卵母细胞质量及胚胎发育潜能产生的直接负面影响可能是其限制DOR不孕患者生殖结局的关键因素。
综上所述,DOR患者卵泡液微环境中存在氧化/抗氧化失衡,可能影响卵母细胞发育、成熟、正常受精及胚胎发育等过程导致卵母细胞质量及胚胎发育潜能下降,提示卵泡微环境中氧化/抗氧化能力失衡可能是引起DOR患者不孕及IVF结局不良的重要因素。本研究结果提示临床可通过抗氧化治疗改善卵泡液微环境中氧化应激状态,为DOR患者IVF-ET获得理想的妊娠结局提供新的思路。
1 梁程程,杨红,齐聪,等.氧化应激对卵巢储备功能下降的影响及中西医抗氧化治疗研究进展.中国中西医结合杂志,2021,41:885-889.
2 孙爱军,唐旭东,张巧利,等.卵巢储备功能降低不孕症中西医结合治疗的理论与临床试验研究探讨.中国实验方剂学杂志,2019,25:1-11.
3 Bishop LA,Richter KS,Patounakis G,et al.Diminished ovarian reserve as measured by means of baseline follicle-stimulating hormone and antral follicle count is not associated with pregnancy loss in younger in vitro fertilization patients.Fertil Steril,2017,108:980-987.
4 Agarwal A,Aponte-Mellado A,Premkumar BJ,et al.The effects of oxidative stress on female reproduction:a review.Reprod Biol Endocrinol,2012,10:49.
5 Jia ZZ,Zhang JW,Zhou D,et al.Deltamethrin exposure induces oxidative stress and affects meiotic maturation in mouse oocyte.Chemosphere,2019,223:704-713.
6 Lord T,Aitken RJ.Oxidative stress and ageing of the post-ovulatory oocyte.Reproduction,2013,146:R217-227.
7 DaBroi MG,Giorgi VSI,Wang F,et al.Influence of follicular fluid and cumulus cells on oocyte quality:clinical implications.J Assist Reprod Genet,2018,35:735-751.
8 Freitas C,Neto AC,Matos L,etal.Follicular Fluid redox involvement for ovarian follicle growth.J Ovarian Res,2017,12,10:44.
9 Gongadashetti K,Gupta P,Dada R,et al.Follicular fluid oxidative stress biomarkers and ART outcomes in PCOS women undergoing in vitro fertilization:A cross-sectional study.Int J Reprod Biomed,2021,19:449-456.
10 Lin X,Dai Y,Tong X,etal.Excessive oxidative stress in cumulus granulosa cells induced cell senescence contributes to endometriosis-associated infertility.Redox Biol,2020,30:101431.
11 Uppangala S,Fernandes G,Salian SR,et al.Reduced ovarian response to controlled ovarian stimulation is associated with increased oxidative stress in the follicular environment.Reprod Biol,2020,20:402-407.
12 吕翠婷,汪辉,朱博雅,等.卵泡液中丙二醛水平对卵巢低反应患者体外受精-胚胎移植结局的影响.实用妇产科杂志,2020,36:790-793.
13 Tabak O,Gelisgen R,Erman H.Oxidative lipid,protein,and DNA damage as oxidative stress markers in vascular complications of diabetes mellitus.Clin Invest Med,2011,34:E163-171.
14 DaBroi MG,Jordão AA Jr,Ferriani RA,et al.Oocyte oxidative DNA damage may be involved in minimal/mild endometriosis-related infertility.Mol Reprod Dev,2018,85:128-136.
15 Tal R,Seifer DB.Ovarian reserve testing:a user′s guide.Am J Obstet Gynecol,2017,217:129-140.
16 张玙,宋佳怡,夏天.温肾健脾方对脾肾阳虚型卵巢储备功能下降患者IVF/ICSI-ET妊娠结局的影响.中国中西医结合杂志,2021,41:184-188.
17 王雪莹,郭薇,谢聪聪,等.卵泡液促甲状腺激素水平对辅助生殖技术实验室指标的影响.基础医学与临床,2020,40:1353-1357.
18 赵燕燕,关青艳,田晓勤,等.卵巢储备功能下降的研究进展.新疆中医药,2018,36:120-123.
![]() B,Özdemir ED,Tü
B,Özdemir ED,Tü![]() O,et al.Diminished ovarian reserve in patients with psoriasis.Taiwan J Obstet Gynecol,2018,57:227-230.
O,et al.Diminished ovarian reserve in patients with psoriasis.Taiwan J Obstet Gynecol,2018,57:227-230.
20 Shi L,Zhang J,Lai Z,et al.Long-Term Moderate Oxidative Stress Decreased Ovarian Reproductive Function by Reducing Follicle Quality and Progesterone Production.PLoS One,2016,11:e0162194.
21 He X,Wang Y,Wu M,et al.Secoisolariciresinol Diglucoside Improves Ovarian Reserve in Aging Mouse by Inhibiting Oxidative Stress.Front Mol Biosci,2022,8:806412.
22 Yang Y,Cheung HH,Zhang C,et al.Melatonin as potential targets for delaying ovarian aging.Curr Drug Targets,2019,20:16-28.
23 Liu X,Lin X,Zhang S,et al.Lycopene ameliorates oxidative stress in the aging chicken ovary via activation of Nrf2/HO-1 pathway.Aging(Albany NY),2018,10:2016-2036.
24 Castiglione Morelli MA,Iuliano A,Schettini SCA,et al.NMR metabolic profiling of follicular fluid for investigating the different causes of female infertility:A pilot study.Metabolomics,2019,15:19.
25 Revelli A,Delle Piane L,Casano S,et al.Follicular fluid content and oocyte qulity:from single biochemical markers to metabolomics.Reprod Biol Endocrinol,2009,7:40.
26 Shen X,Liu X,Zhu P,et al.Proteomic analysis of human follicular fluid associated with successful in vitro fertilization.Reprod Biol Endocrinol,2017,15:58.
27 王亮,孙宁霞,郝敏,等.卵泡液中高水平活性氧影响卵巢储备功能低下患者卵母细胞质量.发育医学电子杂志,2018,6:220-224,235,188.
28 Nie X,Dai Y,Zheng Y,et al.Establishment of a Mouse Model of Premature Ovarian Failure Using Consecutive Superovulation.Cell Physiol Biochem,2018,51:2341-2358.
29 Liu B,Wang JL,Wang XM,et al.Reparative effects of lycium barbarum polysaccharide on mouse ovarian injuries induced by repeated superovulation.Theriogenology,2020,145:115-125.
30 田勇,赖志文,石良艳,等.氧化损伤产物8-OHdG、4-HNE、NTY在成年小鼠卵巢组织中的增龄变化.实用医学杂志,2012,28:2502-2505.
31 Ighodaro OM,Akinloye OA.First line defence antioxidants-superoxide dismutase(SOD),catalase(CAT) and glutathione peroxidase(GPX):Their fundamental role in the entire antioxidant defence grid.Alex J Med,2018,54:287-293.
32 Lim J,Luderer U.Oxidative damage increases and antioxidant gene expression decreases with aging in the mouse ovary.Biol Reprod,2011,84:775-782.
33 Lim J,Nakamura BN,Mohar I,et al.Glutamate cysteine ligase modifier subunit(Gclm)null mice have increased ovarian oxidative stress and accelerated Age-Related ovarian failure.Endocrinology,2015,156:3329-3343.
34 杨纪珂,刘雁峰.补肾疏肝法对卵巢储备功能低下大鼠卵巢功能及氧化应激功能影响的研究.现代中西医结合杂志,2020,29:835-839.
35 饶晨晨,高文雅,陶仕英,等.二仙汤抗化疗性卵巢早衰氧化应激的效应观察.湖南中医药大学学报,2019,39:578-583.
36 李倩,张润驰,张锦松,等.姜黄素对双酚A致小鼠卵巢氧化损伤的保护.动物学杂志,2019,54:875-882.