子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)是仅次于子宫平滑肌肉瘤的第二常见子宫肉瘤,占子宫肉瘤的7%~25%[1]。2014年WHO将子宫内膜间质肿瘤分为四类,即子宫内膜间质结节、低级别子宫内膜间质肉瘤(low grade endometrial stromal sarcoma,LGESS)、高级别子宫内膜间质肉瘤和未分化子宫肉瘤[2]。其中LGESS是一种生长缓慢的低度恶性肿瘤,预后良好,但晚期有复发可能。该疾病复发率为23%~59%,复发后死亡率达15%至25%,目前报道总死亡率不足10%[3]。由于临床缺乏特异性表现,术前影像学诊断困难,最终需依靠术后病理诊断,往往容易造成误诊、漏诊[4]。该疾病罕见,缺乏大样本的临床报道,本研究通过回顾及追踪21例LGESS患者资料,分析其临床特点、影像学表现、病理特征、治疗方式及疾病预后,以期为临床提供参考。
资料与方法
1.一般资料:2010年1月至2020年10月北京大学第三医院妇科收治的LGESS患者共21例,收集其资料,包括患者的年龄、期别、临床症状、影像学检查、冰冻病理、石蜡病理、手术方式、术后辅助治疗、复发情况及生存状态。采取门诊复查或电话随访的方式了解患者目前状态,随访时间截止2021年1月31日。年龄范围17~79岁,平均发病年龄为(42.1±15.4)岁,术后随访10~205个月,中位随访时间为85个月,平均随访时间(85.7±51.7)个月。
2.统计学处理:采用SPSS 25.0进行统计学分析,计量资料用均数±标准差表示,计数资料用百分数表示。两组间率比较采用卡方检验,理论频数小于5采取Fisher精确检验,以P <0.05表示差异有统计学意义。
结果
21例LGESS患者诊断期别大多为早期,Ⅰ-Ⅱ期(80.9%)。临床表现分别为月经量增多或阴道不规则出血(42.8%)、无症状(33.3%)、盆腔包块(14.2%)、下腹痛(9.5%)。术前检查盆腔B超多提示子宫肌瘤或子宫腺肌症。仅有1例患者盆腔B超及MRI均提示肉瘤可能。术前盆腔核磁资料较少,多为术后或复发后检查。21例患者中有7例患者术中进行了冰冻检查,仅有1例提示LGESS。12例清扫淋巴结的患者中仅有1例患者病理提示腹主动脉旁淋巴结有转移,而盆腔淋巴结未见转移,随访8年10个月,并未复发。截止随访时间,有10例患者术后出现复发,复发部位主要为盆腔,复发间隔19~84个月,平均复发时间(48.5±22.5)个月,5例保留卵巢及1例仅切除子宫病灶患者均复发,仅切除子宫病灶患者术后成功完成生育,但剖宫产同时切除子宫及双附件。10例复发患者中3例已因本疾病死亡,其中2例分期为Ⅲ期,1例保留卵巢。
21例LGESS患者术后复发情况及影响因素:5例保留卵巢的复发率为100%,与切除卵巢者比较,差异有统计学意义。淋巴结清扫对比未淋巴结清扫,差异有统计学意义。其余因素比较,差异均无统计学意义。见表1。
表1 21例LGESS患者各种影响因素的术后复发情况
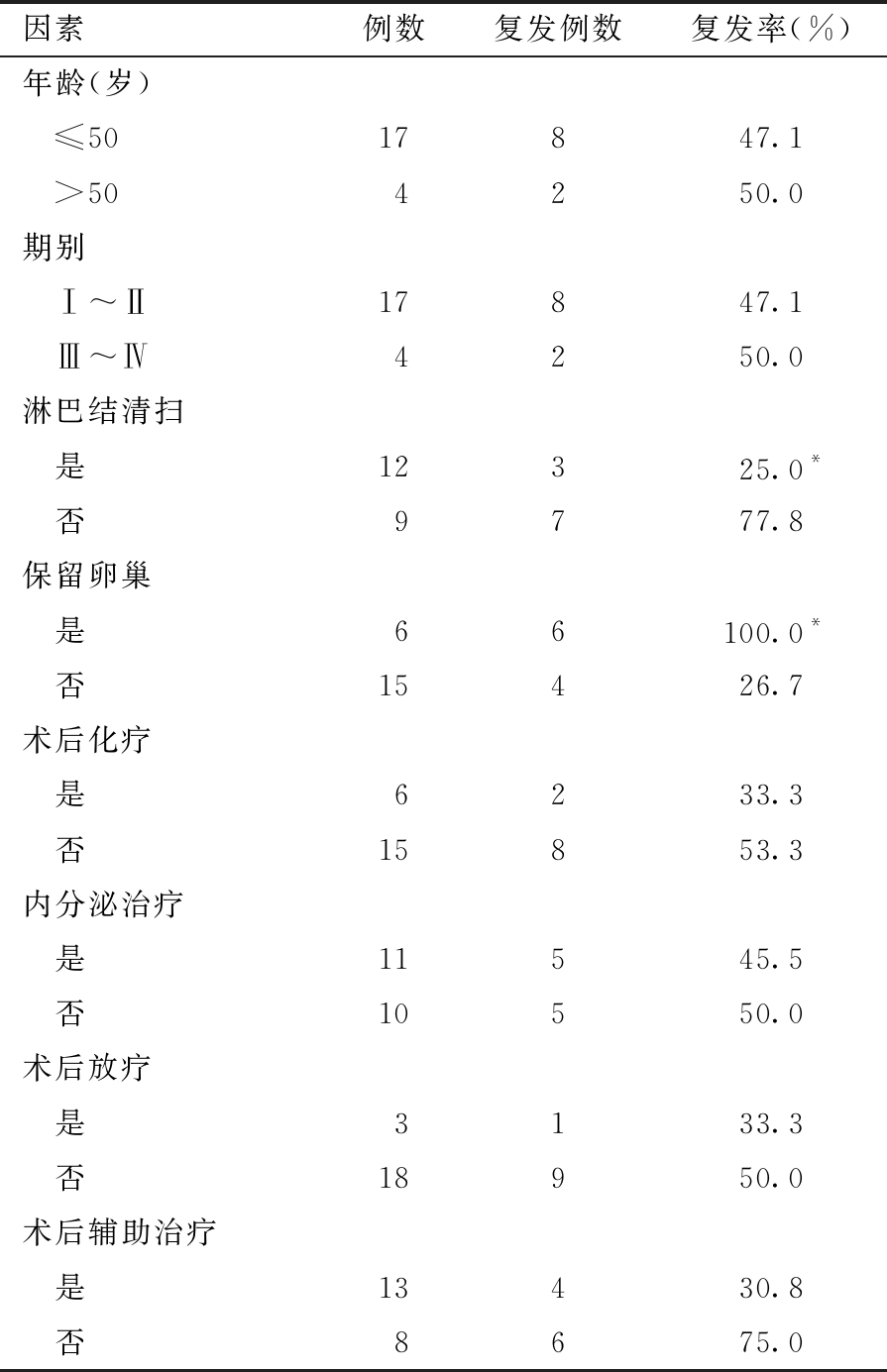
与“否”比较,*P<0.05
因素例数复发例数复发率(%)年龄(岁) ≤5017847.1 >504250.0期别 Ⅰ~Ⅱ17847.1 Ⅲ~Ⅳ4250.0淋巴结清扫 是12325.0* 否9777.8保留卵巢 是66100.0* 否15426.7术后化疗 是6233.3 否15853.3内分泌治疗 是11545.5 否10550.0术后放疗 是3133.3 否18950.0术后辅助治疗 是13430.8 否8675.0
讨论
1.临床特点:LGESS发病年龄大多为40~55岁的女性[4],本研究中患者的平均发病年龄为(42.1±15.4)岁,与文献报道相符。其临床症状不具有特异性,往往表现为异常阴道出血、腹痛,也有一部分患者无症状。
2.影像学表现:LGESS超声影像表现多变,肿块通常位于子宫肌层,有时也可伸入宫腔,并有弥漫性肌层增厚,肿块内多发性囊性变性,不易与子宫平滑肌瘤、子宫腺肌病相鉴别[5]。MRI影像表现不一,缺乏典型的影像,表现为息肉样子宫内膜肿块或类似平滑肌瘤伴囊性变的肌层肿块,边界清楚或者边界不规则[6]。向宫腔生长者需要与息肉和内膜癌、宫颈癌鉴别;肌壁间生长者需要与子宫肌瘤变性鉴别。侵犯肌层者往往表现为蠕虫样或结节状浸润,边界不清。由于子宫内膜间质肉瘤易侵犯血管,MRI可表现为蠕虫样结节沿子宫静脉蔓延。需与静脉内平滑肌瘤相鉴别[7]。
3.病理特征:LGESS肉眼观肿瘤呈黄色蠕虫样。镜下表现为舌状浸润肌层生长,细胞小而圆,核分裂象少,周围可见螺旋动脉样的小血管均匀分布,类似于正常的增生期子宫内膜,常可见淋巴血管侵犯。免疫组化常见ER、PR、CDl0阳性,融合基因JAZF1 FISH具有特异性[8]。往往需与子宫内膜间质结节及平滑肌源性肿瘤相鉴别。LGESS的冰冻诊断有一定难度,本研究中仅1例冰冻与石蜡病理一致,难点在于(1)冰冻切片中肿瘤生长的边界难以全面评估,而LGESS的诊断需要全面评估肿瘤的边界[8];(2)子宫内膜间质肿瘤镜下形态学与平滑肌源性肿瘤具有相似性,而冰冻切片中的假象会进一步增加诊断的难度;(3)LGESS的诊断需要依据临床表现、组织形态、生长方式、免疫组化及分子检测等多方面情况综合分析。
4.治疗:LGESS治疗方式以手术为主,辅以内分泌治疗或放化疗。但目前治疗尚存在争议,主要表现为以下几个方面。
(1)手术是否切除淋巴结的问题。Barney等[9]对1 010例ESS患者进行meta分析,发现进行淋巴结清扫并不会改变患者的生存率。Signorelli等[10]研究随访64例LGESS,19例淋巴结清扫患者仅有3名淋巴结受累,16例早期LGESS中仅有1名淋巴结受累(5%),认为没有迹象表明可以对早期LGESS进行系统的淋巴结清扫术。目前,NCCN指南已不推荐淋巴结清扫。Chan等[11]对831例ESS研究发现淋巴结清扫的患者中有近10%发生淋巴结转移,其生存率明显低于无淋巴结转移者(35.3% vs 80.1%)。本研究12例淋巴结清扫患者中仅有1例淋巴结转移,术后随访8年10个月仍未复发。鉴于LGESS淋巴结转移率低,不建议常规进行淋巴结清扫,术前影像学有淋巴结转移者除外。本研究中清扫淋巴结较未清扫淋巴结的复发率差异有统计学意义,与其他研究不一样,考虑样本量小,可能存在误差偏倚。
(2)保留卵巢与保留生育问题。LGESS属雌激素依赖肿瘤,保留卵巢影响疾病复发,《2021NCCN子宫肿瘤临床实践指南》[12]建议切除卵巢,但有研究表明保留卵巢并不影响生存率,年轻女性能否保留卵巢?一项涉及17项研究LGESS的meta分析[13]表明,保留卵巢组比切除卵巢组肿瘤复发率显着增加(46.8% vs 24.2%),而两组死亡率却没有差异(5.9% vs 7.0%)。一项纳入831名ESS患者的研究[11]发现,Ⅰ-Ⅱ期年轻女性切除卵巢与保留卵巢的患者5年生存率差异无统计学意义,认为早期ESS的年轻患者可以考虑保留卵巢。本研究中有5例患者切除子宫保留卵巢,术后均复发(100%),且其中1例死亡,因此仍建议切除卵巢。
Bai等[14]回顾性研究中19例LGESS进行了子宫病灶切除,其中5名患者术后成功完成生育,认为LGESS可行保留生育能力的手术,但平均复发间隔仅为20.5个月,建议完成生育后尽早切除子宫。本研究中1例仅切除子宫病灶的患者成功完成生育,但剖宫产同时切除子宫及双附件,因此对于有强烈生育愿望的女性来说或许可行保留生育功能的手术。
(3)内分泌治疗。文献报道[15],30年前LGESS病死率可高达19%~50%,而最近的研究显示,病死率不足10%,有学者认为这归结于内分泌治疗的应用。而多项研究表明,内分泌治疗并不能提高生存率,但可以降低复发或延缓复发。Barney等[9]对1 010例ESS患者进行meta分析发现,辅助性激素治疗与提高任何期别、分级的存活率不相关。Comert等[16]回顾性分析37例LGESS患者的资料,认为任何期别LGESS术后激素治疗均可降低复发率。本研究中进行内分泌治疗与未进行内分泌治疗比较,复发率并无显著差异。由于样本量小,存在偏倚误差,需更多的样本资料进一步分析证实。
(4)放疗与化疗。Bai等[14]追踪153例LGESS的回顾性分析发现,初治手术后接受辅助治疗(放疗、激素治疗、 化疗)的患者5年无复发生存率(放疗者92.0%、激素治疗者77.7%、 化疗者74.2%)均高于术后未做放化疗及激素治疗等辅助治疗的观察者(54.8%),复发患者再次手术后接受辅助治疗(放疗、激素治疗、 化疗)的5年生存率(放疗者94.1%,激素治疗者96.0%,化疗者94.4%)均高于术后未做放化疗及激素治疗等辅助治疗的观察者(78.6% ),认为术后辅助治疗有一定益处。本研究中因放化疗样本例数少,有待大样本进一步考证。
综上所述,尽管LGESS临床诊断困难,但总结病例仍有一些特征可循。本研究认为LGESS有易侵犯肌层及脉管的特点,在影像学上可表现为蠕虫样或结节状浸润,边界不清,及沿子宫静脉蔓延的特征;治疗方式上,认为保留卵巢是影响预后的重要因素,建议切除卵巢;淋巴结转移率低,不建议常规淋巴结清扫。术后辅助治疗对复发的影响今后需更多的样本资料进一步证实。
1 Thiel FC,Halmen S.Low-Grade Endometrial Stromal Sarcoma - a Review.Oncol Res Treat,2018,41:687-692.
2 Conklin CM,Longacre TA.Endometrial stromal tumors:the new WHO classification.AdvAnat Pathol,2014,21:383-393.
3 Yamazaki H,Todo Y,Mitsube K,et al.Long-term survival of patients with recurrent endometrial stromal sarcoma:a multicenter,observational study.J Gynecol Oncol,2015,26:214-221.
4 谢伟民,杨佳欣.低级别子宫内膜间质肉瘤的研究进展.中国妇产科临床杂志,2017,18:90-92.
5 Park GE,Rha SE,Oh SN,et al.Ultrasonographic findings of low-grade endometrial stromal sarcoma of the uterus with a focus on cystic degeneration.Ultrasonography,2016,35:124-130.
6 Santos P,Cunha TM.Uterine sarcomas:clinical presentation and MRI features.DiagnInterv Radiol,2015,21:4-9.
7 Ueda M,Otsuka M,Hatakenaka M,et al.MR imaging findings of uterine endometrial stromal sarcoma:differentiation from endometrial carcinoma.Eur Radiol,2001,11:28-33.
8 杨菁,刘从容.子宫内膜间质肿瘤的新认识及研究进展.中华病理学杂志,2020,49:1084-1087.
9 Barney B,Tward JD,Skidmore T,et al.Does radiotherapy or lymphadenectomy improve survival in endometrial stromal sarcoma? Int J Gynecol Cancer,2009,19:1232-1238.
10 Signorelli M,Fruscio R,Dell′Anna T,et al.Lymphadenectomy in uterine low-grade endometrial stromal sarcoma:an analysis of 19 cases and a literature review.Int J Gynecol Cancer,2010,20:1363-1366.
11 Chan JK,Kawar NM,Shin JY,et al.Endometrial stromal sarcoma:a population-based analysis.Br J Cancer,2008,99:1210-1215.
12 National Comprehensive CancerNetwork.NCCN Clinical Practice Guidelines in Oncology:Uterine Neoplasms,V.1.2021.http://www.nccn.org/.
13 Nasioudis D,Ko EM,Kolovos G,et al.Ovarian preservation for low-grade endometrial stromal sarcoma:a systematic review of the literature and meta-analysis.Int J Gynecol Cancer,2019,29:126-132.
14 Bai H,Yang J,Cao D,et al.Ovary and uterus-sparing procedures for low-grade endometrial stromal sarcoma:a retrospective study of 153 cases.Gynecol Oncol,2014,132:654-660.
15 董梦婷,臧玉琴,王颖梅,等.低级别子宫间质肉瘤的内分泌治疗.中国实用妇科与产科杂志,2019,35:238-242.
16 Comert GK,Turkmen O,Kar I,et al.Hormone therapy following surgery in low-grade endometrial stromal sarcoma:Is it related to a decrease in recurrence rate?J Chin Med Assoc,2019,82:385-389.