新生儿出生缺陷是全世界长久以来共同关注的话题,先天性心脏病(congenital heart disease,CHD)则是最常见的胎儿畸形,其发生率位居新生儿缺陷第一位[1]。CHD的发生不仅严重威胁了新生儿的生存质量,也是新生儿死亡的主要原因,中国每年有将近20%以上的CHD新生儿深受复杂、难治、易致死等因素所困扰[1],因此,该疾病的临床预防显得尤为重要。CHD的发病原因复杂,常受多种因素影响,越来越多的研究表明,神经递质5-羟色胺(5-hydroxytryptamine,5-HT)在胚胎心脏发育过程中扮演了重要角色。5-HT,又名血清素,是吲哚类衍生物[2],其主要由色氨酸经色氨酸羟化酶(tryptophan hydroxylase,TPH1)催化生成5-羟色氨酸,再经5-羟色氨酸脱羧酶催化生成,通常与ATP等物质一起储存于肠嗜铬细胞的细胞颗粒内。5-HT作为体内中枢神经系统的神经递质,参与认知、注意、情绪、疼痛、睡眠和觉醒[3],近年来,研究发现5-HT通过参与胚胎发育过程中多种细胞间通讯,与胚胎心脏生长发育密切相关[4],但机制尚不清楚。本文将对5-HT调控人胚胎心脏生长发育的机制进行综述,阐述了5-HT对胚胎心脏产生影响的不同分子机制,从新的角度剖析胚胎心脏发育异常的原因,也为临床预防胚胎心脏发育异常、做好围产期疾病管理等提供新思路,促进孕妇及胎儿的生育健康。
一、胚胎心脏的生长发育过程
心脏是胚胎发育过程中最先形成的器官。人胚胎大约在胎龄第2周末生心区开始分化出围心腔并逐渐生成心管,到第3周末时心管形成,同时循环系统逐步建立。随后,通过扭曲旋转逐渐形成各房室腔及隔膜等结构,第4周末心脏基本外形形成并具有循环作用,至第8周基本完成内部分隔,成为四腔心脏[5]。先天性心血管发育异常主要发生在4~8周这一时期[5]。研究发现,5-HT对胚胎心脏生长发育的调控主要发生在胚胎形成的前8周,并且与其在胎盘和胚胎心脏中的浓度及其信号水平密切相关[6]。
二、胚胎5-HT的来源
基于现有研究发现,胚胎生长发育所需的5-HT主要来源于母体血液循环及胚胎自身合成。当细胞开始表达TPH1时才具备合成5-HT的能力,人胚胎在胎龄55 d时才开始表达TPH1[7],因此,在此之前,早期胚胎生长发育所需的5-HT主要来源于母体血液循环[8]。胎盘是母体与子体物质交换的重要场所,妊娠早期细胞滋养层细胞与合胞体滋养层细胞数量相当,随着妊娠的发展细胞滋养层逐渐融合为合胞体滋养层(synctiotrophoblast,STB)[9],其母体侧可表达与5-HT转运相关的5-HT转运体(serotonin transporter,SERT),当母体血液循环中血小板在胎盘绒毛间隙脱颗粒时,释放的5-HT通过SERT转运进入STB内,进入细胞内的5-HT可能由STB细胞子体侧有机阴离子转运体OCT3转运至子体血液循环中供胚胎发育所需[7]。随着妊娠的发展,胚胎逐步开始表达TPH1合成5-HT,而STB开始表达与5-HT降解有关的单胺氧化酶(monoamine oxidase-A,MAOA),自此大约从妊娠中期开始胚胎发育所需5-HT来源逐渐由母体转换为胚胎自身合成(图1)。因此,在妊娠早期当胚胎所需的5-HT主要来源于母体时,若胎盘转运能力发生改变时可能导致子体5-HT水平出现异常而引起发育异常[8]。

图1 胚胎发育所需5-HT的来源
三、 5-HT在胚胎心脏形成过程中的作用及机制
1. 5-HT对心脏形成的直接影响及其相关机制:5-HT主要与细胞表面的5-HT受体结合,5-HT受体包括7个不同的家族,除了5-HT3受体是配体门控离子通道以外,其余6类均为G蛋白偶联受体(5-HT1,2,4,5,6,7)[3]。
2.5-HT受体介导的分子机制:Ori等[10]应用5-HT受体拮抗剂利坦色林对非洲爪蟾进行发育干预,结果发现利坦色林会引起非洲爪蟾心脏缺陷伴心跳减少和心包水肿等功能缺陷。此外,在多项小鼠研究中发现,5-HT受体基因突变会导致小鼠胚胎心脏缺乏小梁、酪氨酸激酶受体ErbB-2的表达水平特异性降低,最终导致胚胎发育停滞,甚至死亡。因此,5-HT可能通过与5-HT受体结合调控胚胎心脏的发育[11]。
一项以猪为研究对象的实验表明,细胞外信号调节激酶(ERK1/2)可决定主动脉瓣膜间质细胞(valve interstitial cells,VIC)的增殖与活性,当5-HT与5-HT 受体结合后激活Gaq-IP3-PKC信号通路,刺激三磷酸肌醇(IP3)水解,导致细胞内的钙离子和ERK1/2磷酸化增加[12],从而促进纤维母细胞有丝分裂,起到促纤维化作用,并且促进纤维细胞有丝分裂的程度与5-HT浓度相关(图2)[13]。

图2 5-HT通过介导Gap-IP3-PKC通路促纤维母细胞纤维化
此外,5-HT亦可通过激活Gaq-PLC-PKC信号通路影响心脏瓣膜细胞外基质(extracellular matrix,ECM)重构及瓣膜细胞增殖。在绵羊主动脉VIC培养物中,5-HT通过调节Gaq-PLC-PKC信号通路使TGF-β1通路上调[14],导致ECM成分的沉积增加[15],并刺激非经典TGF-β1通路激活多种MAPK(ERK、p38、MAPK和c-jun N末端激酶),使ERK1/2磷酸化,从而调控内皮细胞向间质转化过程,促进心脏成纤维细胞增殖[16]。
因此,基于以上现有研究,5-HT可能通过与5-HT受体结合,调控Gaq-IP3-PKC、Gaq-PLC-PKC信号通路,从而促进纤维细胞有丝分裂及增殖,最终影响胚胎心脏发育[11]。
3. 5-HT与胶原蛋白A的相互作用:ECM是影响胚胎心脏发育的重要因素,当它在重塑时受损时,会使胎儿在出生后继发黏液性瓣膜疾病[17] 。妊娠期间胚胎心脏瓣膜ECM的形成需要5-HT、胶原蛋白A及交联酶转谷氨酰胺酶2(transglutaminase 2,TG 2)共同参与。Sauls等[17]的研究证实,5-HT与胶原蛋白A之间的相互作用会使间质细胞的收缩力增强,导致ECM重塑受损,引起胎儿在出生后继发黏液性瓣膜疾病。此外,体内TG2的活性决定5-HT与胶原蛋白A之间的相互作用,故抑制5-HT-TG2-胶原蛋白A相互作用会影响瓣膜组织大小,最终使胚胎心脏发育异常。
总之,5-HT是胚胎心脏形态发生的重要信号传导分子[18],若拮抗5-HT受体或改变其浓度可能会使VIC中的TGF-β1表达、细胞外信号调节激酶(ERK1/2)的磷酸化以及胶原蛋白A与5-HT相互作用等发生改变,从而使心脏成纤维细胞增殖、ECM重塑受损,最终导致瓣膜纤维化、心脏缺陷及胚胎死亡等不良结局。
4. 5-HT通过胎盘-心脏轴对心脏形成的影响及其相关机制:胎盘是一种用以转运胎儿生长发育所需营养物质、保护胎儿并协调孕妇适应妊娠的体外器官。一直以来,人们对于胎盘发育影响胚胎心脏发育的影响关注较小。近年来,多项研究结果发现,胎盘的生长发育与胚胎心脏发育密切相关。利用无创胎盘血流灌注显像比较正常孕妇与CHD胎儿孕妇的胎盘血流灌注,发现CHD胎儿的全胎盘血流灌注明显降低[19],由此推测胎儿心脏发育与胎盘血液灌流有关。应用小鼠模型敲除与5-HT合成相关的TPH1基因或敲除与5-HT胎盘转运相关的SERT基因,小鼠的胎盘重量均有所减少,且胎盘有大量滋养层细胞发生凋亡,并在小鼠胎盘交界区(海绵滋养层)出现大量坏死、出血及纤维化[20]。此外,胎盘发育异常时胎盘中会缺乏p38-MAPK或PPAR、使胎盘滋养层细胞发生凋亡,进而母体运输至胚胎的氧气及营养物质减少,最终导致心脏缺陷、胚胎心脏发育异常等结局[19,21]。由此,学者们开始关注胎盘发育对于胚胎心脏发育的影响,并提出了“胎盘-心脏轴”的概念,即胎盘发育异常及滋养细胞侵袭会使母体运输到胚胎的氧气及营养物质减少,导致胚胎心脏发育异常[21-22]。
胎盘发育和心脏发育受到许多共同的分子和基因调节,并共有关键的发育途径,这表明其中任何一个发育途径发生改变都可能导致胎盘和胚胎心脏发育异常[19,23]。经典的Wnt/b-catenin途径是心脏和胎盘发育中共享的关键途径之一,胚胎心脏发育中,Wnt信号传导决定了心肌、心脏形态发生、瓣膜形成以及内皮和血管平滑肌细胞增殖[24]。一项关于非洲爪蟾的实验证明,5-HT 参与Wnt的信号传导[25],而另一项针对Wnt调节因子的全基因组siRNA筛查实验[26]则根据三类5-HT受体设想了三种5-HT信号传导对Wnt途径的激活作用:(1)5-HT受体介导了配体或受体跨膜运输;(2)5-HT也可以作为共受体;(3)5-HT会对Wnt信号核糖体产生影响。由于胎盘是5-HT合成与转运的的重要场所,当胎盘发育异常时,5-HT的合成与转运也会随之降低。故胎盘发育异常会使胚胎侧的5-HT水平下降,进而影响Wnt途径的激活,最终导致胚胎心脏发育异常[19,27]。
四、结论
综上所述,在胚胎心脏发育的过程中,5-HT虽有母体转运、胎盘及自身合成等来源,但对于人类而言,妊娠早期发育所需的5-HT主要来源于母体,且对胚胎心脏的发育尤为重要。通过5-HT发挥作用的途径不同,其对胚胎心脏发育的影响可分为直接作用与间接作用。直接作用主要是胚胎侧的5-HT通过5-HT受体上调/下调G蛋白受体信号通路或改变5-HT与纤维蛋白A之间的相互作用等分子机制对胚胎生心区的发生、心脏双轴的建立、心肌增殖、瓣膜发育等心脏形态进行调节。间接作用则是5-HT通过“胎盘-心脏轴”对胚胎心脏发育产生影响,包括调控Wnt信号传导、改变胎盘滋养层细胞功能及胎盘血流灌注程度等影响胚胎心脏发育(图3)。针对5-HT改变引起胚胎心脏发育异常的机制,虽有研究数据佐以论证,但仍需进一步研究。
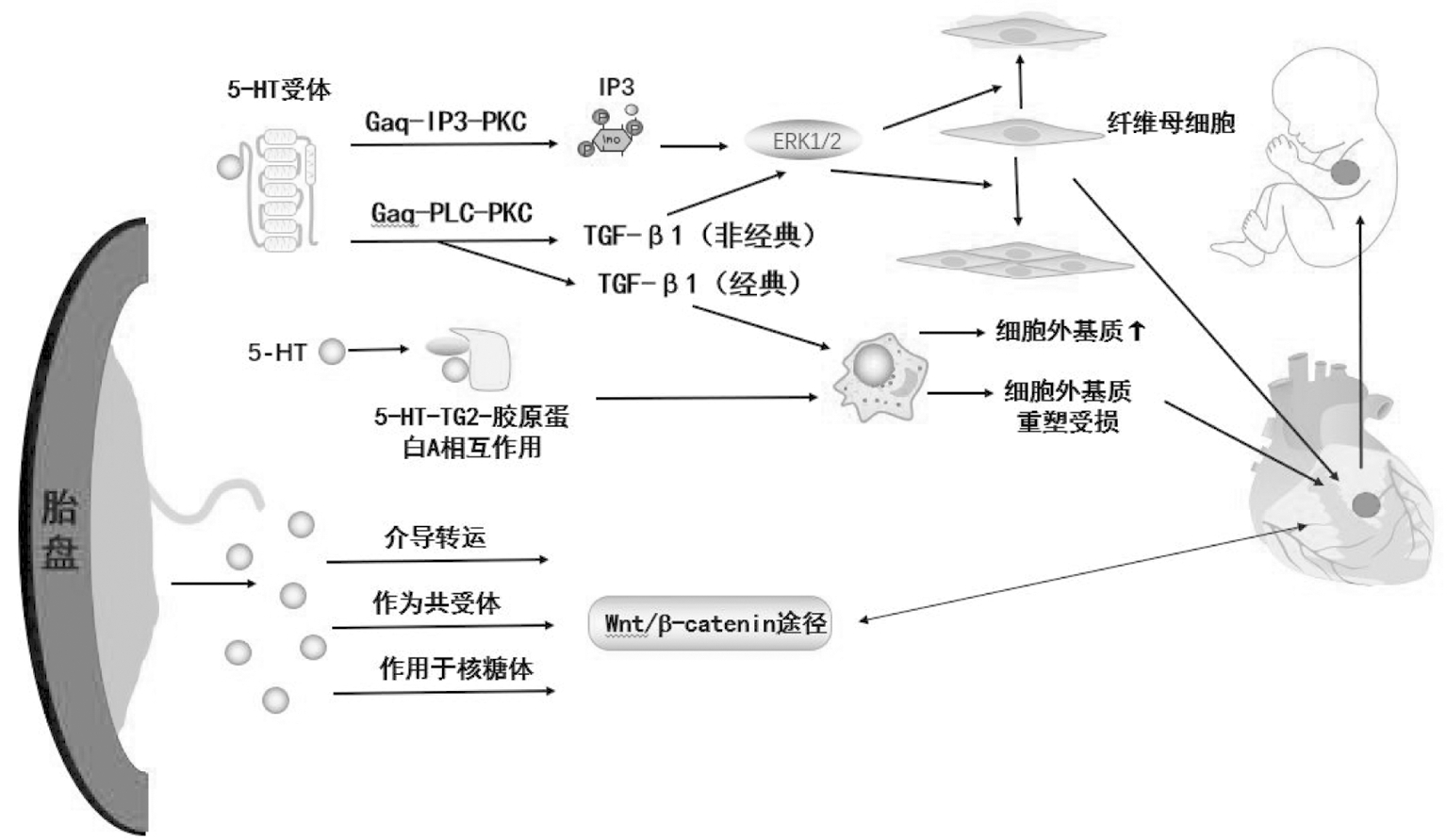
图3 5-HT在胚胎心脏发育的过程中的作用及其相关机制
1 李永鹏.胎儿心脏发育与孕周关系曲线构建.安徽 合肥:安徽医科大学,2019.
2 Fouquet G,Coman T,Hermine O,et al.Serotonin,hematopoiesis and stem cells.Pharmacol Res,2019,140:67-74.
3 Tierney AJ.Feeding,hunger,satiety and serotonin in invertebrates.Proc Biol Sci,2020,287:20201386.
4 Cui S,Park H,Park H,et al.The Role of Serotonin in Ventricular Repolarization in Pregnant Mice.Yonsei Med J,2018,59:279-286.
5 王卫平,孙锟,常立文.儿科学.第9版.北京:人民卫生出版社,2018:264-266.
6 Laurent L,Huang C,Ernest SR, et al.In utero exposure to venlafaxine,a serotonin-norepinephrine reuptake inhibitor,increases cardiac anomalies and alters placental and heart serotonin signaling in the rat.Birth Defects Res A Clin Mol Teratol,2016,106:1044-1055.
7 Kliman HJ,Quaratella SB,Setaro AC,et al.Pathway of Maternal Serotonin to the Human Embryo and Fetus.Endocrinology,2018,159:1609-1629.
8 Laurent L,Deroy K,St-Pierre J,et al.Human placenta expresses both peripheral and neuronal isoform of tryptophan hydroxylase.Biochimie,2017,140:159-165.
9 李继承,曾园山.组织学与胚胎学.第 9版.北京:人民卫生出版社,2018:206-210.
10 Ori M,De Lucchini S,Marras G,et al.Unraveling new roles for serotonin receptor 2B in development:key findings from Xenopus.Int J Dev Biol,2013,57:707-714.
11 Ayme-Dietrich E,Lawson R,Da-Silva S,et al.Serotonin contribution to cardiac valve degeneration:new insights for novel therapies?.Pharmacol Res,2019,140:33-42.
12 Fitzgerald LW,Burn TC,Brown BS,et al.Possible role of valvular serotonin 5-HT(2B) receptors in the cardiopathy associated with fenfluramine.Mol Pharmacol,2000,57:75-81.
13 Rajamannan NM,Caplice N,Anthikad F,et al.Cell proliferation in carcinoid valve disease:a mechanism for serotonin effects.J Heart Valve Dis,2001,10:827-831.
14 Hutcheson JD,Setola V,Roth BL,et al.Serotonin receptors and heart valve disease--it was meant 2B.Pharmacol Ther,2011,132:146-157.
15 Jian B,Xu J,Connolly J,et al.Serotonin mechanisms in heart valve disease I:serotonin-induced up-regulation of transforming growth factor-beta1 via G-protein signal transduction in aortic valve interstitial cells.Am J Pathol,2002,161:2111-2121.
16 Hutcheson JD,Ryzhova LM,Setola V,et al.5-HT(2B) antagonism arrests non-canonical TGF-β1-induced valvular myofibroblast differentiation.J Mol Cell Cardiol,2012,53:707-714.
17 Sauls K,de Vlaming A,Harris BS,et al.Developmental basis for filamin-A-associated myxomatous mitral valve disease.Cardiovasc Res,2012,96:109-119.
18 Sadler TW.Selective serotonin reuptake inhibitors (SSRIs) and heart defects:Potential mechanisms for the observed associations.Reprod Toxicol,2011,32:484-489.
19 Maslen CL.Recent Advances in Placenta-Heart Interactions.Front Physiol,2018,9:735.
20 Rosenfeld CS.Placental serotonin signaling,pregnancy outcomes,and regulation of fetal brain development†.Biol Reprod,2020,102:532-538.
21 Huhta J,Linask KK.Environmental origins of congenital heart disease:the heart-placenta connection.Semin Fetal Neonatal Med,2013,18:245-250.
22 Adams RH,Porras A,Alonso G,et al.Essential role of p38alpha MAP kinase in placental but not embryonic cardiovascular development.Mol Cell,2000,6:109-116.
23 Hemberger M,Cross JC.Genes governing placental development.Trends Endocrinol Metab,2001,12:162-168.
24 Gessert S,Kühl M.The multiple phases and faces of wnt signaling during cardiac differentiation and development.Circ Res,2010,107:186-199.
25 Fukumoto T,Kema IP,Levin M.Serotonin signaling is a very early step in patterning of the left-right axis in chick and frog embryos.Curr Biol,2005,15:794-803.
26 Beyer T,Danilchik M,Thumberger T,et al.Serotonin signaling is required for Wnt-dependent GRP specification and leftward flow in Xenopus.Curr Biol,2012,22:33-39.
27 Linask KK.The heart-placenta axis in the first month of pregnancy:induction and prevention of cardiovascular birth defects.J Pregnancy,2013,2013:320413.