不孕不育在育龄期夫妇的发生率为8%~12%,其中,因男方因素导致的不孕不育病例约占所有病例的50%。导致男性不育的因素包括睾丸功能障碍、睾丸前因素和睾丸后因素,睾丸前因素包括低促性腺激素性性腺功能减退和垂体相关疾病;睾丸后因素包括所有精道梗阻性病变、先天性输精管缺如、感染、炎症及自身免疫性疾病等。睾丸功能障碍病因复杂,包括染色体数目及结构异常、无睾症、隐睾及继发性睾丸功能障碍[1],其中染色体因素在少弱精患者中的发生率为5%~15%,最常见的染色体异常为克氏综合征(47,XXY),可见于14%的无精症患者[2],其次为Y染色体微缺失(8.3%)[3]、染色体平衡易位(0.9%),罗氏易位(0.09%)。
染色体平衡易位(又称相互易位),指非同源染色体发生片段交换后,遗传物质未发生增加或减少[4]。因此平衡易位携带者大多表型正常,但可对其生殖系统功能产生影响,导致不孕不育、自然流产、胎儿生长发育延迟和先天畸形等,染色体平衡易位在一般人群中的患病率为0.123%,在不育男性中患病率较高,为1.62%[5]。目前认为染色体平衡易位导致不育的机制包括:(1)易位后染色体形成四分体的机制及时间限制阻碍减数分裂的正常进行;(2)由于遗传物质的不平衡分离,导致减数分裂失败,异常生殖细胞被清除;(3)染色体分离过程中产生不平衡配子,影响受精卵形成及妊娠;(4)易位片段与X和Y染色体进行配对时,会干扰X染色体的失活,从而发生致死性基因剂量效应;(5)易位染色体与细胞核其他成分的相互作用导致减数分裂错误与细胞死亡[6]。
近年来关于染色体结构异常与男性精液参数相关性的研究结果提示:存在染色体结构异常的男性携带者的精子密度、精子活率及前进精子率较正常对照组男性低,且罗氏易位携带者与常染色体平衡易位携带者相比,罗氏易位携带者的精液分析相关参数更低[7-8]。但之前的研究仅分析了常染色体间平衡易位,未探讨Y染色体-常染色体平衡易位与男性精液质量间的相关性。
因此,本文旨通过一项回顾性队列研究,收集2019年1月至2021年12月于北京大学第三医院生殖中心就诊且染色体核型分析诊断为Y染色体平衡易位的男性病例资料进行分析,并以同期间内染色体核型结果正常(46, XY)的男性病例作为对照。通过两组间比较,分析Y染色体与常染色体间平衡易位与男性精液质量的相关性,为Y染色体平衡易位患者的临床诊治提供一定建议。
资料与方法
一、研究资料
回顾分析2019年1月—2021年12月于北京大学第三医院生殖中心就诊男性患者病历资料,筛选出携带Y染色体平衡易位的病例作为病例组。对照组选择同期因女方家族遗传性单基因遗传病而前往本中心进行胚胎植入前遗传学检测(PGT-M)的夫妇中的男方,并且染色体核型分析结果正常者。纳入标准:(1)年龄24~40周岁;(2)完成染色体核型检查,核型结果为存在Y染色体平衡易位的病例组,或核型分析正常(46, XY)的对照组;(3)完成至少一次精液常规检测,精子形态学检测。排除标准:(1)排除复杂染色体结构变异及Y染色体微缺失的患者;(2)排除严重肝肾功能障碍,梅毒、人类免疫缺陷病毒、腮腺炎、睾丸炎、附睾炎、支原体、衣原体感染、精索静脉曲张、先天性双侧输精管缺如及其他解剖结构变异等可能对男性精液质量造成影响的因素。本研究通过了北京大学第三医院伦理委员会批准(2022SZ-003)。
二、方法
1.G显带染色体核型分析:每位患者采集外周血2 mL于肝素抗凝管中,按照常规方法进行细胞接种培养、秋水仙素终止培养、低渗、预固定及固定、滴片、消化、染色等步骤。每个样本在显微镜下观察计数20个分散较好,处于中期分裂相的细胞。
2.精液常规检查:所有男性均禁欲3~7 d后进行手淫法采集精液于一次性无菌广口杯中,并于5 min内置于37 ℃温箱孵育液化30 min。对精液的相关参数进行检测,包括精液体积、精子密度、精子总数、精液总活率、前向运动精子百分率等进行检测。精液常规检查指标参照世界卫生组织《人类精液检查处理实验手册》(第五版)[9]。
3.统计学分析:比较两组间精液常规质量,包括精子的数量、活率以及形态学检测,分析Y染色体与常染色体间平衡易位与男性精液质量的相关性。使用Kolmogorov-Smirnov test及Shapiro-Wilk test对于连续变量的正态性进行分析。Mann-Whitney U test用于非正态分布资料的两组间比较,Chi-square检验用于分类变量的组间比较。统计学分析过程使用SPSS 24.0版本,当P<0.05认为差异有统计学意义。
结 果
一、本研究纳入患者基本情况
本研究回顾性纳入Y染色体平衡易位男性患者14例,染色体核型正常的对照组男性185例。两组患者的基本信息见表1,经统计学分析两组患者在年龄、身高、体重、BMI、吸烟、酗酒情况方面均无统计学差异。
表1 两组间男性基本情况[M(P25, P75)]
Table 1 Baseline data of two group males[M(P25, P75)]
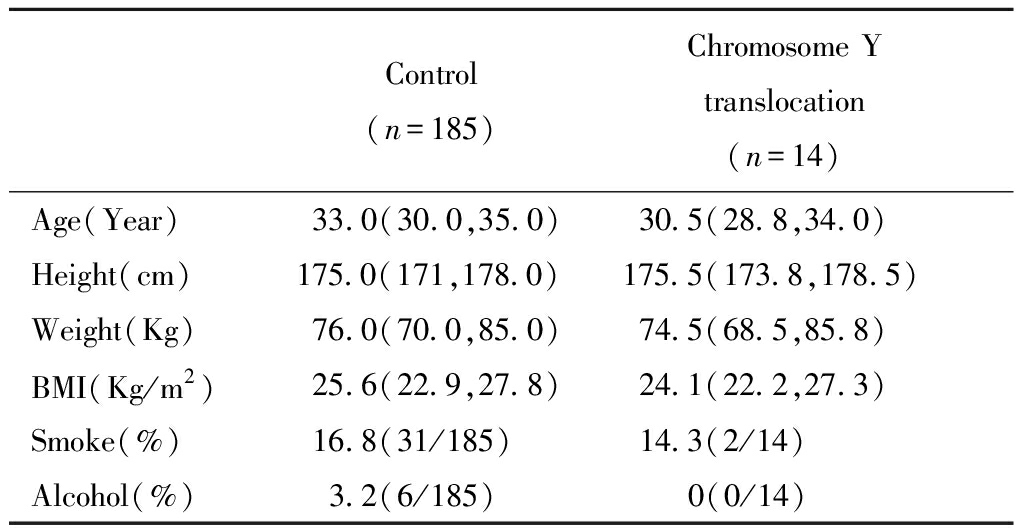
Control(n=185)Chromosome Y translocation (n=14) Age(Year)33.0(30.0,35.0)30.5(28.8,34.0)Height(cm)175.0(171,178.0)175.5(173.8,178.5)Weight(Kg)76.0(70.0,85.0)74.5(68.5,85.8)BMI(Kg/m2)25.6(22.9,27.8)24.1(22.2,27.3)Smoke(%)16.8(31/185)14.3(2/14)Alcohol(%) 3.2(6/185) 0(0/14)
二、14例Y染色体平衡易位患者核型结果及精液质量分析
14例Y染色体平衡易位患者核型结果及精液质量如表2所示,有7例(50%)精液检查为无精症,其中5位患者接受睾丸穿刺取精,3例患者病理结果未见精子,有2例患者病理结果提示偶见个别精子。有7例(50%)患者为严重少弱畸形精子症,正常形态精子百分率均为0%。
表2 Y染色体平衡易位患者核型分析及精液质量
Table 2 Karyotype and semen quality of chromosome Y translocation patients
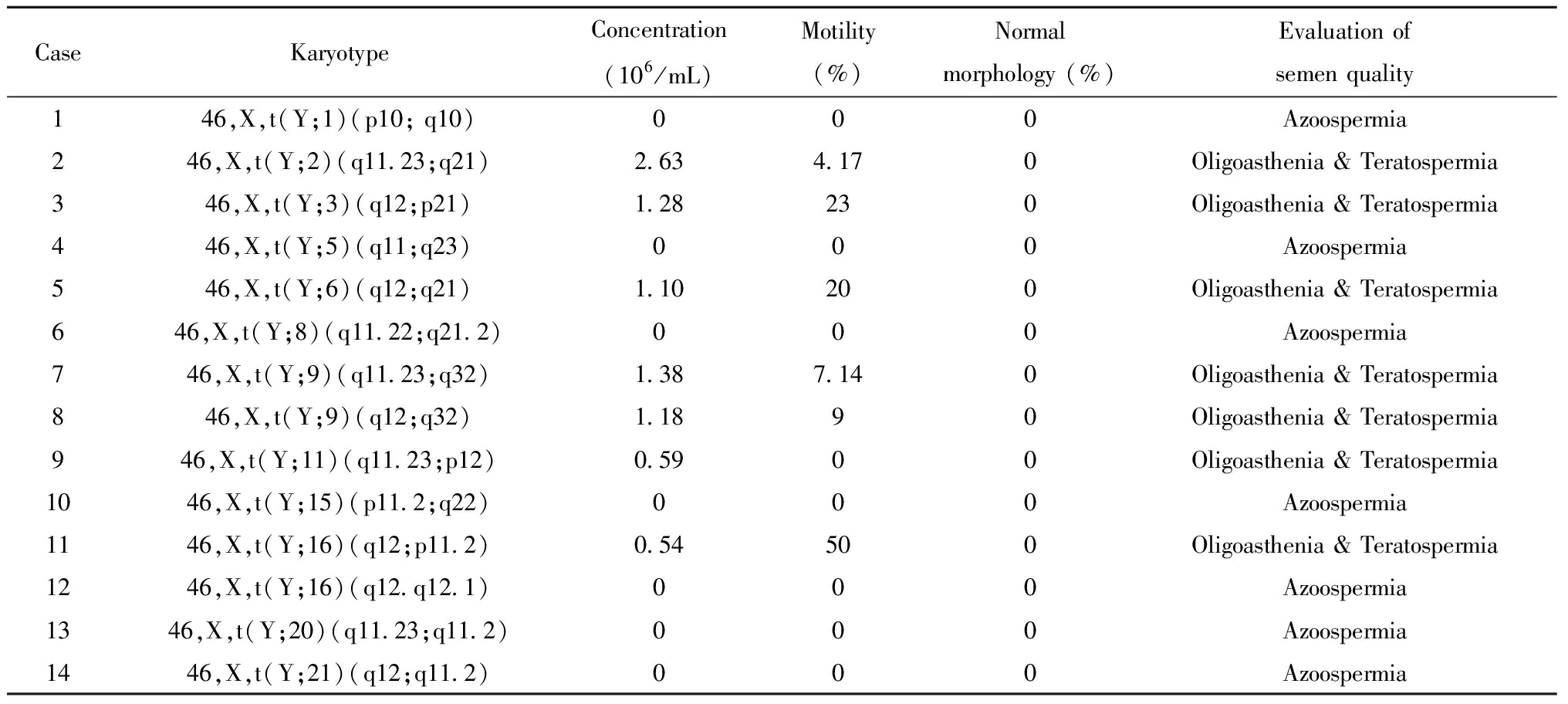
CaseKaryotypeConcentration(106/mL)Motility(%)Normal morphology (%)Evaluation of semen quality146,X,t(Y;1)(p10; q10)000Azoospermia246,X,t(Y;2)(q11.23;q21)2.634.170Oligoasthenia & Teratospermia346,X,t(Y;3)(q12;p21)1.28230Oligoasthenia & Teratospermia446,X,t(Y;5)(q11;q23)000Azoospermia546,X,t(Y;6)(q12;q21)1.10200Oligoasthenia & Teratospermia646,X,t(Y;8)(q11.22;q21.2)000Azoospermia746,X,t(Y;9)(q11.23;q32)1.387.140Oligoasthenia & Teratospermia846,X,t(Y;9)(q12;q32)1.1890Oligoasthenia & Teratospermia946,X,t(Y;11)(q11.23;p12)0.5900Oligoasthenia & Teratospermia1046,X,t(Y;15)(p11.2;q22)000Azoospermia1146,X,t(Y;16)(q12;p11.2)0.54500Oligoasthenia & Teratospermia1246,X,t(Y;16)(q12.q12.1)000Azoospermia1346,X,t(Y;20)(q11.23;q11.2)000Azoospermia1446,X,t(Y;21)(q12;q11.2)000Azoospermia
三、两组间精子质量比较
本研究对于精液质量的评估主要从精子量(精子密度、精子总数),精子活力(精子总活力、前向运动精子百分率),精子形态(正常形态精子百分率)三方面进行。比较两组间各项精子评估指标结果如表3所示。除了精液体积外,Y染色体平衡易位组患者精子密度、数量、活力以及正常形态精子的百分率均低于染色体核型正常的对照组,并具有统计学意义。
表3 两组男性精液质量比较[M(P25, P75)]
Table 3 Comparison of semen quality in two groups[M(P25, P75)]
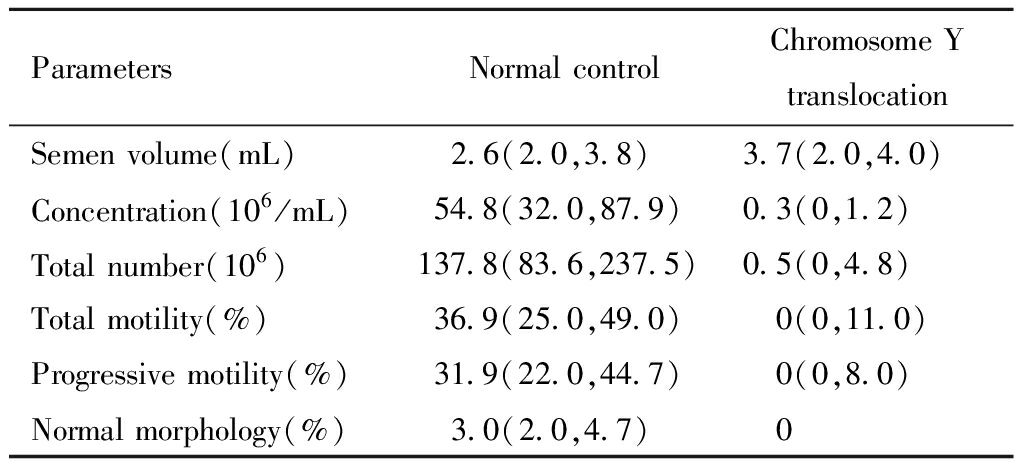
ParametersNormal controlChromosome Y translocationSemen volume(mL) 2.6(2.0,3.8)3.7(2.0,4.0)Concentration(106/mL)54.8(32.0,87.9)0.3(0,1.2)Total number(106)137.8(83.6,237.5)0.5(0,4.8)Total motility(%)36.9(25.0,49.0) 0(0,11.0)Progressive motility(%)31.9(22.0,44.7) 0(0,8.0)Normal morphology(%) 3.0(2.0,4.7) 0
四、Y染色体平衡易位断裂点高发区带
针对14例Y染色体平衡易位患者断裂点进行统计(图1),有2例位于Y染色体短臂,有12例位于Y染色体长臂区域,其中6例断裂点位于Yq12区域,有4例断裂点位于Yq11.23,为相对高频的断裂点发生区域。
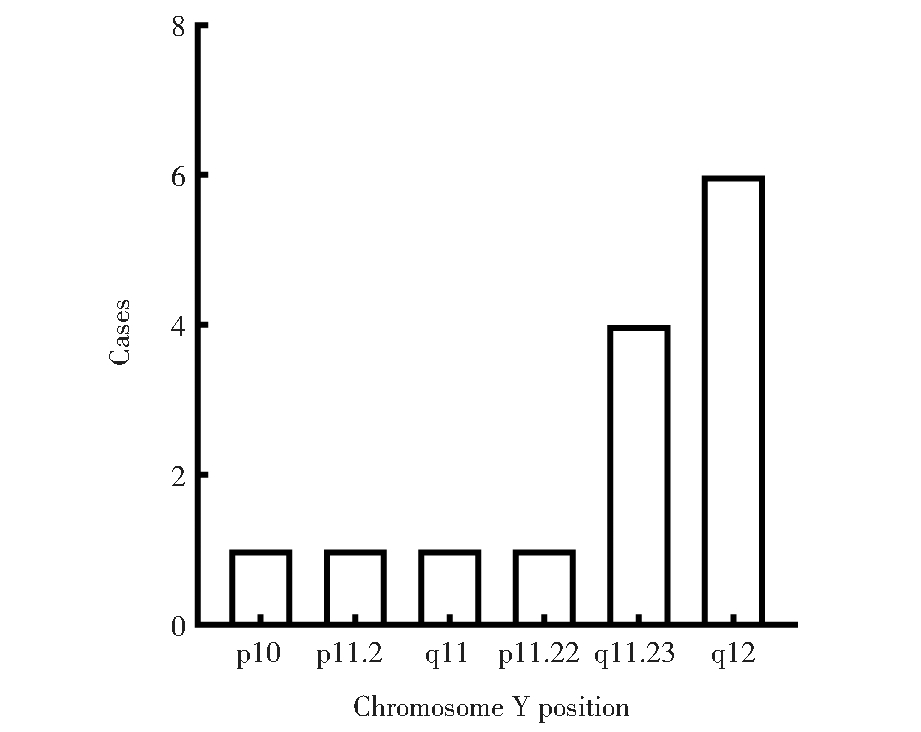
图1 14例Y染色体平衡易位断裂点区带分析
Figure 1 14 cases Chromosome Y translocation position analysis
讨 论
染色体平衡易位是常见的染色体结构变异类型。由于染色体平衡易位仅导致染色体片段位置的变化,遗传物质总量未发生变化,因此平衡易位携带者出现异常表型的频率较低,绝大多数患者的外貌、发育和智力等均正常。平衡易位携带者在减数分裂产生配子时,可以形成四射体,在减数第一次分裂过程中染色体共有三种分离方式2∶2、3∶1、4∶0,共有18种配子形式产生。但当染色体平衡易位携带者与染色体正常人婚配时,由于不平衡配子的产生,可能会导致反复胚胎着床失败、胚胎停育或畸形等不良孕产史。目前研究发现在有不良孕产史和不孕夫妇中染色体平衡易位的发生率显著高于一般人群的发生率,在有≥3次自然流产史的夫妇中的发生率约为4.7% [10]。
目前研究表明染色体平衡易位对于男性精液质量也有一定影响。Mayeur的 团队2019年发表的一项研究分析了81例平衡易位男性患者的精液指标,包括精子密度,精子总数,精子活率和前向运动精子的百分率,结果提示平衡易位携带者的精子密度、精子总数及精子活率显著低于染色体核型正常并且已生育健康后代的染色体核型正常对照组男性[7]。Chen的团队发表的一项纳入了723例染色体平衡易位患者精液质量情况的研究也显示染色体平衡易位组男性的精液密度、精子总数、精液活力、前向运动精子活率均显著低于染色体核型正常的对照组[8]。
既往研究均只纳入了常染色体间平衡易位的男性患者,目前尚无团队对性染色体平衡易位与男性精液质量之间的相关性进行分析。在本研究期间由于涉及X染色体平衡易位的患者例数较少,因此,本研究旨在分析Y染色体平衡易位与男性精液质量的相关性。据文献报道Y-常染色体易位在一般男性人群中的发病率约为1/2 000,其中可能包括Y染色体-常染色体间平衡和非平衡的易位[11]。本研究共纳入14名Y染色体平衡易位的患者和185名染色体核型正常的对照组男性,经分析Y染色体平衡易位组男性精液密度、精子活率和正常形态精子百分率均低于对照男性组。
Y染色体是决定男性性别和精液生成过程的关键染色体,已经发现位于Y染色体的多个基因在性别决定和精子生成过程中发挥关键作用。目前已知Yp11.2区域包括SRY、TSPY基因参与调控性别决定以及男性生精过程;Yq11.221中包括AZFa区域,其中涵盖男性生精相关USP9Y基因;Yq11.222-Yq11.23区域包括AZFb和AZFc区,其中涵盖DAZ、RBMY、BPY2、CDY等参与精子发生过程的基因[12-13]。Yq12为Y染色体长臂外侧2/3的区域,是由非编码的高度重复序列构成的异染色质区,目前尚未发现参与精子发生的相关基因。一项个案报道Yq12区域缺失的男性(排除已知生精基因的缺失)表现为少弱精子症[14]。但目前对于Yq12区域的具体功能尚不清楚。根据表2所示,断裂点涉及Yp11.2、Yq11.22、Yq11.23的患者精液检测提示为无精子症或者严重少弱畸形精子症,断裂点刚好位于无精症因子所在区域,不排除该处断裂点可能影响无精症因子区的结构和功能。14例中有7例患者精液常规完全未见精子,其中5例患者接受睾丸穿刺取精后,有3例未获得精子并且病理结果提示生精小管内无精子产生,另外2例患者睾丸穿刺取精过程中精子极难找,病理结果提示生精小管内偶见个别精子。根据目前结果,由于Y染色体平衡易位导致无精症患者的临床预后较差,很难获得可用精子,因此供精助孕是获得后代的可能途径之一。
Y染色体平衡易位患者精液质量更差的可能原因包括:(1)遗传物质的不平衡分离,导致减数分裂失败,异常生殖细胞被清除;(2)易位片段与X和Y染色体进行配对时,会干扰X染色体的失活,从而发生致死性基因剂量效应;(3)Y染色体作为性染色体,包括更多参与生精过程的关键基因,平衡易位的发生可能影响基因的表达或调控[6]。
本研究的局限性包括回顾性收集了14例Y染色体平衡易位的男性患者,样本量相对较小;部分无精症患者未接受睾丸穿刺取精手术;缺少两组间临床辅助生殖助孕结局的统计。本研究针对Y染色平衡易位与男性精液质量之间的相关性进行了统计分析,发现几乎所有Y染色体平衡易位患者的精液在数量,活力及形态学指标均相对较差,部分患者睾丸穿刺取精后病理结果显示未见或偶见个别精子,提示其预后较差,为此类患者的临床决策及后续治疗提供一定信息和依据。
1 Katz DJ,Teloken P,Shoshany O.Male infertility-The other side of the equation.Aust Fam Physician,2017,46:641-646.
2 Sudhakar D,Shah R,Gajbhiye RK.Genetics of male infertility-present and future:A narrative review.J Hum Reprod Sci,2021,14:217-227.
3 Zhu XB,Gong YH,He J,et al.Multicentre study of Y chromosome microdeletions in 1,808 Chinese infertile males using multiplex and real-time polymerase chain reaction.Andrologia,2017,49.
4 Morin SJ,Eccles J,Iturriaga A,et al.Translocations,inversions and other chromosome rearrangements.Fertil Steril,2017,107:19-26.
5 Zhang HG,Wang RX,Li LL,et al.Male carriers of balanced reciprocal translocations in Northeast China:sperm count,reproductive performance,and genetic counseling.Genet Mol Res,2015,14:18792-18798.
6 Shah K,Sivapalan G,Gibbons N,et al.The genetic basis of infertility.Reproduction,2003,126:13-25.
7 Mayeur A,Ahdad N,Hesters L,et al.Chromosomal translocations and semen quality:A study on 144 male translocation carriers.Reprod Biomed Online,2019,38:46-55.
8 Chen X,Zhou C.Reciprocal translocation and Robertsonian translocation in relation to semen parameters:A retrospective study and systematic review.Andrologia,2022,54:e14262.
9 World Health Organization.WHO laboratory manual for the examination and processing of human semen.5th ed.Geneva:World Health Organization,2010.
10 王昊.两条染色体平衡易位携带者配子类型的理论分析.中国优生与遗传杂志,2011,19:1-2,8.
11 Wang D,Chen R,Kong S,et al.Cytogenic and molecular studies of male infertility in cases of Y chromosome balanced reciprocal translocation.Mol Med Rep,2017,16:2051-2054.
12 Subrini J,Turner J.Y chromosome functions in mammalian spermatogenesis.Elife,2021,10.
13 Dhanoa JK,Mukhopadhyay CS,Arora JS.Y-chromosomal genes affecting male fertility:A review.Vet World,2016,9:783-791.
14 邵敏杰,张小为,陈咏健,等.Y染色体末端缺失患者的细胞遗传学及分子生物学分析.中国优生与遗传杂志,2006,14:38-39,2,封4.