妊娠期糖尿病(gestational diabetes mellitus,GDM)指妊娠前糖代谢正常,妊娠期才出现的糖尿病[1]。中国GDM发病率约为14.8%[2]。既往研究提示母亲的高血糖症影响胎儿代谢,与大于胎龄儿或巨大儿相关[3-6]。但目前宫内暴露于GDM与子代出生后体格生长的关联研究有限,且对不同月龄体格生长的影响尚无一致结论[7-8]。有研究表明宫内暴露于GDM与子代出生后0~6个月体格生长相关[9],但有些研究发现宫内暴露于GDM与子代0~2岁的体格发育无统计学关联[10-11]。也有研究发现宫内暴露于GDM与子代出生后体格生长指标的增长速度相关,但相关研究数量较少[7]。
本研究采用前瞻性队列研究设计,从队列中子代出生开始,通过多次随访收集子代体格生长数据,探索GDM与子代0~8月龄体格生长的关联。
对象与方法
一、研究对象
本研究对象来自一个前瞻性孕妇队列,该队列在北京市海淀区妇幼保健院建立。研究对象的纳入标准为:(1)孕妇在北京市海淀区妇幼保健院建立孕期健康档案,并在本院进行产检和分娩;(2)入组时孕周小于20周;(3)孕妇无严重的精神心理疾病或其他严重疾病;(4)填写知情同意,愿意参与本研究的问卷调查或生物样本采集。孕妇队列在2017年10月—2019年11月共招募4 052名孕妇,其中1 203名孕妇完成了生物样本检测,本研究排除了21例双胎和13例子代出生缺陷的孕妇后,从检测生物样本的孕妇中随机选取了845名,连同其分娩的子代纳入研究。抽取的母婴对基本特征与原队列人群无统计学差异。本研究在子代出生时、产后42 d、3月龄、5月龄和8月龄进行了5次随访,各随访节点分别有845、475、304、159、131名研究对象完成了随访内容。本研究获得北京大学生物医学伦理委员会批准(批件号:IRB00001052-19033-持1+PV)。
二、资料收集方法
1.问卷调查:孕妇被招募进入队列时填写问卷,收集的信息包括孕妇身高、孕前体重、民族、受教育程度、手术史、本次妊娠的异常情况、吸烟和被动吸烟等。
2.临床资料收集:临床资料来自北京市海淀区妇幼保健院的电子信息系统。收集孕妇的末次月经日期、孕产史、每次产检日期及产检结果、妊娠期并发症的诊断以及分娩结局、分娩方式、分娩并发症、孕次、产次;收集新生儿的出生日期、分娩时的孕周、性别、出生体重、出生身长。收集婴儿出生后每次在北京市海淀区妇幼保健院儿童早期发展门诊进行常规体检的身长、体重、疾病信息。
3.GDM的诊断:孕妇在孕24~28周期间到医院进行75 g葡萄糖耐量检查。如果孕妇空腹血糖≥5.1 mmol/L, 或服糖后1 h血糖≥10 mmol/L,或2 h血糖≥8.5 mmol/L,即被诊断为GDM[12]。
4.体格生长指标:根据WHO的体格评价标准(World Health Organization child growth references)[13]分别计算计算研究对象婴儿在出生时、出生后42 d、3个月、5个月、8个月时的年龄别体重Z评分(weight for age Z score, WAZ)、年龄别身长Z评分(length for age Z score,LAZ)以及身长别体重Z评分(weight for length Z score,WLZ)。
三、统计分析
分类变量用频数和百分比描述。采用Kolmogorov-Smirnov法检验两组数据是否符合正态分布,正态分布的连续变量采用均数±标准差描述,不符合正态分布的连续变量采用中位数(四分位数间距)描述。计量资料的组间比较采用独立样本t检验或单因素方差分析,计数资料的组间比较采用卡方检验或Fisher确切概率法。
本研究首先采用线性混合模型分析GDM(二分类变量,有=1/无=0)对子代0~8月龄体格指标Z评分(WAZ、LAZ、WLZ)的影响,由于既往文献提示,GDM对体格生长影响的效应在不同月龄存在差异,因此本研究进一步按照子代年龄分层分析,分别以每个月龄的WAZ、LAZ、WLZ为结局,拟合多元线性回归模型。本研究在多因素线性混合模型中调整了孕前BMI(连续变量)、母亲分娩时年龄(连续变量)、产次(初产=0/经产=1)、分娩时孕周(连续变量)、母亲受教育程度(大专及以下=1/大学本科=2/硕士及以上=3)、民族(汉族=1/少数民族=2)、婴儿性别(男=1/女=2)、子代年龄(连续变量);在分层分析的多元线性回归模型中调整了孕前BMI(连续变量)、母亲分娩时年龄(连续变量)、产次(初产=0/经产=1)、分娩时孕周(连续变量)、母亲受教育程度(大专及以下=1/大学本科=2/硕士及以上=3)、民族(汉族=1/少数民族=2)、婴儿性别(男=1/女=2)。
本研究有44个研究对象的孕前BMI值缺失,由于缺失小于5%,采用其它研究对象孕前BMI的均值进行填补。
采用R软件(4.0.3)进行数据整理和分析,本研究中所有统计学检验均为双侧检验,P<0.05为差异具有统计学意义。
结 果
一、研究对象的基本特征
本研究共纳入845对母婴对。其中母亲患GDM的有137对,占总数的16.2%.母亲患GDM与未患GDM的母婴对基本特征比较见表1。与非GDM组相比,GDM组的母亲,分娩时年龄在35岁及以上所占比例大(16.8% vs 29.9%,P<0.001),经产妇所占比例大(19.6% vs 28.5%,P=0.020),分娩时孕周小(39.6 vs 39.1周,P<0.001),两组的其余特征未见统计学差异。
表1 母亲患GDM与未患GDM的母婴对基本特征比较[例(%)]
Table 1 Characteristics of GDM-exposed mother-child dyads vs unexposed dyads[n(%)]
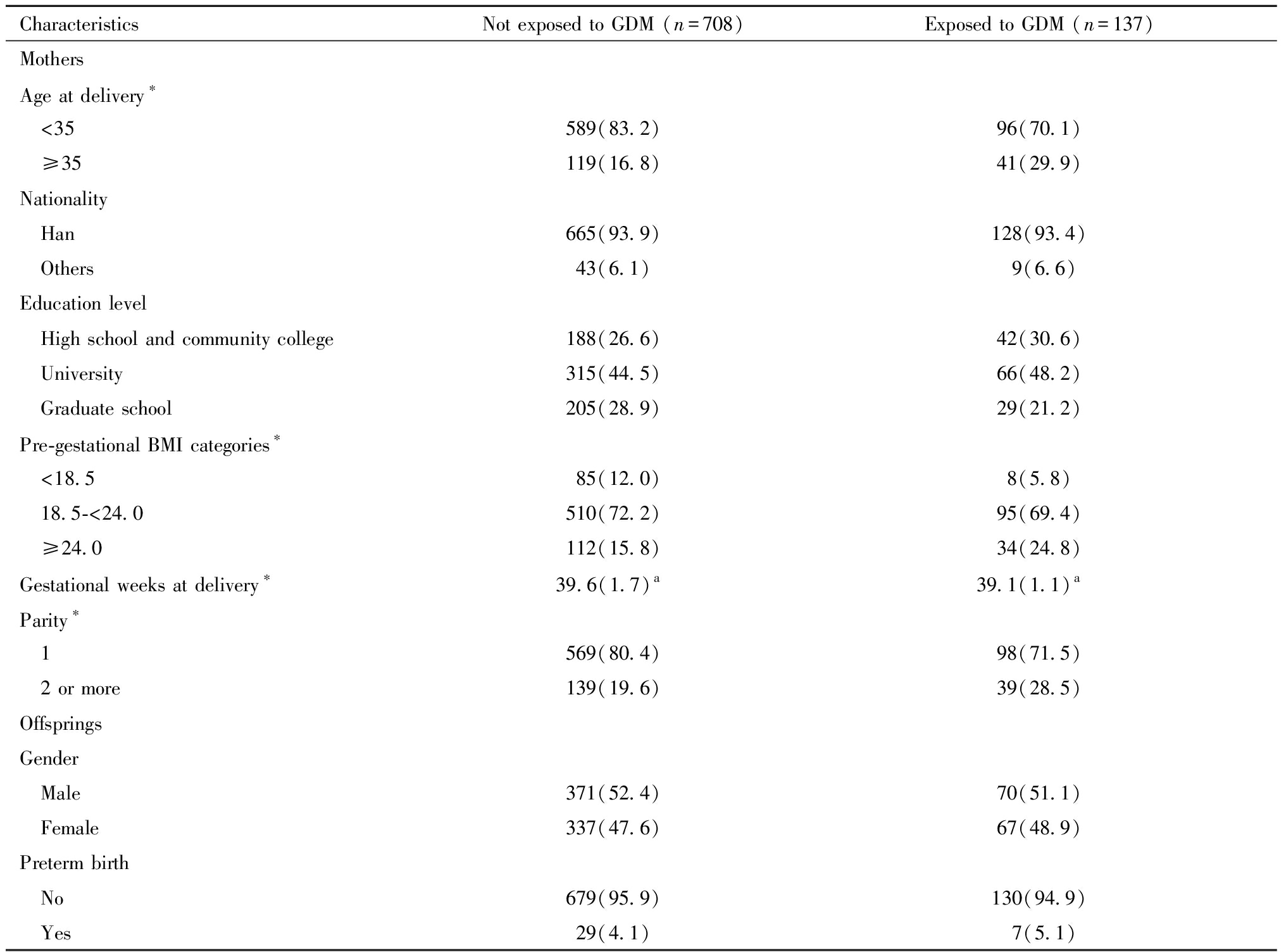
CharacteristicsNot exposed to GDM (n=708) Exposed to GDM (n=137)MothersAge at delivery∗ <35589(83.2)96(70.1) ≥35119(16.8)41(29.9)Nationality Han665(93.9)128(93.4) Others43(6.1)9(6.6)Education level High school and community college188(26.6)42(30.6) University315(44.5)66(48.2) Graduate school205(28.9)29(21.2)Pre-gestational BMI categories∗ <18.585(12.0)8(5.8) 18.5-<24.0510(72.2)95(69.4) ≥24.0112(15.8)34(24.8)Gestational weeks at delivery∗39.6(1.7)a 39.1(1.1) a Parity∗ 1569(80.4)98(71.5) 2 or more139(19.6)39(28.5)OffspringsGender Male371(52.4)70(51.1) Female337(47.6)67(48.9)Preterm birth No679(95.9)130(94.9) Yes29(4.1)7(5.1)
Note:*P<0.05; a Median(Interquartile Range)
二、各月龄随访情况和体格生长特征
表2显示了各次随访观察到子代体格生长指标的人数和基本特征,并比较了5次随访所观察到的研究对象特征是否相同。42 d、3月龄、5月龄、8月龄观察到结局的人数占研究对象总数的百分比分别为:475(56.2%)、304(36.0%)、159(18.8%)和131(15.5%)。对5次随访观察到结局的研究对象特征进行比较,各组的GDM组所占百分比、出生时的WAZ、LAZ、WLZ,分娩时年龄、母亲民族、受教育程度、子代性别、是否为早产儿均未见统计学差异(P>0.05),可以认为5次随访观察到的研究对象来自同一个总体。
表2 参加各次随访的母婴对与分娩时随访到的全部母婴对特征比较[例(%)]
Table 2 Characteristics of mother-child dyads at birth vs at each follow-up[n(%)]
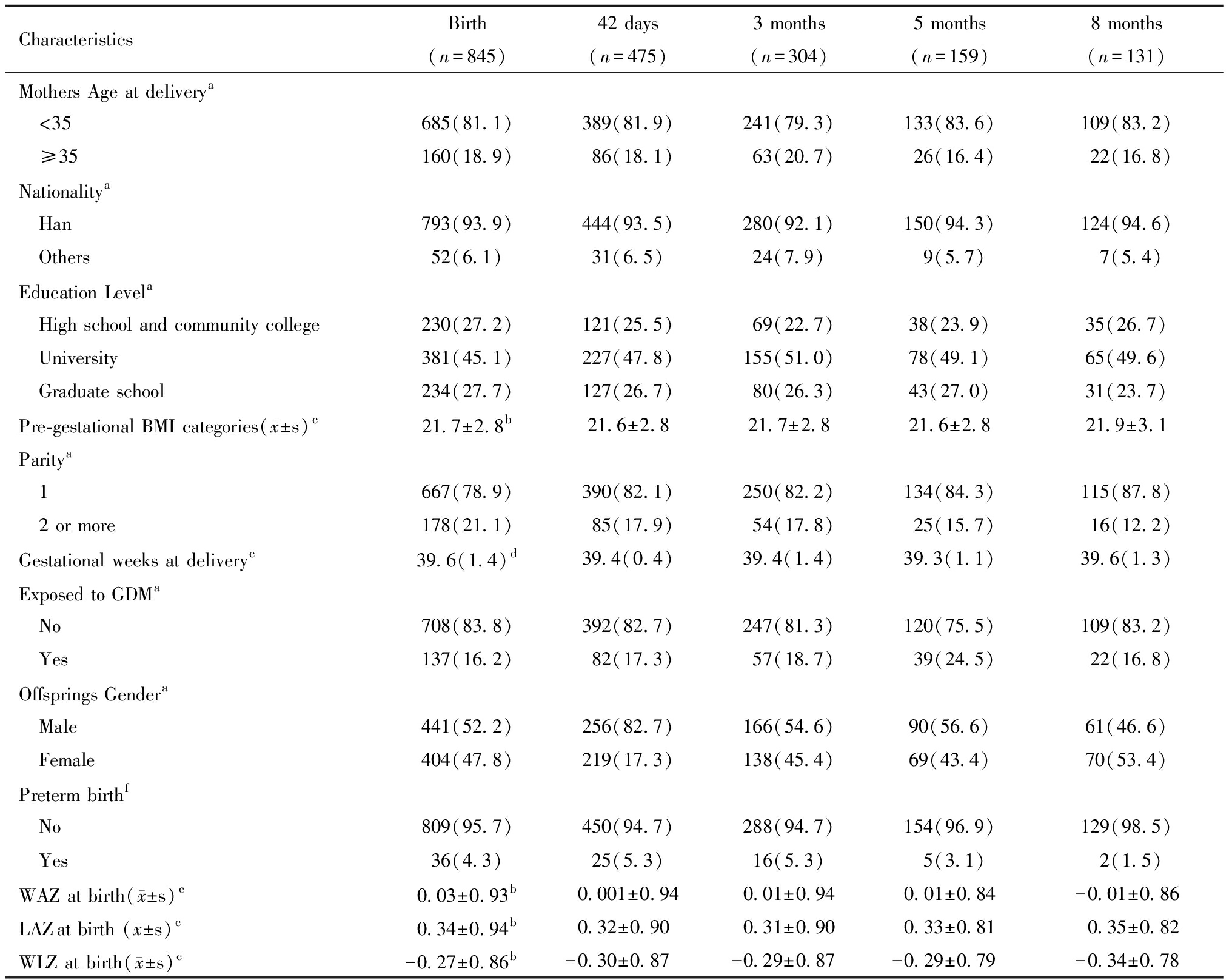
CharacteristicsBirth42 days3 months5 months8 months(n=845)(n=475)(n=304)(n=159)(n=131)Mothers Age at deliverya <35685(81.1)389(81.9)241(79.3)133(83.6)109(83.2) ≥35160(18.9)86(18.1)63(20.7)26(16.4)22(16.8)Nationalitya Han793(93.9)444(93.5)280(92.1)150(94.3)124(94.6) Others52(6.1)31(6.5)24(7.9)9(5.7)7(5.4)Education Levela High school and community college230(27.2)121(25.5)69(22.7)38(23.9)35(26.7) University381(45.1)227(47.8)155(51.0)78(49.1)65(49.6) Graduate school234(27.7)127(26.7)80(26.3)43(27.0)31(23.7)Pre-gestational BMI categories( x±s)c21.7±2.8b21.6±2.821.7±2.821.6±2.821.9±3.1Paritya 1667(78.9)390(82.1)250(82.2)134(84.3)115(87.8) 2 or more178(21.1)85(17.9)54(17.8)25(15.7)16(12.2)Gestational weeks at deliverye39.6(1.4)d39.4(0.4)39.4(1.4)39.3(1.1)39.6(1.3)Exposed to GDM a No708(83.8)392(82.7)247(81.3)120(75.5)109(83.2) Yes137(16.2)82(17.3)57(18.7)39(24.5)22(16.8)Offsprings Gendera Male441(52.2)256(82.7)166(54.6)90(56.6)61(46.6) Female404(47.8)219(17.3)138(45.4)69(43.4)70(53.4)Preterm birthf No809(95.7)450(94.7)288(94.7)154(96.9)129(98.5) Yes36(4.3)25(5.3)16(5.3)5(3.1)2(1.5)WAZ at birth( x±s)c0.03±0.93b0.001±0.940.01±0.940.01±0.84-0.01±0.86LAZat birth ( x±s)c0.34±0.94 b0.32±0.900.31±0.900.33±0.810.35±0.82WLZ at birth( x±s)c-0.27±0.86 b-0.30±0.87-0.29±0.87-0.29±0.79-0.34±0.78
aχ2 test comparing the characteristics of mother-child dyads at birth and at each subsequent follow-up;bMean±SD;cOne-way anova test;dMedian(Interquartile Range);e Kruskal-Wallis test;fFisher′s exact test
Abbreviations:WAZ:weight for age Z score; LAZ:length for age Z score; WLZ:weight for length Z score; GDM:gestational diabetes mellitus
比较5次随访时,GDM与非GDM组的WAZ、LAZ、WLZ三种评分,结果发现两组的体格指标Z评分在各月龄均未见统计学差异,见图1。
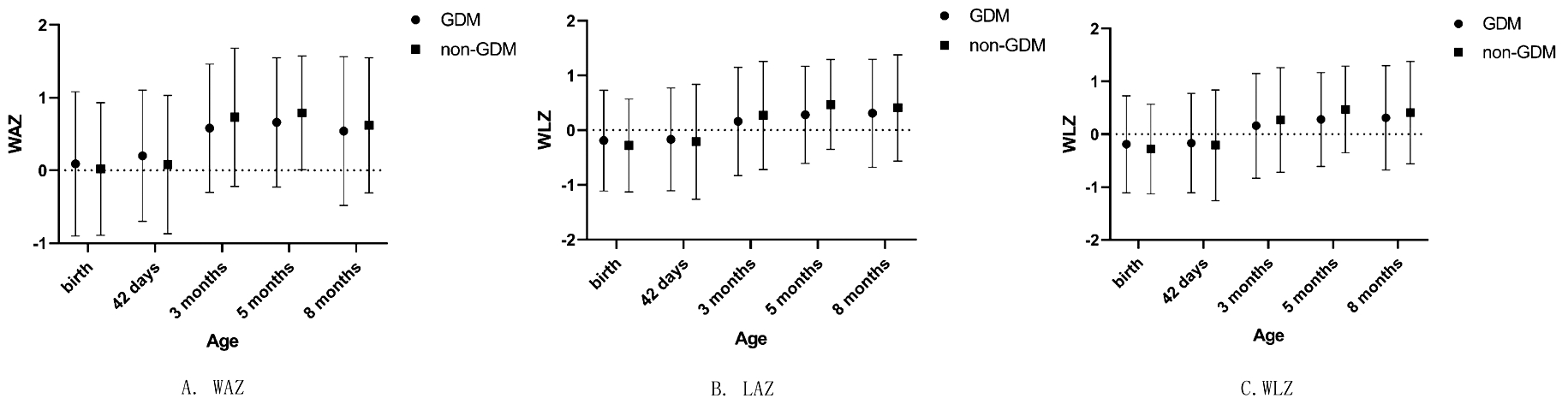
Abbreviations:WAZ:weight for age Z score; LAZ:length for age Z score; WLZ:weight for length Z score; GDM:gestational diabetes mellitus
图1 研究对象各随访时点GDM与非GDM组的体格生长指标Z评分比较
Figure 1 Z scores of infants anthropometric measures at each follow up(Exposed to GDM vs not exposed to GDM)
三、宫内暴露于GDM与子代0~8个月体格生长的关联
表3显示了将子代在各月龄重复测量的体格生长指标Z评分作为结局的线性混合模型结果:与非GDM组相比,GDM组子代0~8月龄的LAZ高(β=0.15, 95% CI:0.01~0.28,P=0.034)。GDM与子代0~8月龄WAZ、WLZ的关联未见统计学意义。
表3 GDM与子代体格生长指标Z评分纵向关联的线性混合模型
Table 3 Associations between intrauterine exposure to GDM and Z scores of repeated anthropometric measures(Linear Mixed Model)
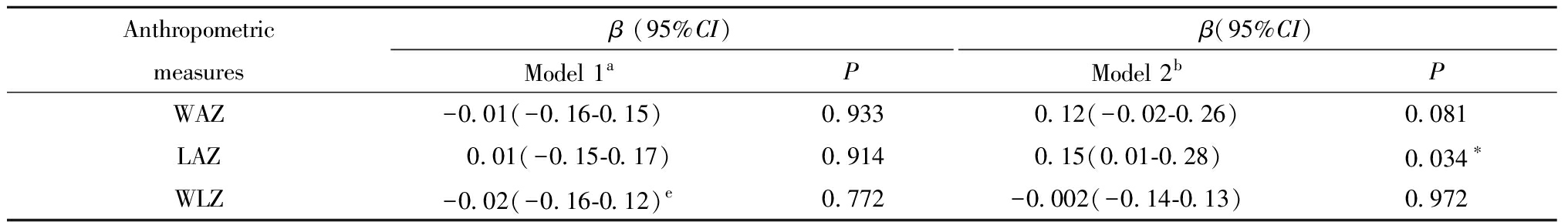
Anthropometricmeasuresβ (95%CI)Model 1aPβ(95%CI)Model 2bPWAZ-0.01(-0.16-0.15)0.933 0.12(-0.02-0.26)0.081LAZ 0.01(-0.15-0.17)0.914 0.15(0.01-0.28)0.034∗WLZ-0.02(-0.16-0.12) e0.772-0.002(-0.14-0.13)0.972
a Model1 GDM(Yes=1/No=0)+Offspring age at follow-up(continuous variable); b Model2 Model 1+ Pre-gestational BMI(continuous variable), mother age at delivery(continuous variable), parity(1=0/2=1), gestational age at delivery(continuous variable), education level of mother(high school and community college=1/university=2/graduate school=3), nationality(Han=1/others=2), gender of offspring(male=1/female=2); *P<0.05
Abbreviations:WAZ:weight for age Z score; LAZ:length for age Z score; WLZ:weight for length Z score; GDM:gestational diabetes mellitus
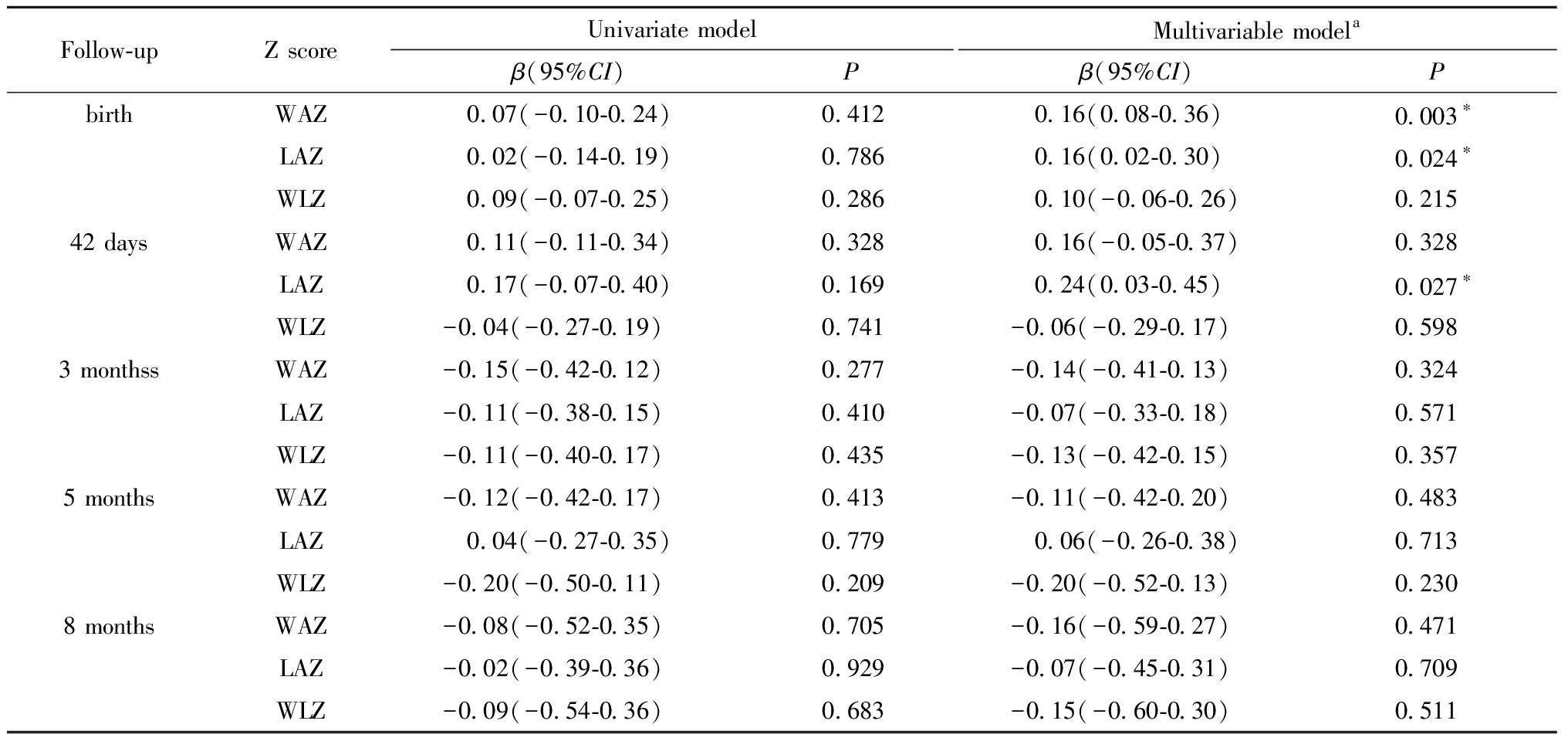
表4显示了GDM与各次随访的WAZ、LAZ、WLZ的关联的线性回归模型结果。多因素线性回归显示:与非GDM组相比,GDM组出生时的WAZ高(β=0.16,95% CI:0.08~0.36,P=0.003),但其它月龄两组WAZ未见统计学差异;GDM组出生时的LAZ高(β=0.16,95% CI:0.02~0.30,P=0.024),子代42 d时LAZ也比非GDM组高(β=0.24,95% CI:0.03~0.45,P=0.027),其它月龄两组未见统计学差异;各月龄GDM与非GDM两组的WLZ未见统计学差异。
表4 出生、42 d、3月龄、5月龄、8月龄时GDM与子代体格生长指标Z评分关联的多元线性回归
Table 4 Associations between intrauterine exposure to GDM and Z scores of anthropometric measures at birth, 42 days, 3 months, 5 months, 8 months(multiple linear regression)
Follow-upZ scoreUnivariate modelβ(95%CI)PMultivariable modelaβ(95%CI)PbirthWAZ 0.07(-0.10-0.24)0.412 0.16(0.08-0.36)0.003∗LAZ 0.02(-0.14-0.19)0.786 0.16(0.02-0.30)0.024∗WLZ 0.09(-0.07-0.25)0.286 0.10(-0.06-0.26)0.21542 daysWAZ 0.11(-0.11-0.34)0.328 0.16(-0.05-0.37)0.328LAZ 0.17(-0.07-0.40)0.169 0.24(0.03-0.45)0.027∗WLZ-0.04(-0.27-0.19)0.741-0.06(-0.29-0.17)0.5983 monthssWAZ-0.15(-0.42-0.12)0.277-0.14(-0.41-0.13)0.324LAZ-0.11(-0.38-0.15)0.410-0.07(-0.33-0.18)0.571WLZ-0.11(-0.40-0.17)0.435-0.13(-0.42-0.15)0.3575 monthsWAZ-0.12(-0.42-0.17)0.413-0.11(-0.42-0.20)0.483LAZ 0.04(-0.27-0.35)0.779 0.06(-0.26-0.38)0.713WLZ-0.20(-0.50-0.11)0.209-0.20(-0.52-0.13)0.2308 monthsWAZ-0.08(-0.52-0.35)0.705-0.16(-0.59-0.27)0.471LAZ-0.02(-0.39-0.36)0.929-0.07(-0.45-0.31)0.709WLZ-0.09(-0.54-0.36)0.683-0.15(-0.60-0.30)0.511
a adjusted for Pre-gestational BMI(continuous variable), mother age at delivery(continuous variable), parity(1=0/2=1),gestational age at delivery(continuous variable), education level of mother(high school and community college=1/university=2/graduate school=3), nationality(Han=1/others=2), gender of offspring(male=1/female=2), GDM(yes=1/no=0); *P<0.05
Abbreviations:WAZ:weight for age Z score; LAZ:length for age Z score; WLZ:weight for length Z score; GDM:gestational diabetes mellitus
讨 论
本研究采用线性混合模型和线性回归模型探索GDM与子代体格生长指标的关联。线性混合模型发现,与非GDM组相比,GDM组子代0~8月龄的LAZ高。根据子代年龄进行分层分析发现,与非GDM组相比,GDM组子代出生时WAZ高,出生和42 d的LAZ高,但其余随访时点两组的体格生长指标Z评分差异未见统计学意义。
本研究发现GDM子代出生时WAZ和LAZ比非GDM组高,此结果与天津地区[14]和巴西地区的大样本队列研究结果一致[15]。2017年的Meta分析显示,GDM组的子代出生时体成分脂肪含量比非GDM组高[5]。GDM与子代出生WAZ相关的可能机制是:GDM母亲的血糖可能通过胎盘转运至胎儿,刺激胎儿合成更多的胰岛素,胰岛素可以作为一种促进胎儿生长发育的生长因子,促进蛋白、脂肪合成和抑制脂解作用[1],导致胎儿体重增加乃至巨大儿的发生[14]。但欧洲的一个队列研究中,GDM母亲接受治疗后,GDM与非GDM组子代出生BMI无统计学差异[7];随机对照试验研究也表明,及时治疗GDM能够降低子代出生体重,降低子代大于胎龄儿的风险[16]。
本研究结果提示GDM与出生和42 d的体格生长相关,但与3月龄、5月龄、8月龄的体格生长关联无统计学意义。既往研究也发现宫内暴露于GDM对子代体格生长的影响在子代不同年龄存在差异。天津的队列也发现GDM与WAZ和LAZ的正向关联仅在出生时有统计学意义,出生后各月龄无统计学意义[14];沈阳的队列中,GDM组子代WLZ比非GDM组高,但这种关联仅存在于出生时、1月龄、3月龄,且效应值随月龄增大而减小,6月龄、8月龄或12月龄时两组WLZ无统计学差异[9]。虽然GDM组出生时体格生长指标比非GDM组高[9,14-15],但有研究发现,GDM组子代出生到6月龄体格生长速度比非GDM组慢[7],这可能是随着子代月龄增长,两组体格生长指标不再有差异的原因之一。另外有研究表明,GDM对子代体格生长的影响可能持续到儿童期。巴西的队列研究表明,GDM组在子代出生时、6月龄、8月龄的BMI Z评分比非GDM组高,其它月龄无统计学差异[15];一篇Meta分析显示,GDM子代10~11岁的肥胖风险比非GDM组高[8]。长期随访的队列研究有助于探索GDM对子代体格生长的影响。
本研究具有一定的优势,首先,基于孕妇队列设计的前瞻性队列研究,危险因素与结局有先后时间顺序,有利于进行因果推断;第二,通过长期随访重复测量体格指标,本研究可以评估GDM与子代在多个时间点体格生长之间的关系。
本研究也有一定的局限性,只有15.5%的研究对象接受了全部5次随访,按照随访时间点进行分组比较时,研究对象的基本特征未见统计学差异。本研究对子代的随访在区级妇幼保健院进行,若研究对象不来妇幼保健院体检,则无法观察到体格生长结局。既往研究在与本研究相似的人群中发现,家长忘记、到其它区居住、儿童因患病被转诊或身体状况不适合体检为儿童中断体检的主要原因[17]。本研究排除了儿童患有影响体格生长疾病的母婴对,仅关注健康的儿童,儿童患病造成的失访对本研究结果的影响有限。此外,巴西的大样本队列到研究对象家中进行随访,子代12月龄时随访率为92.35%,该研究发现GDM对子代出生时体格指标有影响[15],而对出生后的体格指标无影响,与本研究结果相似。综上,虽然本研究存在失访问题,但失访对研究结果的影响有限,本研究的结果可信。
综上所述,宫内暴露于GDM的婴儿,出生时的WAZ,出生时和42 d的LAZ比非GDM组高。本研究结果为进一步探讨宫内暴露于GDM对子代体格生长影响及作用关键期提供了参考依据。
1 乐杰.妇产科学.第7版.北京:人民卫生出版社,2008,150-151.
2 Gao C,Sun X,Lu L,et al.Prevalence of gestational diabetes mellitus in mainland China:A systematic review and meta-analysis.J Diabetes Investig,2019,10:154-162.
3 Kim S Y,Sharma AJ,Sappenfield W,et al.Association of maternal body mass index,excessive weight gain,and gestational diabetes mellitus with large-for-gestational-age births.Obstet Gynecol,2014,123:737-744.
4 Johns EC,Denison FC,Norman JE,et al.Gestational diabetes mellitus:mechanisms,treatment,and complications.Trends Endocrinol Metab,2018,29:743-754.
5 Logan KM,Gale C,Hyde MJ,et al.Diabetes in pregnancy and infant adiposity:systematic review and meta-analysis.ADC Fetal & Neonatal,2017,102:F65-F72.
6 Schwartz R,Teramo KA.Effects of diabetic pregnancy on the fetus and newborn.SEMIN PERINATOL,2000,24:120-135.
7 Toftemo I,Jenum AK,Sletner L.Body mass index trajectories up to preschool age in a multi-ethnic population; relations with maternal gestational diabetes,BMI and gestational weight gain.Acta Paediatr,2021,110:1239-1248.
8 Kawasaki M,Arata N,Miyazaki C,et al.Obesity and abnormal glucose tolerance in offspring of diabetic mothers:A systematic review and meta-analysis.PLoS One,2018,13:e0190676.
9 Hu J,Liu Y,Wei X,et al.Association of gestational diabetes mellitus with offspring weight status across infancy:a prospective birth cohort study in China.BMC Pregnancy Childb,2021,21:21.
10 Crume TL,Ogden L,Daniels S,et al.The impact of in utero exposure to diabetes on childhood body mass index growth trajectories:the EPOCH study.J Pediatr,2011,158:941-946.
11 Prentice PM,Olga L,Petry CJ,et al.Reduced size at birth and persisting reductions in adiposity in recent,compared with earlier,cohorts of infants born to mothers with gestational diabetes mellitus.Diabetologia,2019,62:1977-1987.
12 International Association of Diabetes and Pregnancy Study Groups Consensus Panel.International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy.Diabetes care,2010,33:676-682.
13 World Health Organization.WHO Child Growth Standards:Length/height-for-age,weight-for-age,weigthfor-heigth and body mass index-for-age:Methods and development.Geneva.World Health Organization,2006.
14 Liu G,Li N,Sun S,et al.Maternal OGTT glucose levels at 26-30 gestational weeks with offspring growth and development in early infancy.Biomed Res Int,2014,2014:516980.
15 Buffarini R,Barros AJD,Matijasevich A,et al.Gestational diabetes mellitus,pre-gestational BMIand offspring BMI z-score during infancy and childhood:2004 Pelotas Birth Cohort.BMJ Open,2019,9:e024734.
16 Landon MB,Spong CY,Thom E,et al.Amulticenter,randomized trial of treatment for mild gestational diabetes.N Engl J Med,2009,361:1339-1348.
17 顾燕敏.儿童保健门诊系统管理影响因素分析及应对措施探讨.上海医药,2016,37:25-27.