在常规的体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)治疗过程中,完全受精失败是临床医生、实验室胚胎学家和患者最担忧的问题。它会造成卵母细胞的浪费,导致无可用胚胎移植的现象,给患者带来情绪压力的同时也增加了患者的经济负担。根据文献报道,完全受精失败的发生率在3.5%~15.0%[1-2]。
为了弥补完全受精失败带来的损失,很多生殖中心会在IVF受精的第二天行晚补救单精子卵胞浆注射(late rescue intracytoplasmic sperm injection, late-RICSI),但是由于卵子老化等原因,Late-RICSI的受精率和妊娠率均不理想。目前,为了减少IVF-ET中完全受精失败的发生,越来越多的生殖中心采用短时受精结合早期补救单精子卵胞浆注射(early rescue intracytoplasmic sperm injection, Early-RICSI)的方法,即受精后5~6 h观察第二极体是否释放,以判断是否受精。若受精卵子数占成熟卵子数比例小于50%,则即刻行Early-RICSI。相比于Late-RICSI,Early-RICSI的受精率得到了显著改善,并且能获得满意的妊娠结局[3-4],但是关于该技术的子代安全性的报道却非常有限。本次研究拟回顾性分析近五年本中心行Early-RICSI患者的新生儿结局,探讨该技术对子代安全性的影响。
对象与方法
一、对象
选取2015年1月1日—2020年12月31日于华中科技大学同济医学院附属同济医院行IVF或Early-RICSI并有活产儿成功分娩的所有患者。其中,行Early-RICSI治疗患者只有移植胚胎也为Early-RICSI来源时才能被纳入。同时,为了排除混杂因素的影响,本研究排除了复苏卵、体外成熟及人工辅助激活、植入前遗传学检测和晚补救周期;也排除了供卵、供精、手术取精以及使用冷冻精液周期。最终,共有6 456个周期符合纳入排除标准,其中22(0.3%)个周期由于患者失访或者随访数据不完整而被剔除,最终6 434个周期纳入本次研究。6 434个周期中包含单胎分娩周期5 296个,双胎分娩周期1 333个,三胎分娩周期5个。由于三胎周期样本量过少,故不纳入后续统计分析中。
根据助孕方式,将患者分为IVF组和Early-RICSI组。 IVF组包含单胎分娩周期4 927个,双胎分娩周期1 252个,其中27个IVF双胎分娩周期只有单胎活产,最终IVF组纳入单胎活产儿4 927例,双胎2 477例。Early-RICSI组包含单胎分娩周期369个,双胎分娩周期81个,其中1个Early-RICSI双胎分娩周期只有单胎活产,最终Early-RICSI组纳入单胎活产儿369例,双胎161例。
二、方法
1.促排卵方案:根据患者年龄、不孕原因、卵巢储备、基础内分泌水平等选择个体化的促排方案,包括卵泡期长效长方案、短效长方案、拮抗剂方案和黄体期方案,当至少2~3大卵泡直径≥18 mm时,肌注人绒毛膜促性腺激素(hCG)5 000~10 000 IU后36~38 h在B超引导下经阴道穿刺取卵。
2.胚胎培养:根据取卵当日精液处理后活动精子情况和患者的病史选择授精方式。本中心IVF均采用短时受精,精卵共孵育3~4 h后将卵母细胞从受精皿捞出并脱去周围颗粒细胞,授精后4~6 h在倒置显微镜下观察卵子成熟情况及第二极体状况。如果出现第二极体的卵子未达到成熟卵子数的一半,即刻行Early-RICSI;如果成熟卵子半数以上出现第二极体,则视为受精正常,经G1-PLUS(Vitrolife,瑞典)或卵裂期培养液(COOK,澳大利亚)清洗后将培养皿放回培养箱继续培养。
3.妊娠相关诊断及随访:移植后2周抽血检测hCG,阳性者在移植后28~32 d进行B超检测,以B超观察到宫腔内妊娠囊且有胎心搏动诊断为临床妊娠。本院常规在预产期后2个月内对临床妊娠者行电话随访,随访内容包括新生儿数量、性别、出生体重、出生日期、出生缺陷,母亲孕期并发症等。
4.相关定义说明:早产是指妊娠满28周但不足37周分娩,早早产是指妊娠满28周但不足32周分娩,低出生体重是指新生儿出生体重小于2 500 g,极低出生体重是指新生儿出生体重小于1 500 g,巨大儿是指新生儿出生体重大于或等于4 000 g。
5.统计学处理:采用SPSS 19.0版统计软件包,正态分布计量资料(包括女方年龄、BMI、基础内分泌、平均获卵数、新生儿孕周和出生体重)采用均数±标准差描述,两两比较采用两独立样本的t检验;计数资料(包括移植胚胎胎龄、数量、剖宫产率、早产率、早早产率、低出生体重率、极低出生体重率、巨大儿率)采用率进行描述,比较分析采用卡方检验,必要时采用Fisher确切概率法。当基线资料不齐时,可以采用Logistical回归分析调整混杂因素对应变量的影响。P<0.05为差异有统计学意义。
结 果
一、单、双胎周期新生儿结局比较
单胎活产儿中包含IVF单胎4 927例和Early-RICSI单胎369例。比较两组基线资料发现,IVF组女方年龄显著高于Early-RICSI组(P<0.001),此外,两组体重指数(body mass index,BMI)、基础促卵泡生成素(FSH)、基础雌二醇(E2)、基础孕酮(P)水平、移植胚胎胚龄差异均无统计学意义。双胎活产儿中包含IVF双胎2 477例和Early-RICSI单胎161例。比较两组基线资料发现,IVF组FSH水平显著高于Early-RICSI组(P<0.001),女方年龄显著大于Early-RICSI组(P<0.001),此外两组之间的BMI、E2、P水平、移植胚胎胚龄差异均无统计学意义。见表1。
单胎周期中,比较两组新生儿结局发现,两组剖宫产率、新生儿性别比、孕周、早产率、早早产率、出生体重、低体重率、巨大儿率差异均无统计学意义。调整女方年龄、BMI、FSH、E2、P水平、移植胚胎胚龄、获卵数等混杂因素的影响后,结果并未发生改变。双胎周期中,比较两组新生儿结局发现,IVF组的平均孕周和平均出生体重显著低于Early-RICSI组,低出生体重率和男婴率显著高于Early-RICSI组,但是调整女方年龄、BMI、FSH、E2、P水平、移植胚胎胚龄等混杂因素的影响后发现, IVF组的平均出生体重仍显著低于Early-RICSI组,而平均孕周和低出生体重率和新生儿性别比组间差异均无统计学意义。其他新生儿结局,包括剖宫产率、早产率、早早产率组间差异均无统计学意义。见表2和表3。
表1 两组基线资料比较
Table 1 The comparison of baseline characteristics between IVF group and Early-RICSI group
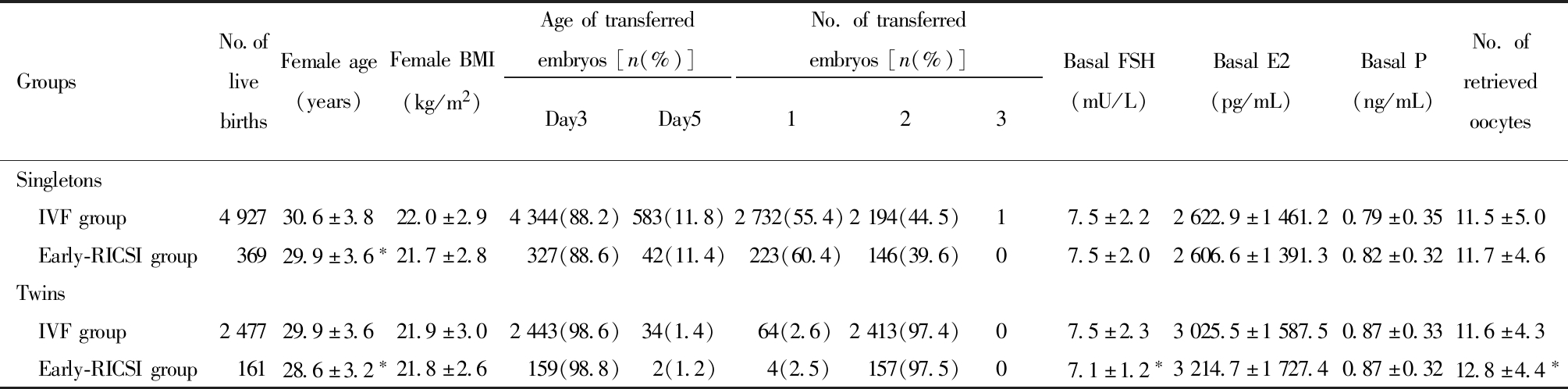
GroupsNo.oflivebirthsFemaleage(years)FemaleBMI(kg/m2)Ageoftransferredembryos[n(%)]Day3Day5No.oftransferredembryos[n(%)]123BasalFSH(mU/L)BasalE2(pg/mL)BasalP(ng/mL)No.of retrieved oocytes Singletons IVFgroup492730.6±3.822.0±2.94344(88.2)583(11.8)2732(55.4)2194(44.5)17.5±2.22622.9±1461.20.79±0.3511.5±5.0 Early-RICSIgroup36929.9±3.6∗21.7±2.8327(88.6)42(11.4)223(60.4)146(39.6)07.5±2.02606.6±1391.30.82±0.3211.7±4.6Twins IVFgroup247729.9±3.621.9±3.02443(98.6)34(1.4) 64(2.6)2413(97.4)07.5±2.33025.5±1587.50.87±0.3311.6±4.3 Early-RICSIgroup16128.6±3.2∗21.8±2.6159(98.8)2(1.2) 4(2.5)157(97.5)07.1±1.2∗3214.7±1727.40.87±0.3212.8±4.4∗
Compared with IVF group, *P<0.05
表2 两组新生儿结局比较
Table 2 The comparison of neonatal outcomes between IVF group and Early-RICSI group
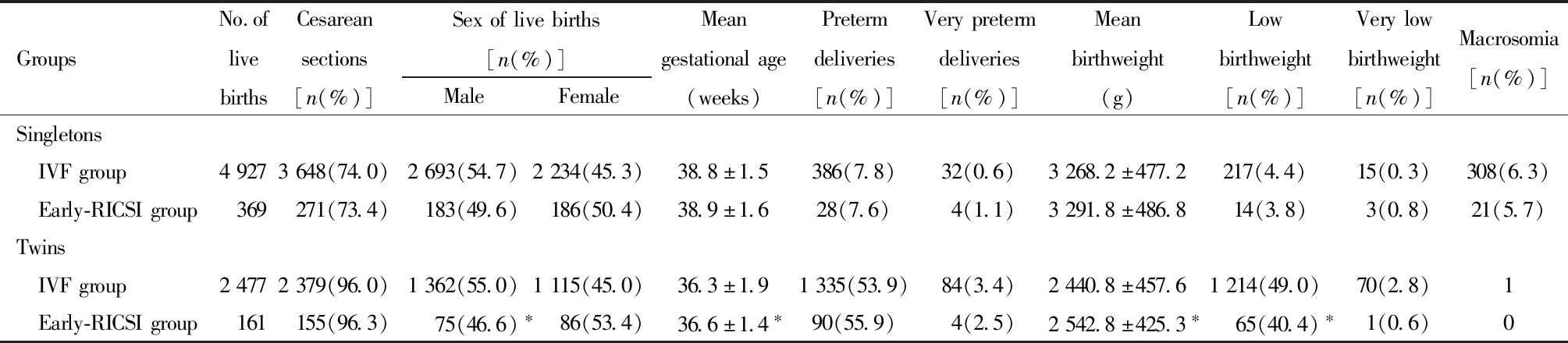
GroupsNo.oflivebirthsCesareansections[n(%)]Sexoflivebirths[n(%)]MaleFemaleMeangestationalage(weeks)Pretermdeliveries[n(%)]Verypretermdeliveries[n(%)]Meanbirthweight(g)Lowbirthweight[n(%)]Verylowbirthweight[n(%)]Macrosomia[n(%)]Singletons IVFgroup49273648(74.0)2693(54.7)2234(45.3)38.8±1.5386(7.8)32(0.6)3268.2±477.2217(4.4)15(0.3)308(6.3) Early-RICSIgroup369271(73.4)183(49.6)186(50.4)38.9±1.628(7.6)4(1.1)3291.8±486.814(3.8)3(0.8)21(5.7)Twins IVFgroup24772379(96.0)1362(55.0)1115(45.0)36.3±1.91335(53.9)84(3.4)2440.8±457.61214(49.0)70(2.8)1 Early-RICSIgroup161155(96.3)75(46.6)∗86(53.4)36.6±1.4∗90(55.9)4(2.5)2542.8±425.3∗ 65(40.4)∗1(0.6)0
Compared with IVF group, *P<0.05
表3 两组新生儿结局回归分析结果
Table 3 The regression analysis of neonatal outcomes between IVF group and Early-RICSI group
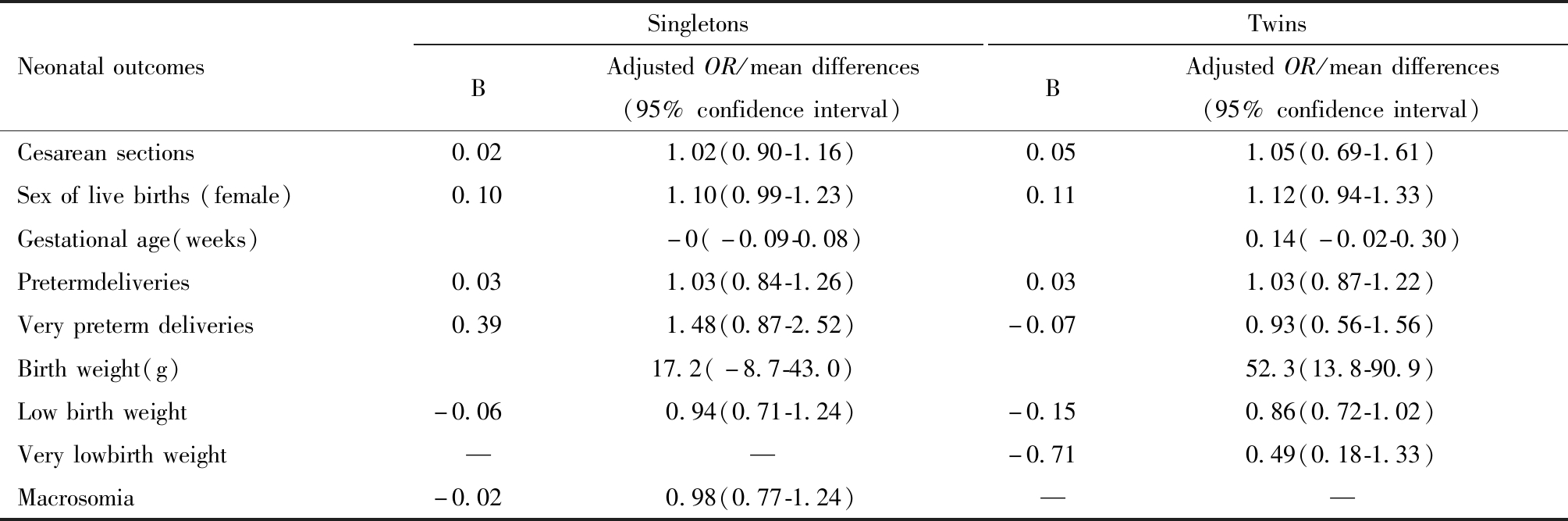
NeonataloutcomesSingletonsBAdjustedOR/meandifferences(95%confidenceinterval)TwinsBAdjustedOR/meandifferences(95%confidenceinterval)Cesareansections0.021.02(0.90-1.16)0.051.05(0.69-1.61)Sexoflivebirths(female)0.101.10(0.99-1.23)0.111.12(0.94-1.33)Gestationalage(weeks)-0(-0.09-0.08) 0.14(-0.02-0.30)Pretermdeliveries0.031.03(0.84-1.26)0.031.03(0.87-1.22)Verypretermdeliveries0.391.48(0.87-2.52)-0.070.93(0.56-1.56)Birthweight(g)17.2(-8.7-43.0) 52.3(13.8-90.9)Lowbirthweight-0.060.94(0.71-1.24)-0.150.86(0.72-1.02)Verylowbirthweight——-0.710.49(0.18-1.33)Macrosomia-0.020.98(0.77-1.24)——
“—”means not obtained limited to the small sample size
讨 论
对于常规IVF-ET来说,受精可以发生在精卵接触后的2~4 h内,而成功受精最早的标志就是第二极体的排出。既往研究显示,受精后4 h有80%的卵子排出第二极体,而受精后6 h,有90%的卵子排出第二极体[5]。因此,受精后4~6 h观察第二极体的排出能够有效评估完全受精失败的发生风险,也为早期补救ICSI提供了可靠的理论依据[6]。
补救ICSI最早于上个世纪90年代由Nagy等提出[7],主要作为IVF完全受精失败患者的备选方案,在受精18~20 h后行Late-RICSI。但是由于此时卵子老化,错过了最佳受精时间,同时胚胎发育和内膜也不同步,晚补救的受精率和妊娠率均不甚理想。2003年Chen等[5]首次提出Early-RICSI并将其应用于临床。相比于Late-RICSI,Early-RICSI受精时间更为提前,一般在IVF受精后6 h左右,此时卵母细胞尚未老化,仍在受精时间窗口期内,并且有报道认为,相比于常规ICSI,此时卵母细胞的细胞核和细胞质发育更成熟,更有利于受精成功,故Early-RICSI的受精率反而高于常规ICSI。但是,也有学者认为,相比于常规IVF,Early-RICSI可能给病人带来额外的风险,增加治疗费用和胚胎培养室的工作负担,最重要的是,其子代安全性尚存在疑问[8]。因此,评估Early-RICSI的子代安全性对其临床适用性显得尤为重要。
既往研究认为,与常规ICSI相比,Early-RICSI虽然增加了多精受精率,降低了优胚率,但是其妊娠率、流产率和活产率与常规ICSI相比并无显著差异,且未给新生儿结局带来不良影响[3,9-11]。但是,既往研究样本量较少,且大都以常规ICSI为对照组,忽略了常规ICSI患者中男方少弱畸精症对新生儿结局的影响。因此,本次研究综合分析了近五年Early-RICSI患者的新生儿结局,并且以常规IVF为对照,最大程度上减少了精子质量对新生儿结局的干扰,是目前样本量较大的研究。
本研究表明,与常规IVF相比,Early-RICSI患者的孕周、早产率、早早产率、低出生体重率、极低出生体重率、巨大儿率、剖宫产率均无显著差异。甚至在双胎新生儿中,Early-RICSI组平均出生体重要显著高于常规IVF组。本研究结论与Huang等[3]的结论基本相似。
总之,本研究认为Early-RICSI并未增加新生儿不良风险,说明Early-RICSI技术的新生儿安全性,提示Early-RICSI可作为短时受精失败预防措施,有临床应用及推广价值。但是,仍需要更大样本量的子代长期随访数据来进一步证实。
1 Bhattacharya S,Hamilton MP,Shaaban M,et al. Conventional in-vitro fertilisation versus intracytoplasmic sperm injection for the treatment of non-male-factor infertility:a randomised controlled trial.Lancet,2001,357:2075-2079.
2 Liu DY,Baker HW.Defective sperm-zona pellucida interaction:a major cause of failure of fertilization in clinical in-vitro fertilization.Hum Reprod,2000,15:702-708.
3 Huang B,Qian K,Li Z,et al.Neonatal outcomes after early rescue intracytoplasmic sperm injection:an analysis of a 5-year period.Fertil Steril,2015,103:1432-1437.e1.
4 聂玉林,赵魁,周静,等.短时授精联合早期补救ICSI对受精失败高危人群的应用结局.当代医学,2020,26:115-118.
5 Chen C,Kattera S.Kattera.Rescue ICSI of oocytes that failed to extrude the second polar body 6 h post-insemination in conventional IVF.Hum Reprod,2003,18:2118-2121.
6 林碎玲,李雪梅,刘红,等.短时受精失败后早期补救卵胞浆内单精子注射的最佳窗口期.中国妇幼保健,2017,32:3273-3276.
7 Nagy ZP,Joris H,Liu J,et al.Intracytoplasmic single sperm injection of 1-day-old unfertilized human oocytes.Hum Reprod,1993,8:2180-2184.
8 Tesarik J.Associate editor′s comment on ′Rescue ICSI of oocytes that failed to extrude the second polar body 6 h post-insemination in conventional IVF′ by Chen and Kattera.Rescue ICSI revisited.Hum Reprod,2003,18:2122-2123.
9 Xiong F,Sun Q,Li G,et al.Perinatal and neonatal outcomes of pregnancies after early rescue intracytoplasmic sperm injection in women with primary infertility compared with conventional intracytoplasmic sperm injection:a retrospective 6-year study.BMC Pregnancy Childbirth,2020,20:460.
10 吴丽敏,鲍蔓蔓,童先宏,等.早期补救卵胞浆内单精子注射妊娠结局及新生儿出生结局评估.实用妇产科杂志,2018,34:782-786.
11 王紫娟,游敏,张红梅,等.辅助生殖技术中短时受精失败结合早期补救ICSI与常规ICSI的临床结局分析.山西医科大学学报,2019,50:79-85.