20世纪90年代,国外学者Nevalainen首次将六西格玛(6σ)理论应用于临床检验[1]。通过计算σ水平可定量描述方法的分析性能,选择最优的质控规则及质控品测定批数和个数[2],实现效益/成本比的最优化[3]。目前,应用6σ方法可较方便地对临床实验室定量测定项目的分析性能和质量指标进行评价[4-9]。
国家免费孕前优生健康检查项目的开展是出生缺陷的一级预防,其中13项检查项目由临床检验实验室承担,检查结果将直接影响临床医生对检查对象的风险评估,评估结果将影响育龄夫妇后续的干预措施及妊娠计划。实验室要保证正确的检测结果以确保受检对象得到正确的风险评估和指导。
承担孕前优生健康检查的机构多为县级,调查发现,江苏省孕前优生实验室在质量管理方面相对欠缺,质量控制方法不够完善,将直接影响实验室的检测质量。本研究利用6σ理论对本省部分孕优实验室肝功能(血清丙氨酸氨基转移酶,Alt)、肾功能(血清肌酐,Cr)和血清葡萄糖(Glu)这三项生化项目的分析性能进行定量评估,以发现问题,给出合适的质量控制方法,同时通过计算质量目标指数(quality goal index,QGI)确定优先改进方向,以提升实验室检测水平。
资料和方法
一、资料
1.研究对象:依托江苏省孕前优生实验室质量管理平台,将每日上报两个浓度水平室内质控数据的38个实验室纳入研究。
2.数据采集:允许总误差(TEa)采用中华人民共和国卫生行业标准(WS/T403-2012)《临床生物化学检验常规项目分析质量指标》中Alt、Cr、Glu的TE/%(分别为16%、12%、7%)[10]。偏倚(Bias)采用2021年第二次江苏省国家免费孕前优生项目临床检验室间质量评价活动中各实验室5个测定结果相对偏差(取绝对值)的平均值,相对偏差=(实验室结果-靶值)/靶值×100%[11]。变异系数(CV)根据2021年7~10月两个水平质控物的在控数据计算累计结果,如果质控物1和质控物2的变异系数相似,采用较大值;质控物1和质控物2相差较大时,采用平均值。
二、方法
1.计算项目的σ质量水平:根据公式σ=(TEa-|Bias|)/CV,计算出每一检测项目的σ质量水平,根据σ质量水平对分析性能进行评估。判断等级标准为“σ<3.0(欠佳)”、“3.0≤σ<4.0(临界)”、“4.0≤σ<5.0(良好)”、“5.0≤σ<6.0(优秀)”和“σ≥6.0(国际水平)”。根据中华人民共和国卫生行业标准(WS/T 641-2018)《临床检验定量测定室内质量控制》中2个浓度水平质控品的西格玛规则为各项目选择推荐的质控方法[12]。
2.计算质量目标指数(quality goal index,QGI):QGI是一个良好的反映方法精密度和正确度的指标,可以帮助实验室找出质量水平没有达到6σ的原因,从而确定优先改进方向。当偏倚超过了它的正确度目标,不精密度满足了它的精密度目标,检测项目的QGI就高;当偏倚满足了它的正确度目标,不精密度超过了它的精密度目标,测试的QGI就低。本研究对σ质量水平在6.0以下的项目计算质量目标指数(QGI=Bias/(1.5CV)),以此确定优先改进方向。QGI<0.8表示项目的精密度不佳,需要优先提高精密度;QGI>1.2表明项目的正确度不佳,需要优先提高正确度;0.8≤QGI≤1.2表明项目的精密度和正确度均需要提高[13]。
结 果
一、各项目σ水平构成情况
共计114个项目结果,σ水平在5.0及以上的约占31.6%(36/114),在6.0及以上的约占26.3%,在3.0以下的约为26.3%,见表1。
二、σ水平在6.0以下项目的QGI构成情况
σ水平在6.0以下的项目共84项,QGI<0.8的占比为60.7%,QGI>1.2的占比为20.2%,QGI在0.8~1.2之间的占比为19.1%,见表2。
三、质控方法及优先改进方向
根据2个浓度水平质控品的西格玛规则,为每一个项目选择推荐的质控方法(σ水平在3.0以下的项目无推荐质控方法),并根据其QGI(σ<6.0的项目)确定优先改进方向,σ水平为6.0及以上的项目无需改进,见表3、表4、表5。
表1 各项目的σ水平构成情况
Table 1 The σ level composition of each item
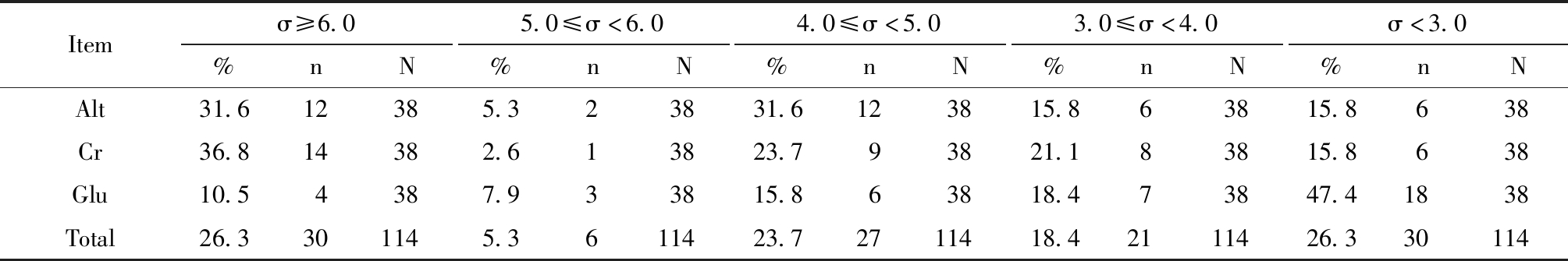
Itemσ≥6.0%nN5.0≤σ<6.0%nN4.0≤σ<5.0%nN3.0≤σ<4.0%nNσ<3.0%nNAlt31.612385.323831.6123815.863815.8638Cr36.814382.613823.793821.183815.8638Glu10.54387.933815.863818.473847.41838Total26.3301145.3611423.72711418.42111426.330114
表2 σ水平在6.0以下项目的QGI构成情况
Table 2 The QGI composition of items with σ level below 6.0
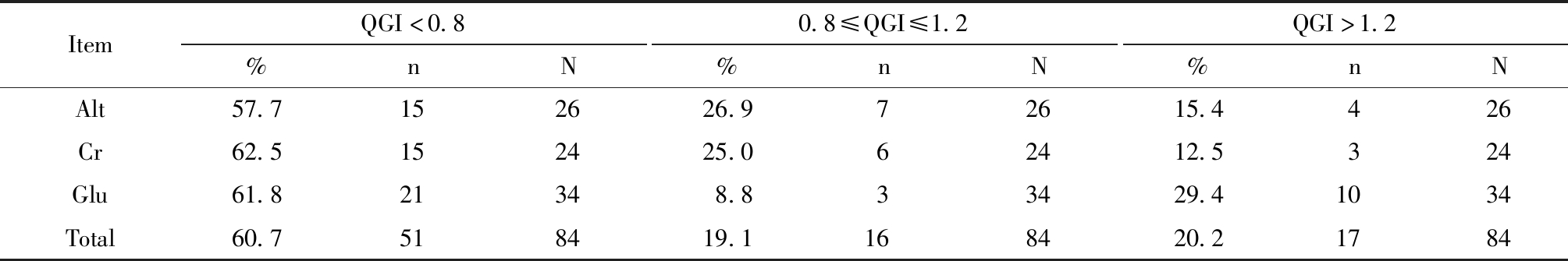
ItemQGI<0.8%nN0.8≤QGI≤1.2%nNQGI>1.2%nNAlt57.7152626.972615.4426Cr62.5152425.062412.5324Glu61.821348.833429.41034Total60.7518419.1168420.21784
表3 Alt的σ水平、推荐的质控方法、QGI及优先改进方向
Table 3 The σ level, recommended quality control methods(RQCM), QGI and preferred improvement directions(PID) of Alt
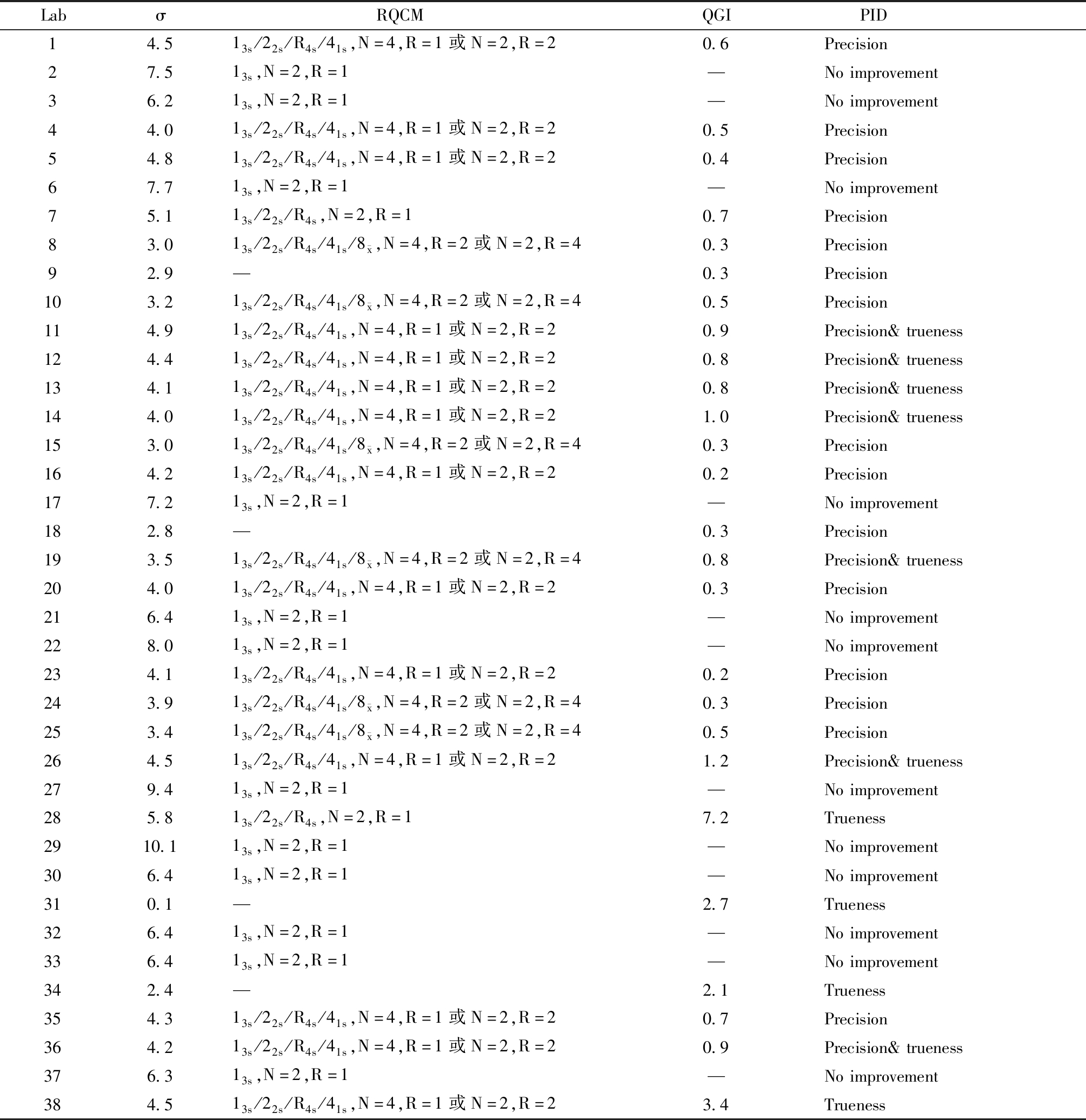
Labσ RQCMQGI PID14.513s/22s/R4s/41s,N=4,R=1或N=2,R=20.6Precision27.513s,N=2,R=1—Noimprovement36.213s,N=2,R=1—Noimprovement44.013s/22s/R4s/41s,N=4,R=1或N=2,R=20.5Precision54.813s/22s/R4s/41s,N=4,R=1或N=2,R=20.4Precision67.713s,N=2,R=1—Noimprovement75.113s/22s/R4s,N=2,R=10.7Precision83.013s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.3Precision92.9—0.3Precision103.213s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.5Precision114.913s/22s/R4s/41s,N=4,R=1或N=2,R=20.9Precision&trueness124.413s/22s/R4s/41s,N=4,R=1或N=2,R=20.8Precision&trueness134.113s/22s/R4s/41s,N=4,R=1或N=2,R=20.8Precision&trueness144.013s/22s/R4s/41s,N=4,R=1或N=2,R=21.0Precision&trueness153.013s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.3Precision164.213s/22s/R4s/41s,N=4,R=1或N=2,R=20.2Precision177.213s,N=2,R=1—Noimprovement182.8—0.3Precision193.513s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.8Precision&trueness204.013s/22s/R4s/41s,N=4,R=1或N=2,R=20.3Precision216.413s,N=2,R=1—Noimprovement228.013s,N=2,R=1—Noimprovement234.113s/22s/R4s/41s,N=4,R=1或N=2,R=20.2Precision243.913s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.3Precision253.413s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.5Precision264.513s/22s/R4s/41s,N=4,R=1或N=2,R=21.2Precision&trueness279.413s,N=2,R=1—Noimprovement285.813s/22s/R4s,N=2,R=17.2Trueness2910.113s,N=2,R=1—Noimprovement306.413s,N=2,R=1—Noimprovement310.1—2.7Trueness326.413s,N=2,R=1—Noimprovement336.413s,N=2,R=1—Noimprovement342.4—2.1Trueness354.313s/22s/R4s/41s,N=4,R=1或N=2,R=20.7Precision364.213s/22s/R4s/41s,N=4,R=1或N=2,R=20.9Precision&trueness376.313s,N=2,R=1—Noimprovement384.513s/22s/R4s/41s,N=4,R=1或N=2,R=23.4Trueness
N=Number of quality control test results per batch;R=Batches
表4 Cr的σ水平、推荐的质控方法、QGI及优先改进方向
Table 4 The σ level, recommended quality control methods(RQCM), QGI and preferred improvement directions(PID) of Cr
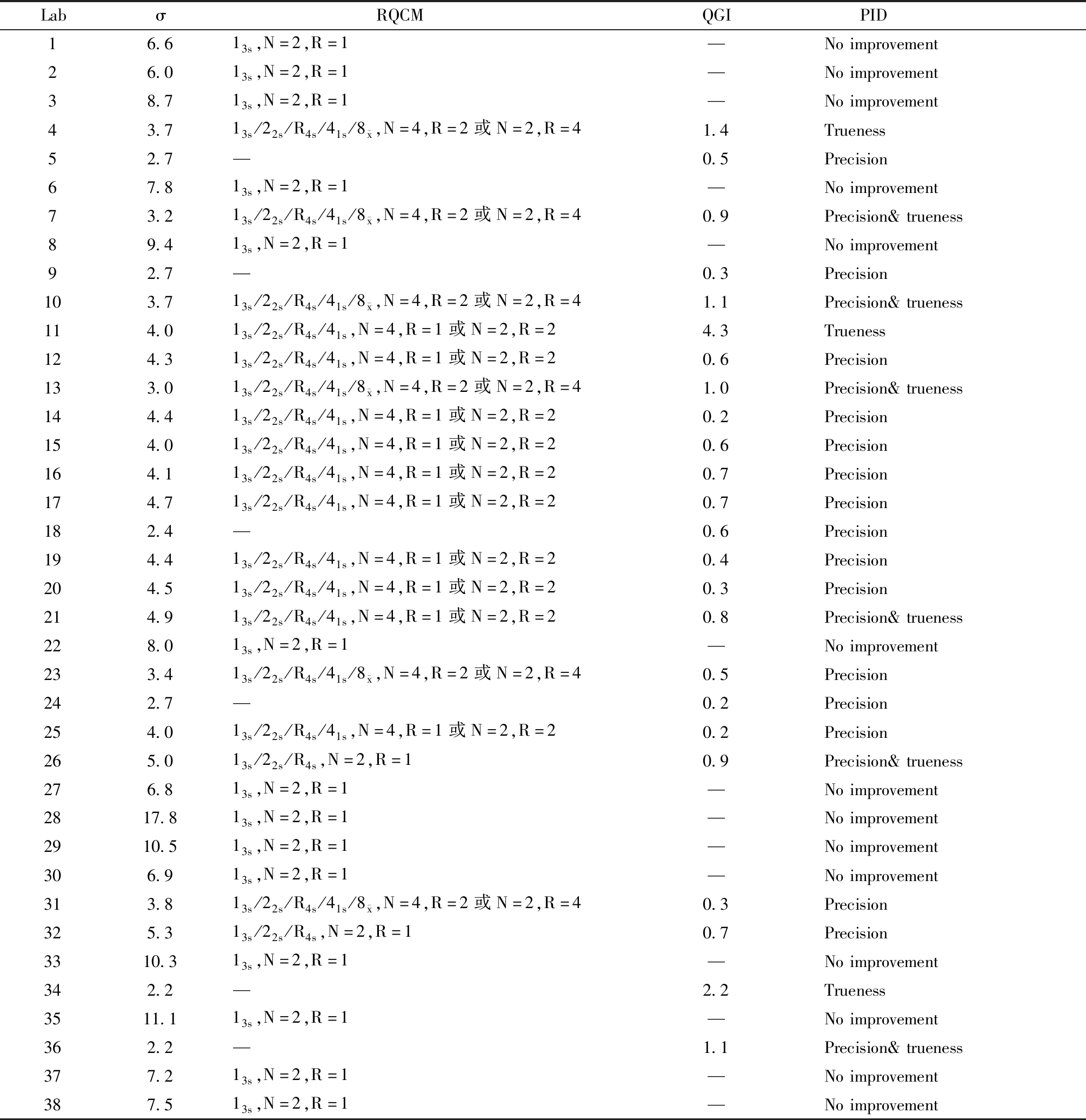
Labσ RQCMQGI PID16.613s,N=2,R=1—Noimprovement26.013s,N=2,R=1—Noimprovement38.713s,N=2,R=1—Noimprovement43.713s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=41.4Trueness52.7—0.5Precision67.813s,N=2,R=1—Noimprovement73.213s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.9Precision&trueness89.413s,N=2,R=1—Noimprovement92.7—0.3Precision103.713s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=41.1Precision&trueness114.013s/22s/R4s/41s,N=4,R=1或N=2,R=24.3Trueness124.313s/22s/R4s/41s,N=4,R=1或N=2,R=20.6Precision133.013s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=41.0Precision&trueness144.413s/22s/R4s/41s,N=4,R=1或N=2,R=20.2Precision154.013s/22s/R4s/41s,N=4,R=1或N=2,R=20.6Precision164.113s/22s/R4s/41s,N=4,R=1或N=2,R=20.7Precision174.713s/22s/R4s/41s,N=4,R=1或N=2,R=20.7Precision182.4—0.6Precision194.413s/22s/R4s/41s,N=4,R=1或N=2,R=20.4Precision204.513s/22s/R4s/41s,N=4,R=1或N=2,R=20.3Precision214.913s/22s/R4s/41s,N=4,R=1或N=2,R=20.8Precision&trueness228.013s,N=2,R=1—Noimprovement233.413s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.5Precision242.7—0.2Precision254.013s/22s/R4s/41s,N=4,R=1或N=2,R=20.2Precision265.013s/22s/R4s,N=2,R=10.9Precision&trueness276.813s,N=2,R=1—Noimprovement2817.813s,N=2,R=1—Noimprovement2910.513s,N=2,R=1—Noimprovement306.913s,N=2,R=1—Noimprovement313.813s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.3Precision325.313s/22s/R4s,N=2,R=10.7Precision3310.313s,N=2,R=1—Noimprovement342.2—2.2Trueness3511.113s,N=2,R=1—Noimprovement362.2—1.1Precision&trueness377.213s,N=2,R=1—Noimprovement387.513s,N=2,R=1—Noimprovement
N=Number of quality control test results per batch;R=Batches
表5 Glu的σ水平、推荐的质控方法、QGI及优先改进方向
Table 5 The σ level, recommended quality control methods(RQCM), QGI and preferred improvement directions(PID) of Glu

Labσ RQCMQGI PID14.513s/22s/R4s/41s,N=4,R=1或N=2,R=20.2Precision23.113s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.4Precision34.813s/22s/R4s/41s,N=41.5Trueness43.213s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.2Precision52.8—0.2Precision614.013s,N=2,R=1—Noimprovement
表5(续)
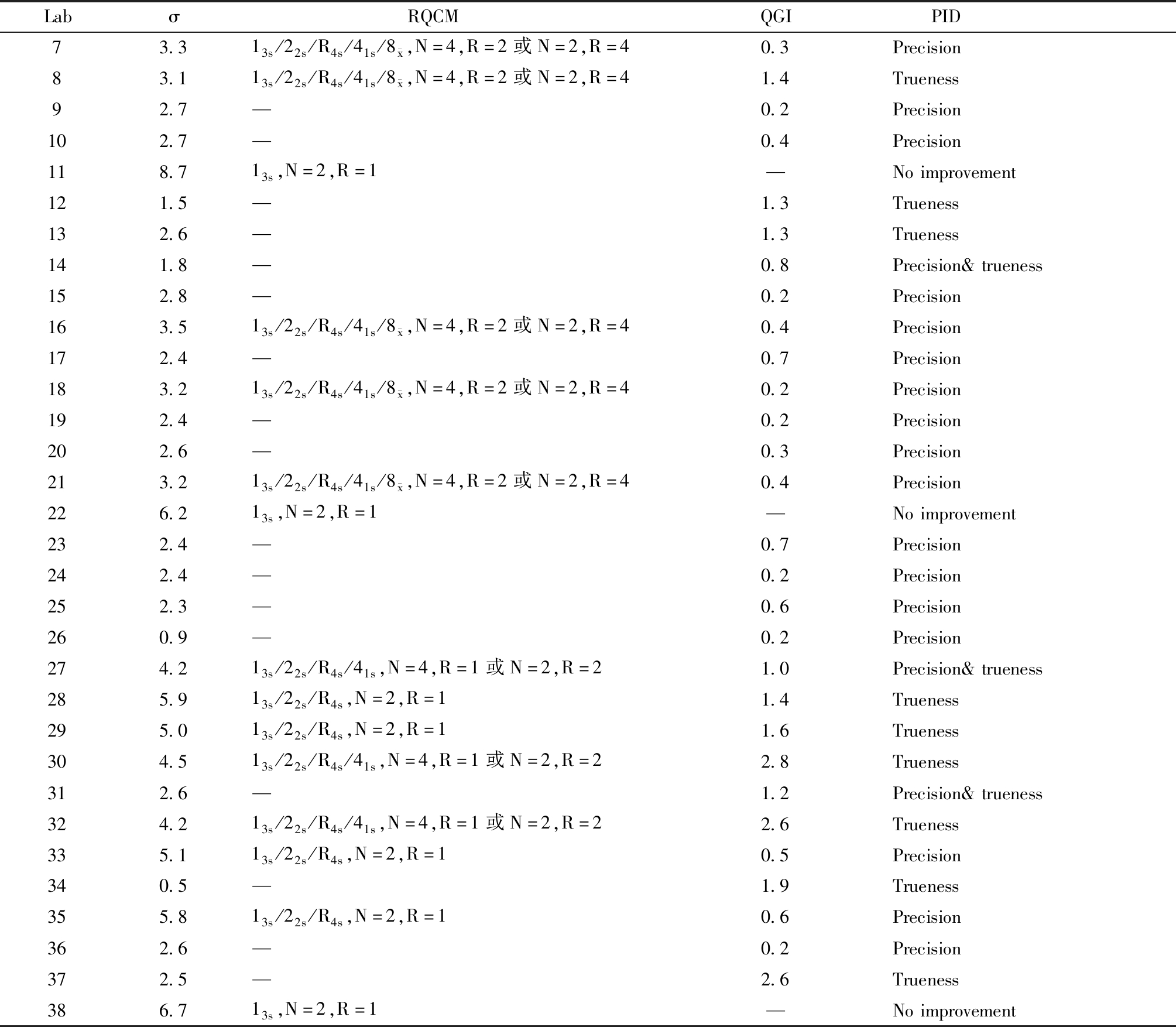
Labσ RQCMQGI PID73.313s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.3Precision83.113s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=41.4Trueness92.7—0.2Precision102.7—0.4Precision118.713s,N=2,R=1—Noimprovement121.5—1.3Trueness132.6—1.3Trueness141.8—0.8Precision&trueness152.8—0.2Precision163.513s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.4Precision172.4—0.7Precision183.213s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.2Precision192.4—0.2Precision202.6—0.3Precision213.213s/22s/R4s/41s/8 x,N=4,R=2或N=2,R=40.4Precision226.213s,N=2,R=1—Noimprovement232.4—0.7Precision242.4—0.2Precision252.3—0.6Precision260.9—0.2Precision274.213s/22s/R4s/41s,N=4,R=1或N=2,R=21.0Precision&trueness285.913s/22s/R4s,N=2,R=11.4Trueness295.013s/22s/R4s,N=2,R=11.6Trueness304.513s/22s/R4s/41s,N=4,R=1或N=2,R=22.8Trueness312.6—1.2Precision&trueness324.213s/22s/R4s/41s,N=4,R=1或N=2,R=22.6Trueness335.113s/22s/R4s,N=2,R=10.5Precision340.5—1.9Trueness355.813s/22s/R4s,N=2,R=10.6Precision362.6—0.2Precision372.5—2.6Trueness386.713s,N=2,R=1—Noimprovement
N=Number of quality control test results per batch;R=Batches
讨 论
6σ理念的最终目标是将产品质量达到6σ水平,产品不合格率控制在0.00034%,是质量控制的最高期望,被认为是国际水平;5σ表示产品的不合格率为0.023%,为优秀水平;4σ表示产品的不合格率为0.621%,为良好水平;3σ表示产品的不合格率为6.681%,是产品需要达到的最低质量要求[14]。就临床实验室而言,σ<3的检测应采取措施提高分析质量,或实验室应使用替代的方法和试剂[15]。
根据σ分布情况,Alt有68.5%的实验室处于良好水平(σ≥4.0)以上,31.6%达到国际水平(σ≥6.0)。3.0≤σ<6.0的占比为52.7%,少于2013年发表的已通过ISO 15189认可的临床实验室Alt的比例,但后者是以基于生物学变异的适当的质量规范作为TEa(32.1%)[16 ],相比本研究中采用的卫生行业标准(16%)[10]要大很多。与河北省26家结果互认实验室Alt的σ相比(TEa采用卫生行业标准16%),3.0≤σ<6.0的比例与其L2水平相似[17]。由于目前国内同时计算多家实验室Alt σ质量水平的数据甚少,且采取的标准和计算方法不同,数据差异较大。
本研究中Cr有63.1%的实验室处于良好水平(σ≥4.0)以上,36.8%达到国际水平(σ≥6.0),3.0≤σ<6.0的实验室占比为47.4%,稍低于Alt,目前暂无文献数据参比。Glu处于良好水平以上的实验室仅有34.2%,仅10.5%达到国际水平(σ≥6.0),3.0≤σ<6.0的实验室占比为42.1%。分析性能欠佳(σ<3.0)的比例较高,占47.4%,这一结果与2015年评价全国血糖检测项目中卫生行业标准的结果相似[18]。造成Glu检测性能普遍不高的原因一方面可能是由于Glu质控品浓度较低,因为有文献报道低浓度水平质控品的σ值较小,考虑项目在低浓度水平的精密度较差[17,19],另一方面可能与采用的卫生行业标准中Glu的允许总误差相对严格有关。
选择不同标准的允许总误差会导致计算的σ质量水平不同,本研究采用的是卫生行业标准(WS/T 403-2012)中规定的允许总误差(Alt 16%,Cr 12%,Glu 7%)[10]。卫生行业标准是基于个体间和个体内生物学变异,并结合国内当前可实现的分析质量水平而设定的[18],相较于室间质量评价要求(GB/T 20470-2006)中规定的可接受范围(Alt 20%,Cr 15%,Glu 10%)[20]要更严格,但与生物学变异导出的“适当的”目标值(Alt 27.48%,Cr 8.87%,Glu 6.96%)[21]比较,后者在Cr和Glu的规定值更严格。采用目前标准评价Alt和Cr,从总体结果来看是比较满意的。鉴于本研究中Glu的σ质量水平在3.0以下的实验室占比较多,具体到各个实验室可能需要结合项目的具体情况选择更合适的允许总误差来评估更为合适。
虽然σ在4.0以上被认为是良好和优秀,但所有检测项目均能达到6σ水平是实验室检测的最终目标,所以对σ水平在6.0以下的项目通过计算QGI,找出分析性能未能达到6σ的原因,确定优先改进方向。从QGI的结果看出,Alt、Cr和Glu分别有57.7%、62.5%和61.8%的实验室QGI<0.8,表明多数实验室需优先改进检测精密度。精密度表示随机误差的大小,影响精密度的因素很多,包括环境、人员更替、日常操作、试剂批号更换等。精密度高是保证正确度高的前提,这些实验室应该花很大精力首要提高检测精密度,在实际操作中应该注意实验室检测条件的恒定,严格执行标准操作规程,控制质控品复溶、保存、复温等因素,尽量减少数据变异。
研究显示Alt有26.9%的实验室QGI在0.8~1.2之间,15.4%的实验室QGI>1.2;Cr有25.0%的实验室QGI在0.8~1.2之间,12.5%的实验室QGI>1.2;Glu则有8.8%的实验室QGI在0.8~1.2之间,29.4%的实验室QGI>1.2。当QGI>1.2时,表示偏倚超出要求,需优先改进正确度。QGI在0.8~1.2之间,表示CV和偏倚同时超出要求,精密度和正确度均需改进。正确度表示测试结果中系统误差的大小,通常以偏倚来度量。影响正确度的因素主要包括方法、仪器、试剂等,正确度不佳的实验室必须经常采取比对试验,校准仪器等方法,消除系统误差。
按照中华人民共和国卫生行业标准(WS/T 641-2018)《临床检验定量测定室内质量控制》中2个浓度水平质控品的西格玛规则[12],σ水平在6.0及以上的项目仅使用13s质控规则,每批测定2个质控结果,测定1批;σ水平在5.0~6.0之间的项目使用13s/22s/R4s质控规则,每批测定2个质控结果,测定1批;σ水平在4.0~5.0之间的项目使用13s/22s/R4s/41s质控规则,每批测定4个质控结果或每批测定2个质控结果,测定2批;σ水平在3.0~4.0之间的项目使用![]() 质控规则,每批测定4个质控结果,测定2批或每批测定2个质控结果,测定4批;σ水平在3.0以下的项目无合适的质控规则。
质控规则,每批测定4个质控结果,测定2批或每批测定2个质控结果,测定4批;σ水平在3.0以下的项目无合适的质控规则。
从推荐的质控规则看,σ水平在5.0以下时,质控规则就开始变得繁琐,尤其是σ在4.0 以下时,需要执行![]() 每批测定4个质控结果,进行2批次测定或者每批测定2个质控结果,进行4批次测定,这在实际操作中是很难实现的,所以对于分析性能处于临界水平以下的方法,首先需要花很大精力对精密度和正确度进行改进,而不应该追求更多的质控规则,同时必须增加对这些检测方法的非统计质量控制,如需要更多的仪器功能检查、校准、预防性维护等,即采用全面质量控制策略[22]。对于σ水平在4.0以上的方法,对精密度和正确度进行改进应该会收到更满意的效果。由于Alt、Cr和Glu多在同一个仪器上进行检测,对于实验室而言,应依照三个项目中σ值最小的项目选择最多的质量控制方法,同时依据三个项目的QGI综合选择改进方向。
每批测定4个质控结果,进行2批次测定或者每批测定2个质控结果,进行4批次测定,这在实际操作中是很难实现的,所以对于分析性能处于临界水平以下的方法,首先需要花很大精力对精密度和正确度进行改进,而不应该追求更多的质控规则,同时必须增加对这些检测方法的非统计质量控制,如需要更多的仪器功能检查、校准、预防性维护等,即采用全面质量控制策略[22]。对于σ水平在4.0以上的方法,对精密度和正确度进行改进应该会收到更满意的效果。由于Alt、Cr和Glu多在同一个仪器上进行检测,对于实验室而言,应依照三个项目中σ值最小的项目选择最多的质量控制方法,同时依据三个项目的QGI综合选择改进方向。
孕前优生实验室作为妇女保健和预防出生缺陷的前期重要关口,关系着育龄家庭的幸福和妇幼健康,应该保证高的检验和服务质量水平。从纳入研究的38个实验室来看,江苏省孕前优生实验室在临床化学检测性能上还有很大的改进空间,这为以后的工作重点指明了方向,如规范开展针对基层实验室检验人员的质量控制培训,为实验室质量改进制定具体的实施方案并督促其执行,将质量改进划入日常工作计划并对其进行考核等。
本研究纳入的实验室数量相对较少,后期研究将进一步增加实验室数量并不断完善评估项目和质量指标,为有针对性地进行质量管理和持续改进提供科学依据。
1 Nevalainen D,Berte L,Kraft C,et al.Evaluating laboratory performance on quality indicators with the six sigma scale.Arch Pathol Lab Med,2000,124:516-519.
2 罗伟,周学文,谌树清,等.六西格玛质量管理在临床定量检测中的应用.检验医学与临床,2017,14:2531-2533,2536.
3 黄亨建,李 萍,宋昊岚,等.临床生化定量分析全面质量控制策略的应用.现代检验医学杂志,2007,2:110-112.
4 Liu Q,Fu M,Yang F,et al.Application of Six Sigma for evaluating the analytical quality of tumor marker assays.J Clin Lab Anal,2019,33:e22682.
5 刘倩,王西珍,张子龄,等.六西格玛在评价内分泌项目分析性能上的应用.中华临床实验室管理电子杂志,2020,8:36-40.
6 刘咏梅,黄小翠,向兵,等.六西格玛度量在甲状腺激素检测项目质量评价中的应用.检验医学与临床,2018,15:2635-2637.
7 陈丽婉,罗东,余曼,等.六西格玛质量管理方法在临床血液学常规项目检测性能评价和质量控制中的应用.实验与检验医学,2021,39:76-78.
8 谢小娟,李小侠,孙晶晶,等.应用六西格玛评价陕西省临床检验质量.中国卫生质量管理,2019,26:56-59.
9 彭海,李子安,阿祥仁,等.应用六西格玛管理方法评价临床常规生化检验项目的质量水平.国际检验医学杂志,2020,41:2544-2546.
10 卫生部临床检验标准专业委员会.WS/T 403-2012 临床生物化学检验常规项目分析质量指标.北京:中国标准出版社,2012.
11 闫玉珠,王冀邯,赵和平,等.6种允许总误差对20个生化项目建立个性化质量控制方案的影响.检验医学与临床,2020,17:3442-3447,3452.
12 卫生部临床检验标准专业委员会.WS/T 641-2018 临床检验定量测定室内质量控制.北京:中国标准出版社,2018.
13 胡丽涛,王薇,王治国.质量目标指数在西格玛质量管理中的应用.中华医学会第七次全国中青年检验医学学术会议论文汇编.南京,2012:187.
14 王治国.6σ质量标准在临床实验室质量控制的应用.上海医学检验杂志,2002,17:125-127.
15 Mao X,Shao J,Zhang B,et al.Evaluating analytical quality in clinical biochemistry laboratory using Six Sigma.Biochem Med,2018,28:020904.
16 康凤凤,王薇,何法霖,等.已通过ISO 15189认可的临床实验室常规生化指标的性能评价.临床检验杂志,2013,31:57-59.
17 吴昊,王会茹,李贵霞,等.应用σ度量评价河北省26家结果互认实验室常规生化项目的检测性能.河北医科大学学报,2019,40:1207-1210,1225.
18 肖亚玲,王薇,赵海建,等.用西格玛性能验证图评价中国血糖检测项目.临床检验杂志,2015,33:223-225.
19 李润青,宫丽君,王腾蛟,等.西格玛方法在临床生化检验质量管理中的应用.中华检验医学杂志,2017,40:727-732.
20 卫生部临床检验标准专业委员会.GB/T 20470-2006 临床实验室室间质量评价要求.北京:中国标准出版社,2006.
21 张路,王薇,王治国.允许总误差在西格玛度量用于评价临床化学检测项目分析质量上的应用研究.检验医学,2015,30:953-957.
22 王治国主编.临床检验质量控制技术.第3版.北京:人民卫生出版社,2014:554-567.