卵巢癌是常见妇科恶性肿瘤之一,发病率居妇科肿瘤第三位,病死率居妇科肿瘤首位[1]。据一份最近的美国癌症统计报告分析,2021年美国有21 410例新发卵巢癌,有13 770例死于卵巢癌[2]。早期卵巢癌患者的5年生存率可达70%~90%,而晚期的5年生存率仅为3%~19%[3],由于卵巢癌患者早期往往缺乏典型临床症状很难做到及早发现,且疾病进展快,绝大多数患者在确诊时已为晚期 [4]。因此,尽早发现该疾病对于卵巢癌患者的治疗及预后尤为重要。CA125是目前临床应用最广泛的卵巢癌血清标志物,约82%的卵巢癌患者血清CA125水平升高,而早期卵巢癌患者中仅有约50%伴有血清CA125升高,且血清CA125水平在子宫内膜异位症、盆腔炎等妇科良性病变中也有不同程度升高,因此其作为筛查指标的作用有限[5]。有研究表明,炎症在癌症的发生、发展过程中起到重要作用[6]。近年来,已有不少研究发现SII及NLR对胃癌、胰腺癌、食管癌、肝癌、乳腺癌等恶性肿瘤的诊断及预后具有指导价值[7-11],但关于术前外周血系统性免疫炎症指数(systemic immune-inflammation index,SII)与卵巢癌临床价值的研究较少。本文通过回顾性研究探讨术前外周血SII、中性粒细胞和淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)及糖类抗原125(Cancer Antigen,CA125)在卵巢癌临床诊断中的价值,以期为卵巢癌的诊断和早期评估提供指导。
对象与方法
1.对象:选取2017年1月—2020年1月本院妇科经手术治疗后病理确诊的90例卵巢癌(卵巢癌组)及90例卵巢良性肿瘤(卵巢良性肿瘤组)患者的临床病例资料进行分析。纳入标准为(1)临床资料完整,术前1周有血常规及血清CA125检测结果;(2)卵巢癌患者进行全面分期手术,良性卵巢肿瘤患者进行卵巢切除术或者卵巢囊肿剥离术;(3)术前未行化、放疗,术前2周未使用抗生素。排除标准为合并其他感染性疾病、血液病、严重肝肾损伤、免疫性疾病、其他恶性肿瘤。卵巢癌组患者年龄35~68岁,平均年龄(52.4±8.7)岁;病理类型包括卵巢浆液性囊腺癌68例,卵巢黏液性囊腺癌10例,透明细胞癌4例,子宫内膜样腺癌3例,颗粒细胞瘤5例,上皮性卵巢癌占94.4%,其中浆液性囊腺癌占75.6%;FIGO分期为Ⅰ~Ⅱ期 49例,Ⅲ~Ⅳ期 41例。卵巢良性肿瘤组患者年龄35~65岁,平均年龄(51.9±8.9)岁;病理类型包括成熟型囊性畸胎瘤30例,浆液性囊腺瘤32例,黏液性囊腺瘤13例,卵巢巧克力囊肿15例。两组基线资料比较,差异无统计学意义。
2.资料收集:收集患者临床资料包括年龄、术前1周血常规检测结果、血清CA125检测结果、病理类型、术后FIGO分期、腹水量及淋巴结转移等资料。根据公式计算出SII(SII=中性粒细胞计数×血小板计数/淋巴细胞计数)及NLR(NLR=中性粒细胞计数/淋巴细胞计数)。肿瘤术后分期依据国际妇产科联盟2014年修订的FIGO分期标准进行[12]。采用迈瑞BC-6800型全自动血液细胞分析仪进行血常规检测,采用罗氏CobasE601型全自动电化学发光免疫分析仪检测血清CA125水平。
3.统计学处理:应用SPSS 21.0软件进行数据分析。计量资料以![]() 表示,组间比较采用t检验,计数资料组间比较采用χ2检验,通过SPSS软件绘制ROC曲线确定SII、NLR、CA125的最佳截断值,比较三者单独及联合检测的灵敏度、特异度及ROC曲线下面积(area under curve,AUC),判断诊断准确度。ROC曲线是以真阳性率(灵敏度)为纵坐标,假阳性率(1—特异度)为横坐标绘制的曲线,可直观反映某方法不同截断点下灵敏度与特异度的关系,为选择最优截断点即诊断临界点提供依据,AUC可用来评价诊断实验的准确性[13]。约登指数是灵敏度与特异度之和减去1,该指数越大说明筛查实验的效果越好,真实性越大。以二元Logistic回归分析对SII、NLR、CA125联合诊断进行综合分析。以P<0.05表示差异有统计学意义。
表示,组间比较采用t检验,计数资料组间比较采用χ2检验,通过SPSS软件绘制ROC曲线确定SII、NLR、CA125的最佳截断值,比较三者单独及联合检测的灵敏度、特异度及ROC曲线下面积(area under curve,AUC),判断诊断准确度。ROC曲线是以真阳性率(灵敏度)为纵坐标,假阳性率(1—特异度)为横坐标绘制的曲线,可直观反映某方法不同截断点下灵敏度与特异度的关系,为选择最优截断点即诊断临界点提供依据,AUC可用来评价诊断实验的准确性[13]。约登指数是灵敏度与特异度之和减去1,该指数越大说明筛查实验的效果越好,真实性越大。以二元Logistic回归分析对SII、NLR、CA125联合诊断进行综合分析。以P<0.05表示差异有统计学意义。
结果
1.卵巢癌组与卵巢良性肿瘤组患者术前NLR、SII、CA125水平的对比:卵巢癌组NLR、SII、CA125水平高于良性肿瘤组,差异有统计学意义,见表1。
表1 两组患者外周血NLR、SII、CA125水平的比较
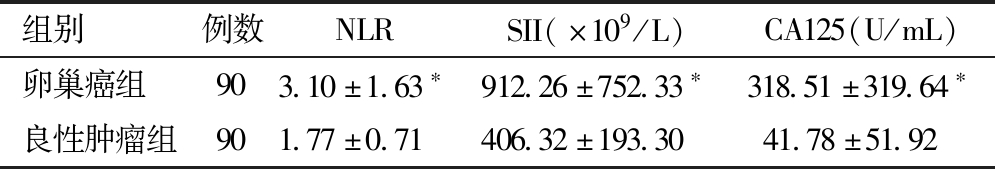
组别 例数NLRSII(×109/L)CA125(U/mL)卵巢癌组 903.10±1.63∗912.26±752.33∗318.51±319.64∗良性肿瘤组901.77±0.71406.32±193.3041.78±51.92
与良性肿瘤组比较,*P<0.05
2.术前SII、NLR、CA125单独和联合诊断卵巢癌的效能评价:对卵巢癌组与卵巢良性肿瘤组患者术前SII、NLR、CA125水平通过ROC曲线进行分析,见图1,通过ROC曲线,得出SII=559.90,NLR=2.27,CA125=43.40为最佳截点。SII、NLR、CA125及SII+NLR+CA125三项联合的AUC分别为0.799、0.816、0.843、0.874,灵敏度分别为63.3%、65.6%、77.8%、87.8%,特异度分别为86.7%、85.6%、80.0%、77.8%。见表2。
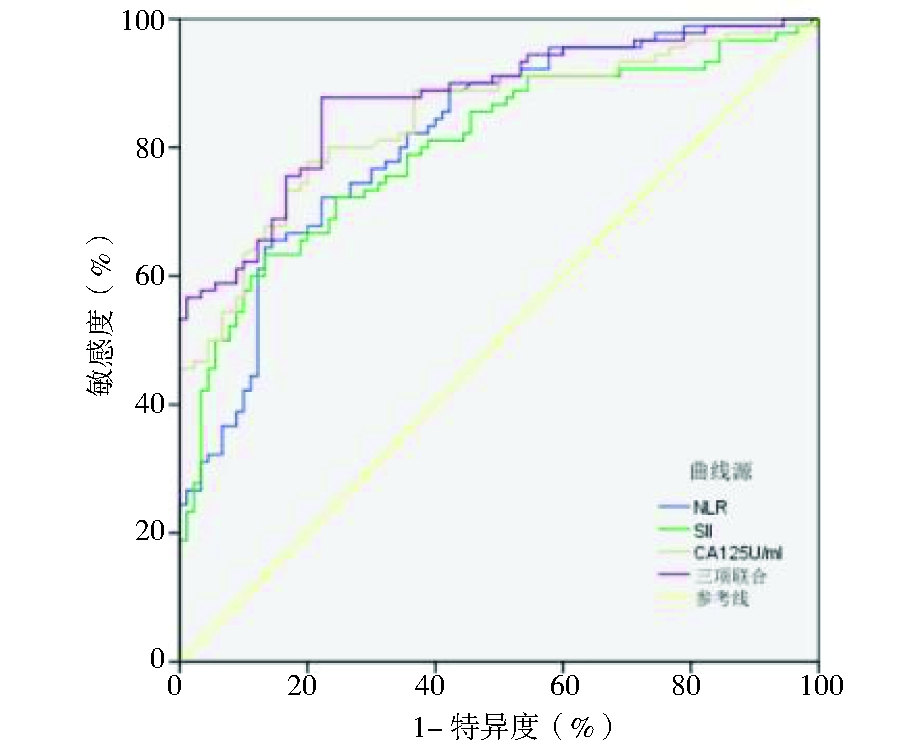
图1 术前外周血SII、NLR、CA125单独及联合诊断卵巢癌效能
表2 术前外周血SII、NLR、CA125单独及联合诊断卵巢癌效能

指标AUC值(95%CI)Cut-off值灵敏度(%)特异度(%)约登指数SIINLRCA125三项联合0.799(0.734-0.865)0.816(0.754-0.877)0.843(0.785-0.901)0.874(0.823-0.925)559.90 2.2743.40—63.365.677.887.886.785.680.077.80.5000.5120.5780.656
3.术前SII、NLR与卵巢癌临床病理特征的关系:根据ROC曲线获得最佳截断值,以SII=559.90,将卵巢癌患者分为低SII组(SII<559.90×109/L)和高SII组(SII≥559.90×109/L);以NLR=2.27,将卵巢癌患者分为低NLR组(NLR<2.27)和高NLR组(NLR≥2.27),分别分析SII、NLR与卵巢癌相关临床病理特征的关系。低SII与高SII、低NLR与高NLR在卵巢癌病理组织类型(浆液性囊腺癌与非浆液性囊腺癌)、FIGO分期、淋巴结转移、腹水量比较,差异有统计学意义;卵巢癌患者年龄比较,差异无统计学意义。见表3。
表3 术前外周血SII、NLR与卵巢癌临床病理特征关系
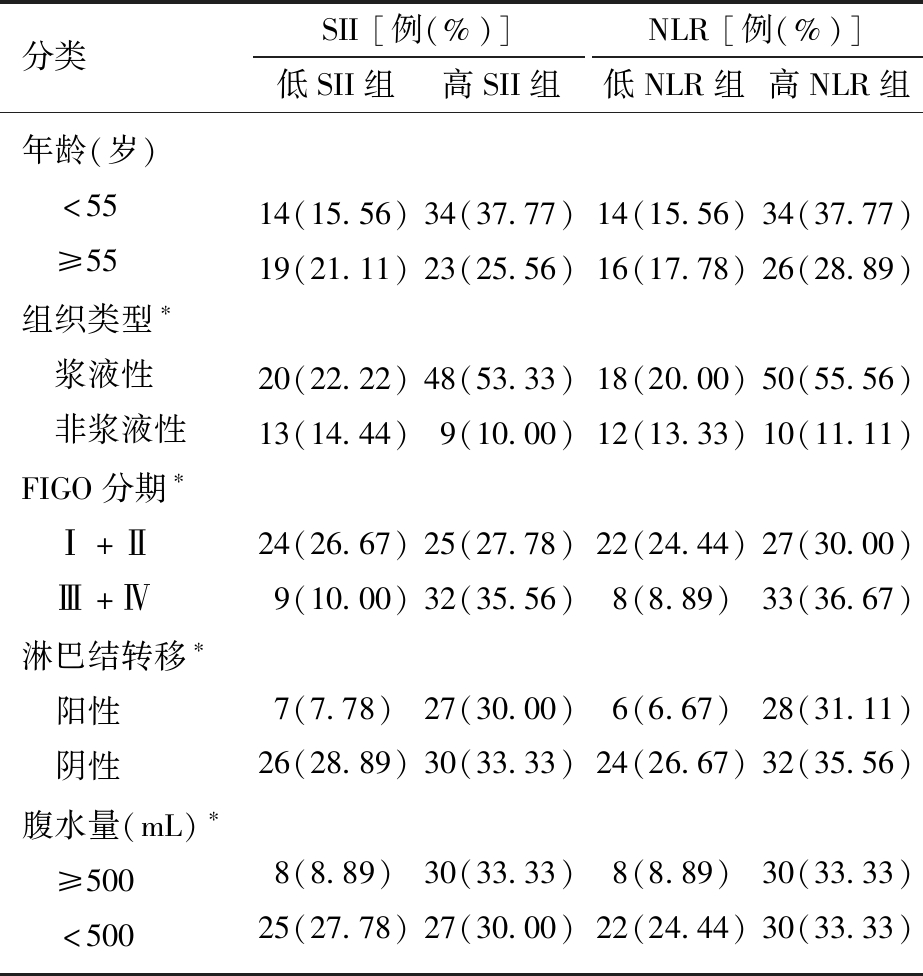
分类SII[例(%)]低SII组高SII组NLR[例(%)]低NLR组高NLR组年龄(岁) <55 ≥55组织类型∗ 浆液性 非浆液性FIGO分期∗ Ⅰ+Ⅱ Ⅲ+Ⅳ淋巴结转移∗ 阳性 阴性腹水量(mL)∗ ≥500 <50014(15.56)19(21.11)20(22.22)13(14.44)24(26.67)9(10.00)7(7.78)26(28.89)8(8.89)25(27.78)34(37.77)23(25.56)48(53.33)9(10.00)25(27.78)32(35.56)27(30.00)30(33.33)30(33.33)27(30.00)14(15.56)16(17.78)18(20.00)12(13.33)22(24.44)8(8.89)6(6.67)24(26.67)8(8.89)22(24.44)34(37.77)26(28.89)50(55.56)10(11.11)27(30.00)33(36.67)28(31.11)32(35.56)30(33.33)30(33.33)
低SII与高SII、低NLR与高NLR比较,*P<0.05
讨论
1863年 Rudolf Virchow 在肿瘤组织中发现白细胞,提出慢性炎症部位是肿瘤起源的理论,首次将慢性炎症和肿瘤联系起来[14]。2014年,Hu[15]等首次提出了SII,文中指出该指标是在NLR基础上的改进,相比NLR而言,能够更全面的反映炎症和免疫的平衡关系。中性粒细胞和血小板的促肿瘤作用以及淋巴细胞的抗肿瘤作用也许能够解释SII作用原理。中性粒细胞通过分泌炎症介质、激活内皮细胞等机制,增强癌细胞的侵袭、增殖和转移,并帮助癌细胞逃避免疫监视[16-17]。淋巴细胞具有强大的抗肿瘤免疫功能,可以抑制抑制肿瘤细胞增殖和迁移[18]。血小板可以释放生长因子,在肿瘤细胞的粘附、浸润和肿瘤组织的血管生成过程中发挥重要的作用[19-20]。
本研究通过回顾性分析方式,对比了卵巢良恶性肿瘤术前外周血NLR、SII、CA125水平,结果显示,卵巢癌组SII、NLR、CA125水平高于良性肿瘤组,差异有统计学意义,与杜博[21]等研究结果一致,提示NLR、SII、CA125水平在卵巢癌的诊断方面具有一定的临床价值。通过ROC曲线分析,得出SII、NLR、CA12及三者联合检测的AUC分别为0.799、0.816、0.843、0.874,各项指标的AUC均>0.7,可推测各项指标在一定程度上具有较高的诊断价值。其中SII、NLR、CA125及SII+NLR+CA125三项指标联合诊断灵敏度分别为63.3%、65.6%、77.8%、87.8%,特异度分别为86.7%、85.6%、80.0%、77.8%。SII检测特异度最高,这说明该指标运用于卵巢癌患者鉴别诊断具有较好的特异性,可明显减少卵巢癌的误诊风险。三项指标联合检测的AUC最大,且检测灵敏度最高,可推测出三项联合检测诊断准确性最优,因此,推测NLR、SII可辅助CA125用于卵巢良恶性肿瘤的鉴别诊断。浆液性囊腺癌是卵巢癌中最常见的组织类型,本研究中卵巢癌组患者病理组织分类上皮性卵巢癌占94.4%,其中浆液性囊腺癌占75.6%,通过对低SII与高SII、低NLR与高NLR在卵巢癌病理组织类型(浆液性囊腺癌与非浆液性囊腺癌)比较,可推测SII、NLR可能是卵巢癌病理组织学类型的一个潜在预测标志物。丁朝霞等[22]通过对147例良性临床肿瘤和134例上皮性卵巢癌的术前外周血NLR水平分析发现,高NLR(≥2.04)与患者术后FIGO分期、淋巴结转移、腹水量相关。Nie等[23]通过对553例上皮性卵巢癌患者的术前外周血SII水平分析发现,高SII(≥612)与患者术后FIGO分期、淋巴结转移相关。以上两份文献结果在本研究中均得到证实,由此可以推测,SII、NLR与卵巢癌患者的FIGO分期、淋巴结转移及腹水量具有相关性,预示着卵巢癌患者病情的活动性,且FIGO分期与卵巢癌患者的预后密切相关,故SII、NLR在一定程度上可成为卵巢癌患者评估病情及推测预后的重要参考指标。
由于本研究是一个单中心的回顾性研究,难以避免的存在样本量不足、选择偏倚等缺陷,将来仍需大样本、多中心的前瞻性研究来进一步证实SII、NLR联合CA125在卵巢癌的诊断及恶性程度预测上的临床价值。此外,SII、NLR属于炎症指标,易受到其他炎症疾病、药物等的影响,在使用该类指标进行临床分析时应该对患者的基本情况进行综合分析。
综上所述,术前外周血SII、NLR联合CA125检测一定程度上可成为卵巢癌患者早期诊断、评估病情及推测预后的重要参考指标,此外,术前外周血SII及NLR的结果只需通过一份术前血常规的报告进行简单的计算即可获取,相比其他传统的检查方式来说,其具有价格低廉、操作简便、重复性强等优点,是一种值得在临床上推广的新方法。
1 李宁,孔北华,尹如铁,等.晚期上皮性卵巢癌一线维持治疗专家共识.现代妇产科进展,2019,28:721-723.
2 Siegel RL,Miller KD,Fuchs HE,et al.Cancer Statistics,2021.CA Cancer J Clin,2021,71:7-33.
3 Blyuss O,Burnell M,Ryan A,et al.Comparison of Longitudinal CA125 Algorithms as a First-Line Screen for Ovarian Cancer in the General Population.Clin Cancer Res,2018,24:4726-4733.
4 中国抗癌协会妇科肿瘤专业委员会.卵巢恶性肿瘤诊断与治疗指南(2021年版) .中国癌症杂志,2021,31:490-500.
5 徐丛剑,王宜生,杨子健.CA125在卵巢癌诊断中的应用困境与突破 .中国实用妇科与产科杂志,2016,32:417-421.
6 Todoric J,Antonucci L,Karin M.Targeting Inflammation in Cancer Prevention and Therapy.Cancer Prev Res(Phila),2016,9:895-905.
7 张宇,汪亦民,薛英威.全身免疫炎症指数(SII)与胃癌患者临床病理因素及预后的相关性.现代肿瘤医学,2021,29:441-445.
8 周发权,陈师,孙红玉,等.系统免疫炎症指数与胰腺癌患者预后关系的系统评价和Meta分析 .中国普通外科杂志,2020,29:1076-1083.
9 汪帅,李红玲.中性粒细胞/淋巴细胞比值、纤维蛋白原在食管癌诊断中的价值.中华临床医师杂志(电子版),2021,15:365-369.
10 于翔,成思航,曹磊,等.术前全身免疫炎症指数与DEB-TACE治疗肝癌患者预后相关性分析.介入放射学杂志,2021,30:461-465.
11 赵佳琳,曹希,彭理,等.系统性炎症相关指标与乳腺癌临床病理及预后的相关性分析.南京医科大学学报(自然科学版),2021,41:74-81.
12 李晶,吴妙芳,林仲秋.《FIGO 2021妇癌报告》——卵巢癌、输卵管癌、腹膜癌诊治指南解读.中国实用妇科与产科杂志,2022,38:301-309.
13 李太顺,刘沛.ROC曲线绘制和曲线下面积比较的SAS宏包.中国卫生统计,2018,35:302-304.
14 Balkwill F,Mantovani A.Inflammation and cancer:back to Virchow?.Lancet,2001,357:539-545.
15 Hu B,Yang XR,Xu Y,et al.Systemic immune-inflammation index predicts prognosis of patients after curative resection for hepatocellular carcinoma.Clin Cancer Res,2014,20:6212-6222.
16 Ocana A,Nieto-Jiménez C,Pandiella A,et al.Neutrophils in cancer:prognostic role and therapeutic strategies.Mol Cancer,2017,16:137.
17 Eileen UQ,Carlos R.Neutrophils in Cancer:Two Sides of the Same Coin.J Immunol Res,2015,2015:1-21.
18 杜淑敏,任玉环.系统性免疫炎症指数SII与卵巢癌的相关性研究进展.中西医结合心血管病电子杂志,2020,8:26-29.
19 Gao L,Zhang H,Zhang B,et al.Prognostic value of combination of preoperative platelet count and mean platelet volume in patients withresectable non-small cell lung cancer.Oncotarget,2017,8:15632-15641.
20 梁彩霞,郑翠玲,肖泽均,等.外周血生物标志物在前列腺癌鉴别诊断中的作用及对恶性程度评判价值.标记免疫分析与临床,2018,25:766-771.
21 杜博,魏海峰,倪志强,等.CA125联合中性粒细胞与淋巴细胞比值对卵巢癌诊断及预后判断的意义.中国免疫学杂志,2014,12:1670-1671.
22 丁朝霞,闫丽萍,孙华芹,等.上皮性卵巢癌患者术前外周血中性粒细胞/淋巴细胞比值在诊断及复发预测中的作用.中国肿瘤生物治疗杂志,2017,24:1124-1128.
23 Nie D,Gong H,Mao X,et al.Systemic immune-inflammation index predicts prognosis in patients with epithelial ovarian cancer:A retrospective study.Gynecol Oncol,2019,152:259-264.