由于社会节奏加快、职场竞争加剧、工作压力增大等诸多因素,女性生育年龄逐渐推迟,导致不孕症患者中卵巢储备功能减退(diminished ovarian reserve,DOR)的患者越来越多,据报道约10%的不孕妇女患DOR[1]。高龄DOR 患者主要表现在随着年龄增长,卵巢卵泡池中始基卵泡丢失速度加倍,卵巢储备功能持续下降和卵母细胞内的活性氧簇(Reactive oxygen species,ROS)积聚,线粒体功能下降,这就导致其卵子质量在不断的减退,非整倍体发生比例由于年龄增加而迅速增加。目前,如何改善这类患者的临床治疗结局,提高临床妊娠成功率一直是生殖专家以及胚胎学家探讨的热点问题。相关研究已经证实,生长激素(Growth hormone,GH)和类胰岛素生长因子家族(Insulin-like growth factors,IGFs)在窦前卵泡到排卵前卵泡的发育一直到凋亡阶段都有着不可忽视的重要作用[2]。GH 可以有效的调节卵母细胞内的线粒体功能,直接改善卵子质量以及提高胚胎的整倍体率[3]。
因此,本研究采用回顾性分析,探究生长激素添加对于高龄卵巢储备功能减退(DOR)患者体外授精-胚胎移植(IVF-ET)结局的影响,指在探索GH在高龄DOR患者 IVF-ET中的临床应用的潜在价值,为今后GH 在辅助生殖技术中的临床应用提供依据。
资料与方法
一、一般资料
本研究收集了从2019年5月—2020年12月在海南医学院第一附属医院生殖中心进行IVF-ET患者的资料,纳入研究对象236人并同时满足高龄(35岁≤~<40岁)和DOR的诊断标准。
DOR的确诊标准:(1)血清抗缪勒氏管激素(AMH)≤1.1 ng/mL或卵泡生成素(FSH)>10 IU/L;(2)经阴道B超提示双侧卵巢基础窦状卵泡数(≥2 mm的卵泡)小于5~7个;满足其中之一即可诊断。
排除标准:患有急性传染病、躯体器质性疾病、双方染色体出现异常,精神疾病,生殖器官出现急性、生殖系统炎症和癌症、卵巢巧克力囊肿、子宫腺肌症、甲状腺功能异常、高泌乳素血症等相关疾病,以及BMI>30 kg/m2。
二、研究方法
1. 促排卵方案:入组患者均采用促性腺激素释放激素拮抗剂(GnRH-ant)方案来进行促排卵,在月经第2天开始启动,其中118例单用促性腺激素(Gn)为对照组,其余118例增加GH,为Gn+GH组。
GnRH-ant方案:依照患者的年龄、基础激素水平、BMI、窦状卵泡数量决定Gn的启动剂量。第一次使用剂量为225 IU/d,从使用Gn第4天开始,根据患者血清黄体生成素(LH)、雌激素(E2)、孕酮(P)激素水平及卵泡大小对Gn剂量进行调整。Gn对照组:月经第二天开始单用Gn,当最大卵泡平均直径达到14 mm或者≥6个卵泡平均直径达到11~13 mm时,或者血清E2浓度已经达到了400 pg/mL,开始应用GnRH-ant(思则凯,默克雪兰诺,德国) ,0.25 mg/d,一直使用到HCG日。Gn+GH组:Gn启动时同时添加GH,余处理方式同Gn组。当2个卵泡平均大小≥18 mm或3个卵泡平均大小≥17 mm时,当晚使用HCG 6 000 IU肌肉注射,34~36 h后阴道B超引导下进行穿刺取卵。
2. 胚胎移植及黄体支持:取卵后根据患者胚胎情况,选择第三天的卵裂胚或者第五天的囊胚进行新鲜周期移植。如若该周期未获卵或无可利用胚胎或因其他因素(个人因素、内膜因素等)则取消该周期。对剩余的胚胎冷冻或进行囊胚培养。全部病人在取卵的第一天开始口服地屈孕酮片10 mg BID+阴道黄体酮凝胶90 mg QD。
3.观察指标:对比两组患者年龄、不孕时间、基础FSH、LH、E2,AFC、Gn使用时间、Gn用量、扳机日血清E2、LH、P水平和子宫内膜厚度,获卵数、2PN受精率、优质胚胎率、可利用胚胎数、平均移植胚胎数、周期取消率、着床率、临床妊娠率、流产率等指标。其中2PN受精率=2PN受精数/获卵数,优质胚胎率=优质胚胎数/胚胎总数,周期取消率=取消周期数/总周期数,着床率=孕囊数/移植胚胎数,临床妊娠率=临床妊娠周期数/胚胎移植周期数,流产率=流产周期数/临床妊娠周期数。
4.妊娠结局与随访:自取卵当天开始持续给予黄体支持。移植后12~14 d抽血行血β-HCG检查确认是否生化妊娠,移植后28~35 d行经阴道超声检查确诊是否为临床妊娠(超声下宫内或宫外可见妊娠囊或原始心管搏动者);移植75 d查胚胎顶臀长(CRL)和颈项透明带厚度(NT)。
5. 统计分析:使用SPSS 19.0软件对所得到的的数据进行分析,计量数据t检验,计数数据χ2检验。P <0.05具有统计学差异。
结 果
一、两组患者基本情况比较
两组患者年龄、不孕时间、BMI、AFC、基础性激素水平、AMH值进行比较均无统计学差异,如表1所示。
表1 两组患者一般临床资料比较![]()
Table 1 Comparison of basic characteristics between Gn and Gn+GH ![]()
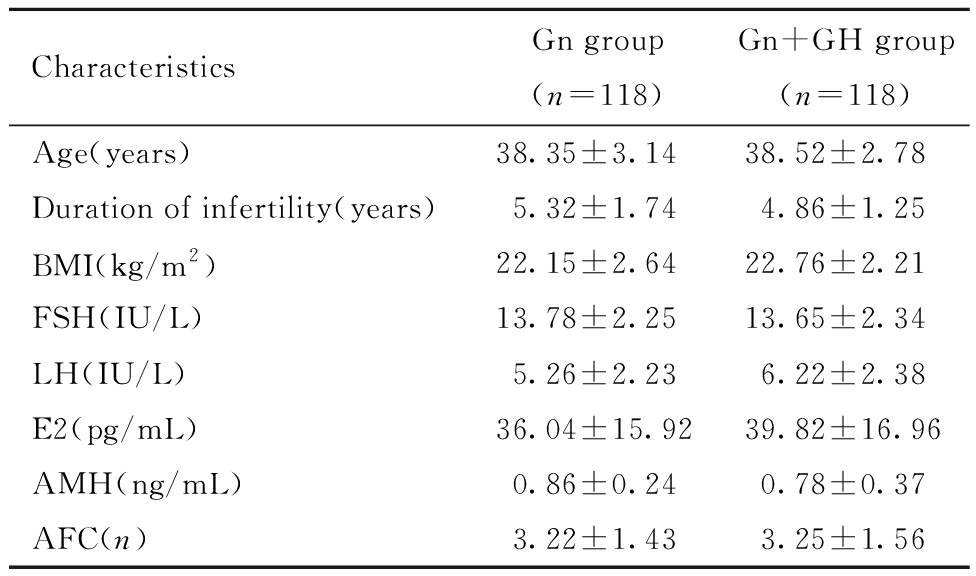
CharacteristicsGn group(n=118)Gn+GH group(n=118)Age(years) 38.35±3.1438.52±2.78Duration of infertility(years)5.32±1.744.86±1.25BMI(kg/m2)22.15±2.64 22.76±2.21FSH(IU/L)13.78±2.2513.65±2.34LH(IU/L)5.26±2.236.22±2.38E2(pg/mL)36.04±15.92 39.82±16.96 AMH(ng/mL)0.86±0.240.78±0.37AFC(n)3.22±1.433.25±1.56
二、两组患者促排卵情况比较
两组患者Gn使用时间、Gn用量、扳机日E2、LH、P水平、扳机日子宫内膜厚度、2PN受精率、平均移植胚胎数以及周期取消率指标进行对比,无统计学差异(P>0.05)。Gn+GH组的获卵数、可利用胚胎数及优质胚胎率分别为(4.13±2.51)、(2.20±1.53)和44.9%,均高于Gn组,差异有统计学意义。如表2所示。
表2 两组患者促排卵情况比较![]()
Table 2 Comparison of ovulation induction between Gn and Gn+GH ![]()

CharacteristicsGn group(n=118)Gn+GH group(n=118)Gn use time(days)8.25±2.467.86±2.68Gn dose(U)2 267.65±212.422 247.28±218.65E2 on the trigger day(pg/mL)1 267.78±143.46 1 358.77±145.05LH on the trigger day(IU/L)3.62±2.763.89±2.58P on the trigger day(ng/mL)1.02±0.421.12±0.46 Endometrial thickness on the trigger day(mm)10.34±2.5511.25±2.96Retrieved oocytes(n)* 2.71±1.724.13±2.51 2PN fertilization rate(%)65.75(432/657) 67.45(458/679)Available embryos(n)* 1.67±1.302.20±1.53High-quality embryos rate(%)*38.89(168/432)44.98(206/458)Averageembryos transferred(n) 1.50±0.50 1.55±0.53Cycle cancellation rate(%)10.17(12/118)5.08(6/118)
Comparison between two groups,* P<0.05
三、两组患者临床结局比较
Gn+GH组着床率以及临床妊娠率大于Gn组,但无统计学差异。两组的流产率也无统计学意义。如表3所示。
表3 两组患者临床结局比较
Table 3 Comparison of clinical outcomes between two groups

CharacteristicsGn group(n=118)Gn+GH group(n=118)Implantation rate(%) 28.57(52/182)31.28(61/195)Clinical pregnancy rate(%)36.79(39/106) 40.18(45/112) Miscarriage rate(%)5.13(2/39) 6.67(3/45)
讨 论
由于女性年龄不断增加,其生育能力呈现逐年降低的趋势,特别是35岁以上的女性群体,卵巢储存功能不佳,卵巢低反应的发生比例有所上升。在IVF-ET技术中,DOR是造成卵巢对促排卵药物反应程度减弱的重要原因之一,影响获卵数和卵母细胞质量,并使周期取消率升高[4]。相关的研究证实,该类患者ART助孕时卵巢反应低下,Gn剂量大、获卵数目少、周期取消率居高不下、可使用胚胎数量少、临床妊娠率低并且流产率高[5]。针对DOR患者来说,大剂量Gn 的使用并不能有效提升卵泡数目以及改善卵子质量,同时,由于大剂量的药物对于卵子产生刺激,导致其质量得不到保证、子宫内膜内环境不良等问题和患者还要承担高额的费用[6]。
对于高龄 DOR 患者,卵子质量的下降是造成妊娠失败的主要因素,GH 对于此类患者临床结局的改善很可能源于增加可获得卵子数目及提高卵子的质量。研究表明,生长激素能够在优势卵泡中聚集、提高卵泡存活率以及细胞增殖方面发挥作用,从而提高DOR患者的卵巢反应,获得优质胚胎[7]。本次研究结果显示GH+Gn组的获卵数、可利用胚胎数及优质胚胎率明显高于Gn组(P<0.05)。康卫卫等[8]研究证实,使用生长激素在高龄卵巢储备功能减退患者IVF助孕过程中,可有效减少Gn用量和使用时间,增加子宫内膜厚度和获卵数,有助于获得高质量胚胎和良好的妊娠结局。另外研究证实,GH和Gn的共同使用有利于改善卵巢的反应性,提高受精率、妊娠率和活产率[9]。Tesarik [10]等研究也发现对于年龄>40岁的超排卵人群,GH 应用虽然没有显著改善患者的获卵数,但是在 GH 组正常受精数、高质量胚胎数均有明确改善,并且临床妊娠率与活产率显著升高。一项荟萃研究的结果也证实,补充生长激素能够有效提升IVF/ICSI卵巢反应不良患者的活产率、临床妊娠率以及获卵数,同时减少Gn使用剂量以及周期取消率[11]。但是在本研究中,虽然Gn+GH组2PN受精率、着床率以及临床妊娠率高于Gn组,但均无统计学差异。
GH作为由垂体前叶所产生的一类单链多肽,能够在机体呈现脉冲式产生,其对机体相关的影响主要经过蛋白作用从而实现,其中包含IGFs、生长激素结合蛋白、类胰岛素生长因子结合蛋白等物质[12]。在卵巢窦前卵泡壁、卵母细胞和卵丘上都有生长激素受体,能够直接受到该物质的调控作用。生长激素可以经过受体介导,经过LH的作用,让卵泡膜细胞当中的雄性激素生成,并且能够让FSH导致颗粒细胞的芳香化酶作用产生了一定的促进效应,因此机体性激素生成增加,加快卵泡增长并且可以提升可排卵数量[13]。除此之外,生长激素在动物实验中已经明确表明,可经过增强卵母细胞的线粒体功能以及三磷酸腺苷(ATP)等物质的生成,从而增加卵母细胞的质量[14]。其他的研究也证实,年龄大于35岁的女性,卵巢反应较差的患者应用生长激素进行治疗后可上调自身受体以及增强线粒体活性,从而改善卵母细胞的质量[15]。GH 除了直接作用于卵巢对卵子发育起作用外,还通过作用于肝脏,刺激增加IGF-1的产生或对卵巢组织进行刺激分泌 IGF-1,从而来调控卵泡的发育[16]。
本研究针对高龄(35岁≤~<40岁)且合并DOR患者,在促排卵过程中使用生长激素能够增加获卵数和可利用胚胎数以及提高胚胎质量,可利用胚胎数的增加给予该类患者更多移植机会,从而提高持续妊娠率和累积活产率。今后还需继续密切随访该类患者的持续妊娠率和活产率,获得更有说服力的数据,以及开展多中心、大数据随机对照研究进行深层次研究。
1 Maheshwari A,Fowler P,Bhattacharya S.Assessment of ovarian reserve--should we perform tests of ovarian reserve routinely.Hum Reprod,2006,21:2729-2735.
2 Scheffler F,Vandecandelaere A,Soyez M,et al.Follicular GH and IGF1 levels are associated with oocyte cohort quality:A pilot study.Front Endocrinol(Lausanne),2021,12:793621.
3 Regan S,Knight PG,Yovich JL,et al.Growth hormone during in vitro fertilization in older women modulates the density of receptors in granulosa cells,with improved pregnancy outcomes.Fertil Steril,2018,110:1298-1310.
4 Ata B,Seyhan A,Seli E.Diminished ovarian reserve versus ovarian aging:overlaps and differences.Curr Opin Obstet Gynecol,2019,31:139-147.
5 Morin SJ,Patounakis G,Juneau CR,et al.Diminished ovarian reserve and poor response to stimulation in patients <38 years old:a quantitative but not qualitative reduction in performance.Hum Reprod,2018,33:1489-1498.
6 Youssef MA,van Wely M,Mochtar M,et al.Low dosing of gonadotropins in in vitro fertilization cycles for women with poor ovarian reserve:systematic review and meta-analysis.Fertil Steril,2018,109:289-301.
7 Safdarian L,Aghahosseini M,Alyasin A,et al.Growth hormone(GH) improvement of ovarian responses and pregnancy outcome in poor ovarian responders:A randomized study.Asian Pac J Cancer Prev,2019,20:2033-2037.
8 康卫卫,梁新新.生长激素黄体期注射在高龄卵巢储备功能减退IVF-ET助孕中的应用.海南医学,2020,31:875-878.
9 Ob′edkova K,Kogan I,Krikheli I,et al.Growth hormone co-treatment in IVF/ICSI cycles in poor responders.Gynecol Endocrinol,2017,33:15-17.
10 Tesarik J,Hazout A,Mendoza C.Improvement of delivery and live birth rates after ICSI in women aged >40 years by ovarian co-stimulation with growth hormone.Hum Reprod,2005,20:2536-2541.
11 Yang P,Wu R,Zhang H.The effect of growth hormone supplementation in poor ovarian responders undergoing IVF or ICSI:a meta-analysis of randomized controlled trials.Reprod Biol Endocrinol,2020,18:76.
12 Altmäe S,Mendoza-Tesarik R,Mendoza C,et al.Effect of growth hormone on uterine receptivity in women with repeated implantation failure in an oocyte donation program:a randomized controlled trial.J Endocr Soc,2018,2:96-105.
13 Cui N,Li AM,Luo ZY,et al.Effects of growth hormone on pregnancy rates of patients with thin endometrium.J Endocrinol Invest,2019,42:27-35.
14 Hou HY,Wang X,Yu Q,et al.Evidence that growth hormone can improve mitochondrial function in oocytes from aged mice.Reproduction,2018,157:345-358.
15 Weall BM,Al-Samerria S,Conceicao J,et al.A direct action for GH in improvement of oocyte quality in poor-responder patients.Reproduction,2015,149:147-154.
16 Devesa J,Caicedo D.The role of growth hormone on ovarian functioning and ovarian angiogenesis.Front Endocrinol(Lausanne),2019,10:450.