不孕不育是当今生殖健康领域的重大问题之一,其中男性不育约占50%[1-2],传统的常规精液参数包括精子的浓度及活力等指标,是男性生育情况评估的基础[3]。随着计算机辅助精液分析系统(computer-aided sperm analysis,CASA)在男科实验室的推广应用,临床上不仅能获得精子浓度及活力等常规参数,还可以获得更客观、准确的精子运动参数,包括平均路径速率(average path velocity,VAP)、曲线速率(curvilinear velocity,VCL)、直线速率(straight-line velocity,VSL)、精子头侧摆幅度(amplitude of lateral head displacement,ALH)、前向性(straightness,STR)、直线性(linearity,LIN)和鞭打频率(beat-cross frequency,BCF)。这些指标可以间接反映人类精子的受精能力,但在临床中仍未得到充分重视。不明原因男性不育症(unexplained male infertility,UMI)指常规精液分析结果正常且排除身体及内分泌失调的男性不育症,其发病率约为15%[4]。目前关于CASA分析获得的精子运动参数对UMI患者的检测意义尚不清楚。
近年来,精子DNA损伤的评估也是男性不育症的一个研究热点。既往研究表明精子DNA损伤与许多生殖健康的指标密切相关,包括受精、胚胎质量、着床、临床妊娠、自然流产、先天性畸形和儿童疾病等[5-8]。有学者发现在UMI患者中有相当一部分人的精子DNA碎片非常高[9]。同时随着年龄的增长,男性的精子DNA完整性也变得更差[10-13]。全国二孩政策开放以后,高龄男性的生育问题备受关注。而国内关于UMI患者年龄与精子DNA损伤的关系鲜有报道,本文旨在研究UMI患者的年龄与其精子活力、精子运动参数及DNA损伤的关系,为UMI的临床诊治提供有用的信息。
对象与方法
1.研究对象:本文对2013年1月—2018年12月在广州医科大学附属第三医院不孕不育专科门诊就诊的400例UMI患者进行回顾性分析。纳入标准:男性,发育正常,BMI <24 kg/m2;无遗传病、传染病;否认吸烟史;不存在性功能异常和射精障碍;2次精液分析结果正常(精子浓度≥15×106/mL,PR% ≥32%并且正常形态精子百分率≥4%);与配偶未采取避孕措施,有规律性生活至少12个月未能获得临床妊娠[14]并排除女方不孕因素而未找到明确原因。按照年龄将UMI患者分为二组:<35岁组(276例)和≥35岁组(124例)。所有研究对象的样本及信息采集皆通过广州医科大学附属第三医院伦理委员会批准。
2. 精液分析:所有研究对象禁欲2~7 d,手淫法收集精液于无菌取精杯中,37°C 孵育待其完全液化后,按照WHO《人类精液检查与处理实验室手册》 (第5版) 进行显微镜湿片初检后,采用计算机辅助精子分析(CASA)系统 (Hamilton Thorne IVOSⅠ,USA) 检测精子浓度、活力及精子运动参数(VAP、VSL、VCL、ALH、STR、LIN和BCF):取混匀后的精液样本6 μL加入固定盖片计数板(Leja公司,深度20 μm),将计数板放入CASA分析仪中预热后分析20个视野,每个样本扫描精子总数不少于400条。根据仪器制造商的说明书设定,精子具有VAP >5 μm/s且VSL>11 μm/s则被分类为前向运动。精子形态评估采用改良巴氏染色法,光镜下分类200条精子。
3. 精子DNA损伤检测:采用精子染色质扩散(sperm chromatin dispersion,SCD)试验检测精子DNA缺损率。试剂盒来源于深圳华康生物医学工程有限公司,实验步骤按照试剂盒说明书进行,光镜下计数400条精子,分类晕环的有无和大小,小晕环、无晕环和退化表示精子核DNA断裂,大晕环和中晕环表示精子核DNA完整。结果以DFI表示,DFI =异常精子数/计数精子总数×100%。DFI的正常参考值为小于30%。
4.统计学分析:采用SPSS 19.0统计软件进行数据分析,计量资料以![]() 表示。变量不服从正态分布,采用Spearman相关分析进行相关性分析,不同年龄组间精子运动参数的比较采用两个独立样本 t 检验方法,DFI异常率及OR值的比较采用χ2检验。P<0.05为差异有统计学意义。
表示。变量不服从正态分布,采用Spearman相关分析进行相关性分析,不同年龄组间精子运动参数的比较采用两个独立样本 t 检验方法,DFI异常率及OR值的比较采用χ2检验。P<0.05为差异有统计学意义。
结果
1. 不同年龄组的精子活力、运动参数及DFI水平比较:≥35岁组的PR%、VAP和VCL均低于<35岁组,差异有统计学意义(P<0.05)。两个年龄组间精子总活力、VSL、ALH、STR、LIN及BCF的差异均无统计学意义。所有研究对象总体的DFI异常率为8.5%(34/400)。≥35岁组的DFI水平及DFI异常率均高于<35岁组且差异具有统计学意义(P均<0.05)。≥35岁组的精子DNA损伤风险是<35岁组的2.759倍(95%CI:1.356~5.614)。见表1和表2。
表1 不同年龄组的精子活力、运动参数及DFI水平比较![]()
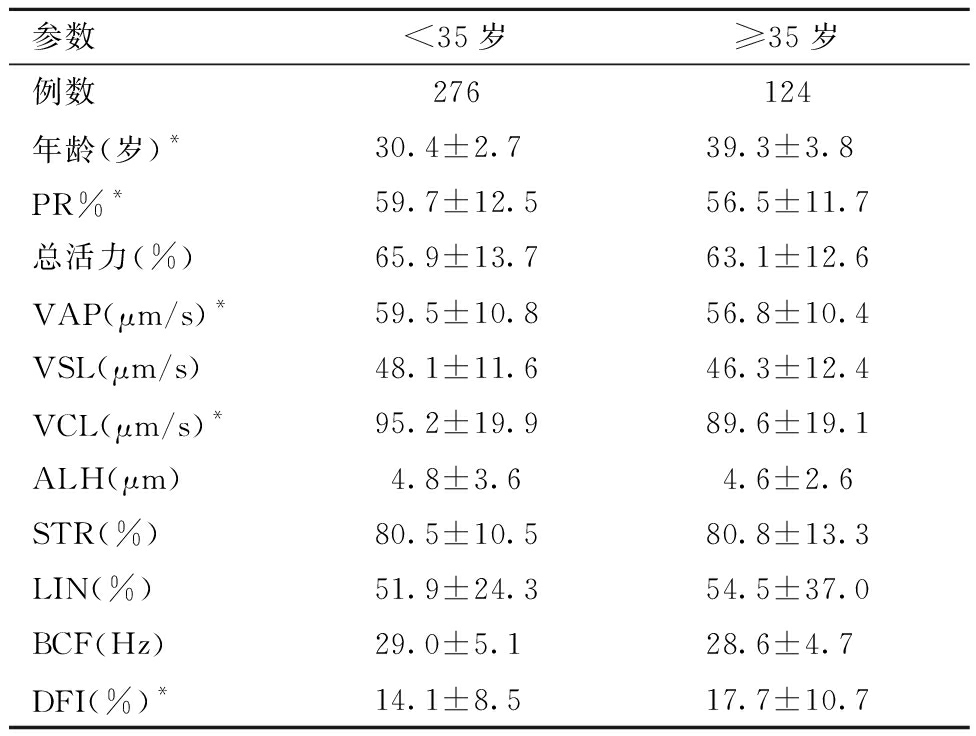
参数<35岁≥35岁例数276124年龄(岁)*30.4±2.7 39.3±3.8 PR%*59.7±12.556.5±11.7总活力(%)65.9±13.763.1±12.6VAP(μm/s)*59.5±10.856.8±10.4VSL(μm/s)48.1±11.646.3±12.4VCL(μm/s)*95.2±19.989.6±19.1ALH(μm)4.8±3.64.6±2.6STR(%)80.5±10.580.8±13.3LIN(%)51.9±24.354.5±37.0BCF(Hz)29.0±5.1 28.6±4.7 DFI(%)*14.1±8.5 17.7±10.7
注:两组比较,*P<0.05
表2 不同年龄组精子DFI异常率的比较
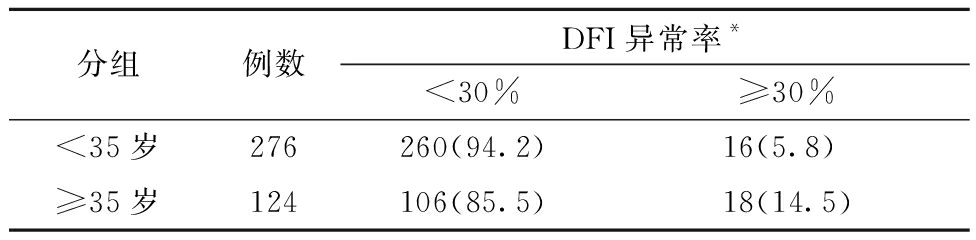
分组例数DFI异常率*<30%≥30%<35岁276260(94.2)16(5.8) ≥35岁124106(85.5)18(14.5)
注:两组比较,*P=0.004
二、年龄与精子活力、运动参数及DFI的相关性分析
UMI患者年龄与PR%、总活力、VAP、VSL和VCL呈负相关(P均<0.05),而与精子DFI呈正相关(P<0.05)且具有统计学意义。年龄与ALH、STR、LIN和BCF的相关关系无统计学意义。见表3。
表3 年龄与精子活力、运动参数及DFI的相关性分析(n=400)
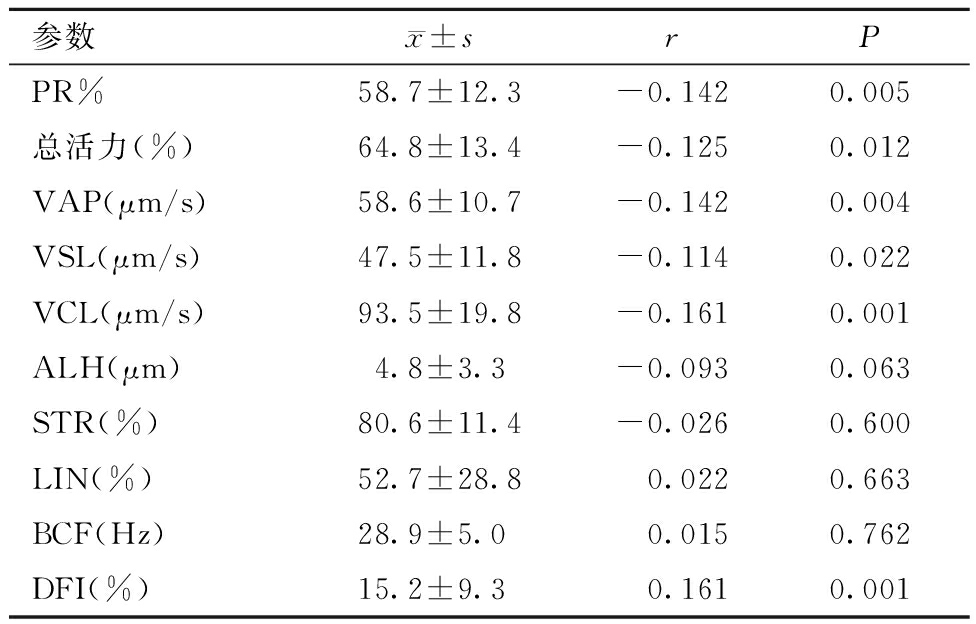
参数x±srPPR%58.7±12.3-0.1420.005总活力(%)64.8±13.4-0.1250.012VAP(μm/s)58.6±10.7-0.1420.004VSL(μm/s)47.5±11.8-0.1140.022VCL(μm/s)93.5±19.8-0.1610.001ALH(μm)4.8±3.3-0.0930.063STR(%)80.6±11.4-0.0260.600LIN(%)52.7±28.8 0.0220.663BCF(Hz)28.9±5.0 0.0150.762DFI(%)15.2±9.3 0.1610.001
讨论
1.年龄与UMI患者精子运动参数的关系:CASA具有分析速度快、客观测量精子运动参数的优点,其提供的LIN、STR、VSL和VAP是精子前向运动的指标,VCL和BCF是精子生存能力和活力的标志,而LIN和STR也被用来描述精子的游动模式。由于精子运动参数的准确性容易受到仪器温度、计数板深度和精子浓度等的影响,本研究由经过专业培训的资深男科实验室技术人员进行实验操作,严格按照仪器说明书进行设置参数和操作,初检精子浓度>50×106/mL的标本稀释后再进行精子运动参数检测。
既往研究表明,随着男性年龄的递增,精液质量呈下降趋势[15],更有学者发现,大于29岁的男性其精液体积、形态及活动力的异常率明显升高[12]。精子的运动学特征由精子运动速度、速度比和摆动来决定。然而年龄对UMI男性精子运动参数的影响研究甚少。Veron等[16]通过对5000多例不育患者研究发现,精子的活力及VAP、VSL、VCL和BCF与患者年龄呈负相关。Fréour等[17]在年轻的具有生育力的男性中也发现,ALH、VCL、LIN和STR的值伴随年龄升高而显著下降。本研究在UMI患者中发现,其年龄与PR%、总活力以及精子运动参数VAP、VSL和VCL呈负相关关系。表明UMI患者与未进行临床分类的不育患者相似,随着年龄的增长,精子活力及VAP、VSL和VCL均显示出下降的趋势,但与正常生育力男性相比,本研究中UMI男性的VCL和ALH较高而LIN和STR较低。VAP、VSL和VCL是反映精子运动速度的重要指标,尽管UMI患者的精液分析检测结果处于WHO第5版标准的参考范围之内,但通过CASA的应用,本课题发现年龄可能会通过影响精子VAP、VSL和VCL而导致UMI男性前向运动精子百分率及精子总活力的最终下降,与此同时,本研究发现≥35岁组的PR%、VAP和VCL均明显低于<35岁组。这提示≥35岁的UMI患者其精子运动的平均路径速率与曲线速率出现了明显的下降,其发生机制可能与年龄增长引起附睾的氧化应激状态改变,包括ROS总体水平上升和附睾组织的抗氧化保护失效引起精子损伤有关[18],本课题组将在后续研究中开展氧化应激相关的实验中来进一步验证。
2.年龄对UMI患者DNA损伤的影响:既往研究显示,随着年龄的增长,DNA严重受损的精子比例也在增加[19]。Deenadayal等[20]报道>45岁的印度男性具有更高的精子DNA碎片。有学者研究显示,>40岁的男性比<40岁的男性精子DNA损伤程度更高[21]。骆强翔等[22]对6162例不育患者的精液样本研究发现,精子DFI与患者年龄呈正相关。本课题组先前也证实了年龄的增长引起不育男性的精子DFI水平升高[13]。Oleszczuk等[9]在122例UMI患者中,发现DFI ≥ 30% 的比例为8.4%,与本文研究对象总体的DFI异常率8.5%相近,另外本研究还通过年龄分组,发现不同年龄组间的DFI水平及DFI异常率均存在明显差异,≥35岁组的DFI异常率高达14.52%,其精子DNA损伤风险是<35岁组的2倍多。这进一步反映了年龄可能对UMI男性精子DNA损伤存在影响。Agarwal等[23]提出男性年龄的增长是引起精子DNA碎片水平升高的高风险因子,而氧化应激水平的升高被认为是其主要机制。精子DNA损伤与年龄增长以及不良的生育结局密切相关[24]。因此在临床诊疗工作中,UMI患者的年龄及其精子DNA损伤程度应该引起高度重视。
综上所述,本研究初步阐明了年龄的增长可能影响UMI患者精子运动参数下降以及精子DNA损伤水平的上升。精子细胞VAP、VCL和VSL的下降与较高的精子DNA损伤有关,从而降低生育潜力。本文推测精子DNA损伤水平的升高可能是高龄UMI男性的不育原因之一,为临床UMI的诊治提供一个新的视角。由于本研究未能获得研究对象的日常饮食生活习惯、职业及居住环境等相关资料,故无法完全排除混杂因素对研究结果的影响,这仍需要本课题组后续实验深入研究。
1 Panner Selvam MK,Agarwal A,Pushparaj PN,et al.Sperm Proteome Analysis and Identification of Fertility-Associated Biomarkers in Unexplained Male Infertility.Genes (Basel),2019,10:522.
2 Lu R,Chen X,Yu W,et al.Analysis of age-associated alternation of SCSA sperm DNA fragmentation index and semen characteristics of 1790 subfertile males in China.J Clin Lab Anal,2020,34:e23548.
3 Baskaran S,Finelli R,Agarwal A,et al.Diagnostic value of routine semen analysis in clinical andrology.Andrologia,2021,53:e13614.
4 Hamada A,Esteves SC,Nizza M,et al.Unexplained male infertility:diagnosis and management.Int Braz J Urol,2012,38:576-594.
5 Shamsi MB,Imam SN,Dada R.Sperm DNA integrity assays:diagnostic and prognostic challenges and implications in management of infertility.J Assist Reprod Genet,2011,28:1073-1085.
6 Simon L,Lewis SE.Sperm DNA damage or progressive motility:which one is the better predictor of fertilization in vitro.Syst Biol Reprod Med,2011,57:133-138.
7 Simon L,Castillo J,Oliva R,et al.Relationships between human sperm protamines,DNA damage and assisted reproduction outcomes.Reprod Biomed Online,2011,23:724-734.
8 Simon L,Zini A,Dyachenko A,et al.A systematic review and meta-analysis to determine the effect of sperm DNA damage on in vitro fertilization and intracytoplasmic sperm injection outcome.Asian J Androl,2017,19:80-90.
9 Oleszczuk K,Augustinsson L,Bayat N,et al.Prevalence of high DNA fragmentation index in male partners of unexplained infertile couples.Andrology,2013,1:357-360.
10 Petersen CG,Mauri AL,Vagnini LD,et al.The effects of male age on sperm DNA damage:an evaluation of 2,178 semen samples.JBRA Assist Reprod,2018,22:323-330.
11 Rosiak-Gill A,Gill K,Jakubik J,et al.Age-related changes in human sperm DNA integrity.Aging (Albany NY),2019,11:5399-5411.
12 Gill K,Jakubik-Uljasz J,Rosiak-Gill A,et al.Male aging as a causative factor of detrimental changes in human conventional semen parameters and sperm DNA integrity.Aging Male,2020,23:1321-1332.
13 Guo LY,Zhou H,Liu M,et al.Male age is more critical to sperm DNA integrity than routine semen parameters in Chinese infertile males.Andrologia,2020,52:e13449.
14 陈子江,刘嘉茵,黄荷凤,等.不孕症诊断指南.中华妇产科杂志,2019,54:505-511.
15 Hellstrom WJ,Overstreet JW,Sikka SC,et al.Semen and sperm reference ranges for men 45 years of age and older.J Androl,2006,27:421-428.
16 Verón GL,Tissera AD,Bello R,et al.Impact of age,clinical conditions,and lifestyle on routine semen parameters and sperm kinematics.Fertil Steril,2018,110:68-75.e4.
17 Fréour T,Jean M,Mirallie S,et al.Computer-assisted sperm analysis parameters in young fertile sperm donors and relationship with age.Syst Biol Reprod Med,2012,58:102-106.
18 Almeida S,Rato L,Sousa M,et al.Fertility and Sperm Quality in the Aging Male.Curr Pharm Des,2017,23:4429-4437.
19 Singh NP,Muller CH,Berger RE.Effects of age on DNA double-strand breaks and apoptosis in human sperm.Fertil Steril,2003,80:1420-1430.
20 Deenadayal Mettler A,Govindarajan M,Srinivas S,et al.Male age is associated with sperm DNA/chromatin integrity.Aging Male,2020,23:822-829.
21 Alshahrani S,Agarwal A,Assidi M,et al.Infertile men older than 40 years are at higher risk of sperm DNA damage.Reprod Biol Endocrinol,2014,12:103.
22 骆强翔,廖勇彬,黄昌平,等.精子DNA碎片指数与年龄和精液参数的相关性及其对IVF-ET的影响.中华男科学杂志,2020,26:708-712.
23 Agarwal A,Majzoub A,Baskaran S,et al.Sperm DNA Fragmentation:A New Guideline for Clinicians.World J Mens Health,2020,38:412-471.
24 Panner Selvam MK,Ambar RF,Agarwal A,et al.Etiologies of sperm DNA damage and its impact on male infertility.Andrologia,2021,53:e13706.