母乳是新生儿的最佳食物选择,世界卫生组织建议在婴儿出生后的头6个月内采用纯母乳喂养 [1]。但母乳喂养率并不理想,北京地区2016年产后6周、12周、24周母乳喂养率分别为75.6%、68.9%和53.2%[2]。影响母乳喂养行为的因素中母乳性黄疸较为常见,多无临床症状,预后良好,很少引起胆红素脑病[3]。其中迟发型母乳性黄疸是指发生在出生后7~10 d,可持续6~12周的黄疸,易造成母乳喂养中断或提前终止[4],是导致母乳喂养失败的原因之一。
目前,关于乳母膳食对迟发型母乳性黄疸影响的研究报道较少,一项关于限制能量的地中海饮食对血清胆红素影响的研究显示,长期遵循该类饮食模式可以降低胆红素浓度,但没有进行饮食中特定食物种类或营养素对胆红素代谢的研究[5]。Loprinzi等[6]研究富含类黄酮的水果和蔬菜的摄入量对胆红素水平的影响发现,两者存在正相关关系。膳食除了直接对胆红素代谢进行影响,膳食因素能否通过影响母乳成分造成迟发型母乳性黄疸的发生尚不明确。
母乳中的成分复杂,既能满足婴幼儿营养需求,还能通过各类生物活性因子调节肠道生态及胆红素代谢。已有研究提示母乳中的生物活性因子如β-葡萄糖醛酸酶(β-glucuronidase,β-GD)、表皮生长因子(epidermal growth factor, EGF)和甲胎蛋白等[7-8],可能与迟发型母乳性黄疸的发生相关[9]。EGF具有许多生物学作用,如可促进细胞内DNA、RNA和蛋白质合成,刺激细胞增殖和分化,抑制胃酸分泌,促进果酸、前列腺素合成,调节精子、卵巢发育和生殖功能的作用。母乳中EGF可以促进新生儿胃、肠道发育。Kumral等[7]的研究发现母乳性黄疸的程度与母乳中EGF的增加有关。EGF作为促进新生儿胃肠道发育的生物活性因子,可能抑制迟发型母乳性黄疸的发生。母乳中EGF对迟发型母乳性黄疸的影响及其作用机制尚无明确结论。产后乳母膳食可以对母乳成分产生较大的影响[10],母乳EGF含量与膳食摄入量的关系,目前没有相关研究报道。已发表的母乳成分对迟发型母乳性黄疸影响的研究,均仅随访至产后四周内,人群样本量也较小[11]。
本研究采用巢式病例对照设计,采集产后42 d天的母乳样本检测母乳中宏量营养素含量及EGF水平,并对哺乳期膳食进行调查,探讨乳母膳食及母乳成分是否影响迟发型母乳性黄疸的发生。
对象与方法
1.研究对象:本研究基于课题组建立的母乳库随访队列,采用前瞻性巢式病例对照研究,选择21例随访过程中诊断为迟发型母乳性黄疸的足月患儿作为黄疸组,同时以1:1个体匹配方式从相同队列中选择胎龄、性别匹配的对照。
2.产妇纳入及排除标准:2020年10月1日—2021年12月31日在北京大学人民医院接受产前检查并在本医院分娩;年龄在20~45岁;产后准备进行纯母乳喂养。产妇排除标准包括(1)拒绝签署知情同意书;(2)严重的肝、肾疾病以及精神心理疾患等;(3)艾滋病、乙肝等传染性疾病。
3.迟发型母乳性黄疸组新生儿纳入标准[12]:足月儿(胎龄≥37周),纯母乳喂养或以母乳喂养为主的新生儿(母乳喂养占喂养的70%以上);黄疸迁延不退>3周:产后42 d经皮测胆黄疸值≥5.0 mg/dL[13-14]。
对照组新生儿纳入标准:足月儿(胎龄≥37周),纯母乳喂养或以母乳喂养为主的新生儿:产后42 d经皮测胆黄疸值<5.0 mg/dL;无任何其他临床症状。
新生儿排除标准[12]:两组均排除胎龄<37 周; 血型不合,Coombs′实验阳性,葡萄糖-6-磷酸脱氢酶缺乏,溶血性疾病,网织红细胞增多症,血涂片异常,红细胞增多症,头颅血肿,窒息史,体温过低,颅内出血,胆汁淤积症;新生儿甲状腺功能减退症及苯丙酮尿症筛查阳性。
最终共纳入黄疸组21例,对照组21例。本研究已通过北京大学人民医院伦理委员会批准,受试者均知情同意并签署知情同意书。
4.问卷调查:采用自行设计的乳母和婴儿营养与健康状况调查问卷,由培训合格的调查员采取“面对面”询问方式进行,收集内容包括(1)基本情况。产妇年龄、身高、体重、BMI、孕周、分娩日期、分娩方式、胎次、新生儿性别、新生儿体重。(2)膳食情况。记录月子期间(6周内)饮食情况,根据《中国食物成分表:标准版》[15]计算乳母膳食各营养素摄入情况,利用食物频率问卷(Food Frequency Questionnaire, FFQ)评估乳母产后6周内的膳食对婴儿迟发型母乳性黄疸发生的影响。
5.样品采集:于产后42 d上午9~11时,用手挤法或电动吸奶器采集纳入标准的乳母单侧乳房一次哺乳中间(哺乳5~7min后)的母乳5 mL,记录采集时间后立即冷冻保存,转移至母乳库-80℃冰箱待检。
6.母乳宏量营养素检测:采用母乳成分分析仪(HKANGYU KY-9003)进行母乳中脂肪、蛋白质、乳糖、水分、能量和密度的检测。
7.母乳EGF检测:采用酶联免疫吸附试验(ELISA)试剂盒(Bioss bsk11025)测量母乳中EGF的浓度。母乳标本从-80°C冰箱取出后,室温解冻后,无菌管分装,离心20 min(3 000 g/min)收集上清。用纯化的EGF抗体包被微孔板,向已包被的板微孔中依次加入标准品及待测样本,再与生物素化的EGF抗体结合,其后加入辣根过氧化物酶(HRP)标记的链霉亲和素,经过彻底洗涤后加入底物TMB显色。TMB在HRP酶的催化作用下转化成蓝色,并在酸的作用下最终转化成黄色。颜色的深浅和样本中的EGF含量呈正相关。用酶标仪在450 nm波长下测定吸光值(OD值),通过绘制标准曲线计算样本中EGF浓度。
8.统计学处理:使用 Epidata进行数据双录入,应用SPSS 24.0软件对数据进行统计分析。符合正态分布的计量资料用均数±标准差进行描述,非正态分布的计量资料用中位数和四分位法描述,计数资料采用百分比描述。膳食成分进行对数变换后与母乳EGF含量的关系采用多重线性回归模型进行分析。P<0.05表明差异有统计学意义。
结果
1.一般情况:本次研究共纳入42对产妇和婴儿。其中21对迟发型母乳性黄疸婴儿及乳母为黄疸组,21对正常婴儿及乳母为对照组。两组间产妇年龄、BMI、孕周、分娩方式、胎次、妊娠期合并症、新生儿性别、新生儿身长、新生儿体重、1 min、5 min Apgar评分比较,差异均无统计学意义。见表1。
表1 两组基本情况描述
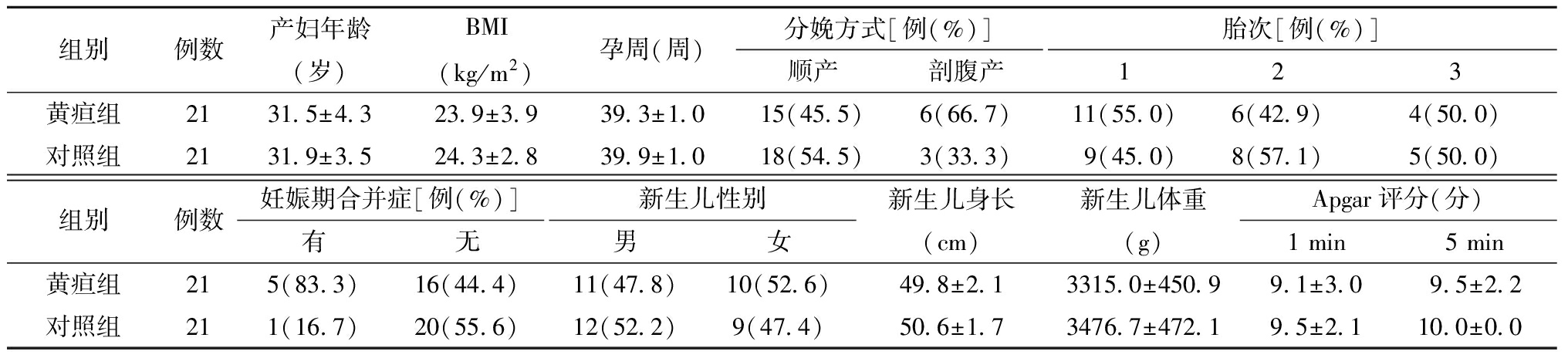
组别例数产妇年龄(岁)BMI(kg/m2)孕周(周)分娩方式[例(%)]顺产剖腹产胎次[例(%)]123黄疸组2131.5±4.323.9±3.939.3±1.015(45.5)6(66.7)11(55.0)6(42.9)4(50.0)对照组2131.9±3.524.3±2.839.9±1.018(54.5)3(33.3)9(45.0)8(57.1)5(50.0)组别例数妊娠期合并症[例(%)]有无新生儿性别男女新生儿身长(cm)新生儿体重(g)Apgar评分(分)1 min5 min 黄疸组215(83.3)16(44.4)11(47.8)10(52.6)49.8±2.13315.0±450.99.1±3.09.5±2.2对照组211(16.7)20(55.6)12(52.2)9(47.4)50.6±1.73476.7±472.19.5±2.110.0±0.0
2.乳母膳食食物种类与迟发型母乳性黄疸的关系:在膳食食物种类摄入量的比较中,蔬菜摄入量组间差异有统计学意义。见表2。
表2 乳母膳食食物种类摄入量(g)与迟发型母乳性黄疸的关系[M(P25, P75)]
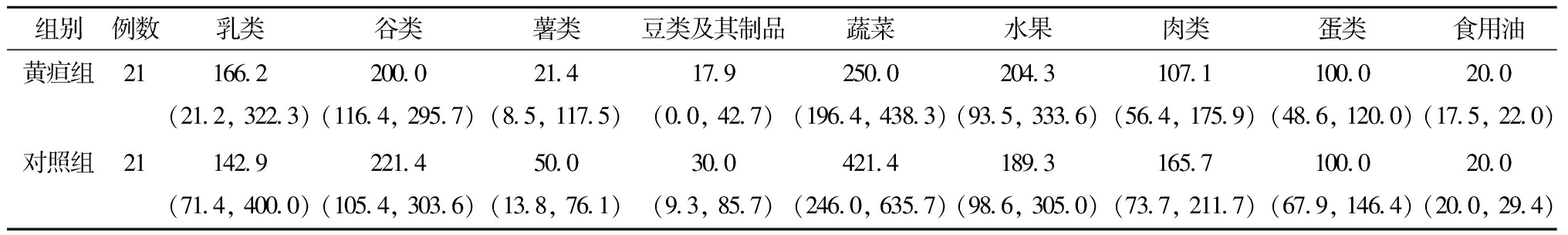
组别例数乳类 谷类 薯类豆类及其制品蔬菜 水果 肉类蛋类食用油黄疸组21166.2(21.2, 322.3)200.0(116.4, 295.7)21.4(8.5, 117.5)17.9(0.0, 42.7)250.0(196.4, 438.3)204.3(93.5, 333.6)107.1(56.4, 175.9)100.0(48.6, 120.0)20.0(17.5, 22.0)对照组21142.9(71.4, 400.0)221.4(105.4, 303.6)50.0(13.8, 76.1)30.0(9.3, 85.7)421.4(246.0, 635.7)189.3(98.6, 305.0)165.7(73.7, 211.7)100.0(67.9, 146.4)20.0(20.0, 29.4)
3.母乳宏量营养素含量与迟发型母乳性黄疸的关系:黄疸组母乳矿物质为(0.2±0.1)g/100 mL、蛋白质(0.9±0.2)g/100 mL、密度(1.0±0.0)g/mL、脂肪(4.2±1.3)g/100 mL、乳糖(7.2±1.9)g/100 mL、能量(70.0±11.7)kcal/100 mL、水分(87.5±2.1)g/100 mL;对照组母乳矿物质为(0.2±0.0)g/100 mL、蛋白质(1.0±0.2)g/100 mL、密度(1.0±0.0)g/mL、脂肪(4.1±0.7)g/100 mL、乳糖(8.0±1.3)g/100 mL、能量(72.8±9.7)kacl/100 mL、水分(86.7±1.8)g/100 mL。两组间母乳上述宏量营养素含量差异无显著性。见图1。
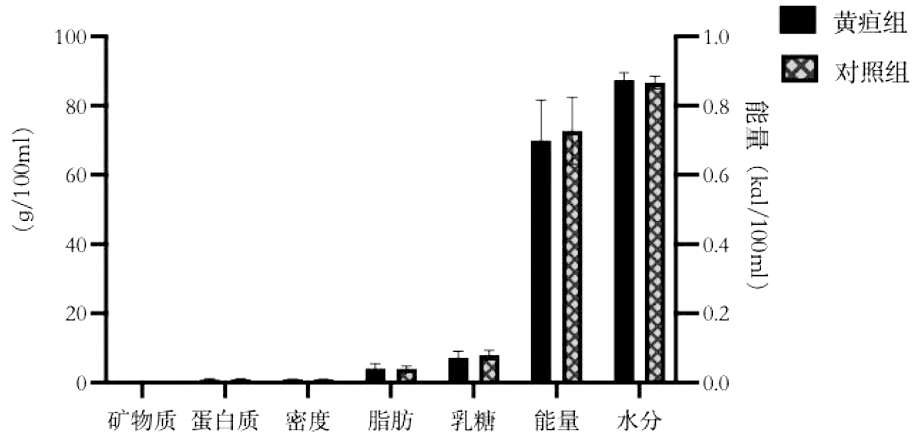
图1 母乳宏量营养素矿物质、蛋白质、密度、脂肪、乳糖、能量、水分与迟发型母乳性黄疸的关系
4.母乳EGF与迟发型母乳性黄疸的关系:黄疸组母乳EGF含量为(39.8±20.0)ng/mL,对照组母乳EGF含量为(50.8±18.1)ng/mL,两组EGF含量比较,差异有统计学意义。见图2。
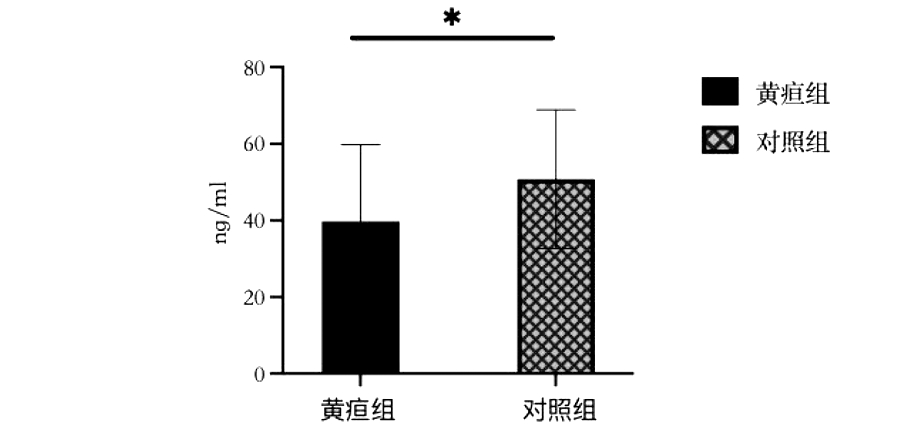
*P<0.05
图2 母乳表皮生长因子与迟发型母乳性黄疸的关系
5.母乳EGF的食物来源分析:为进一步探讨母乳EGF的食物来源,采用多重线性回归分析经对数转换后膳食食物种类摄入量与母乳EGF含量的关系,变量筛选选择逐步回归法。模型F=4.7,P=0.04,包含食用油变量的模型具有统计学意义。当控制其他变量后,每多摄入1 g食用油,母乳EGF含量增加0.4 ng/mL。见表3。
表3 膳食食物种类与母乳EGF多重线性回归结果

食物种类模型1aβ95% CIP食用油0.40.74~35.180.04
a纳入模型的变量有:乳母每日摄入的乳类、谷类、薯类、豆类及其制品、蔬菜、水果、肉类、蛋类、食用油,表格仅展示经筛选后最终纳入模型的营养素
讨论
本研究对成熟乳中的宏量营养素及EGF进行检测,分析产后膳食对母乳中EGF含量的影响,探讨母乳成分及乳母膳食对于迟发型母乳性黄疸的发生的影响。结果显示,黄疸组产后42 d的母乳中EGF的含量显著低于对照组,黄疸组乳母膳食摄入蔬菜低于对照组,乳母膳食中摄入食用油的摄入量与母乳中EGF浓度呈正相关。膳食摄入食用油可影响迟发型母乳性黄疸发生。
母乳作为婴儿天然的食物,对婴儿的生长发育有着重要影响。本研究中两组间母乳宏量营养素的含量没有差异,可推测母乳性黄疸的婴幼儿继续母乳喂养,宏量营养素的摄入量不会受到影响。然而,北京地区各社区医院将母乳性黄疸设定为婴幼儿疫苗接种的禁忌症,部分社区医院鼓励乳母暂停母乳喂养替换为配方奶粉,保证黄疸值下降至可接种疫苗水平,造成了母乳喂养中止[14]。近期的研究表明,婴幼儿相对较高的胆红素水平可能对远期发展有利。胆红素具有细胞保护和抗氧化作用,血清胆红素水平的降低与冠状动脉疾病发病率增加有关[16]。中国《特殊健康状态儿童预防接种专家共识(婴儿黄疸与预防接种)》[17]建议“母乳性黄疸患儿身体健康状况良好,没有其他并发症,可按免疫程序接种疫苗”,各地区疾控中心应适度放宽疫苗接种禁忌症标准,保证如期完成接种计划促进母乳喂养。
本研究两组母乳的检测结果显示,宏量营养素对母乳性黄疸的发生影响不大,迟发型母乳性黄疸的发生发展可能受母乳中的其他生物活性成分的调控;采用巢式病例对照的研究设计发现黄疸组母乳中EGF含量低于对照组,提示母乳中EGF能降低迟发型母乳性黄疸的发生风险。已报道的动物实验表明,EGF对乳鼠肠道的形态和功能成熟有积极作用,EGF可促进大鼠结肠发育[18-19]。婴幼儿由于肝脏功能不成熟,肠道形态及微生态环境均不稳定,导致胆红素代谢障碍,胆红素在体内蓄积形成黄疸,而母乳中EGF可以促进肝脏的生长和成熟[20],从而减少胆红素在血液中的含量,抑制黄疸的发生。Kumral等[7]及严志君等[21]的研究均提示母乳EGF与新生儿血清胆红素正相关,本研究母乳样本采集的时间点在产后6周,晚于上述两项研究,可能导致结果的差异。但采集产后6周的母乳样本更符合迁延的迟发型母乳性黄疸的特征,可以弥补既往研究的不足之处。
既往研究提示乳母膳食、乳母营养储备和营养素利用情况都可能引起母乳中生物活性成分的变化[10, 22-26]。Lu等的研究中检测了北京、杭州、兰州三地区母乳中EGF含量,同时调查哺乳期饮食情况[27],结果显示母乳中EGF的浓度与蛋白质、总能量、蔬菜、水果、豆制品和乳制品食品的摄入量呈负相关,提示大豆异黄酮和大蒜素可抑制EGF受体的表达,降低体内EGF的水平。本研究结果则表明母乳EGF含量与食用油摄入量呈正相关,一项关于核桃油对SD大鼠伤口愈合作用的研究[28]表明,核桃油含有大量的不饱和脂肪酸,如亚油酸和亚麻酸,能明显抑制NF-κB的表达,同时促进EGF的表达。
本研究首次利用FFQ量表评估乳母产后6周内的膳食对婴儿迟发型母乳性黄疸发生的影响,结果显示对照组蔬菜的摄入量显著高于黄疸组,提示乳母摄入蔬菜能降低迟发型母乳性黄疸的发生风险。在两组组间比较中,可能受限于本研究样本量较少,食用油摄入量差异没有显著性。已报道的动物研究表明,脂肪酸中亚油酸(18:2)和亚麻酸(18:3),可以与肝脏细胞膜Z蛋白的结合进而抑制胆红素的结合[29-30]。目前,关于乳母膳食对迟发型母乳性黄疸影响的研究报道较少,池新访等[31]的研究提示孕妇妊娠37周后多进食新鲜的水果和蔬菜、每天喝水1 500 mL以上,对延迟新生儿黄疸出现时间、加快黄疸消退时间有积极作用。综合上述膳食因素、母乳EGF及迟发型母乳性黄疸三者之间的相关性研究结果,可推测乳母产后6周内膳食摄入的食用油可通过影响母乳中EGF水平,起到降低迟发型母乳性黄疸发生风险的作用。
本研究首次探讨了北京地区乳母成熟乳中EGF含量对婴儿迟发型母乳性黄疸的影响,与既往的研究报道结果不同,本研究中母乳性黄疸婴儿乳母母乳EGF含量低于对照组,母乳EGF含量对迟发型母乳性黄疸的影响及其潜在作用机制还有待后续进一步的研究。本研究调查了乳母哺乳期膳食情况,首次分析了膳食对迟发型母乳性黄疸的影响,以及母乳EGF含量与膳食食物摄入量的相关关系,为后续乳母膳食干预措施预防迟发型母乳性黄疸的研究提供了理论依据。
1 Global strategy for infant and young child feeding.Geneva.World Health Organization,2003.
2 吴佳铭.北京市母亲共同养育感知现状及其与母乳喂养的相关性研究.北京协和医学院,2017.
3 汤明旭,王凤东.母乳性黄疸的研究进展.医学综述,2014,20:2968-2970.
4 Muchowski KE.Evaluation and treatment of neonatal hyperbilirubinemia.Am Fam Physician,2014,89:873-878.
5 Coltell O,Asensio EM,Sorlí JV,et al.Genome-Wide Association Study(GWAS)on Bilirubin Concentrations in Subjects with Metabolic Syndrome:Sex-Specific GWAS Analysis and Gene-Diet Interactions in a Mediterranean Population.Nutrients,2019,11:90.
6 Loprinzi PD,Mahoney SE.Association between flavonoid-rich fruit and vegetable consumption and total serum bilirubin.Angiology,2015,66:286-290.
7 Kumral A,Ozkan H,Duman N,et al.Breast milk jaundice correlates with high levels of epidermal growth factor.Pediatr Res,2009,66:218-221.
8 Soldi A,Tonetto P,Varalda A,et al.Neonatal jaundice and human milk.J Matern Fetal Neonatal Med,2011,24 Suppl 1:85-87.
9 Summerhayes M,National Institute for Health and Clinical Excellence.2008:Springer Berlin Heidelberg.
10 Bravi F,Wiens F,Decarli A,et al.Impact of maternal nutrition on breast-milk composition:a systematic review.Am J Clin Nutr,2016,104:646-662.
11 胡瑞.人乳外泌体miRNA与新生儿母乳性黄疸相关性研究.上海交通大学,2018.
12 邵肖梅,叶鸿瑁,丘小汕,主编.实用新生儿学.第四版.北京:人民卫生出版社,2011:277-279.
13 Weng YH,Chiu YW,Cheng SW.Breast milk jaundice and maternal diet with chinese herbal medicines.Evid Based Complement Alternat Med,2012,2012:150120.
14 王庆,王青海,孙洪亚, l等.母乳性黄疸儿童接种乙肝疫苗安全性观察.首都公共卫生,2020,14:73-75.
15 杨月欣,主编.,中国食物成分表标准版.第 6 版.北京:北京大学医学出版社.2019.
16 Grant DJ,Bell DA.Bilirubin UDP-glucuronosyltransferase 1A1 gene polymorphisms:susceptibility to oxidative damage and cancer?.Mol Carcinog,2000,29:198-204.
17 孔小行.特殊健康状态儿童预防接种专家共识之十一——婴儿黄疸与预防接种.中国实用儿科杂志,2019,34:87-88.
18 Oka Y,Ghishan FK,Greene HL,et al.Effect of mouse epidermal growth factor/urogastrone on the functional maturation of rat intestine.Endocrinology,1983,112:940-944.
19 Pollack PF,Goda T,Colony PC,et al.Effects of enterally fed epidermal growth factor on the small and large intestine of the suckling rat.Regul Pept,1987,17:121-132.
20 Opleta K,O′Loughlin EV,Shaffer EA,et al.Effect of epidermal growth factor on growth and postnatal development of the rabbit liver.Am J Physiol,1987,253:G622-626.
21 严志君,罗芳.表皮生长因子和葡萄糖醛酸糖苷酶与母乳性黄疸的相关性.现代实用医学,26:808-809.
22 Winkvist A,Habicht JP,Rasmussen KM.Linking maternal and infant benefits of a nutritional supplement during pregnancy and lactation.Am J Clin Nutr,1998,68:656-661.
23 Lovelady CA.The impact of energy restriction and exercise in lactating women.Adv Exp Med Biol,2004,554:115-1120.
24 Ballard O,Morrow AL.Human milk composition:nutrients and bioactive factors.Pediatr Clin North Am,2013,60:49-74.
25 Innis SM.Impact of maternal diet on human milk composition and neurological development of infants.Am J Clin Nutr,2014,99:734s-41s.
26 Keikha M,Bahreynian M,Saleki M,et al.Macro-and Micronutrients of Human Milk Composition:Are They Related to Maternal Diet? A Comprehensive Systematic Review.Breastfeed Med,2017,12:517-527.
27 Lu M,Jiang J,Wu K,et al.Epidermal growth factor and transforming growth factor-α in human milk of different lactation stages and different regions and their relationship with maternal diet.Food Funct,2018,9:1199-1204.
28 Ma Q,Wu YS,Shen JY,et al.Walnut oil promotes healing of wounds and skin defects in rats via regulating the NF-kB pathway.Pharmazie,2018,73:721-724.
29 Bevan BR,Holton JB.Inhibition of bilirubin conjugation in rat liver slices by free fatty acids,with relevance to the problem of breast milk jaundice.Clin Chim Acta,1972,41:101-107.
30 Foliot A,Ploussard JP,Housset E,et al.Breast milk jaundice:in vitro inhibition of rat liver bilirubin-uridine diphosphate glucuronyltransferase activity and Z protein-bromosulfophthalein binding by human breast milk.Pediatr Res,1976,10:594-598.
31 池新访,戴月嫦,钟永红,等.孕妇妊娠37周后饮食干预对新生儿黄疸的影响.中国误诊学杂志,2011, 11:5861.