妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种妇女在妊娠期间首次发生的糖代谢异常疾病[1]。作为妊娠期最常见的并发症之一,GDM与诸多不良妊娠结局风险增加有关,主要包括2型糖尿病、妊娠期高血压疾病、巨大儿和早产等[2-3]。一项系统综述表明,GDM在中国大陆流行率高达14.8%(95% CI:12.8%~16.7%)[4],已成为中国较为严重的公共卫生问题。
肌醇(inositol)即六羟基环己烷,又称环己六醇,是一种天然存在的营养物质。肌醇广泛存在于谷物、玉米、豆类和肉类中[5]。一些研究表明,肌醇为细胞内胰岛素信号传导的第二信使,可能通过参与PI3K/AKT信号通路调节人体糖代谢[6];在动物模型和以胰岛素抵抗为特征的人群中,肌醇均可作为一种胰岛素增敏剂,降低胰岛素抵抗水平[7]。人群研究中也有一项病例对照研究表明,GDM孕妇体内的肌醇水平显著低于健康孕妇人群[8]。因此,肌醇可能作为一种潜在有益的补充剂用于预防GDM发生。
近年来,国内外关于孕期口服肌醇预防GDM的随机对照试验(randomized controlled trial,RCT)研究逐渐增多,但取得的临床效果存在一定的争议。本文采用循证医学方法,对当前已发表的有关孕期口服肌醇预防GDM的RCT研究进行Meta分析,以期评估肌醇预防GDM的有效性。
一、文献的纳入、排除标准及检索策略
1.纳入标准:(1)研究类型为评价孕期口服肌醇预防GDM的RCT;(2)研究对象为单胎妊娠且排除既往糖尿病史、诊断为GDM或具有严重临床疾病的孕妇;(3)干预措施为干预组补充肌醇,对照组予以安慰剂或空白处理;(4)结局指标。主要结局为GDM发生率,次要结局包括巨大儿发生率、早产发生率、妊娠期高血压发生率、诊断日OGTT试验血糖值(空腹血糖、1 h血糖、2 h血糖,以1mmol/L=18 mg/dL的标准进行换算,单位统一为mg/dL)、新生儿出生体重、干预前后胰岛素抵抗指数变化值(ΔHOMA-IR)以及血清空腹胰岛素等。
2.排除标准:(1)动物实验、机制研究、药理研究、药物合成研究;(2)两组均服用肌醇;(3)研究方案、文献综述、系统综述、队列研究、病例对照研究、个案研究、病例系列研究、专家意见、临床指南、经济学评价、产品宣传等;(4)非预防性的RCT研究;(5)混合干预,或干预组和对照组都服用可能影响研究结局的药物,但两组间服用剂量不同;(6)重复发表的文献;(7)非中英文文献。
3.文献检索策略:计算机检索PubMed、Embase、Cochrane Library、CNKI和WanFang Data数据库,搜集有关孕期口服肌醇预防GDM的RCT,检索时限均为建库至2021年6月20日,并在ClinicalTrial.gov、ISRCTN registry等平台检索和对比研究的注册信息,确保RCT研究的真实性。本文采用主题词与自由词检索,中文检索词包括妊娠期糖尿病、妊娠糖尿病、GDM、肌醇、环己六醇、手性肌醇、纤维醇等,以CNKI为例,检索式为((SU = ‘妊娠期糖尿病’)OR(SU = ‘妊糖’)OR(SU = ‘孕期糖尿病’)OR(SU = ‘妊娠糖尿病’)OR(SU = ‘GDM’))AND((SU = ‘肌醇’)OR(SU = ‘纤维醇’)OR(SU = ‘肌糖’)OR(SU = ‘环己六醇’))。英文检索词包括 gestational diabetes mellitus、diabetes,gestational、gestational diabetes、pregnancy diabetes mellitus、inositol、cyclohexanehexol、Myo-inositol等,以Embase为例,检索式为(‘pregnancy diabetes mellitus’/exp OR ‘pregnancy diabetes mellitus’ OR ‘gestational diabetes’ OR ‘gestational diabetes mellitus’)AND(‘inositol’/exp OR ‘inositol’ OR ‘cyclohexanehexol’ OR ‘Myo-inositol’)。
二、文献筛选及质量评价
由两名研究者独立筛选文献、提取资料并交叉核对。如有分歧,则通过讨论或与第三方协商解决。使用Excel 2019软件提取文献信息,包括研究人群基本信息(样本量、人群特征、年龄、BMI和干预时间)、分组情况和结局指标等,并制定偏倚风险评价表格。
采用Cochrane Reviewer′s Handbook 5.0.1[9]推荐的偏倚风险评价工具对纳入的研究进行评价,包括随机序列的生成、分配隐藏、研究者与受试者盲法、结果评定者盲法、不完全数据结局、选择性结局报告和其他偏倚等7个方面内容。再采用Jadad量表对纳入的研究进行质量评价[10],包括随机序列的产生(0~2分)、随机化隐藏(0~2分)、盲法(0~2分)、撤出与退出(0~1分)等4个方面内容,进行总体质量评分(1~3分为低质量,4~7分为高质量)。
三、统计分析
采用Review Manager 5.4.1软件进行数据分析。连续性结局变量和二分类变量分别以均数差(mean difference,MD)和风险比(risk ratio,RR)为效应分析统计量,并计算各自的95%置信区间(Confidence interval,CI)。使用卡方检验P值和I2来探究各研究间的异质性,如研究结果间的统计学异质性较小(P > 0.10且I2 <25%)则采用固定效应模型; 如异质性较大(P≤0.10或I2≥25%),则采用随机效应模型进行合并分析,并谨慎解释研究结果。同时绘制“漏斗图”以展示潜在的发表偏倚。
四、文献检索结果
1.文献筛选结果及纳入文献基本特征:通过双人独立检索和筛选,共得339篇文献;去重及阅读摘要初筛排除306篇,详细阅读全文后排除24篇,最终共纳入9篇文献,含8篇英文和1篇中文,详细的文献筛选流程见图1。纳入的文献发表时间为2013—2021年,国家和地区包括自意大利(7/9)、爱尔兰(1/9)和中国(1/9),样本量共计1 429例。
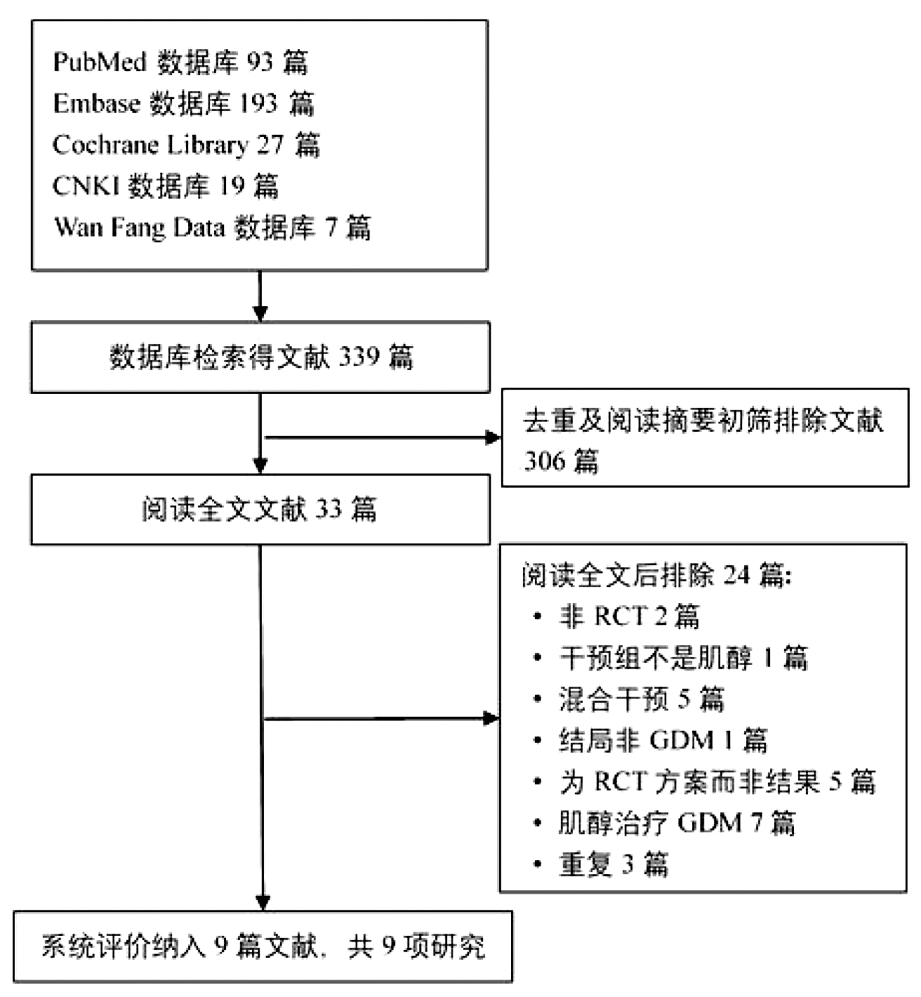
图1 文献筛选流程及结果
对照措施为安慰剂或与干预组相同剂量的叶酸。干预措施分为“肌肉肌醇”和“肌肉肌醇+D-手性肌醇”两个亚组,其中“肌肉肌醇”组干预剂量均为“肌肉肌醇2 000 mg +叶酸200 μg,每天两次”[11-17];而“肌肉肌醇+ D-手性肌醇”组干预剂量为“138 mg肌肉肌醇+ 550 mg D-手性肌醇”[18]或“1 000 mg肌肉肌醇+27.6 mg D-手性肌醇+ 400 μg叶酸”[19],因后者肌醇剂量和比例不同且各只有1项研究,故未再继续分亚组进行分析。研究基本特征详见表1。
表1 纳入研究的基本特征
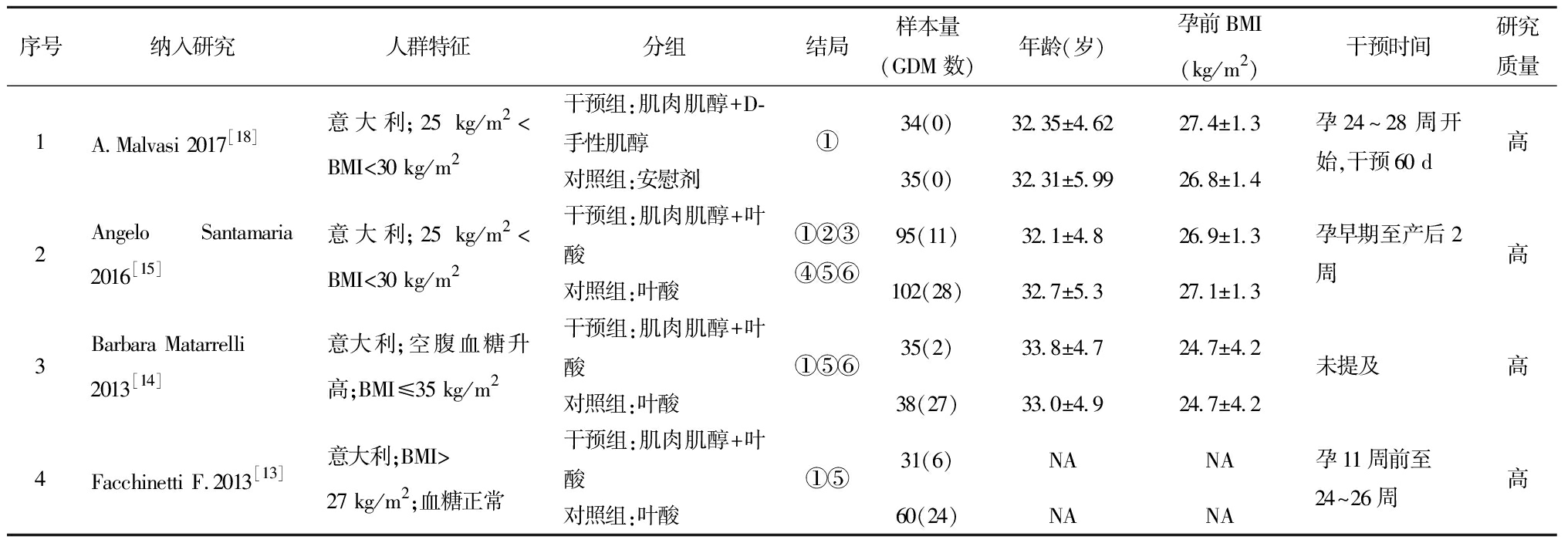
序号纳入研究人群特征分组结局样本量(GDM数)年龄(岁)孕前BMI(kg/m2)干预时间研究质量1A.Malvasi 2017[18]意大利;25 kg/m2
表1(续)
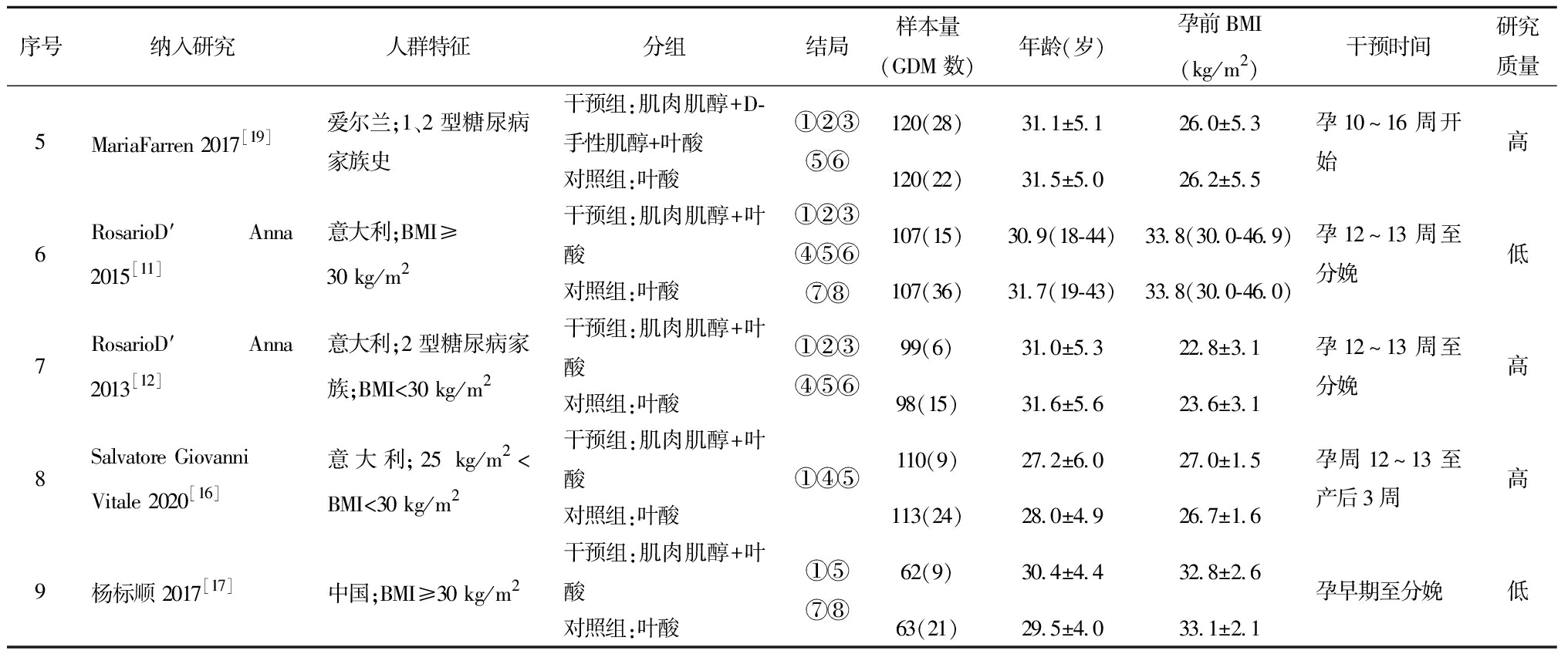
序号纳入研究人群特征分组结局样本量(GDM数)年龄(岁)孕前BMI(kg/m2)干预时间研究质量5MariaFarren 2017[19]爱尔兰;1、2型糖尿病家族史干预组:肌肉肌醇+D-手性肌醇+叶酸对照组:叶酸①②③⑤⑥120(28)31.1±5.126.0±5.3120(22)31.5±5.026.2±5.5孕10~16周开始高6RosarioD′Anna 2015[11]意大利;BMI≥30 kg/m2干预组:肌肉肌醇+叶酸对照组:叶酸①②③④⑤⑥⑦⑧107(15)30.9(18-44)33.8(30.0-46.9)107(36)31.7(19-43)33.8(30.0-46.0)孕12~13周至分娩低7RosarioD′Anna 2013[12]意大利;2型糖尿病家族;BMI<30 kg/m2干预组:肌肉肌醇+叶酸对照组:叶酸①②③④⑤⑥99(6)31.0±5.322.8±3.198(15)31.6±5.623.6±3.1孕12~13周至分娩高8Salvatore Giovanni Vitale 2020[16]意大利;25 kg/m2 BMI:体重指数;NA:数据未报告;年龄与孕前BMI的数据展示为均值±标准差或中位数(P25-P75);结局指标:①GDM发生率 ②巨大儿发生率 ③早产发生率④妊娠期高血压发生率 ⑤OGTT试验血糖(0 h、1 h、2 h)⑥新生儿出生体重 ⑦ΔHOMA-IR ⑧血清空腹胰岛素
大部分研究详细报告了随机、分配隐匿和结局缺失情况,但未具体描述盲法,存在一定的偏倚风险,偏倚风险评价结果详见图2。原始研究的Jadad量表总体质量评价大多为高质量,详情见表1。
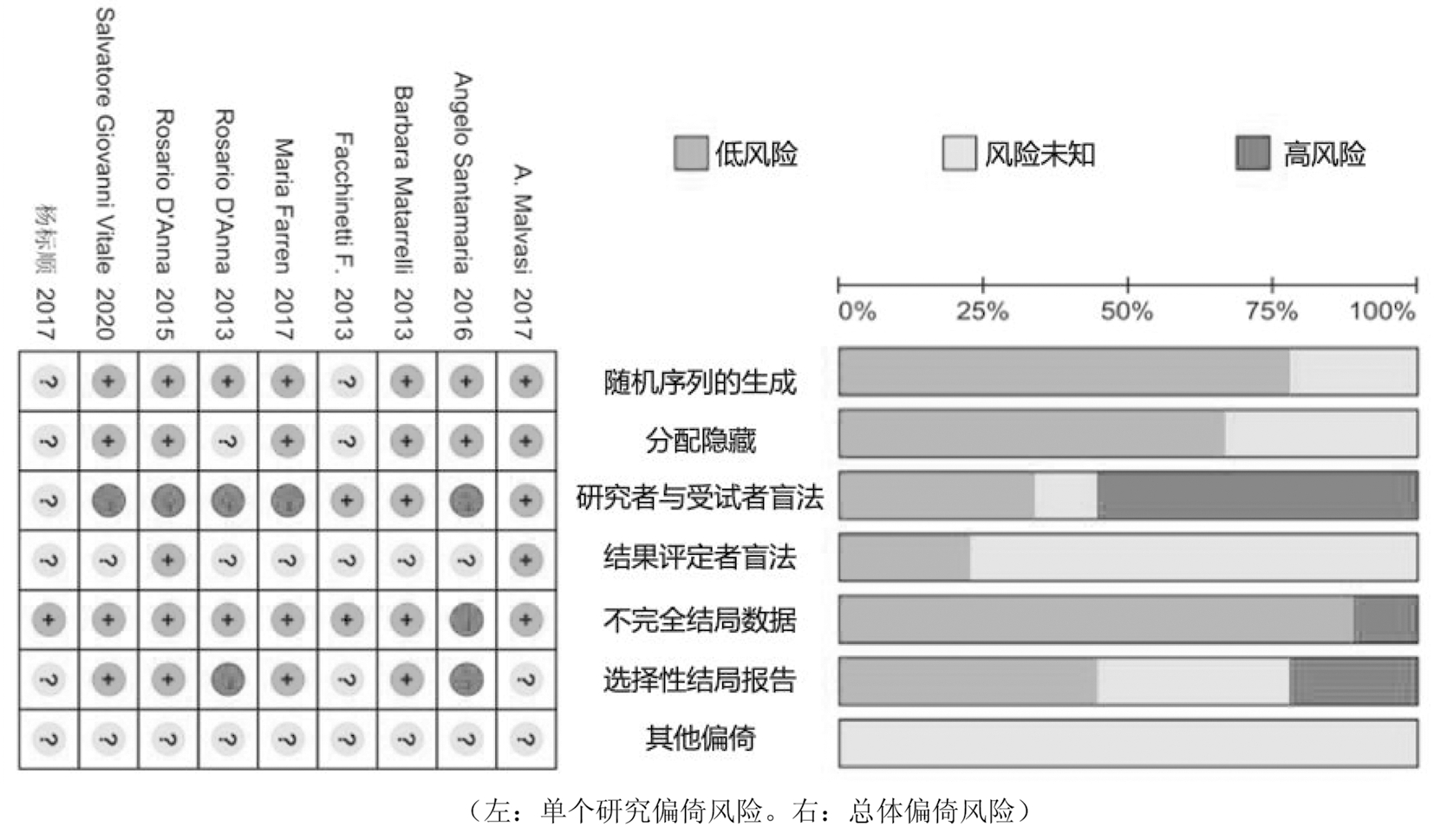
(左:单个研究偏倚风险。右:总体偏倚风险)
图2 偏倚风险评价结果
2.Meta分析结果:汇总后共计9项研究(1 429例)报告了GDM发生率,随机效应模型Meta分析结果显示,肌醇(包括肌肉肌醇和手性肌醇)干预与对照相比可以显著降低GDM发生(RR=0.45,95% CI :0.28~0.70),差异具有统计学意义(P<0.0001),但合并后的结果异质性较大(I2=69%),因此,进一步做了亚组分析。亚组分析后发现,与对照组相比,肌肉肌醇组可以预防GDM发生(RR=0.39,95% CI :0.30~0.52,P<0.00001;I2=0%),“肌肉肌醇+D-手性肌醇”与对照组的发病率差异无统计学意义(RR=1.27,95% CI:0.77~2.09,P=0.34),但纳入的汇总研究共有2项,样本量较小,有待进一步研究补充。Meta分析具体结果详见图3。

图3 肌醇预防妊娠期糖尿病的Meta分析结果(主要结局)
共有8项研究(1 354例)报告了OGTT试验的结果,包括空腹血糖、1 h血糖和2 h血糖,随机效应模型Meta分析结果显示,除1 h血糖(MD=-5.57,95% CI:-13.31~2.17,P=0.16)外,组间空腹血糖(MD=-3.31,95% CI:-4.58~-2.04,P<0.001)、和2 h血糖(MD=-9.20,95% CI:-15.11~-3.29,P=0.002)、差异均具有统计学意义。5项研究(915例)报告了新生儿出生体重,随机效应模型Meta分析结果显示,两组(MD=-5.04,95% CI:-116.36~106.29,P=0.93)差异没有统计学意义。共有2项研究(339例)关注了空腹血清胰岛素和ΔHOMA-IR,固定效应模型结果显示,肌醇不能显著降低空腹血清胰岛素的水平(MD=-1.84,95% CI :-3.92~0.24,P=0.08),对孕期ΔHOMA-IR高水平有显著预防作用(MD=-1.19,95% CI:-1.70~-0.68), P<0.001)。
本文还分析了肌醇对巨大儿和妊娠期高血压疾病的预防效果。其中4项研究(829例)报告了巨大儿发生率,随机效应模型Meta分析结果显示,肌醇无法显著降低巨大儿的发生率(RR=0.65,95% CI:0.20~2.11,P=0.47)。固定效应模型的汇总结果提示,肌醇对早产和妊娠期高血压疾病均有显著预防效果,其中共有4项研究(829例)报告了早产发生率情况(RR=0.35,95% CI:0.17~0.70,P=0.003);4项研究(818例)报告了妊娠期高血压疾病发生率(RR=0.35,95% CI:0.19~0.66,P=0.001)。
本文进一步排除1项“肌肉肌醇+D-手性肌醇”的研究来单独分析肌肉肌醇预防GDM的效应,结果显示,肌肉肌醇对降低OGTT空腹血糖和2 h血糖、预防巨大儿和早产均有显著作用,具体结果详见表2。
表2 肌醇预防妊娠期糖尿病的Meta分析结果(次要结局)
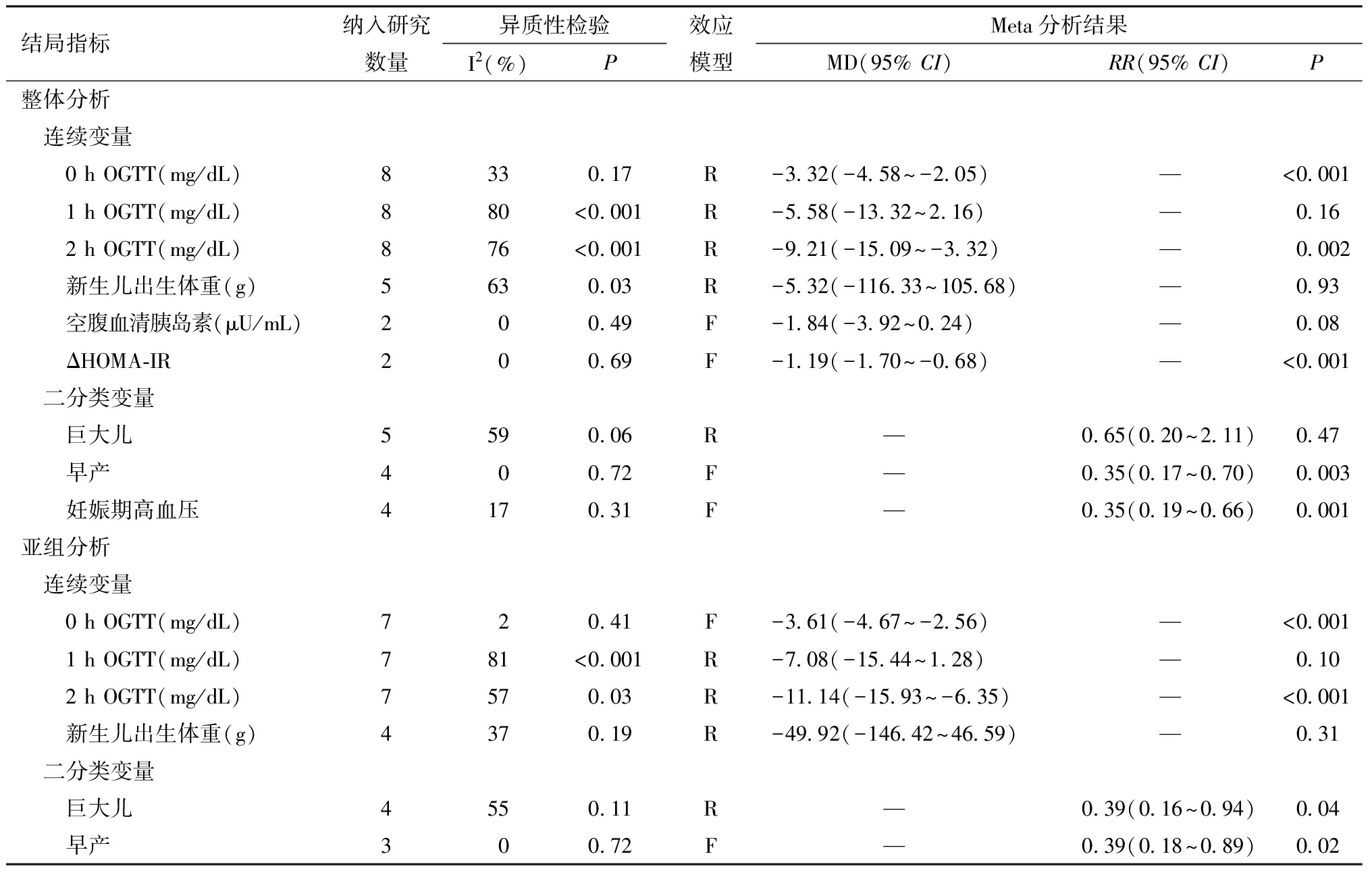
结局指标纳入研究数量异质性检验I2 (%)P效应模型Meta分析结果MD(95% CI) RR(95% CI)P整体分析 连续变量 0 h OGTT(mg/dL)8330.17R-3.32(-4.58~-2.05)—<0.001 1 h OGTT(mg/dL)880<0.001R-5.58(-13.32~2.16)—0.16 2 h OGTT(mg/dL)876<0.001R-9.21(-15.09~-3.32)—0.002 新生儿出生体重(g)5630.03R-5.32(-116.33~105.68)—0.93 空腹血清胰岛素(μU/mL)200.49F-1.84(-3.92~0.24)—0.08 ΔHOMA-IR200.69F-1.19(-1.70~-0.68)—<0.001 二分类变量 巨大儿5590.06R —0.65(0.20~2.11)0.47 早产400.72F —0.35(0.17~0.70)0.003 妊娠期高血压4170.31F —0.35(0.19~0.66)0.001亚组分析 连续变量 0 h OGTT(mg/dL)720.41F-3.61(-4.67~-2.56)—<0.001 1 h OGTT(mg/dL)781<0.001R-7.08(-15.44~1.28)—0.10 2 h OGTT(mg/dL)7570.03R-11.14(-15.93~-6.35)—<0.001 新生儿出生体重(g)4370.19R-49.92(-146.42~46.59)—0.31 二分类变量 巨大儿4550.11R —0.39(0.16~0.94)0.04 早产300.72F —0.39(0.18~0.89)0.02
该表亚组分析仅包括“肌肉肌醇”组。效应模型:R为随机效应模型;F为固定效应模型。若P值低于0.001则统一表示为P<0.001。
3.发表偏倚分析:漏斗图(图4)具有一定的不对称性,提示可能存在发表偏倚,但本研究所纳入的符合要求的RCT数目较少,漏斗图具有局限性,仅作参考。
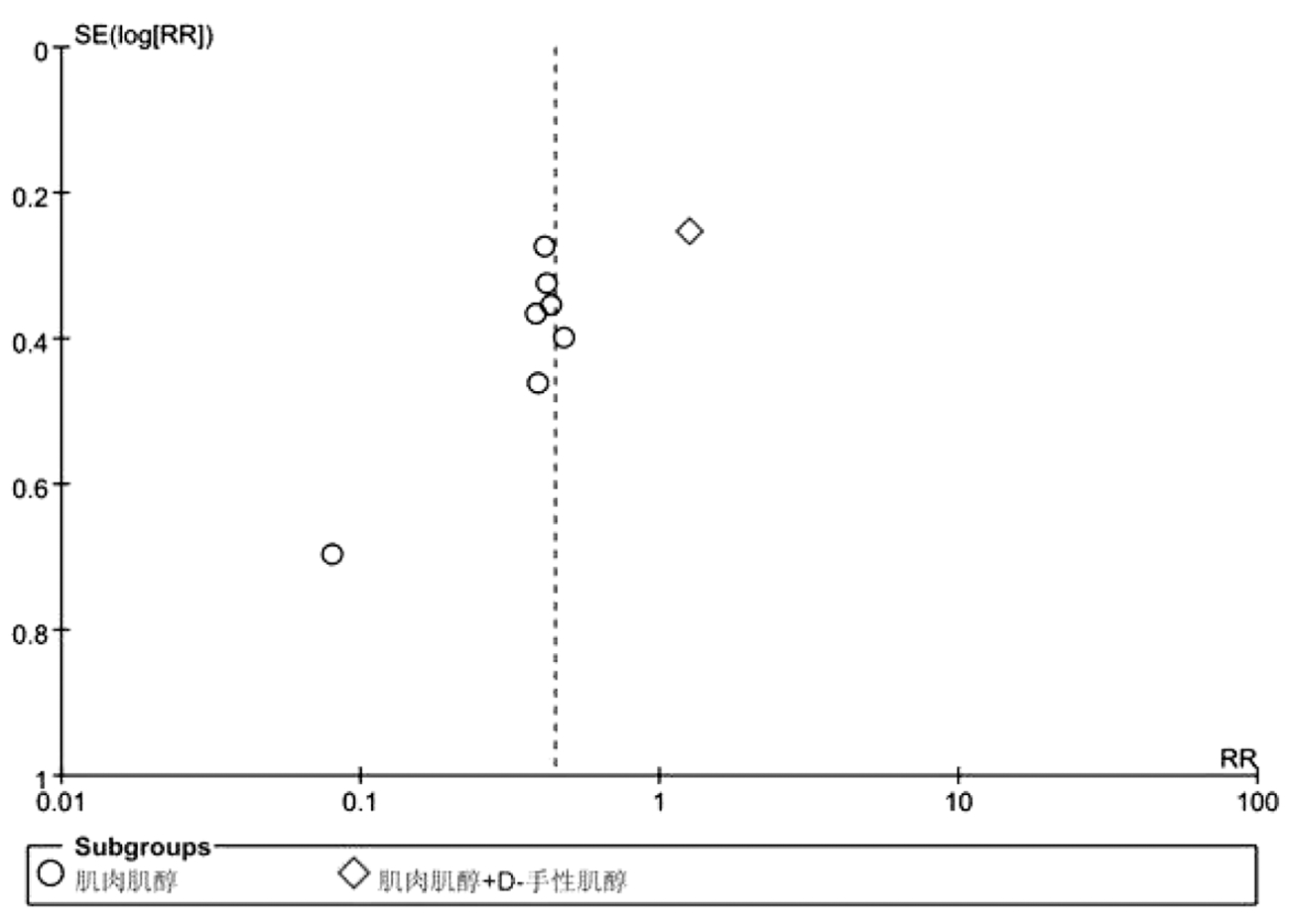
图4 肌醇预防妊娠期糖尿病Meta分析漏斗图
五、讨论
GDM是妊娠期重要的并发症之一,其在世界范围流行率约为14.7%[20],而中国大陆的GDM流行率约为14.8%,与世界范围流行率接近,近几年呈上升趋势[4]。GDM的危险因素包括孕前超重肥胖、年龄增长、糖尿病家族史等[21-22],同时GDM也是2型糖尿病、早产和巨大儿等的危险因素[2-3]。肌醇包括9种异构体,其中最重要的两种异构体为肌肉肌醇和D-手性肌醇[23],二者有共同的体内代谢途径,肌肉肌醇可在体内通过特定的差向异构酶转换成D-手性肌醇[24]。肌肉肌醇和D-手性肌醇被认为是胰岛素信号传导的第二信使,以肌醇磷酸多糖的形式参与胰岛素信号传导,可以增强胰岛素敏感性,从而达到降低血糖[25]。
一项病例对照研究表明,GDM孕妇肌醇水平与对照组相比显著降低[8],但临床试验肌醇预防GDM的有效性存在争议。几项有关RCT研究表明[11-12,14-17],肌肉肌醇干预组的GDM发生率显著低于对照组,但Facchinetti等的研究[13]没有发现肌肉肌醇可以显著预防GDM的作用;Malvasi[18]和Farren[19] 等研究也均未发现“肌肉肌醇+D-手性肌醇”共同干预对GDM的发生有保护作用。以上RCT研究的总样本量在69~240之间,均相对较小,将来尚需更有说服力的证据做进一步验证。
本文主要荟萃临床试验肌醇预防GDM的效果,Meta分析结果显示,与对照组服用安慰剂或相同剂量的叶酸相比,孕妇服用“2 000 mg,每天两次”剂量的肌肉肌醇,GDM发生风险是不服用者的0.39倍(95% CI:0.30~0.52),而服用“肌肉肌醇+D-手性肌醇”无法显著预防GDM发生[RR=1.27,95% CI :0.77~2.09),P = 0.34)。本文检索文献发现,孕妇服用肌醇和未服用肌醇比较,OGTT 1 h血糖、新生儿出生体重、空腹血清胰岛素和巨大儿发生率组间分布没有显著差异,而OGTT空腹血糖、OGTT 2 h血糖、ΔHOMA-IR、早产发生率和妊娠期高血压发生率组间差异均具有统计学意义。本文进一步通过亚组分析发现,肌肉肌醇组巨大儿发生率显著低于对照组发生率。以上相关结果提示,肌肉肌醇可能预防GDM的发生,并可降低孕妇血糖、胰岛素抵抗指数,以及早产、巨大儿和妊娠期高血压的发生率,而D-手性肌醇的作用还需进一步研究。本文文献检索发现,部分原始研究每组只有30多例孕妇,而且结论不尽一致。本文Meta分析通过荟萃已发表的多个研究,提高了原主题的统计效能,增加了结果可信度;而且本文Meta分析仅仅纳入随机对照研究设计方案,消除了重要混杂对结论的影响,研究结果可以较好地估计肌肉肌醇对GDM预防的效应值。
本文Meta分析,具备如下优势,第一,从二分类和连续变量两个角度综合分析肌醇与GDM的关系,结果可靠且具有重要参考意义;第二,兼顾其他重要结局,可为肌醇预防孕妇及子代健康提供重要结果;第三,纳入了中英文不同来源的文献,纳入的研究大多报告了较好的随机性、分组隐匿和结局数据情况,结果较为可信;第四,纳入RCT的研究对象大多是超重肥胖或具有糖尿病家族史的孕妇,相较于其他人群GDM的发病率较高,在GDM高危人群中开展肌醇对GDM的预防效果研究同质性较好,结果可为肥胖超重以及糖尿病家族史等高危人群的GDM预防提供重要科学参考价值。
本研究也存在一定的局限性,第一,纳入的研究大多未使用盲法或对盲法的描述不清,因此存在一定的偏倚风险;第二,纳入的研究干预措施接近一致,无法对肌醇预防GDM的剂量-反应关系作出评价;第三,研究对照组基本采用与干预组同等水平的叶酸作为对照,难以发现肌醇与叶酸在预防GDM中潜在的联合作用。
1 Petersmann A,Müller-Wieland D,Müller UA,et al.Definition,Classification and Diagnosis of Diabetes Mellitus.Exp Clin Endocrinol Diabetes,2019,127:S1-S7.
2 Plows JF,Stanley JL,Baker PN,et al.The Pathophysiology of Gestational Diabetes Mellitus.Int J Mol Sci,2018,19:3342.
3 王彬苏,周秋明,盛望望,等.中国妊娠期糖尿病危险因素及妊娠结局的调查分析.中国医刊,2019,54:1014-1019.
4 Gao C,Sun X,Lu L,et al.Prevalence of gestational diabetes mellitus in mainland China:A systematic review and meta-analysis.J Diabetes Investig,2019,10:154-162.
5 徐运杰,季丰泉,苏双良.肌肉肌醇的代谢和生理功能.饲料博览,2021:1-6.
6 Croze ML,Soulage CO.Potential role and therapeutic interests of myo-inositol in metabolic diseases.Biochimie,2013,95:1811-1827.
7 Larner J,Brautigan DL,Thorner MO.D-chiro-inositol glycans in insulin signaling and insulin resistance.Mol Med,2010,16:543-552.
8 赵欣媛,张建华,张瑾.酮体、肌醇含量变化在妊娠期糖尿病患者中的表达及与胎儿畸形的相关性研究.中国优生与遗传杂志,2018,26:64-66.
9 Higgins JP,Green S.Cochrane handbook for systematic reviews of interventions version 5.1.0.2011; Available from:http://handbook-5-1.cochrane.org.
10 Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary? Control Clin Trials,1996,17:1-12.
11 D′Anna R,Di Benedetto A,Scilipoti A,et al.Myo-inositol Supplementation for Prevention of Gestational Diabetes in Obese Pregnant Women:A Randomized Controlled Trial.Obstet Gynecol,2015,126:310-315.
12 D′Anna R,Scilipoti A,Giordano D,et al.myo-Inositol supplementation and onset of gestational diabetes mellitus in pregnant women with a family history of type 2 diabetes:a prospective,randomized,placebo-controlled study.Diabetes Care,2013,36:854-857.
13 Facchinetti F,Pignatti L,Interdonato ML,et al.Myoinositol supplementation in pregnancies at risk for gestational diabetes:Interim analysis of a randomized controlled trial(RCT).Am J Obstet Gynecol,2013,208:S36.
14 Matarrelli B,Vitacolonna E,D′Angelo M,et al.Effect of dietary myo-inositol supplementation in pregnancy on the incidence of maternal gestational diabetes mellitus and fetal outcomes:a randomized controlled trial.J Matern Fetal Neonatal Med,2013,26:967-972.
15 Santamaria A,Di Benedetto A,Petrella E,et al.Myo-inositol may prevent gestational diabetes onset in overweight women:a randomized,controlled trial.J Matern Fetal Neonatal Med,2016,29:3234-3237.
16 Vitale SG,Corrado F,Caruso S,et al.Myo-inositol supplementation to prevent gestational diabetes in overweight non-obese women:bioelectrical impedance analysis,metabolic aspects,obstetric and neonatal outcomes-a randomized and open-label,placebo-controlled clinical trial.Int J Food Sci Nutr,2021,72:670-679.
17 杨标顺.产前补充肌醇预防肥胖孕妇妊娠期糖尿病的临床研究.全科医学临床与教育,2017,15:531-533.
18 Malvasi A,Kosmas I,Mynbaev OA,et al.Can trans resveratrol plus d-chiro-inositol and myo-inositol improve maternal metabolic profile in overweight pregnant patients? Clin Ter,2017,168:e240-e247.
19 Farren M,Daly N,McKeating A,et al.The Prevention of Gestational Diabetes Mellitus With Antenatal Oral Inositol Supplementation:A Randomized Controlled Trial.Diabetes Care,2017,40:759-763.
20 Saeedi M,Cao Y,Fadl H,et al.Increasing prevalence of gestational diabetes mellitus when implementing the IADPSG criteria:A systematic review and meta-analysis.Diabetes Res Clin Pract,2021,172:108642.
21 Lee KW,Ching SM,Ramachandran V,et al.Prevalence and risk factors of gestational diabetes mellitus in Asia:a systematic review and meta-analysis.BMC Pregnancy Childbirth,2018,18:494.
22 Juan J,Yang H.Prevalence,Prevention,and Lifestyle Intervention of Gestational Diabetes Mellitus in China.Int J Environ Res Public Health,2020,17:9517.
23 李洋洋,侯丽辉,李妍,等.肌醇与多囊卵巢综合征患者胰岛素抵抗的研究进展.中国医药导报,2021,18:37-40.
24 Bizzarri M,Fuso A,Dinicola S,et al.Pharmacodynamics and pharmacokinetics of inositol(s)in health and disease.Expert Opin Drug Metab Toxicol,2016,12:1181-1196.
25 Özturan A,Arslan S,Kocaadam B,et al.Effect of inositol and its derivatives on diabetes:a systematic review.Crit Rev Food Sci Nutr,2019,59:1124-1136.