胎儿游离DNA(cell-free fetal DNA,cffDNA)的发现推动了无创产前检测技术(non-invasive prenatal test, NIPT)的迅速发展,因其具有无创性、较高的敏感性和特异性,目前已广泛应用于临床上筛查高危人群的胎儿21-三体、18-三体和13-三体。cffDNA来源于胎盘滋养层细胞的凋亡和释放,cffDNA浓度的变化可能间接反映胎盘功能变化。少数国外的研究发现,在早、中孕期cffDNA浓度低的孕妇发生妊娠期高血压、子痫前期、妊娠期糖尿病、早产、胎儿宫内生长受限等妊娠并发症的风险增加[1-4]。cffDNA有望成为胎盘相关妊娠疾病早期筛查的新靶标,然而国内缺乏相关大样本量的队列研究。本研究拟基于本院NIPT检测的单胎妊娠孕妇队列,随访围产结局,评估cffDNA浓度与不良围产结局的相关性,以期为妊娠并发症的早期筛查提供新思路。
对象与方法
一、研究对象
回顾性收集2017年4月—2021年4月本院行NIPT检测的孕妇12 085例,经过纳排标准筛选活产分娩的单胎妊娠孕妇。
1.纳入标准:(1)单胎妊娠;(2)符合NIPT筛查指征且NIPT检测获得有效结果:血清学产前筛查临界风险(1/1 000≤21-三体风险值<1/250,1/1 000≤18-三体风险值<1/350)、介入性产前诊断禁忌症以及错过血清学筛查最佳时间、自愿要求等;(3)孕妇在本院分娩,临床信息完整。
2.排除标准:(1)检测孕周<12周;(2)胎儿染色体异常或结构畸形;(3)流产(<28周分娩),包括晚期自然流产、不明原因胎死宫内、因母体因素或胎儿畸形中期引产。
本研究经本院伦理委员会审核批准(M2021225)。
二、研究方法
1. 样本采集:采集孕妇的外周静脉血10 mL,乙二胺四乙酸抗凝,24 h内分离血浆,具体流程为:4℃、1 600×g离心10 min,取上清血浆;1 600×g离心10 min,分离上清血浆至EP管中;取600 μL血清样本提取DNA。
2. cffDNA提取、建库及测序:使用QIAamp DSP DNA试剂盒提取得到cffDNA,通过实时定量聚合酶链式反应(Real Time quantification Polymerase Chain Reaction,RT-qPCR)技术进行DNA扩增和文库制备。利用高通量测序平台(BioelectronSeq 4000基因测序仪),通过半导体测序法对其进行碱基序列读取和计数,获得不低于400 M的有效读数。通过TMAP软件将所有测序数据与人类基因组参考序列进行对比、生物信息分析,得出胎儿患21-三体、18-三体、13-三体的风险值。
3. cffDNA浓度测定和分组:采用Y染色体基因(ChrY)标记男胎DNA,应用RT-qPCR估算男胎的cffDNA浓度。基于TaqMan荧光定量PCR结合高通量测序检测胎儿特异性单核苷酸多态性位点,以此作为cffDNA标记物计算女胎cffDNA浓度。cffDNA浓度的分组:依据cffDNA浓度在整个cffDNA浓度梯度的百分位分为四组,即cffDNA浓度≤25th、25th
4. 病历资料搜集:搜集的资料包括孕妇采血时的年龄、孕周(根据末次月经和孕早期超声胎儿头臂长核对孕周)、体质指数(body mass index, BMI),以及分娩次数、受孕方式。从实验室获取NIPT检测结果、cffDNA浓度。通过病案系统获取妊娠期合并症及并发症、分娩孕周和新生儿出生体重。
5. 结局指标:包括妊娠期高血压(gestational hypertension,GHT)、子痫前期(preeclampsia, PE)、妊娠期糖尿病(gestational diabetes mellitus, GDM)、自发性早产(spontaneous preterm birth, SPB),胎儿宫内生长受限(fetal growth restriction, FGR)。其中PE按严重程度分为早发型子痫前期(early onset preeclampsia,Early Onset PE)、重度子痫前期(severe preeclampsia, SPE)、子痫前期并发胎儿宫内生长受限(preeclampsia complicated with fetal growth restriction,PE with FGR)。所有疾病诊断标准均参照第九版《妇产科学》。
6. 统计学处理:应用SPSS 26.0软件对数据进行统计分析。本队列的连续变量资料均不符合正态分布,以中位数(四分位间距)表示,组间差异比较采用Kruskal Wallis 检验;分类变量资料采用频数及率进行描述,组间差异比较采用χ2检验或Fisher精确概率法。多因素分析采用Logistic回归分析分别计算未校正和校正后的OR值和95%的置信区间。使用受试者工作特征曲线(receiver operating characteristic curve, ROC Curve)评估cffDNA浓度对不良围产结局的预测效果,计算曲线下面积(area under the curve, AUC)。P<0.05为差异有统计学意义。
结 果
一、研究对象一般情况
2017年4月—2021年4月本院行NIPT检测的孕妇12 085例,排除NIPT检测失败134例、孕妇临床信息不完整1 062例、胎儿染色体异常或结构畸形88例、晚期自然流产112例、不明原因胎死宫内32例、因母体因素中期引产11例、多胎妊娠729例,研究队列最终纳入单胎妊娠孕妇9 917例。
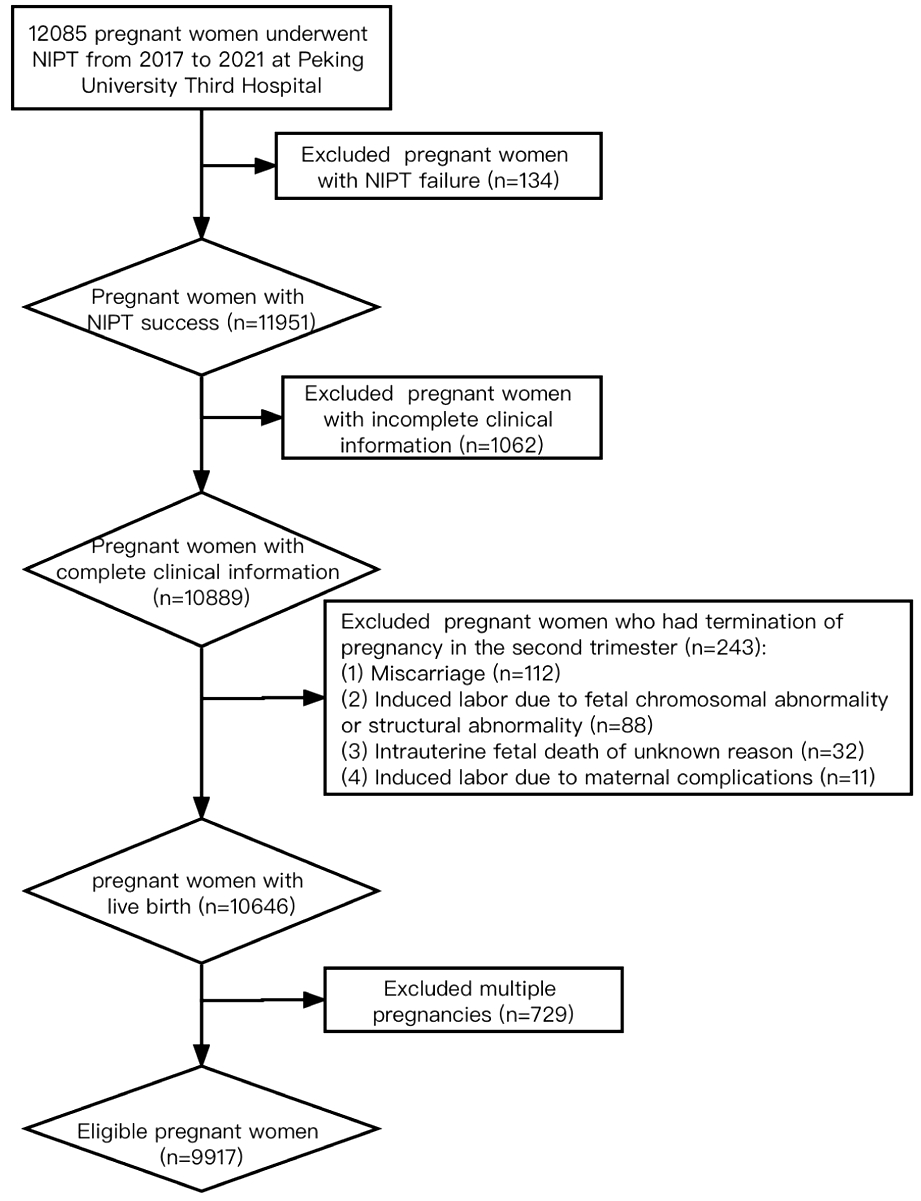
图1 流程图
Figure 1 Flowchart
二、孕妇和胎儿的一般情况
表1列出不同cffDNA浓度梯度的母胎基线特征。采血时的孕周中位数为16+3(15~17)周,各组间采血孕周差异无统计学意义(P=0.18),各组间的孕妇采血年龄、BMI、受孕方式、孕产次差异具有统计学意义(P<0.05),其中cffDNA浓度≤25th(低浓度组)与cffDNA浓度>75th百分位相比,低浓度组的检测时孕妇年龄更高(年龄中位数33 vs 32,P=0.02),孕妇BMI更大(BMI中位数23.2 vs 21.3,P<0.01),人工辅助受孕率更高(16.2% vs 12.1%,P<0.01),产次≥1的概率更高(15.9% vs 8.4%,P<0.01)。各组间的分娩孕周、新生儿出生体重无统计学差异(P>0.05)。
表1 不同cffDNA浓度梯度的母胎基线特征
Table 1 Maternal and fetal baseline characteristics by cffDNA fraction layers
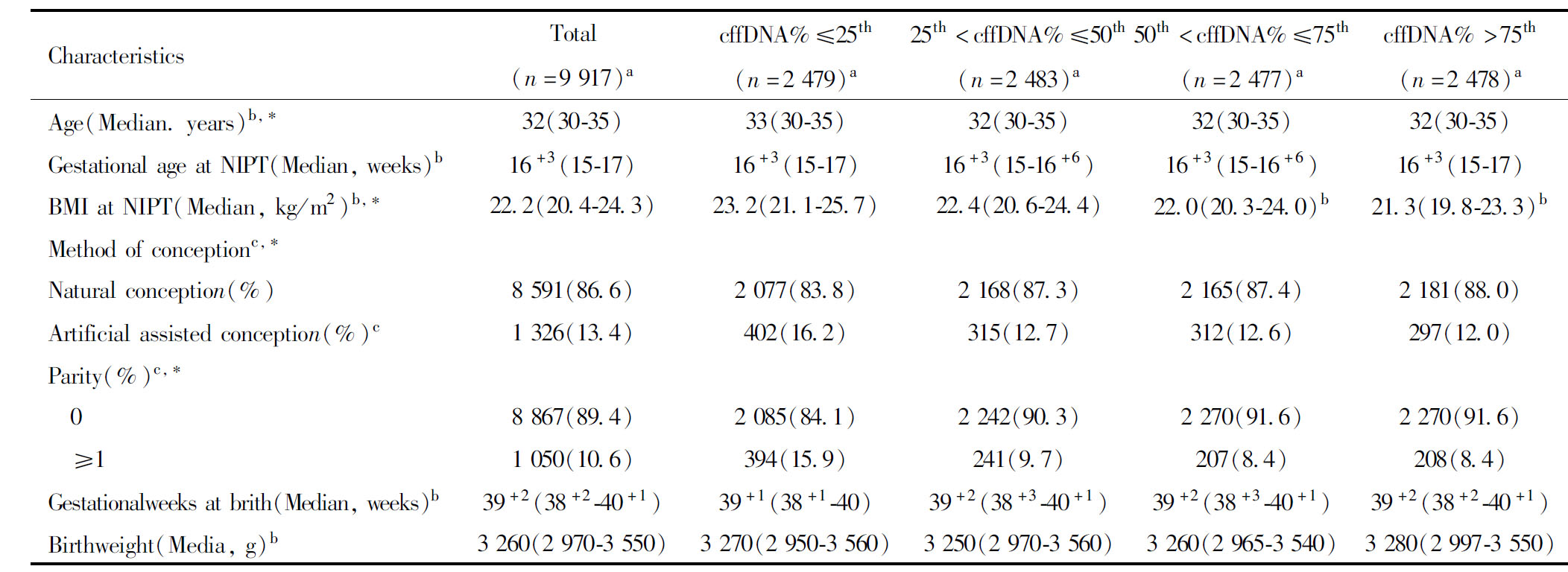
CharacteristicsTotal(n=9 917)acffDNA%≤25th(n=2 479)a25th
a n It presented the number of different group; b Continuous variable was presented as median(IQR); c Categorical variable was presented as N(%); * Compared between the groups, P<0.05.
三、cffDNA浓度与不良围产结局的多因素分析
表2显示了不同cffDNA浓度梯度发生不良围产结局的风险,以cffDNA浓度>75th为参考,校正孕妇年龄、BMI、受孕方式、产次后,cffDNA浓度≤25th(低浓度组)发生GHT(校正后的OR=1.5, 95%CI:1.1~2.1)、PE(校正后的OR=1.5, 95%CI:1.1~1.9)、GDM(校正后的OR=1.2, 95%CI:1.1~1.4)、FGR(校正后的OR=1.8, 95%CI:1.3~2.6)的风险更高,且cffDNA浓度梯度越低,上述妊娠并发症的风险越大。但cffDNA浓度≤25th与自发性早产(校正后的OR=0.9, 95%CI:0.8~1.2)无明显相关性。图2(1)森林图展示了不同cffDNA浓度梯度发生GHT、PE、GDM、FGR的风险情况。
表2 不同cffDNA浓度梯度与不良围产结局的相关性
Table 2 Correlation between different cffDNA fraction layers and adverse perinatal outcomes
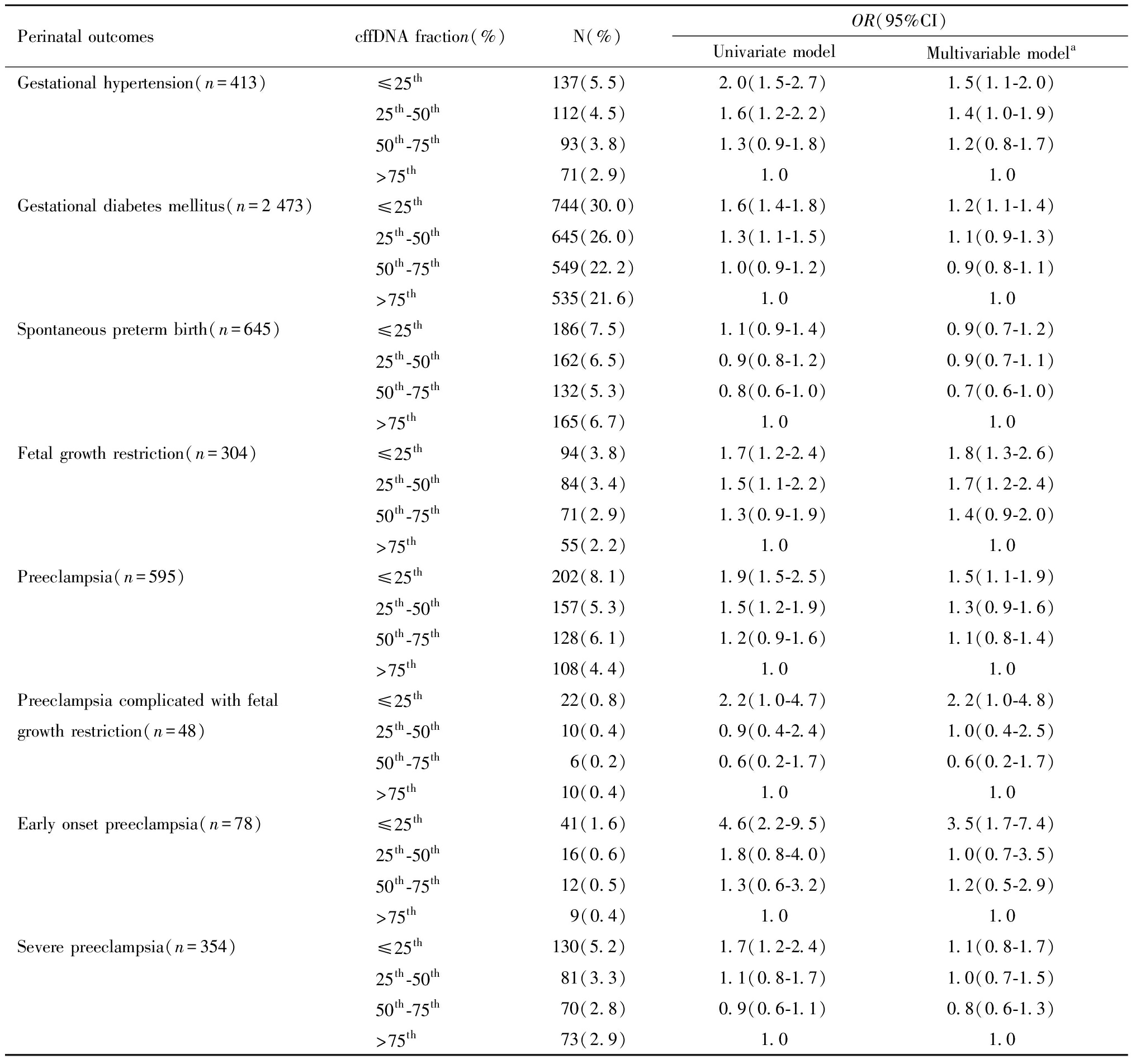
Perinatal outcomescffDNA fraction(%)N(%)OR(95%CI)Univariate modelMultivariable modelaGestational hypertension(n=413)≤25th137(5.5)2.0(1.5-2.7)1.5(1.1-2.0)25th-50th112(4.5)1.6(1.2-2.2)1.4(1.0-1.9)50th-75th93(3.8)1.3(0.9-1.8)1.2(0.8-1.7)>75th71(2.9)1.01.0Gestational diabetes mellitus(n=2 473)≤25th744(30.0)1.6(1.4-1.8)1.2(1.1-1.4)25th-50th645(26.0)1.3(1.1-1.5)1.1(0.9-1.3)50th-75th549(22.2)1.0(0.9-1.2)0.9(0.8-1.1)>75th535(21.6)1.01.0Spontaneous preterm birth(n=645)≤25th186(7.5)1.1(0.9-1.4)0.9(0.7-1.2)25th-50th162(6.5)0.9(0.8-1.2)0.9(0.7-1.1)50th-75th132(5.3)0.8(0.6-1.0)0.7(0.6-1.0)>75th165(6.7)1.01.0Fetal growth restriction(n=304)≤25th94(3.8)1.7(1.2-2.4)1.8(1.3-2.6)25th-50th84(3.4)1.5(1.1-2.2)1.7(1.2-2.4)50th-75th71(2.9)1.3(0.9-1.9)1.4(0.9-2.0)>75th55(2.2)1.01.0Preeclampsia(n=595)≤25th202(8.1)1.9(1.5-2.5)1.5(1.1-1.9)25th-50th157(5.3)1.5(1.2-1.9)1.3(0.9-1.6)50th-75th128(6.1)1.2(0.9-1.6)1.1(0.8-1.4)>75th108(4.4)1.01.0Preeclampsia complicated with fetal ≤25th22(0.8)2.2(1.0-4.7)2.2(1.0-4.8)growth restriction(n=48)25th-50th10(0.4)0.9(0.4-2.4)1.0(0.4-2.5)50th-75th 6(0.2)0.6(0.2-1.7)0.6(0.2-1.7)>75th10(0.4)1.01.0Early onset preeclampsia(n=78)≤25th41(1.6)4.6(2.2-9.5)3.5(1.7-7.4)25th-50th16(0.6)1.8(0.8-4.0)1.0(0.7-3.5)50th-75th12(0.5)1.3(0.6-3.2)1.2(0.5-2.9)>75th 9(0.4)1.01.0Severe preeclampsia(n=354)≤25th130(5.2)1.7(1.2-2.4)1.1(0.8-1.7)25th-50th81(3.3)1.1(0.8-1.7)1.0(0.7-1.5)50th-75th70(2.8)0.9(0.6-1.1)0.8(0.6-1.3)>75th73(2.9)1.01.0
a Adjusted maternal age, BMI, method of conception and parity.
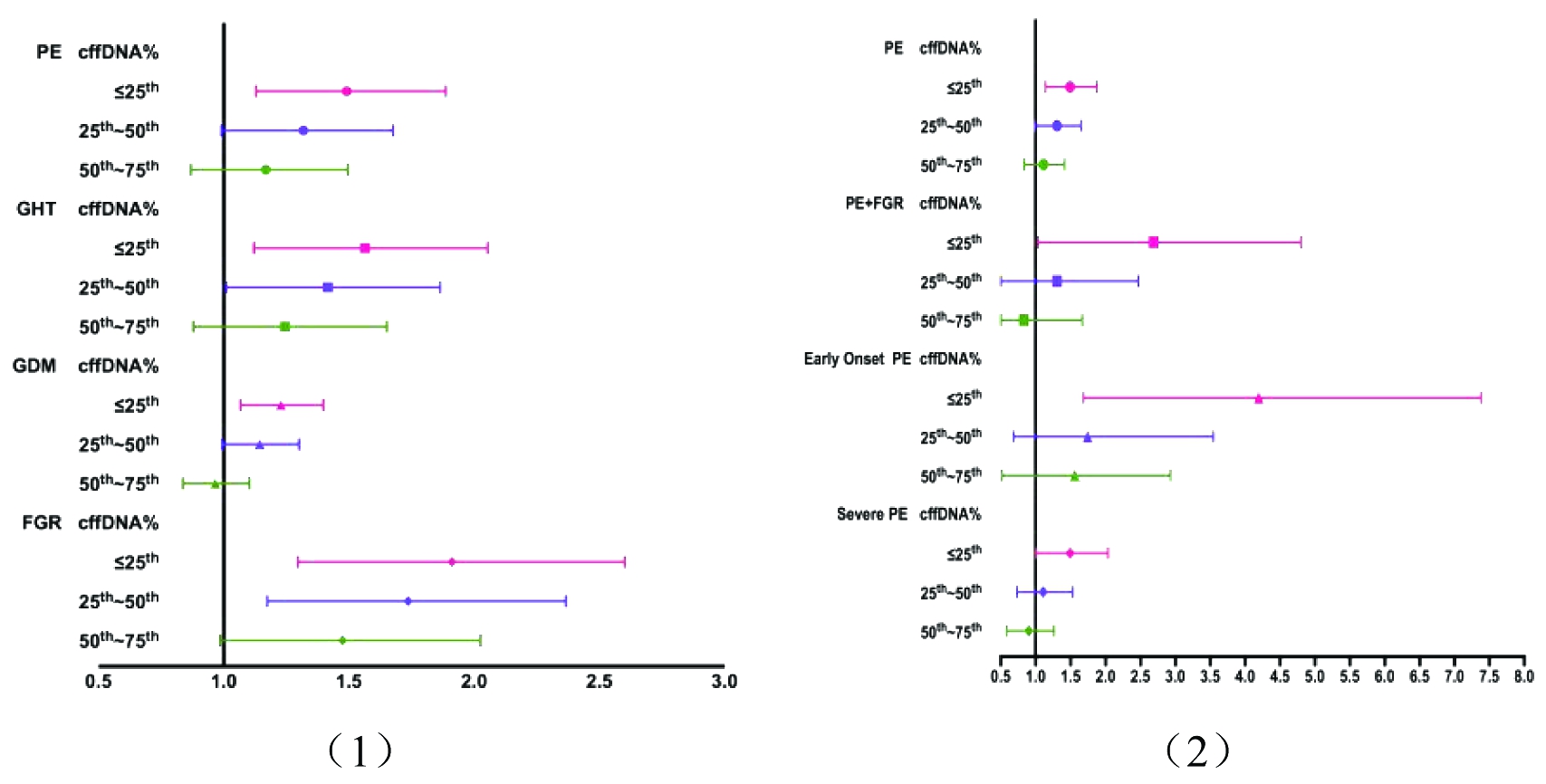
图2 (1) cffDNA浓度梯度与围产结局的风险森林图;
图2(2)cffDNA浓度梯度与不同类型子痫前期的风险森林图
Figure 2 (1) OR values of cffDNA fraction layer and perinatal outcomes; Figure 2(2) OR values of cffDNA fraction layer and different types of preeclampsia.
另外,比较不同cffDNA浓度梯度在不同类型PE的发生风险(表2),发现cffDNA浓度≤25th发生早发型PE(校正后的OR=3.5, 95%CI:1.7~7.4)、PE并发FGR(校正后的OR=2.2, 95%CI:1.0~4.7)和重度PE(校正后的OR =1.4, 95%CI:1.0~2.0)的风险更高,其中发生早发型PE的风险最大,是cffDNA浓度>75th的3.5倍,表明cffDNA浓度降低与PE的严重程度有关,发病越早、病情越重,cffDNA浓度越低。图2(2)森林图展示了不同cffDNA浓度梯度发生PE、PE并发FGR、早发型PE、重度PE的风险情况。
四、cffDNA浓度联合母体因素对妊娠并发症的ROC曲线分析:
使用cffDNA浓度以及cffDNA浓度结合孕妇年龄、BMI、受孕方式、产次因素进行ROC曲线分析(表3和图3),cffDNA浓度联合母体因素对早发型PE和PE并发FGR的预测准确性最高,早发型PE的AUC值0.9(0.9~1.0),敏感性93.6%,特异性89.2%,PE并发FGR的AUC值 0.9(0.9~1.0),敏感性93.8%,特异性86.2%。
表3 cffDNA浓度联合母体因素对围产结局的ROC分析
Table 3 ROC analysis of cffDNA fraction combined with maternal factors on perinatal outcomes
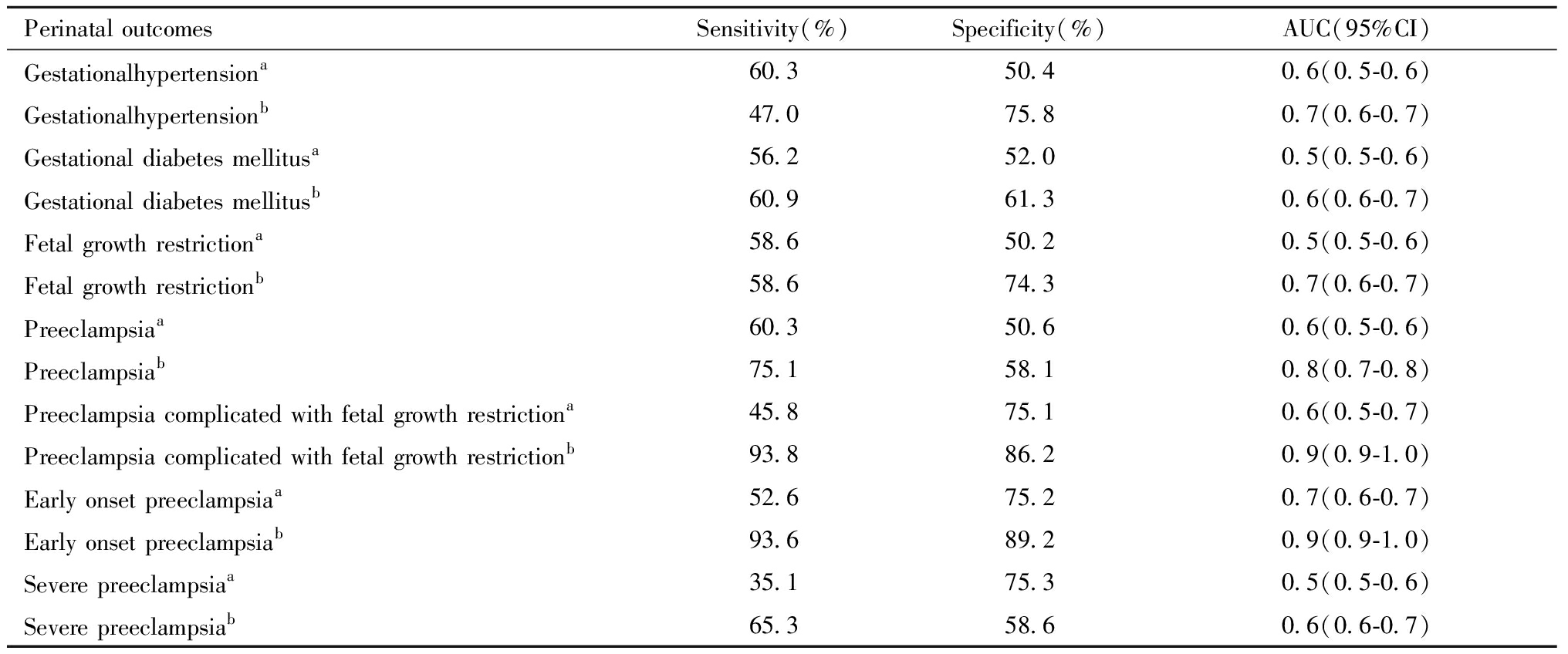
Perinatal outcomesSensitivity(%)Specificity(%)AUC(95%CI)Gestationalhypertensiona60.350.40.6(0.5-0.6)Gestationalhypertensionb47.075.80.7(0.6-0.7)Gestational diabetes mellitusa56.252.00.5(0.5-0.6)Gestational diabetes mellitusb60.961.30.6(0.6-0.7)Fetal growth restrictiona58.650.20.5(0.5-0.6)Fetal growth restrictionb58.674.30.7(0.6-0.7)Preeclampsiaa60.350.60.6(0.5-0.6)Preeclampsiab75.158.10.8(0.7-0.8)Preeclampsia complicated with fetal growth restrictiona45.875.10.6(0.5-0.7)Preeclampsia complicated with fetal growth restrictionb93.886.20.9(0.9-1.0)Early onset preeclampsiaa52.675.20.7(0.6-0.7)Early onset preeclampsiab93.689.20.9(0.9-1.0)Severe preeclampsiaa35.175.30.5(0.5-0.6)Severe preeclampsiab65.358.60.6(0.6-0.7)
a The single index of cffDNA fraction predicts pregnancy complications. b The multiple indicates of cffDNA fraction, age, BMI, method of conception, parity predict pregnancy complications.

图3 cffDNA浓度联合母体因素对妊娠并发症的ROC曲线分析
Figure 3 ROC curves of cffDNA fraction combined with maternal factors on perinatal outcomes
讨 论
本研究是目前探究低cffDNA浓度与不良围产结局相关性研究中样本量最大的队列研究。本研究发现在孕12+0~26+6周的母体外周血中,不同cffDNA浓度梯度发生不良围产结局的风险存在差异。低cffDNA浓度,即cffDNA浓度≤25th(cffDNA浓度≤13.3%)发生GHT、PE、GDM和FGR的风险最高。
一、低cffDNA与妊娠期高血压疾病:GHT是指妊娠20周后新发的血压升高,而PE是在GHT的基础上伴有尿蛋白阳性或靶器官损伤,该类疾病严重威胁母婴健康,是全球范围内孕产妇和围产儿病死率升高的主要原因。目前临床上缺乏对PE有效的治疗方法,主要是对症治疗和适时终止妊娠,但也会增加医源性早产的概率,已有研究表明[5]对PE高风险的孕妇从妊娠11+0~14+0周开始每天口服150mg阿司匹林至36周,可以有效降低PE早产的风险。因此,早期筛查、早期防治对降低PE的发生率和改善不良围产结局具有重要意义,而目前通过病史联合血清学指标预测PE的方法效率不高,故临床上亟需一种高效、早期的标志物可以有效预测PE。cffDNA可以间接反映胎盘功能,又能在妊娠早期检测,有望成为PE预测的新靶标。本研究发现,GHT和PE的风险随cffDNA浓度的下降有升高的趋势,cffDNA浓度≤25th、25th
二、低cffDNA与胎儿宫内生长受限:FGR是指胎儿应有的生长潜能受损,估测的胎儿体重小于同孕龄第10百分位,胎盘功能是影响胎儿生长因素的主要原因之一,FGR的早期筛查及早期干预对于胎儿生长发育具有重要意义。本研究表明随着cffDNA浓度梯度降低,FGR的发生风险升高,cffDNA浓度≤25th时FGR的风险是cffDNA浓度>75th的1.8倍。既往研究也报道过cffDNA浓度降低与FGR的风险增加有关,Clapp等[7]研究发现在cffDNA浓度<5th(cffDNA浓度<5.3%)的孕妇中,新生儿出生体重<10th的风险增加(OR=2.3, 95%CI:1.2~4.7),新生儿出生体重<5th的风险更高(OR= 3.7, 95%CI:1.4~9.0)。广泛的胎盘血管内皮损伤、胎盘灌注下降使得胎盘体积减小和胎盘功能障碍,进而导致胎儿血供减少、发育迟缓,也使得cffDNA浓度降低[8],cffDNA对FGR的预测潜能有待进一步研究。
三、低cffDNA与妊娠期糖尿病:GDM是指妊娠期首次发生的血糖高于正常标准值,可能导致微血管病变、胎盘血管异常,进而影响胚胎和胎盘的发育[9],血糖控制不佳者,对母儿的影响极大,感染、羊水过多、巨大儿、新生儿低血糖等风险增加。目前GDM主要依靠妊娠24~28周进行75g口服糖耐量实验(oral gucose tolerance test, OGTT)诊断,诊断时间接近孕晚期,早期预测可以更早的进行饮食指导和体重管理,改善母胎结局。本研究表明低cffDNA浓度组发生GDM的风险更高(OR=1.2, 95%CI:1.1~1.4),Hopkins等[10]一项病例对照研究也显示,GDM孕妇与正常孕妇相比,cffDNA浓度更低,认为GDM孕妇体重更大、肥胖比例更高,肥胖孕妇血容量增加导致母体游离DNA增加,另外脂肪组织的坏死、凋亡增加也会导致母体游离DNA增加,对cffDNA产生稀释作用,使cffDNA浓度下降[11]。荷兰的一项NIPT筛查队列纳入了295例因cffDNA浓度<4%导致NIPT检测失败的孕妇,与荷兰正常孕妇人群进行比较,发现cffDNA浓度低的孕妇发生GDM的概率更高,但该研究未校正孕妇BMI[2]。本研究在校正BMI后,差异仍具有统计学意义(校正后的OR=1.2, 95%CI:1.1~1.4),表明在排除母体因素后,cffDNA浓度低与GDM仍存在相关性。但不可否认,孕妇BMI升高与GDM的发生有关,也与cffDNA浓度降低有关[12-13],BMI对研究结果具有不可忽视的影响,因此cffDNA浓度对GDM的预测价值尚需进一步探讨,后续可对BMI正常和肥胖人群进行分层分析。
四、低cffDNA与自发性早产:SPB指妊娠达28周但不足37周且排除医源性因素分娩者,目前临床上多认为孕24周前超声检测宫颈长度<25mm,提示SPB风险增大,但对SPB的预测价值还不明确。胎盘血管灌注损伤可能是SPB发病的原因之一,近年来,cffDNA在预测SPB方面的探索引起了研究者们极大的关注。Yuan等[4]纳入了2191例孕13~26周行NIPT的单胎孕妇,发现cffDNA浓度<10th时,<34周分娩的SPB(OR=3.1, 95%CI:1.2~7.9)风险更高。也有研究表明cffDNA浓度与SPB无显著相关性[3,14],与本研究结果一致。SPB病因复杂,也可能与炎性损伤和物理应激有关,cffDNA浓度对SPB的预测价值尚不明确。
五、研究优势与局限性:目前国内针对cffDNA浓度与不良围产结局相关性研究数量少且样本量小,证据性不高,而本研究是目前国内分析cffDNA低浓度与不良围产结局相关性研究中样本量最大的单胎队列研究。另外,国外的研究对于低浓度的定义多数是cffDNA浓度<4%,即主要分析NIPT失败与不良围产结局的相关性,但NIPT失败的发生率仅为0.1%~3%[15],与NIPT成功组样本量差距悬殊,故以cffDNA浓度<4%作为阈值预测妊娠并发症可能不适用于大多数孕妇,本研究依据队列的cffDNA总体水平进行cffDNA浓度梯度分组,定义cffDNA浓度≤25th(cffDNA浓度≤13.3%)为低浓度组,提高了cffDNA的浓度阈值,且各浓度梯度组间样本量基本相同,对于比较不良围产结局的发生风险准确性更高。本研究虽然是单中心研究,无法判断不同医疗水平对结果的影响,但所有样本的检测环境和分析方法一致,排除了样本检测差异的干扰。另外,本研究未分析cffDNA浓度在不同孕周和疾病发生前后的变化趋势,需要纵向研究进行更深入的探讨。
综上所述,cffDNA低浓度与不良围产结局有关,发生妊娠期高血压、子痫前期、妊娠期糖尿病、胎儿宫内生长受限的风险更高,且子痫前期病情越重、发病时间越早,风险越高。cffDNA有望成为胎盘相关妊娠并发症预测的新靶标。
1 Rolnik DL,da Silva Costa F,Lee TJ,et al.Association between fetal fraction on cell-free DNA testing and first-trimester markers for pre-eclampsia.Ultrasound Obst Gyn,2018,52:722-727.
2 Becking EC,Wirjosoekarto SAM,Scheffer PG,et al.Low fetal fraction in cell-free DNA testing is associated with adverse pregnancy outcome:Analysis of a subcohort of the TRIDENT-2 study.Prenatal Diag,2021,41:1296-1304.
3 Gerson KD,Truong S,Haviland MJ,et al.Low fetal fraction of cell-free DNA predicts placental dysfunction and hypertensive disease in pregnancy.Pregnancy Hypertens,2019,16:148-153.
4 Yuan X,Zhou L,Zhang B,et al.Association between low fetal fraction of cell free DNA at the early second-trimester and adverse pregnancy outcomes.Pregnancy Hypertens,2020,22:101-108.
5 Rolnik DL,Wright D,Poon LC,et al.Aspirin versus placebo in pregnancies at high risk for preterm preeclampsia.Nejm,2017,377:613-622.
6 Kim YR,Jung I,Park G,et al.First-trimester screening for early preeclampsia risk using maternal characteristics and estimated placental volume.J Matern-fetal Neo M,2021,34:1155-1160.
7 Clapp MA,Berry M,Shook LL,et al.Low fetal fraction and birth weight in women with negative first-trimester cell-free DNA screening.Am J Perinat,2020,37:86-91.
8 Soongsatitanon A,Phupong V.First trimester 3D ultrasound placental volume for predicting preeclampsia and/or intrauterine growth restriction.J Obstet Gynaecol,2019,39:474-479.
9 Sabry MM,Mahmoud MM,Shoukry HS,et al.Interactive effects of apelin,renin-angiotensin system and nitric oxide in treatment of obesity-induced type 2 diabetes mellitus in male albino rats.Arch Physiol Biochem,2019,125:244-254.
10 Hopkins MK,Koelper N,Bender W,et al.Association between cell-free DNA fetal fraction and gestational diabetes.Prenatal Diag,2020,40:724-727.
11 Cao J,Qiao L,Jin J,et al.Lipid Metabolism Affects fetal fraction and screen failures in non-invasive prenatal testing.Front Med-prc,2021,8:811385.
12 Hui L,Bianchi DW.Fetal fraction and noninvasive prenatal testing:What clinicians need to know.Prenatal Diag,2020,40:155-163.
13 Juul LA,Hartwig TS,Ambye L,et al.Noninvasive prenatal testing and maternal obesity:A review.Acta Obstet Gyn Scan,2020,99:744-750.
14 Guo FF,Yang JX,Huang YL et al.Association between fetal fraction at the second trimester and subsequent spontaneous preterm birth.Prenatal Diag,2019,39:1191-1197.
15 王皖骏,段红蕾,丁蔚,等.基于高通量测序的孕妇外周血胎儿游离DNA产前检测的失败率及原因分析.中华医学遗传学杂志,2021,38:1171-1175.