近年中国育龄人群不孕不育发生率已上升至10%~15%,男性不育占其中的30%~40% [1]。在辅助生殖技术治疗过程中,精子的体外优化处理是辅助生殖技术(assisted reproductive technology,ART)的关键环节之一,其目的是为了从精液中筛选出活力、形态、受精潜能最优的精子用于体外受精,而精子处理方法的选择取决于精液标本的质量。常规精液处理方法有密度梯度离心法、直接上游法和洗涤法等,各种方法都有其优缺点。目前国内多数生殖中心实验室使用密度梯度离心和上游法优化精子,其过程包括数次的离心与洗涤操作。研究报道[2]精子离心是机械性的剪切力,可引起精子蛋白质组学以及基因组水平的改变,甚至会导致严重的精子功能障碍。而DNA甲基化的异常可能会影响到后续胚胎的发育,从而影响体外受精与胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)的最终临床结局[4]。
精子浮游器上游法优选精子的过程是模拟体内精子的自然筛选过程,不经历密度梯度、离心和洗涤等过程,直接富集最优的精子用于体外受精[3]。目前国内对该产品的使用报道较少。因此为了解浮游器上游法与本中心主流使用的密度梯度结合上游法优化精子后对胚胎发育的影响,本文比较密度梯度离心结合上游法和浮游器上游法对体外受精—胚胎移植中受精及胚胎发育的影响,旨在为辅助生殖实验室精液优化技术方法应用提供依据。
对象与方法
一、研究对象
回顾性分析2021年3月—2022年2月在海南省妇女儿童医学中心生殖医学中心行IVF/ICSI治疗周期的夫妇病例402/157对。包括男性因素、女性因素、混合因素和发病原因不明的不孕不育。纳入标准:IVF适应证:(1)女方包括盆腔及输卵管因素、排卵障碍、子宫内膜异位症、多囊卵巢综合征等;(2)男方禁欲3 d ~ 5 d后取卵日手淫采集的精液,精液量≥1 mL,浓度>15×106/mL。ICSI适应证:(1)不明原因的前次IVF受精失败或受精率小于30%等;(2)男方精液量≥1 mL,浓度>15×106/mL或轻度弱精子症。排除标准:(1)女方获卵数<5个,年龄40岁以上;排除各种严重的内科合并症的病例;(2)男方重度少弱精子症患者;(3)附睾、睾丸穿刺取精患者;(4)逆行射精;(5)供精、供卵。
二、研究方法
1.密度梯度离心结合上游法优选精子:精液由患者本人于取卵日手淫法获取。精液液化后1h之内处理精液,记录精子浓度、精子活力(率)、精液体积和液化时间等。在锥形离心管底加入0.5 mL 45%的Sperm Grad液,而后在其下0.5 mL 90%的Sperm Grad液,使两液交界处见明显分层,然后将精液轻轻加在梯度液的上面,415 g(1 500 r/min)离心20 min后去掉上清。沉淀物用1.5 mL Sperm Rinse悬浮300 g离心5 min后去上清,视精子沉淀情况加入1 mL左右精子洗涤液,37 ℃、5% CO2培养箱中上游40 min。最后轻轻吸取上游液至新的小试管中用于卵子受精。
2.精子浮游器上游法优选精子:待精液完全液化后处理精液,记录精子浓度、精子活力(率)、精液体积和液化时间等。吸取1mL左右Sperm Rinse加至已标记有夫妻双方姓名浮游管底部,然后吸取1 mL已吹打均匀液化的精液轻轻加到精子洗涤液底部,上层液面刚好超过粉红色的浮游通孔的上缘,使凹槽内充满液体,置于45°倾角的试管架内,放置于37 ℃、5% CO2培养箱中上游40 min。最后轻轻吸取凹槽中的精子至新的试管中用于卵子受精。
3. 控制性超排卵以及卵母细胞收集:严格按照本科室制定的人类辅助生殖临床技术操作规程进行控制性超促排卵,待优势卵泡直径超过18 mm时,予以人绒毛膜促性腺激素肌注,并于34~36 h行阴道超声引导下取卵术并收集卵母细胞。
4. 胚胎培养:取卵后3~5 h(夜针后39~41 h)进行IVF/ICSI授精,IVF授精的PR精子的浓度为10万~15万条/mL,ICSI操作为在显微镜下挑选活力好、形态正常的精子进行卵子注射。根据本中心制定的胚胎评分标准对胚胎进行详细评分,以本院患者实际情况随后选取1~2个优质胚胎进行移植或者选择全胚冷冻处理。
5. 试剂与耗材:SpermGrad、SpermRinse、G-IVF Plus、G1、G2等胚胎培养液均为瑞典Vitrolife 公司产品;辅助生殖用精子浮游器的制作材料是聚丙烯,由15 mL的圆底试管和内部的浮游通孔组成,浮游通孔直径6 mm,通孔外围是凹槽。详见图1。
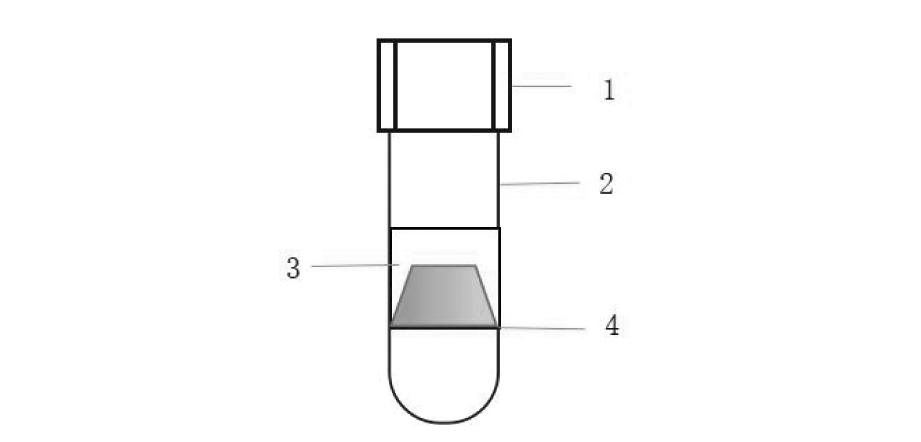
1-Upstream pipe lid;2-Upstream pipe;3-Floating through the hole;4-Card position line
图1 辅助生殖用精子浮游管示意图
Figure 1 Schematic of sperm swimming trapper for assisted reproduction
6. 观察指标:受精率=(2PN卵子数+1PN卵子数+多PN卵子数+0PN卵裂卵子数)/加精卵子数×100%;卵裂率=卵裂胚胎数/受精卵子数×100%;优质胚胎率=优质胚胎数/正常受精卵裂胚胎数×100%;囊胚形成率=II期及II期以上囊胚数/行囊胚培养卵裂期胚胎总数×100%;可利用囊胚率=可利用囊胚数/II期及II期以上囊胚数×100%。
7. 统计学方法:采用SPSS25.0统计软件进行统计分析,连续变量符合正态分布以平均数±标准差![]() 表示;P<0.05表示差异具有统计学意义。
表示;P<0.05表示差异具有统计学意义。
结 果
一、密度梯度离心结合上游法与浮游器上游法的一般数据比较
经过筛选IVF周期共有398对夫妇,ICSI周期共有157对夫妇纳入研究,根据不同精子优化处理方法分为密度梯度离心结合上游法(IVF周期:n=276;ICSI周期:n=79)和浮游器上游法(IVF周期:n=126;ICSI周期:n=78)。
IVF/ICSI周期密度梯度离心结合上游法组和浮游器上游法组在女方平均年龄、男方平均年龄、不孕年限、体质指数、基础FSH、基础LH、基础E2等均无统计学差异(P>0.05)。见表1~2。
表1 两组患者的基本情况和促排卵情况![]()
Table 1 Basic information, ovulation induction and other index of two ![]()
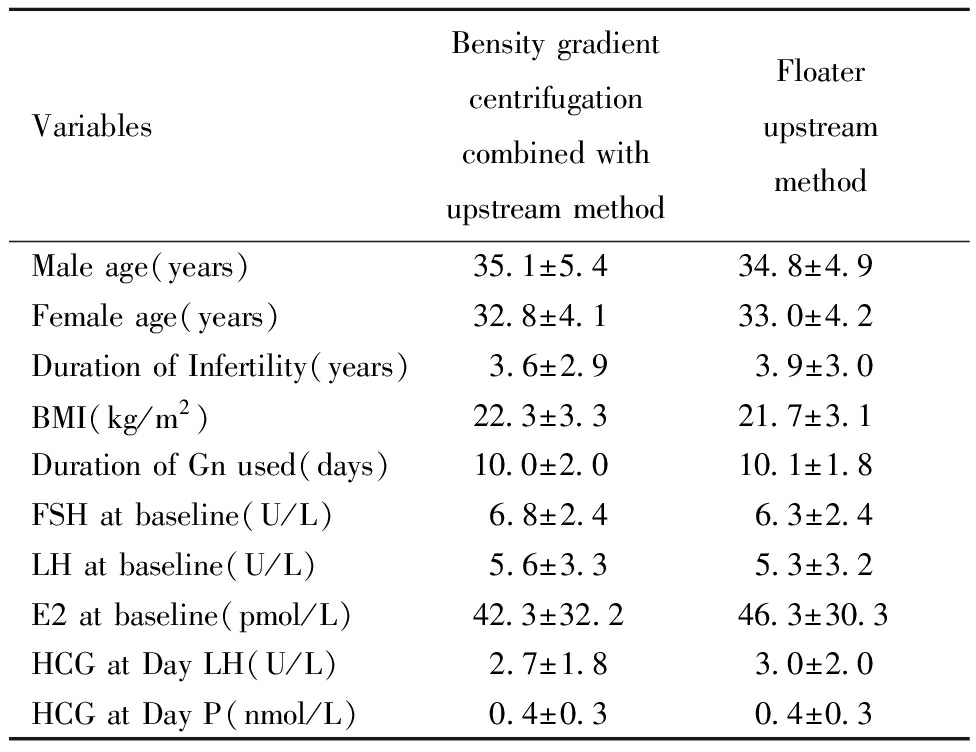
VariablesBensity gradient centrifugationcombined withupstream methodFloater upstreammethodMale age(years) 35.1±5.434.8±4.9Female age(years)32.8±4.133.0±4.2Duration of Infertility(years)3.6±2.93.9±3.0BMI(kg/m2)22.3±3.321.7±3.1Duration of Gn used(days)10.0±2.010.1±1.8FSH at baseline(U/L)6.8±2.46.3±2.4LH at baseline(U/L)5.6±3.35.3±3.2E2 at baseline(pmol/L)42.3±32.246.3±30.3HCG at Day LH(U/L)2.7±1.83.0±2.0HCG at Day P(nmol/L)0.4±0.30.4±0.3
表2 两组患者的基本情况和促排卵情况![]()
Table 2 Basic information, ovulation induction and other index of two ![]()
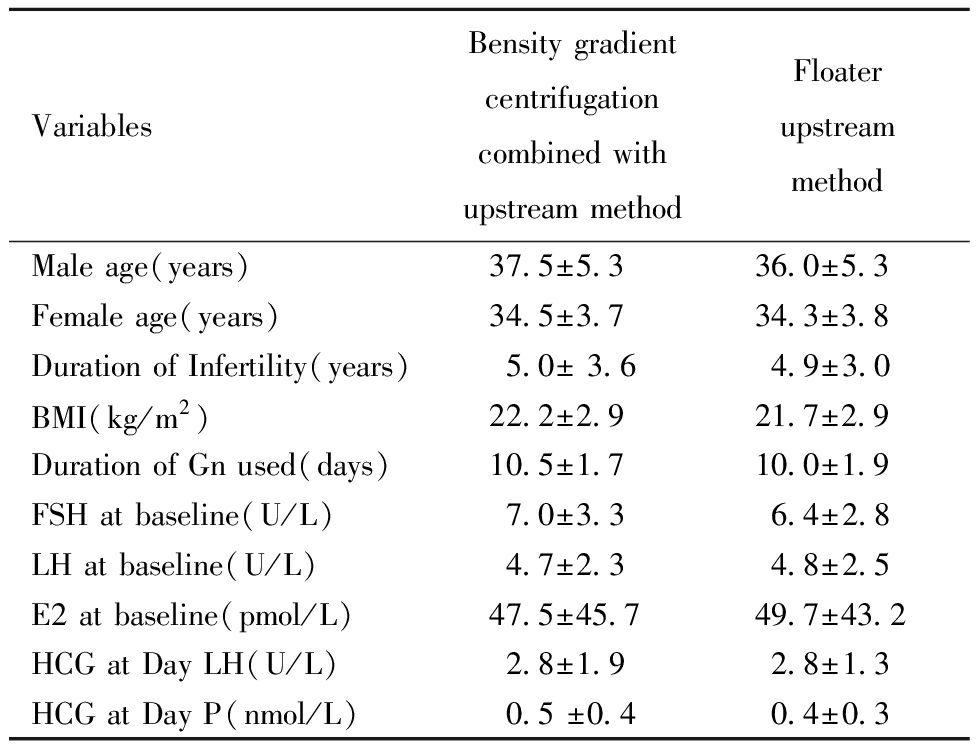
VariablesBensity gradientcentrifugation combined withupstream methodFloaterupstreammethodMale age(years) 37.5±5.336.0±5.3Female age(years)34.5±3.734.3±3.8Duration of Infertility(years)5.0± 3.64.9±3.0BMI(kg/m2)22.2±2.921.7±2.9Duration of Gn used(days)10.5±1.710.0±1.9FSH at baseline(U/L)7.0±3.36.4±2.8LH at baseline(U/L)4.7±2.34.8±2.5E2 at baseline(pmol/L)47.5±45.749.7±43.2HCG at Day LH(U/L)2.8±1.92.8±1.3HCG at Day P(nmol/L)0.5 ±0.40.4±0.3
二、两组常规精液检查相关参数比较
IVF方案精液处理前后密度梯度离心结合上游法组和浮游器上游法组男方精子浓度、活率、前向运动精子、回收率的比例差异均无统计学意义(P>0.05)。ICSI方案因行单精子显微注射,需选择形态正常、活动力高的优质精子进行受精,两组入组的筛选标准中存在弱精子症的病例,处理前两组的精子活力之间存在差异,而精液处理后两组精子浓度、活率、回收率的比例差异均无统计学意义(P>0.05)。见表3~4。
表3 两组精子参数处理前后比较![]()
Table 3 Comparison of sperm parameters before and after treatment in the two ![]()
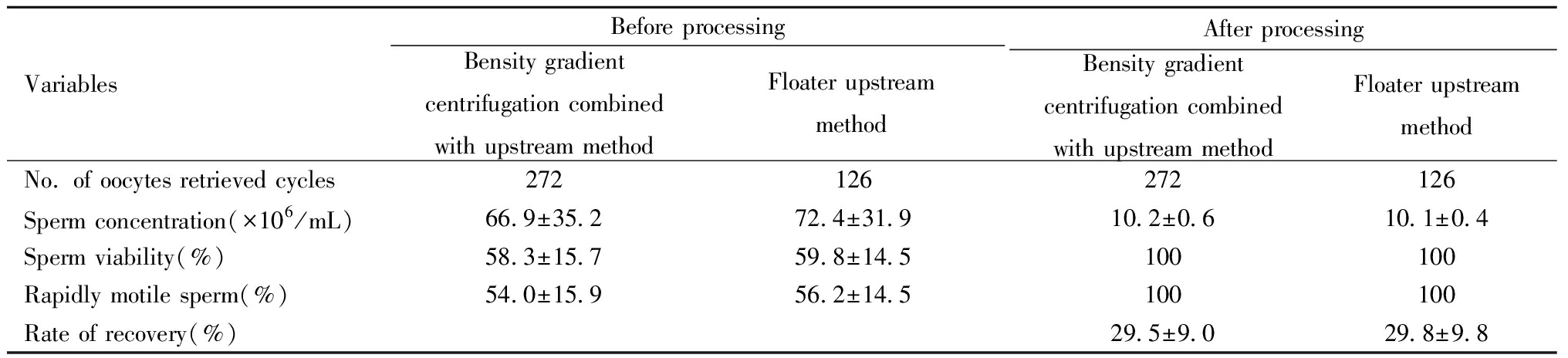
VariablesBefore processingBensity gradientcentrifugation combinedwith upstream methodFloater upstreammethod After processingBensity gradientcentrifugation combinedwith upstream methodFloater upstreammethod No. of oocytes retrieved cycles272126272126Sperm concentration(×106/mL)66.9±35.272.4±31.910.2±0.610.1±0.4Sperm viability(%)58.3±15.759.8±14.5100100Rapidly motile sperm(%)54.0±15.956.2±14.5100100Rate of recovery(%)29.5±9.029.8±9.8
表4 两组精子参数处理前后比较![]()
Table 4 Comparison of sperm parameters before and after treatment in the two ![]()

VariablesBefore processingBensity gradient centrifugation combined with upstream methodFloater upstreammethodAfter processingBensity gradient centrifugation combined with upstream methodFloater upstream methodNo. of oocytes retrieved cycles79787978Sperm concentration(×106/mL)55.2±34.760.0±31.48.8±2.98.7±3.4Sperm viability(%)48.7±20.956.1±19.3∗100100Rate of recovery(%)——29.7±9.227.8±9.3
Note: Compared between the two groups, *P<0.05
三、不同精子处理方法对卵子受精及胚胎发育结局的影响
IVF/ICSI周期密度梯度离心结合上游法组和浮游器上游法组平均获卵数、成熟卵子数、受精率、卵裂率、正常卵裂率、囊胚形成率差异均无统计学意义(P>0.05)。在IVF周期,浮游器上游法组的双原核受精率显著高于密度梯度离心结合上游法组(72.2±19.9)% vs(68.0±18.0)%,差异有统计学意义(P<0.05)。浮游器上游法组多PN受精率显著低于密度梯度离心结合上游法组(5.3±9.1)% vs(7.4±9.9)%,浮游器上游法组优质囊胚率显著高于密度梯度离心结合上游法组(62.6±33.0)% vs(53.2 ±34.0)%,差异均有统计学意义(P<0.01)。ICSI周期浮游器上游法组D3优质胚胎率显著高于密度梯度离心结合上游法组(38.0±27.7)% vs(28.2±25.3)%,浮游器上游法组优质囊胚率显著高于密度梯度离心结合上游法组(52.6±37.0)% vs(40.2±38.3)%,差异均有统计学意义(P<0.05)。见表5。
表5 两组之间各种指标的比较![]()
Table5 Comparison of the various indicators between the two ![]()
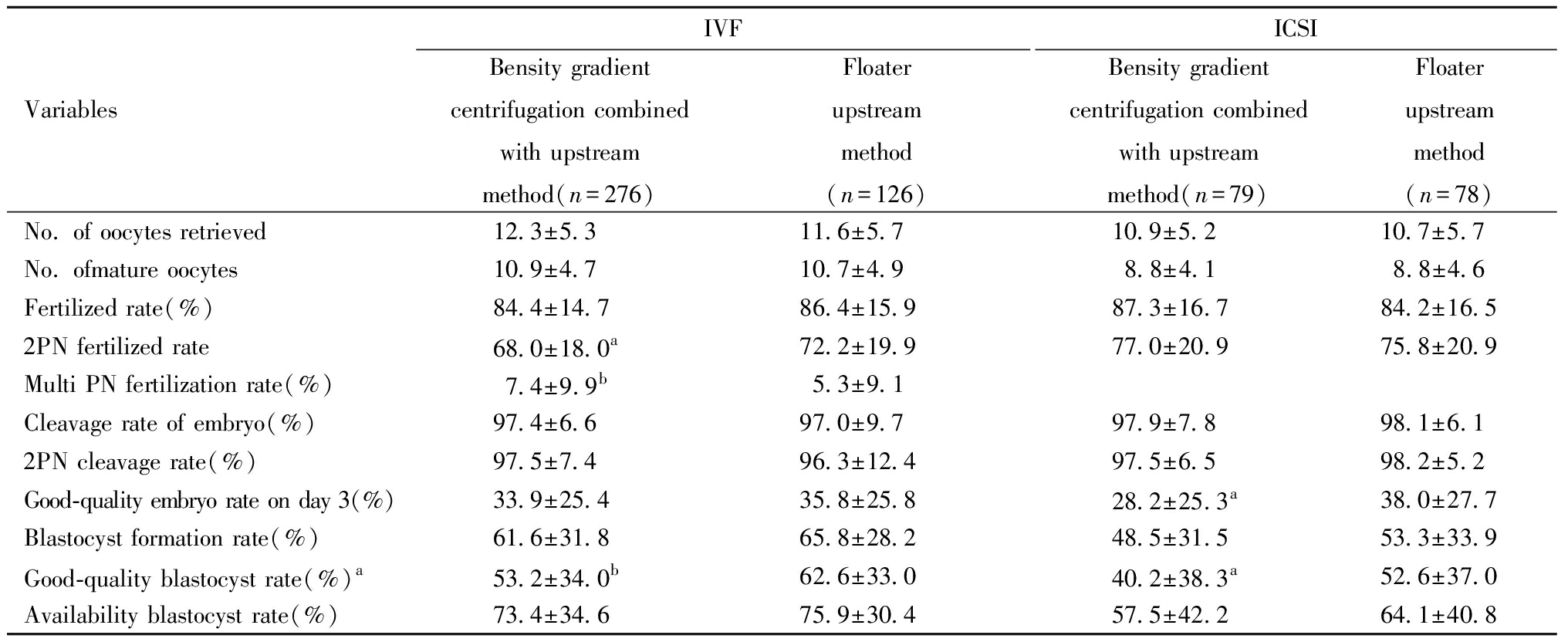
VariablesIVFBensity gradientcentrifugation combinedwith upstreammethod(n=276)Floater upstream method(n=126)ICSIBensity gradientcentrifugation combinedwith upstreammethod(n=79)Floater upstreammethod(n=78)No. of oocytes retrieved12.3±5.311.6±5.710.9±5.210.7±5.7No. ofmature oocytes10.9±4.710.7±4.98.8±4.18.8±4.6Fertilized rate(%)84.4±14.786.4±15.987.3±16.784.2±16.52PN fertilized rate68.0±18.0a72.2±19.977.0±20.975.8±20.9Multi PN fertilization rate(%)7.4±9.9b5.3±9.1Cleavage rate of embryo(%)97.4±6.697.0±9.797.9±7.898.1±6.12PN cleavage rate(%)97.5±7.496.3±12.497.5±6.598.2±5.2Good-quality embryo rate on day 3(%)33.9±25.435.8±25.828.2±25.3a38.0±27.7Blastocyst formation rate(%)61.6±31.865.8±28.248.5±31.553.3±33.9Good-quality blastocyst rate(%) a53.2±34.0b62.6±33.040.2±38.3a52.6±37.0Availability blastocyst rate(%)73.4±34.675.9±30.457.5±42.264.1±40.8
Notes: Compared between the two groups, aP<0.05,bP<0.01.
讨 论
本研究采用的精子浮游器上游法优选精子的过程是模拟体内精子的自然筛选过程,与常规的直接上游法不同,其内部结构是一个特制的塑料管,不经历密度梯度离心和洗涤等步骤,减少对精子的损害,对比密度梯度离心法,所需时间短,筛选精液中既能克服重力又能跨过浮游通孔的上缘进人凹槽的精子用于IVF和ICSI受精。
IVF过程是人工将大量精子直接与卵母细胞在体外共同孵育完成体外受精,此过程对精子的自然选择是有限的,而卵胞浆内单精子显微注射技术(ICSI)则是将单个精子直接注入卵胞质内,因此该过程对精子的选择尤为重要,通常需要尽量多地选择形态正常、活动力高的优质精子进行受精[5]。目前国内大多数生殖中心的精液优化处理方法主要是密度梯度离心法和直接上游法。直接上游法主要用于精液质量较好的和相对正常的精液,依赖于活动精子在培养液中的运动能力。本研究中采用的浮游器上游法与传统的上游法相似,但是所用耗材及步骤有所不同。传统的上游法多采用小试管或锥形管加入精液上游后一段时间收集精子或收集后大多还需经过离心洗涤,精浆与培养液的接触面积较大,而有些还需经过再沉淀的过程。本研究采用的精子浮游器,避免了传统上游法的缺点,该浮游器通孔外围是凹槽,精液中活力好的精子通过浮游通孔上游到凹槽中,无需再次沉淀过程,同时减少精液液化后的精浆接触培养液可能引起的精子损伤及污染。
密度梯度离心法能较好地分离精子和其他细胞及碎片,可以去除精浆、不活动精子、畸形精子、细胞碎片及其他有害的物质,从而回收更多形态正常的精子[6],特别适用于少精子症、畸精子症、弱精子症或者冷冻复苏后的精液,能提高精子的回收率[7]。但梯度离心法步骤需要经过数次的离心和洗涤操作,其中难免有可能对精子产生物理损伤。浮游法不同于直接上游法和密度梯度法,其处理过程不需要离心和数次洗涤。研究发现精子离心是机械性的剪切力,多次反复离心可致脂质过氧化产生,引起的活性氧增强非特异性渗透离子,也抑制膜受体和酶的作用,甚至都会导致严重的精子功能障碍,进而可能会影响卵子受精[2]。本研究中两种精液优化方法处理之后精子的回收率无统计学差异,精子与卵子受精后两组之间受精率差异没有统计学意义,提示梯度离心和浮游器优选的精子对于卵子的受精能力影响不大,精子仍具有使卵子受精的能力。精子的质膜是最容易损伤的部位,功能完整的质膜是精子能够进行新陈代谢,完成获能和顶体反应以及与透明带结合并穿过透明带的基础。研究发现密度梯度离心法处理后部分精子会表现为精子质膜和顶体外膜的损伤,精子尾部中段的损伤为线粒体和中心粒细胞器的损伤,但研究并未表现为中段的丢失[3],提示了一定程度的精子质膜和顶体外膜的肿胀和破裂。只要顶体内膜和尾部中段未丢失,精子仍具有使卵子受精的能力,因此对受精的影响并不明显,但可能对后续胚胎发育造成影响[8]。
近年研究认为精子DNA碎片是影响胚胎质量的重要因素之一。研究报道梯度离心可能会损害精子DNA的完整性,尤其是在运动能力和形态受损的不育男性的精液样本中,这些样本产生高病理活性氧水平(因为精子形态异常),并且总抗氧化能力低于正常男性的精浆[4,19]。含有DNA碎片的精子可能具有使卵子受精的能力,但当精子DNA损伤超过一定阈值时,会干扰正常受精和早期胚胎发育会造成影响,引起胚胎发育减慢,导致妊娠丢失[9]。处理过程中多次的离心操作会对精子的细胞结构造成损伤,精子的质膜是最容易损伤的部位,精子单位膜完整性遭到破坏将会影响精子正常的新陈代谢、受精、卵裂和后续胚胎发育[10-12]。本研究比较在IVF和ICSI周期两组精子优化处理后对后续胚胎发育的情况,结果显示在IVF周期浮游器上游法组的双原核受精率显著高于密度梯度离心结合上游法组,浮游器上游法组的多PN受精率极显著低于密度梯度离心结合上游法组,浮游器上游法组的优质囊胚率极显著高于密度梯度离心结合上游法组。ICSI周期浮游器上游法组的D3优质胚胎率、优质囊胚率也明显高于密度梯度离心结合上游法组。但IVF/ICSI卵裂率、正常卵裂率、囊胚形成率差异均无统计学意义。本研究与曹晓敏等的研究结果相符,以上结果再次验证使用浮游器精子优化方法获得的胚胎具有较好的发育潜能,明显提高优质胚胎率。推测原因为对比密度梯度离心法,浮游组的精子未经过梯度离心,对精子的物理损伤小,降低精子DNA碎片,提高了精子质量,最后获取的高质量的精子用于体外受精。过多的精子DNA损伤被认为会影响IVF受精率以及之后的胚胎发育[13]。Palini等的研究也显示浮游法可获得更高的优质胚胎率和妊娠率[14]。文献报道早期胚胎发育潜能对于妊娠的维持至关重要,胚胎发育不良会导致自然流产的增加[15],尤其是早期的妊娠丢失,表现为生化妊娠[13,16]。本研究发现尤其在囊胚发育阶段,显著增加优质囊胚率。精子质量对胚胎基因组的贡献非常大,尤其影响囊胚的发育[17]。囊胚移植的高种植率和活产率使得医生和患者更愿意选择单胚胎移植,在累积妊娠率不降低的情况下,极大地降低了多胎率和多胎带来的孕期和围产期的风险[17-18]。
综上所述,本文对比了密度梯度离心结合上游法和采用精子浮游器上游法分选精子后的受精及胚胎发育的区别。结果显示浮游器上游法可获得较高的正常受精率、优质胚胎率和优质囊胚率。试管婴儿的最终目的是孕育健康的胎儿,而这个需要获得更多高质量的正常胚胎,浮游器的使用在一定程度上提高了本中心双原核来源的胚胎,降低了多精受精的胚胎以及获得较高质量的胚胎,有助于进一步提高试管婴儿的成功率。同时通过使用该方法,还可以减少成本和错配错误,该方法简化了常规精液处理的操作步骤,处理所需时间明显缩短,方便快捷自然。但目前该浮游器的使用数据报道较少,希望后续有更多的研究总结,尤其浮游器上游法精子DNA的完整性。
1 Varshini J,Srinag BS,Kalthur G,et al.Poor sperm quality and advancing age are associated with increased sperm DNA damage on infertile men.Andrologia,2012,44:642-649.
2 Dutta S,Majzoub A,Agarwal A.Oxidative stress and sperm function:a systematic review on evaluation and management.Arab J Urol,2019,17:87-97.
3 曹晓敏,刘丽,邸建永,等.浮游器筛选后精子超微结构变化和IVF-ET结局分析:一项随机对照试验.中华生殖与避孕杂志,2021,41:610-617.
4 Muratori M,Tarozzi N,Carpentiero F,et al.Sperm selection with density gradient centri- fugation and swim up:effect on DNA fragmentation in viable spermatozoa.Sci Rep,2019,9:7492.
5 付景丽,丁秋霞,黄燕.人类辅助生殖技术的研究进展.局解手术学杂志,2019,28:418-421.
6 World Health Organization.WHO laboratory manual for the examination and processing of human semen.Cambridge:Cambridge University Press,2010.
7 邱峰龙,左阳花,冯播,等.不同精液优化处理方式前后精子质量参数的变化及对IVF-ET结局的影响.中国临床研究,2017,30:109-112.
8 Khalil WA,El-Harairy MA,Zeidan A,et al.Evaluation of bull spermatozoa during and after cryopreservation:structural and ultrastructural insights.Int J Vet Sci Med,2018,6 Suppl:S49- S56.
9 Sharma RK,Said T,Agarwal A.Sperm DNA damage and its clinical relevance in assessing reproductive outcome.Asian J Androl,2004,6:139-148.
10 Yamanaka M,Tomita K,Hashimoto S,et al.Combination of density gradient centrifugation and swim-up methods effectively decreases morphologically abnormal sperms.J Reprod Develop,2016,62:599-606.
11 王青欣,王迪,王霞.精子DNA碎片对IVF-ET胚胎发育和临床结局的影响.实用妇产科杂志,2021,37:522-526.
12 陈其桂,李大文.精子顶体完整性对IVF-ET结局影响的研究进展.中国临床新医学,2020,13:945-949.
13 Zini A ,Jamal W ,Cowan L,et al.Is sperm DNA damage associated with IVF embryo quality A systematic review.J Assist Reprod Genet,2011,28:391-397.
14 Palini S,Stefani SD,Primiterra M,et al.Comparison of in vitro fertilization outcomes in ICSI cycles after human sperm preparation by density gradient centrifugation and direct micro swim-up without centrifugation.Jbra Assist Reprod,2017,21:89-93.
15 倪晓蓓,朱丽华,徐志鹏,等.男方因素与IVF-ET新鲜胚胎移植周期临床结局的相关性分析.生殖医学杂志,2021,30:610-615.
16 Borini A,Tarozzi N,Bizzaro D,et al.Sperm DNA fragmentation:paternal effect on early post-implantation embryo development in ART.Hum Reprod,2006,21:2876- 2881.
17 Lee D,Jee BC.Evaluation of normal morphology,DNA fragmentation,and hyaluronic acid binding ability of human spermatozoa after using four different commercial media for density gradient centrifugation.Clin Exp Reprod Med,2019,46:8-13.
18 Lou H,Li N,Guan Y,et al.Association between morphologic grading and implantation rate of Euploid blastocyst.J Ovarian Res,2021,14.
19 Vinnakota C,Cree L,Peek J,et al.Incidence of high sperm DNA fragmentation in a targeted population of subfertile men.Syst Biol Reprod Med,2019,65:451-457.