宫颈癌是世界范围内第二常见的女性生殖系统恶性肿瘤,也是女性由于癌症死亡的第四大病因[1-2]。每年,宫颈癌导致约30万妇女死亡,影响近 60万妇女,尤其是中年妇女和生活在资源匮乏地区的妇女[3]。据国际癌症研究机构的统计,2020 年全球约有604 000例新发宫颈癌病例和342 000例死亡病例[2]。高危型人乳头瘤病毒(Human Papillomavirus,HPV)的感染(HPV16/18)是宫颈癌发生发展中十分重要的原因;除此之外,性传播疾病、吸烟、多次分娩和长期使用口服避孕药等也在一定程度上参与了宫颈癌的发生[4-5]。HPV疫苗的问世,使得宫颈上皮内瘤变和宫颈癌的发病率显著下降[6]。虽然已有高效的一级预防(HPV疫苗)和二级预防(宫颈细胞学筛查)措施,然而还有一部分与HPV无关的宫颈癌病例难以在早期发现[5]。因此,有必要开展更深入的研究,探究与宫颈癌发生发展相关的分子事件。
长非编码RNA(long non-coding RNA,lncRNA)是一类不编码蛋白质且长度大于200 nt的RNA分子。近年来,多项研究表明,lncRNA通过竞争性内源RNA(competing endogenous RNA,ceRNA)机制,调控下游基因的表达,从而影响宫颈癌的发生发展[7-9]。近年来研究表明,MIR210HG是一个与多种恶性肿瘤发生发展相关的lncRNA分子。例如,MIR210HG在胃癌组织中呈显著的高表达水平,且在体外能显著促进胃癌细胞的迁移和侵袭[10];在非小细胞肺癌组织中,MIR210HG也呈现显著的高表达水平,且敲低MIR210HG后可抑制癌细胞的增殖和迁移[11]。在女性生殖系统恶性肿瘤中也有类似的报道,例如在卵巢癌、宫颈癌和子宫内膜癌组织中,MIR210HG的表达均显著上调[12-14]。但仍缺少大样本量、多中心的研究来证实MIR210HG在宫颈癌组织中的高表达。因此,有必要开展大样本量的研究进一步证实MIR210HG在宫颈癌组织中的高表达。
本研究通过检索GEO、TCGA、SRA、ArrayExpress等高通量数据库,收集宫颈癌相关的lncRNA数据集,以综合探究MIR210HG在宫颈癌组织与正常宫颈组织中表达的差异。同时,通过多种方法探究MIR210HG在宫颈癌中相关的ceRNA网络,进一步挖掘了MIR210HG在宫颈癌中潜在的分子机制。
材料与方法
一、数据收集及处理:
通过检索ArrayExpress、SRA、GEO等数据库,收集宫颈癌相关的lncRNA数据集,检索式如下:“(“cervical cancer” OR “cervical carcinoma”) AND(lncRNA OR lincRNA OR “long non-coding RNA”)”。数据集纳入标准:(1)样本来源于人类宫颈癌组织;(2)数据集中宫颈癌样本与正常对照均应≥3例;(3)lncRNA表达矩阵可获取。数据集排除标准:(1)样本经过放射、药物或基因敲除等人为干预;(2)缺少相应的注释文件。同时还下载TCGA-CESC队列的RNA测序数据,并与GTEx数据库中正常宫颈组织的测序数据合并、标准化。截至2022年1月20日,共纳入4个数据集:TCGA-GTEx(306例宫颈癌,81例正常宫颈)、GSE145372[15-16](4例宫颈癌,4例正常宫颈)、GSE149763[17](3例宫颈癌,3例正常宫颈)和GSE167362[18](3例宫颈癌,3例正常宫颈)。
此外,以相同的方法检索并整理宫颈癌相关的miRNA和mRNA高通量数据集,将来自同一平台的数据集合并,并利用R语言(v4.0.4)sva包校正批次效应。利用meta包计算每个miRNA和mRNA的标准化均数差(standard mean difference,SMD),以获得宫颈癌中差异表达的miRNA和mRNA。计算标准如下:当异质性统计量I2<50%时,提示各队列之间异质性较小,使用固定效应模型(fixed effects model)合并SMD;反之,使用随机效应模型(random effects model)合并SMD[19]。当SMD>0且95%CI不包含0时,提示该mRNA(或miRNA)是高表达的;当SMD<0且95%CI不包含0时,提示该mRNA(或miRNA)是低表达的[20]。
二、MIR210HG在宫颈癌与正常对照组织之间的表达差异:
在本研究中,借助GraphPad Prism 8绘制散点图来探究MIR210HG在宫颈癌与正常对照组织之间的表达差异。同时,还绘制受试者工作特征(receiver operating characteristics,ROC)曲线来评估MIR210HG区分宫颈癌组织和正常宫颈组织的能力。该过程由ROC曲线下面积(area under the curve,AUC)来评估,0.5 为了综合评估MIR210HG在宫颈癌组织中的表达水平,合并计算4个宫颈癌相关lncRNA数据集中MIR210HG的SMD,合并计算的过程借助Stata v15.1(TX,USA)完成。计算标准及合并SMD的判读标准同1所述。同时,还利用Stata v15.1绘制综合受试者工作特征(summary receiver operating characteristics,SROC)曲线来综合评估MIR210HG区别宫颈癌组织与正常组织的准确性。 三、构建MIR210HG在宫颈癌中相关的ceRNA网络: 通过在线工具DIANA-LncBase v2,使用结合位点预测模块预测MIR210HG的靶miRNA,并将预测所得miRNA与计算获得的低表达miRNA取交集。同时,还利用ENCORI数据库计算MIR210HG与上述所获得的靶miRNA的相关性。此外,TargetScan Human v8.0数据库用于预测上述miRNA的靶基因,并将预测的靶基因与我们计算所得高表达mRNA取交集。Cytoscape v3.7.1软件用于构建ceRNA网络。 四、统计分析: 两组样本中MIR210HG表达差异的分析由独立样本t检验完成。Pearson相关系数r用于评估MIR210HG与靶miRNA、miRNA与靶基因之间的相关性。在本研究中,P<0.05提示结果具有统计学意义。 一、MIR210HG在宫颈癌组织与正常对照组织中的表达差异: 在本研究纳入的4个宫颈癌相关lncRNA数据集中,TCGA-GTEx、GSE149763检测到MIR210HG在宫颈癌组织中的表达水平较正常对照组织高,但只有TCGA-GTEx数据集的结果具有统计学意义(P<0.0001,图1A)。ROC曲线提示MIR210HG区分宫颈癌组织及正常对照组织具有轻度到中度的准确性(AUC=0.6250—0.8889;图1B)。 A:MIR210HG表达水平的散点图;P值基于独立样本t检验。Tumor,肿瘤组;Normal,正常组织组;B:MIR210HG在各个数据集中的ROC曲线; Sensitivity,敏感度;1-Specificity,1-特异度;AUC,曲线下面积 由于MIR210HG在纳入的4个数据集中表达水平不一致,我们采用异质性检验,结果提示MIR210HG在宫颈癌组织中的表达具有同质性(I2=41.2%,P=0.162,图2A),固定效应模型得出总SMD=0.57(95%CI [0.33—0.81],P<0.05;图2A),进一步证实MIR210HG在宫颈癌组织中呈高表达水平。Egger检验提示发表偏倚不具有统计学意义(P=0.157;图2B)。SROC曲线下面积达到0.71,提示MIR210HG具有中度区分宫颈癌组织与正常对照组织的能力(图2C)。 A:森林图提示,与正常对照组相比,MIR210HG在宫颈癌组织中表达上调;SMD,标准化均数差。B:Egger检验提示结果无发表偏倚。C:SROC曲线提示MIR210HG具有轻度区分宫颈癌组织的能力;SENS(Sensitivity),敏感性;SPEC(Specificity),特异性;AUC,曲线下面积 二、MIR210HG在宫颈癌中相关的ceRNA网络: 将预测的靶miRNA与宫颈癌中低表达的miRNA取交集,我们共获得11个miRNA。我们利用ENCORI数据库计算了这11个miRNA与MIR210HG在宫颈癌组织中表达相关性(基于TCGA-CESC数据集),其中3个miRNA与MIR210HG呈显著的负相关关系:hsa-miR-424-5p、hsa-miR-218-5p和hsa-miR-3194-5p(表1)。图3展示了MIR210HG相关的ceRNA网络图。 表1 MIR210HG与预测靶miRNA在宫颈癌组织中表达的相关性 miRNAPearson′s rPhsa-miR-2861 0.0580.315hsa-miR-193a-5p-0.0120.837hsa-miR-497-5p-0.0830.145hsa-miR-424-5p-0.1870.001hsa-miR-3154 0.0180.759hsa-miR-548q 0.0050.928hsa-miR-1915-3p-0.0530.335hsa-miR-218-5p-0.1740.002hsa-miR-4687-3p-0.0540.347hsa-miR-3194-5p-0.1710.003hsa-miR-3665-0.0890.12 Note:Based on the results from ENCORI. 图3 宫颈癌中MIR210HG及其相关的ceRNA网络ceRNA,竞争性内源RNA。 三、宫颈癌中hsa-miR-424-5p与其靶基因表达的相关性: 选择与MIR210HG表达相关性最强的hsa-miR-424-5p探讨其与靶基因的相关性(图4A)。在ENCORI数据库中计算hsa-miR-424-5p与靶基因的相关性,其中MYB与hsa-miR-424-5p的表达相关性最强(表2),呈显著的负相关(图4B)。森林图提示,hsa-miR-424-5p在宫颈癌组织中的表达显著低于正常宫颈组织(SMD=-0.91,95%CI:-1.35~-0.48, P<0.05;图4C);而MYB在宫颈癌组织中的表达显著高于正常宫颈组织(SMD=1.11,95%CI:0.10~2.11, P<0.05;图4D)。图4E展示了hsa-miR-424-5p与MIR210HG、MYB的结合序列。 表2 hsa-miR-424-5p与预测靶基因在宫颈癌组织中表达的相关性 Target genePearson′s rPCCNE1-0.0030.955CDCA4 0.0620.681KIF23 0.0490.395MYB-0.1580.006BTLA 0.0240.677SLC25A37-0.0830.15CDC37L1 0.1170.04TNFSF13B 0.0290.615 Note:Based on the results from ENCORI. 图4 hsa-miR-424-5p与MIR210HG及靶基因MYB表达的相关性以及结合序列 宫颈癌是第四大最常见的癌症,也是女性癌症死亡的第四大原因,发病率和死亡率均处于较高水平。除了总所周知的HPV感染,宫颈癌的发生发展仍受到其他因素的影响[1-2,4-5]。虽然HPV疫苗的接种和宫颈细胞学的筛查在一定程度上起到了预防宫颈癌的作用,影响宫颈癌发生发展的分子事件仍需要不断探索。近年来,许多研究报道lncRNA在宫颈癌的发生发展中起到一定的作用[7-9, 21]。MIR210HG作为一个与肿瘤相关的lncRNA分子,其在多种肿瘤中的表达水平及潜在分子机制已被相继探讨。但仍缺少相关多中心、大样本的整合分析,以证实MIR210HG在宫颈癌中的表达水平。为此,开展了这项多中心的整合分析。 本研究阐述了MIR210HG在宫颈癌组织中高表达。MIR210HG在多种恶性肿瘤中的低表达水平已被相继报道,如胰腺癌、胃癌、非小细胞肺癌等[10-11,22]。至于女性生殖系统癌症,MIR210HG在卵巢癌、子宫内膜癌、宫颈癌中均呈高表达的状态[12-14]。与这些研究不同之处在于,本研究收集全球范围与宫颈癌相关的lncRNA高通量数据集,通过大样本量的整合计算(316例宫颈癌样本,91例正常宫颈样本),来确定MIR210HG在宫颈癌组织中的表达。整合计算的结果表明,与正常女性相比,MIR210HG在宫颈癌中的表达是显著上调的。然而,由于临床数据的缺失,本研究未能开展相关的亚组分析以确定临床病理参数是否与MIR210HG的表达水平相关,这也有待我们今后的深入探讨。 同时,本研究还探讨了MIR210HG在宫颈癌中相关的ceRNA机制。近年的研究表明,ceRNA可能与癌症的发生发展及患者的预后相关[9, 21, 23]。此前已有研究报道,MIR210HG可能通过ceRNA机制参与多种肿瘤的发生发展,例如子宫内膜癌中的MIR210HG-miR-337-3p/137-HMGA2轴,以及宫颈癌中的MIR210HG/miR-503-5p/TRAF4轴等[12, 14]。本研究中通过结合位点预测以及大样本量的计算,构建了MIR210HG在宫颈癌中的ceRNA机制,推测MIR210HG可能通过hsa-miR-424-5p/MYB轴参与宫颈癌的发生发展。 此外,还探究了MIR210HG相关靶miRNA hsa-miR-424-5p与MYB在宫颈癌组织中的表达。有研究报道hsa-miR-424-5p在宫颈癌组织中呈现低表达水平,且高表达hsa-miR-424-5p可以抑制宫颈癌细胞的增殖和迁移[24]。在本研究中,利用收集的多中心样本验证了hsa-miR-424-5p在宫颈癌组织中的低表达(348例宫颈癌组织,42例正常对照);同时,1018例多中心样本的整合计算结果也表明,MYB在宫颈癌组织中的表达显著上调,且同时预测了MYB与hsa-miR-424-5p的8mer结合位点。本研究表明MYB可能是hsa-miR-424-5p的一个潜在靶基因。 综上所述,本研究首次采用整合多中心样本计算的方法揭示了lncRNA MIR210HG在宫颈癌组织中的高表达,并构建MIR210HG在宫颈癌中相关的ceRNA,推测MIR210HG/hsa-miR-424-5p/MYB轴可能参与宫颈癌的发生发展。然而,MIR210HG在宫颈癌中的分子机制仍需要进一步的实验探究。 1 Cohen PA,Jhingran A,Oaknin A,et al.Cervical cancer.Lancet,2019,393:169-182. 2 Sung H,Ferlay J,Siegel RL,et al.Global Cancer Statistics 2020:GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries.CA Cancer J Clin,2021,71:209-249. 3 Arbyn M,Weiderpass E,Bruni L,et al.Estimates of incidence and mortality of cervical cancer in 2018:a worldwide analysis.Lancet Glob Health,2020,8:e191-e203. 4 Bhatla N,Singhal S.Primary HPV screening for cervical cancer.Best Pract Res Clin Obstet Gynaecol.2020,65:98-108. 5 Zhang S,Xu H,Zhang L,et al.Cervical cancer:Epidemiology,risk factors and screening.Chin J Cancer Res,2020,32:720-728. 6 Lei J,Ploner A,Elfström K M,et al.HPV Vaccination and the risk of invasive cervical cancer.N Engl J Med,2020,383:1340-1348. 7 Aalijahan H,Ghorbian S.Long non-coding RNAs and cervical cancer.Exp Mol Pathol,2019,106:7-16. 8 Zhou YH,Cui YH,Wang T,et al.Long non-coding RNA HOTAIR in cervical cancer:Molecular marker,mechanistic insight,and therapeutic target.Adv Clin Chem,2020,97:117-140. 9 Luan X,Wang Y.LncRNA XLOC_006390 facilitates cervical cancer tumorigenesis and metastasis as a ceRNA against miR-331-3p and miR-338-3p.J Gynecol Oncol,2018,29:e95. 10 Li ZY,Xie Y,Deng M,et al.c-Myc-activated intronic miR-210 and lncRNA MIR210HG synergistically promote the metastasis of gastric cancer.Cancer Lett,2022,526:322-334. 11 Kang X,Kong F,Huang K,et al.LncRNA MIR210HG promotes proliferation and invasion of non-small cell lung cancer by upregulating methylation of CACNA2D2 promoter via binding to DNMT1.Onco Targets Ther,2019,12:3779-3790. 12 Wang AH,Jin CH,Cui GY,et al.MIR210HG promotes cell proliferation and invasion by regulating miR-503-5p/TRAF4 axis in cervical cancer.Aging(Albany NY),2020,12:3205-3217. 13 Liu P,Huang H,Qi X,et al.Hypoxia-induced lncRNA-MIR210HG promotes cancer progression by inhibiting HIF-1α degradation in ovarian cancer.Front Oncol,2021,11:701488. 14 Ma J,Kong FF,Yang D,et al.lncRNA MIR210HG promotes the progression of endometrial cancer by sponging miR-337-3p/137 via the HMGA2-TGF-β/Wnt pathway.Mol Ther Nucleic Acids,2021,24:905-922. 15 Xu J,Zou J,Wu L,et al.Transcriptome analysis uncovers the diagnostic value of miR-192-5p/HNF1A-AS1/VIL1 panel in cervical adenocarcinoma.Sci Rep,2020,10:16584. 16 Xu J,Zhang Y,Huang Y,et al.circEYA1 Functions as a Sponge of miR-582-3p to Suppress Cervical Adenocarcinoma Tumorigenesis via Upregulating CXCL14.Mol Ther Nucleic Acids,2020,22:1176-1190. 17 Chen Y,Chen D,Wang J,et al.Dysregulated lncRNAs act as competitive endogenous RNAs and are associated with cervical cancer development in UYGHUR women.Technol Cancer Res Treat,2021,20:1533033821989711. 18 Li L,Peng Q,Gong M,et al.Using lncRNA sequencing to reveal a putative lncRNA-mRNA correlation network and the potential role of PCBP1-AS1 in the pathogenesis of cervical cancer.Front Oncol,2021,11:634732. 19 Liang ZQ,Zhong LY,Li J,et al.Clinicopathological significance and underlying molecular mechanism of downregulation of basonuclin 1 expression in ovarian carcinoma.Exp Biol Med(Maywood),2021,247:106-119. 20 Liang ZQ,Gao L,Chen JH,et al.Downregulation of the coiled-coil domain containing 80 and its perspective mechanisms in ovarian carcinoma:A comprehensive study.Int J Genomics.2021:3752871. 21 Ding H,Zhang L,Zhang C,et al.Screening of significant biomarkers related to prognosis of cervical cancer and functional study based on lncRNA-associated ceRNA regulatory network.Comb Chem High Throughput Screen,2021,24:472-482. 22 Yu T,Li G,Wang C,et al.MIR210HG regulates glycolysis,cell proliferation,and metastasis of pancreatic cancer cells through miR-125b-5p/HK2/PKM2 axis.RNA Biol,2021,18:2513-2530. 23 Wang L,Cho K B,Li Y,et al.Long Noncoding RNA(lncRNA)-mediated competing endogenous RNA networks provide novel potential biomarkers and therapeutic targets for colorectal cancer.Int J Mol Sci,2019,20:5758. 24 Dong J,Wang Q,Li L,et al.Upregulation of long non-coding RNA small nucleolar RNA host gene 12 contributes to cell growth and invasion in cervical cancer by acting as a sponge for MiR-424-5p.Cell Physiol Biochem,2018,45:2086-2094.结 果
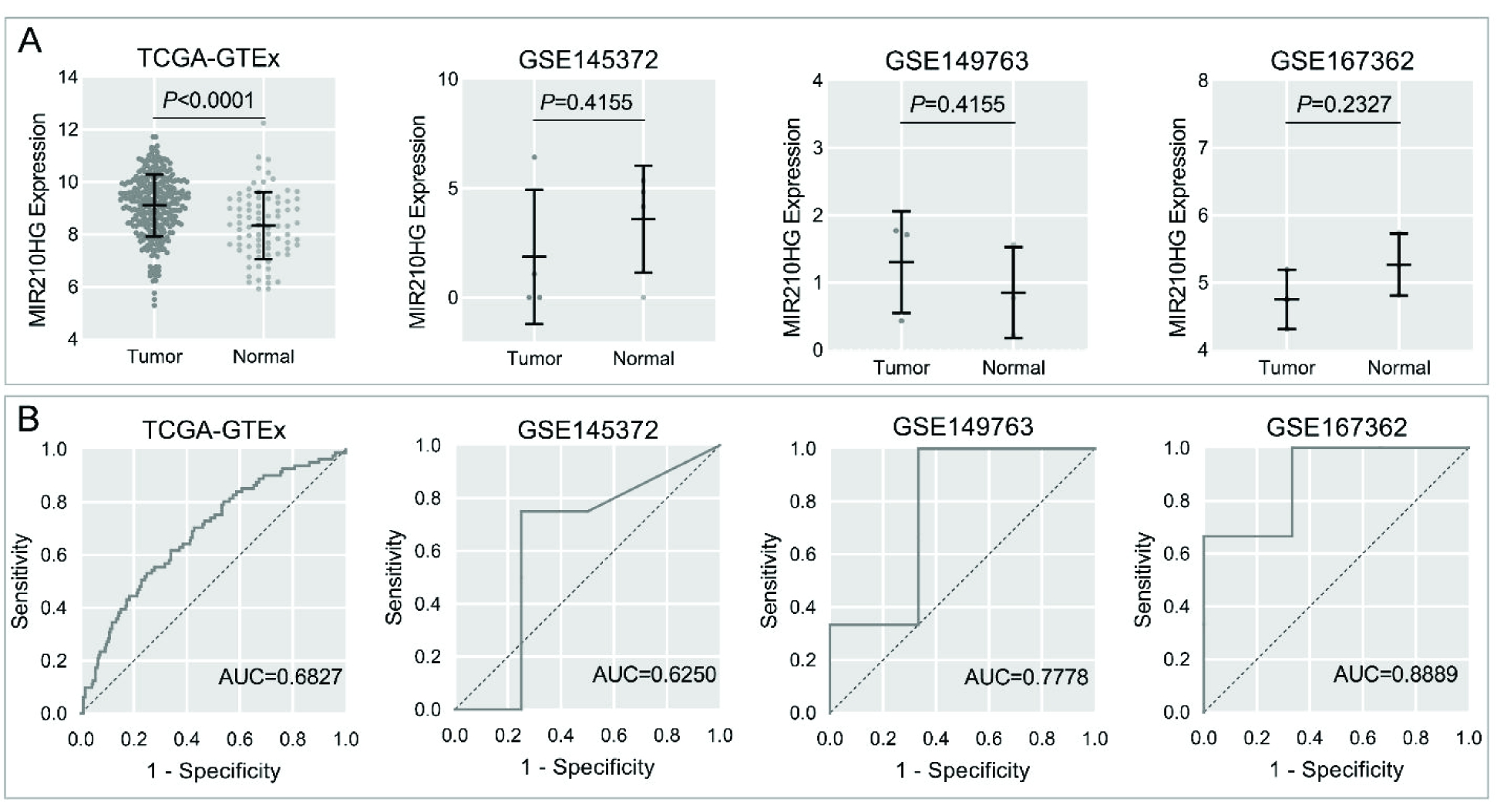
A:Scatter plots of MIR210HG expression; P-value is based on Student′s t-test. B:ROC curves of MIR210HG in each dataset.
图1 MIR210HG在宫颈癌及其正常对照组织中的表达水平差异及MIR210HG区分宫颈癌组织的能力
Figure 1 Differential expression of MIR210HG in cervical cancer and normal control tissues and the ability of MIR210HG to differentiate cervical cancer tissues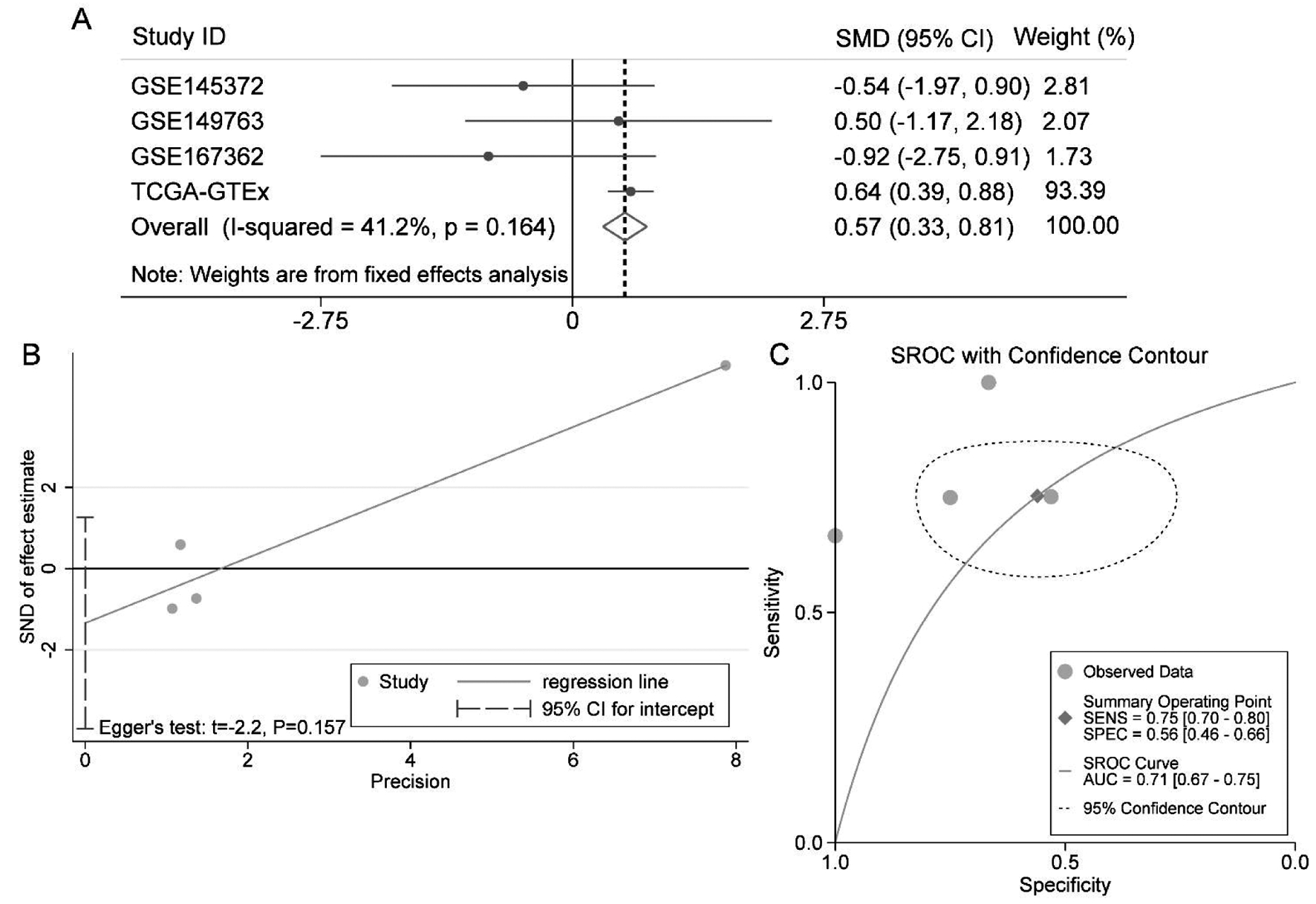
A:Forest plot reveals the upregulation of MIR210HG in cervical cancer tissues; B:Egger′s test identifies no publication bias; C:SROC curves demonstrates the mild discriminatory capacity in cervical cancer
图2 整合计算评估MIR210HG在宫颈癌组织和正常对照组织中的表达水平差异及MIR210HG区分宫颈癌组织的能力
Figure 2 Evaluation of MIR210HG expression difference between cervical cancer tissues and normal control tissues by integrated calculation and the ability of MIR210HG to differentiate cervical cancer tissues
Table 1 Expression correlation between MIR210HG and predicted target miRNA in cervical cancer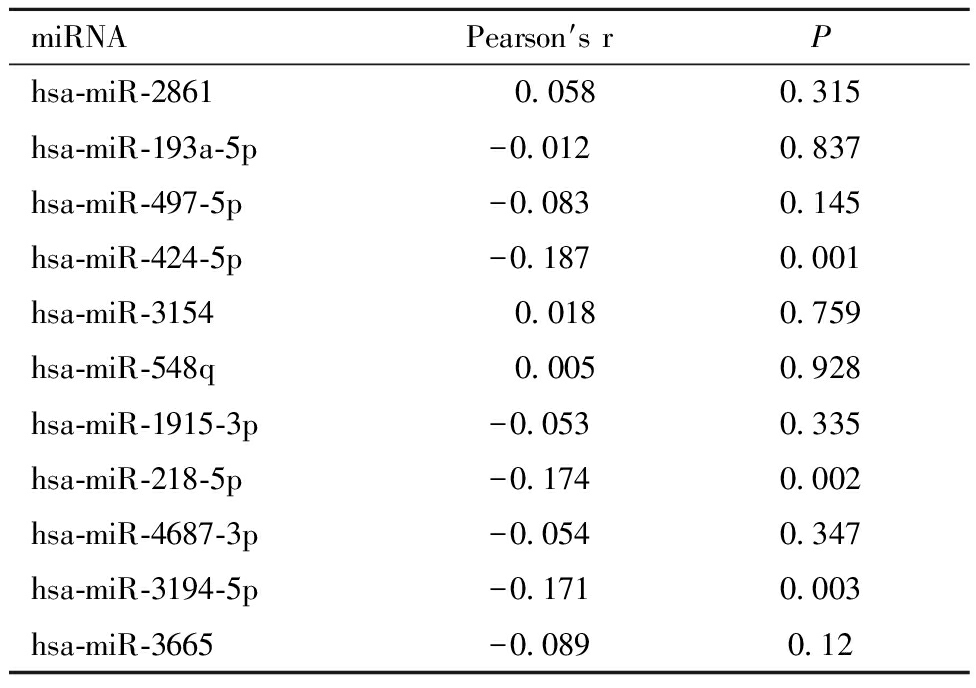
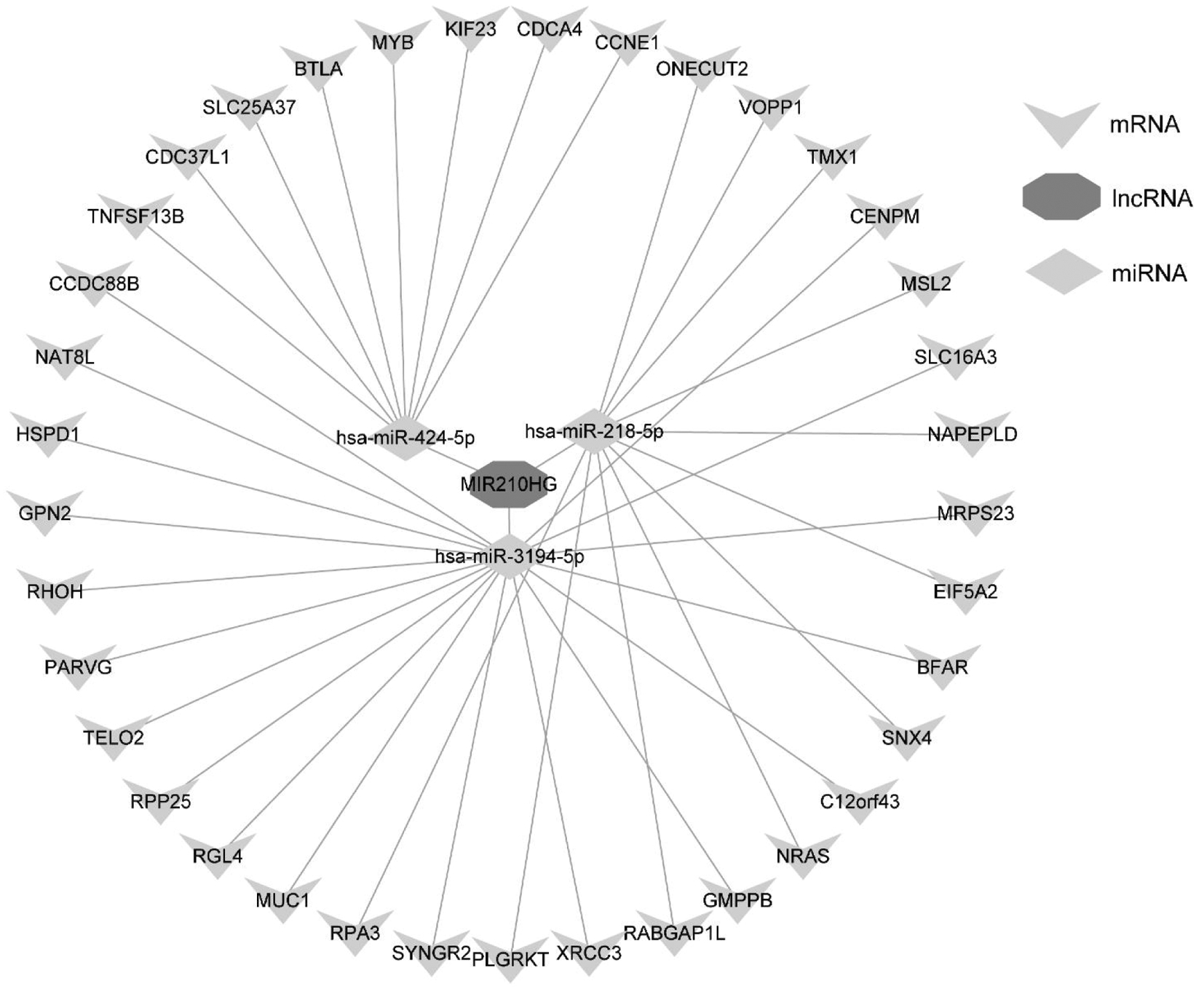
Figure 3 MIR210HG and its related ceRNA network in cervical cancer
Table 2 Expression correlation between hsa-miR-424-5p and predicted target gene in cervical cancer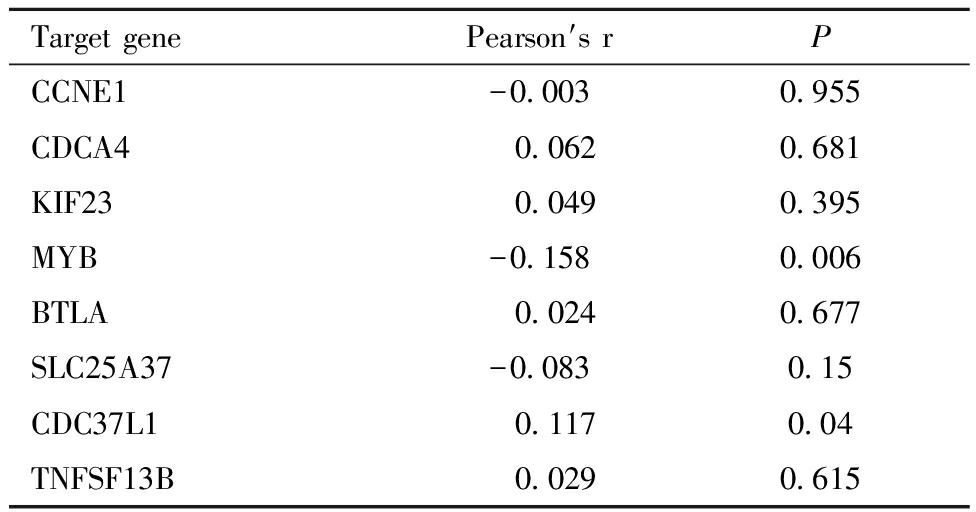
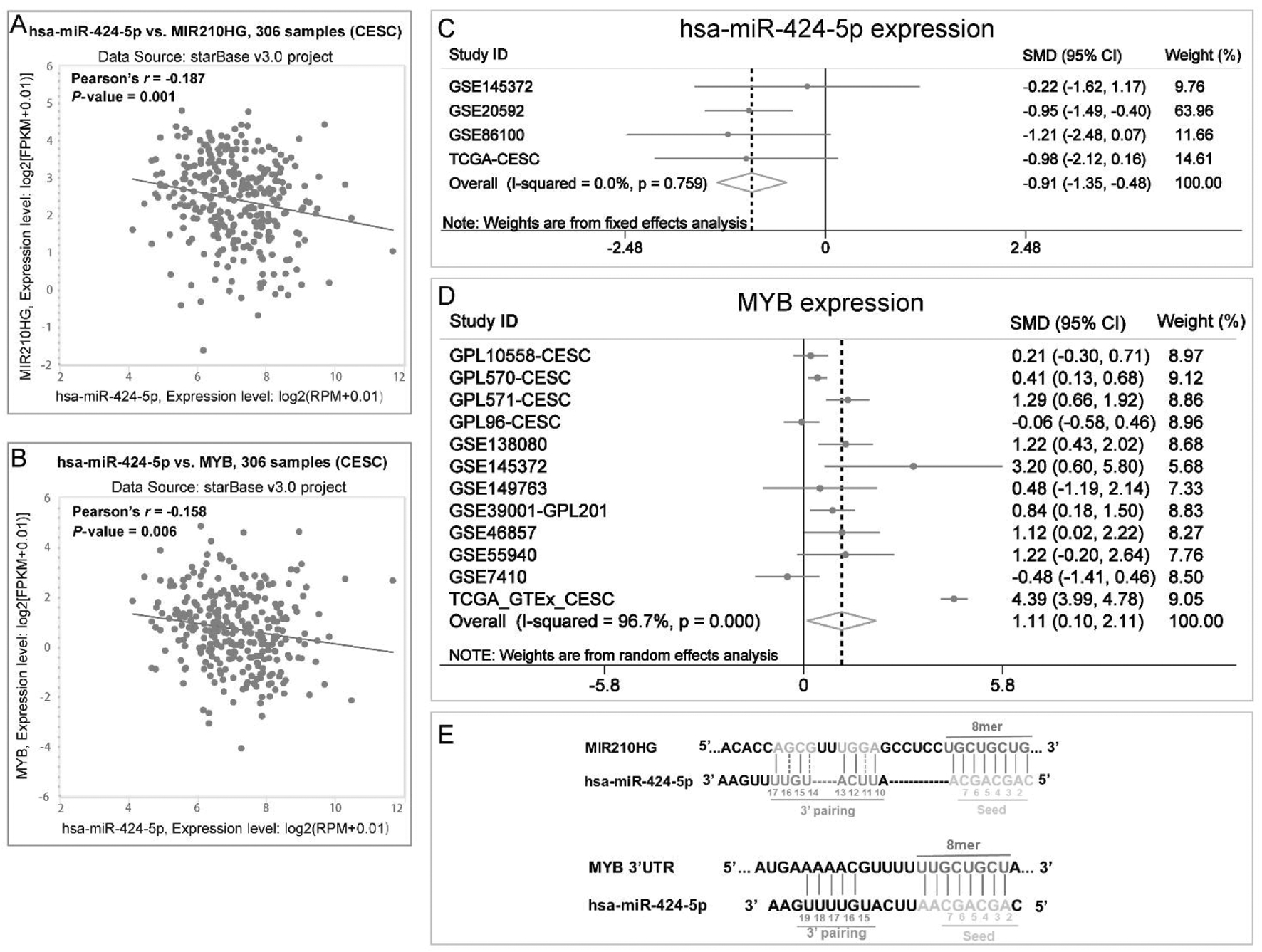
A:基于ENCORI数据库,hsa-miR-424-5p与MIR210HG表达的Pearson相关分析;CESC,宫颈癌。B:基于ENCORI数据库,hsa-miR-424-5p与靶基因MYB表达的Pearson相关分析;CESC,宫颈癌。C:森林图提示,与正常对照组织相比,hsa-miR-424-5p在宫颈癌组织中表达下调; SMD,标准化均数差;CESC,宫颈癌。D:森林图提示,与正常对照组织相比,MYB在宫颈癌组织中表达上调;SMD,标准化均数差;CESC,宫颈癌。E:hsa-miR-424-5p与MIR210HG、MYB的结合序列;3′UTR,3′-端非翻译区;8mer,与成熟miRNA种子区域及后一位碱基完全匹配。
Figure5. Expression correlation and binding sequence of hsa-miR-424-5p with MIR210HG and target gene MYB. A:The Pearson′s correlation analysis between hsa-miR-424-5p and MIR210HG based on ENCORI database; B:The Pearson′s correlation analysis between hsa-miR-424-5p and MYB based on ENCORI database; C:Forest plot reveals the downregulation of hsa-miR-424-5p in cervical cancer tissues; D:Forest plot reveals the upregulation of MYB in cervical cancer tissues; E:The combining sequences of hsa-miR-424-5p on MIR210HG and MYB.讨 论