膳食中的蛋白来源一直被人们关注[1]。食物中的蛋白质含有某些特定的氨基酸序列,这些氨基酸构成的肽或称生物活性肽已被发现可以调节多种生理过程[1];氨基酸本身也可以作为信号分子影响多种代谢过程,从而对人类健康产生影响[2-3]。
研究发现,膳食蛋白质不同来源可能会影响脑中血清素及儿茶酚胺类物质的合成[4]。不同来源的高蛋白摄入可能会对小鼠血脑屏障造成不同影响[5];来源于酪蛋白和大豆蛋白的肽对小鼠大脑部分脑区中的单胺神经递质代谢的影响也有所不同[6]。
牛乳及其制品是最常见的膳食蛋白来源之一,牛乳中的蛋白质主要包含酪蛋白和乳清蛋白两大类[7]。酪蛋白及乳清蛋白中已经分离鉴别出多种生物活性肽[8-10]。来源于大豆的蛋白质则被认为是植物性食物中少有的优质蛋白,大豆蛋白及其肽则被认为具有包括降低血脂,抗糖尿病、高血压、癌症,减轻氧化应激及炎症反应,调节免疫及神经活动在内的广泛的生物活性[11],相关干预实验及机制研究已经较充分的证明了上述生物活性源于蛋白或肽自身,而非大豆中所包含的其它营养成分[12-14]。
上述研究揭示了不同来源蛋白及其肽影响神经系统功能的可能性。然而目前尚无研究探讨不同来源蛋白对神经系统发育的影响。对包括人类在内的哺乳动物而言,胚胎及幼年期神经系统的发育对其功能十分重要,在神经系统中,小脑主要负责对运动功能进行调节,与具有更复杂的脑区分布和更复杂功能的大脑相比,其结构功能均较为独立,故本研究希望通过动物模型,探索摄入不同来源蛋白后,大鼠胎鼠及仔鼠小脑代谢组的改变,以初步探索不同来源的蛋白成分对子代运动及协调能力发育的可能影响。
材料与方法
一、实验材料
大豆分离蛋白(soy protein isolate,纯度≥90%,西安维特生物科技有限责任公司),浓缩牛乳蛋白(milk protein concentrate,纯度≥85%,美国Grassland Dairy Products Inc.)。
二、实验动物
12周龄雌性SPF级Sprague-Dawley(SD)大鼠,每组24只,共3组,体重260~290 g,由北京大学医学部实验动物科学部提供[许可证号:SCXK(京)2016-0010]。饲养于恒温(24±0.5)℃,恒湿(50±10%)并用灯光模拟日夜循环的环境中[许可证号:SYXK(京)20160041]。
三、主要试剂及仪器
样本处理及检测所用主要试剂为:蒸馏水(屈臣氏),质谱级乙腈(Thermo Fisher)、甲醇(Thermo Fisher)、甲酸(Sigma-Aldrich)。主要仪器为:Thermo Scientific M16710-33型漩涡振荡器、昆山市超声仪器有限公司KQ5200DE型超声波清洗器、Beckman Coulter Microfuge22R型台式高速冷冻离心机、Eppendorf Concentrator plus型真空浓缩仪、岛津SHIMADZU Nexera UHPLC LC-30A型超快速液相色谱仪、AB SCIEXTM TripleTOF5600+型质谱仪。
四、动物干预实验
1.实验流程:实验雌鼠适应性饲养3 d后,在下午18:00与健康SD雄鼠按雌雄性别比2:1合笼。次日晨检查阴栓,见到阴栓的雌鼠认为受孕,并记为妊娠第0.5天(gestational day 0.5, GD0.5)。将受孕雌鼠按孕前体重随机分为3组,每组24只,分别记为S1、S2、S3组,于GD0.5始每组饲喂不同配方饲料进行干预,持续至妊娠第18.5天(GD18.5)或出生后21天(postnatal day 21, PD21)。S1组饲料中蛋白成分50%来源于大豆分离蛋白,50%来源于浓缩牛乳蛋白;S2组则75%来源于大豆分离蛋白,25%来源于浓缩牛乳蛋白;S3组则均来源于大豆分离蛋白。
2.干预饲料配制:干预饲料配制遵循美国营养学会AIN93啮齿类实验动物生长繁殖期(G型)纯化饲料标准,其详细配方请详见表1,每组饲料中仅蛋白来源不同,其余营养素均保持平衡。
表1 干预饲料配方及营养成分
Table 1 The formula and nutrient composition of the intervention feeds
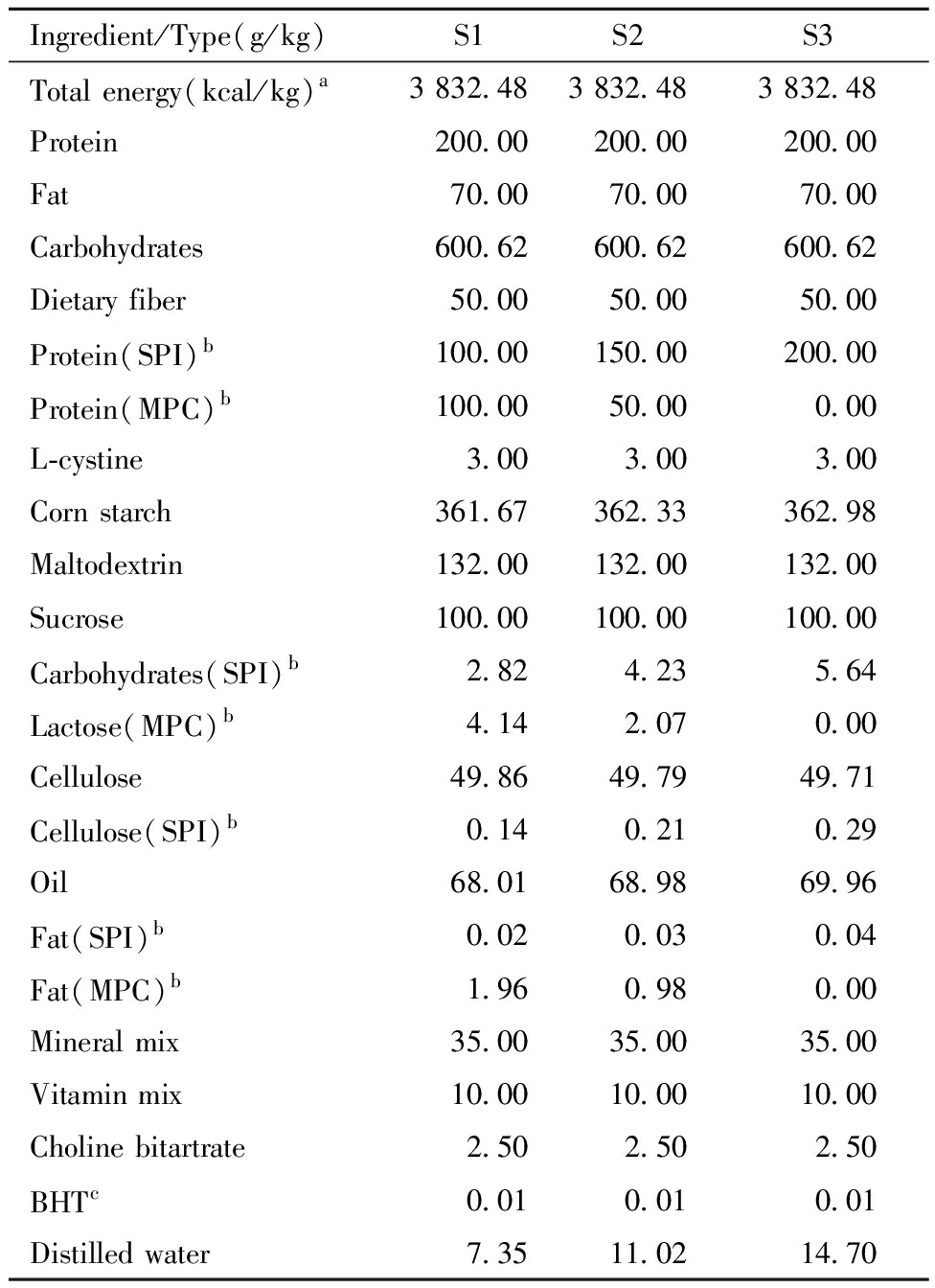
Ingredient/Type(g/kg)S1S2S3Total energy(kcal/kg)a3 832.483 832.483 832.48Protein200.00200.00200.00Fat70.0070.0070.00Carbohydrates600.62600.62600.62Dietary fiber50.0050.0050.00Protein(SPI)b100.00150.00200.00Protein(MPC)b100.0050.000.00L-cystine3.003.003.00Corn starch361.67362.33362.98Maltodextrin132.00132.00132.00Sucrose100.00100.00100.00Carbohydrates(SPI)b2.824.235.64Lactose(MPC)b4.142.070.00Cellulose49.8649.7949.71Cellulose(SPI)b0.140.210.29Oil68.0168.9869.96Fat(SPI)b0.020.030.04Fat(MPC)b1.960.980.00Mineral mix35.0035.0035.00Vitamin mix10.0010.0010.00Choline bitartrate2.502.502.50BHTc0.010.010.01Distilled water7.3511.0214.70
a All units are g/kg except that the total energy is kcal/kg; b SPI:soy protein isolate, MPC:milk protein concentrate; c BHT:dibutylhydroxytoluene,an food antioxidant
3.生物样本收集:GD18.5晚,每组按体重随机选取12只孕鼠,隔夜禁食后,乙醚麻醉处死,完整剥离子宫并逐只解剖胎鼠。从上丘和下丘处小心剥分胎鼠小脑,并剪除连接在脑干上的蒂。每5只胎鼠小脑混合为1份样本,每只孕鼠收集2份胎鼠小脑样本,立即液氮速冻后保存于-80 ℃超低温保存箱中。
其余孕鼠使其自然分娩,持续饲喂干预饲料至仔鼠出生后第21天(PD21)。PD2-3时,将每窝仔鼠数减少至10只,尽量雌雄各半。PD21晨,离乳仔鼠,每窝随机选取雌雄各1只仔鼠进行禁食,8小时后乙醚麻醉处死。从上丘和下丘处小心剥分胎鼠小脑,并剪除连接在脑干上的蒂。记录仔鼠性别,每只仔鼠小脑单独保存,共收集20份仔鼠小脑样本,同样立即液氮速冻后保存于-80℃超低温保存箱中。
本实验方案已获北京大学生物医学伦理委员会实验动物福利伦理分会委员审批(伦理批准号:LA2020440)。
五、非靶向代谢组学检测方法
1.样本前处理:简单随机选取来自10只不同孕鼠的10份胎鼠小脑,以及来自不同10窝的5只雄性、5只雌性仔鼠小脑进行非靶向代谢组学检测。4℃解冻后准确称取100 mg小脑组织,加入1000 μL冷乙腈,研磨,混悬液于冰浴中超声提取30 min,在12 000 rpm,4 ℃下离心10 min,取出100 μL在37 ℃下真空离心浓缩至干。残渣用100 μL乙腈溶解,于12 000 rpm,4 ℃下离心10 min,取上清液进样10 μL,用超高效液相色谱-串联质谱法(ultra-high performance liquid chromatography-mass spectrometry,UPLC-MS)进行检测。
2.色谱条件:色谱柱为Waters BEH HILIC Column(100×2.1mm, 1.7 μm)。柱温为35 ℃,流速为0.300 mL/min,流动相A:0.1%甲酸,1 mM乙酸铵溶液,流动相B:乙腈。洗脱程序为:0 min,A:5%、B:95%;8 min,A:50%、B:50%;10 min,A:50%、B:50%;12 min,A:95%、B:5%;15 min,A:5%、B:95%。
3.质谱条件:质谱则分别采用电喷雾电离(electrospray ionization, ESI)正离子和负离子模式进行检测。ESI源雾化气50 psi(1psi≈6.9 kPa),辅助气50 psi,气帘气25 psi,雾化温度:正离子500 ℃、负离子400 ℃,喷雾电压:正离子5 500 V、负离子4 400 V。TOF MS扫描范围100~1 200 Da,产物离子扫描范围50~1 000 Da。
4.质量控制:随机选取胎鼠小脑及仔鼠小脑前处理后上清液各5份,少量等体积混合后制得质控(QC)样本,每检测10例样本后插入1例QC样本,通过QC样本的重现性和稳定性评估仪器状态及方法可靠性。
六、统计学方法
通过Analysis Base File Converter软件将原始数据转换成ABF格式,导入MS-DIAL 4.60预处理后得到原始数据矩阵。对MassBank,Respect,GNPS三个数据库进行全库检索,将提取的峰信息与数据库进行比对,鉴定样本中所包含的代谢物种类。
使用主成分分析(principal component analysis, PCA)观察各样本总体代谢轮廓及样本间的天然区分情况,然后用偏最小二乘判别分析(partial least-squares discrimination analysis, PLS-DA)区分各组间代谢轮廓的总体差异,并计算各代谢物的变量投影重要性(variable importance for the projection, VIP),通过置换检验判断PLS-DA模型的过拟合情况;同时计算不同组间代谢物的差异倍数(fold change, FC),并应用t检验判断组间代谢物水平有无统计学差异。综合VIP值、FC、t检验结果,筛选出各实验组间的差异代谢物,本研究中的筛选标准为:VIP>1且组间差异倍数FC>1.5或<2/3且t检验中P值<0.05。筛选出组间差异代谢物后,比较不同组间有无共同差异代谢物,并对原始特征离子响应强度行趋势方差分析,趋势方差分析中采用Bonferroni方法进行多重校正检验。上述数据分析均采用R4.1.2完成。
结 果
一、一般情况
S1、S2、S3组孕鼠GD0.5至GD18.5平均增重依次为(130.2±18.3)g、(137.4±16.8)g、(133.9±17.5)g(依次n=10, 11, 11);PD21日仔鼠离乳时平均体重依次为(52.2±4.4)g、(53.9±5.3)g、(52.6±4.3)g(依次n=20, 20, 22)。孕鼠孕期增重及仔鼠离乳体重三组间均不存在统计学差异。
各组间胎鼠小脑及仔鼠小脑样本的PCA得分图如图1所示。结果表明胎鼠小脑中仅S1组与S3蛋白组间代谢轮廓有一定天然区分;而仔鼠小脑中,S1组与S2组或S3组间代谢轮廓均有一定天然区分。
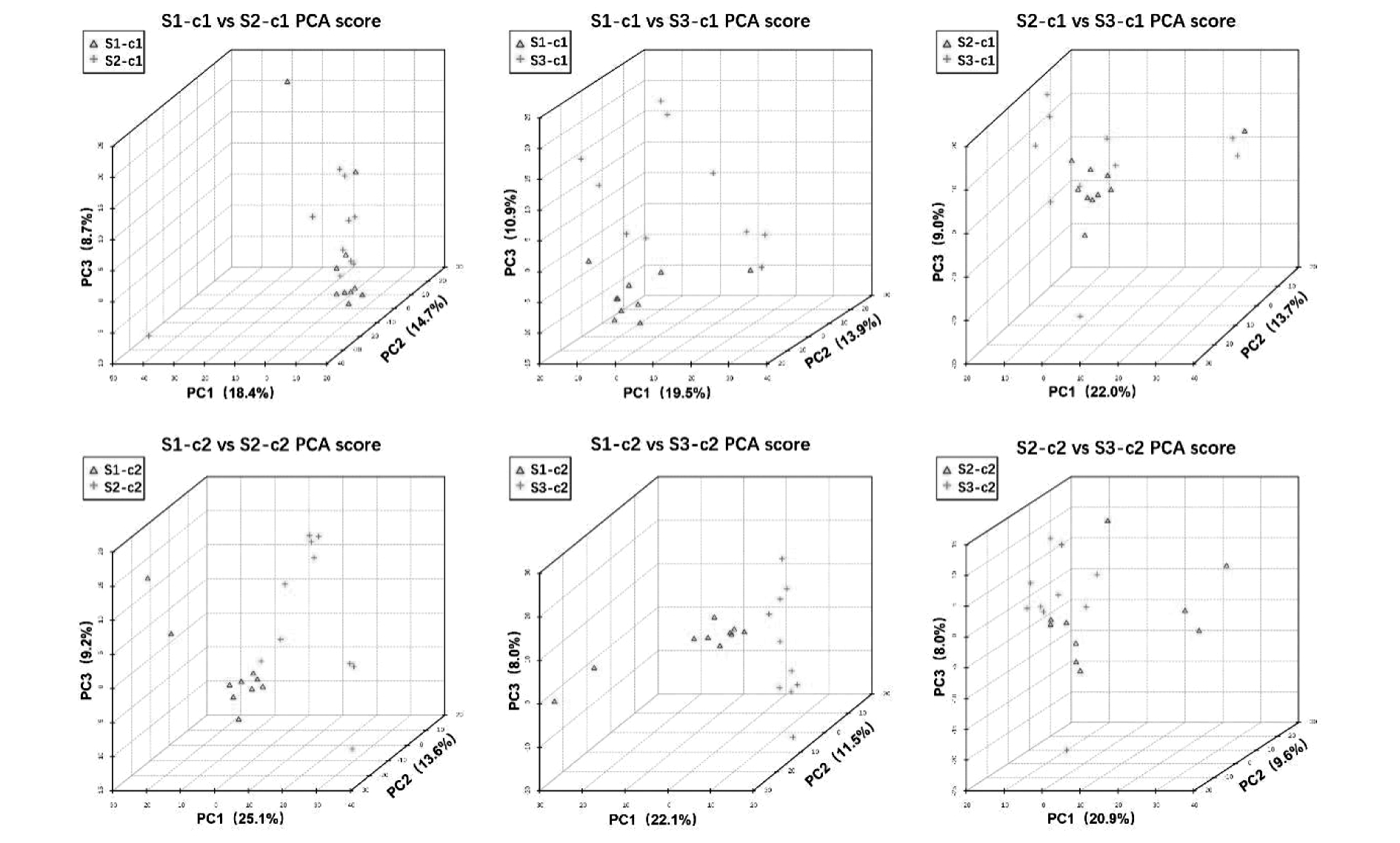
图1 各组样本间PCA得分图 c1:胎鼠小脑,c2:仔鼠小脑,n=10
Figure 1 PCA scores between samples in each group c1:fetal rat cerebellum, c2:offspring rat cerebellum, n=10
二、差异代谢物筛选
为寻找两组仔鼠血浆及小脑间对分类贡献最大的潜在小分子代谢物,进一步对样本数据进行PLS-DA分析,并对PLS-DA模型进行置换检验。各组样本间PLS-DA得分图如图2所示,置换检验结果则如表2所示。
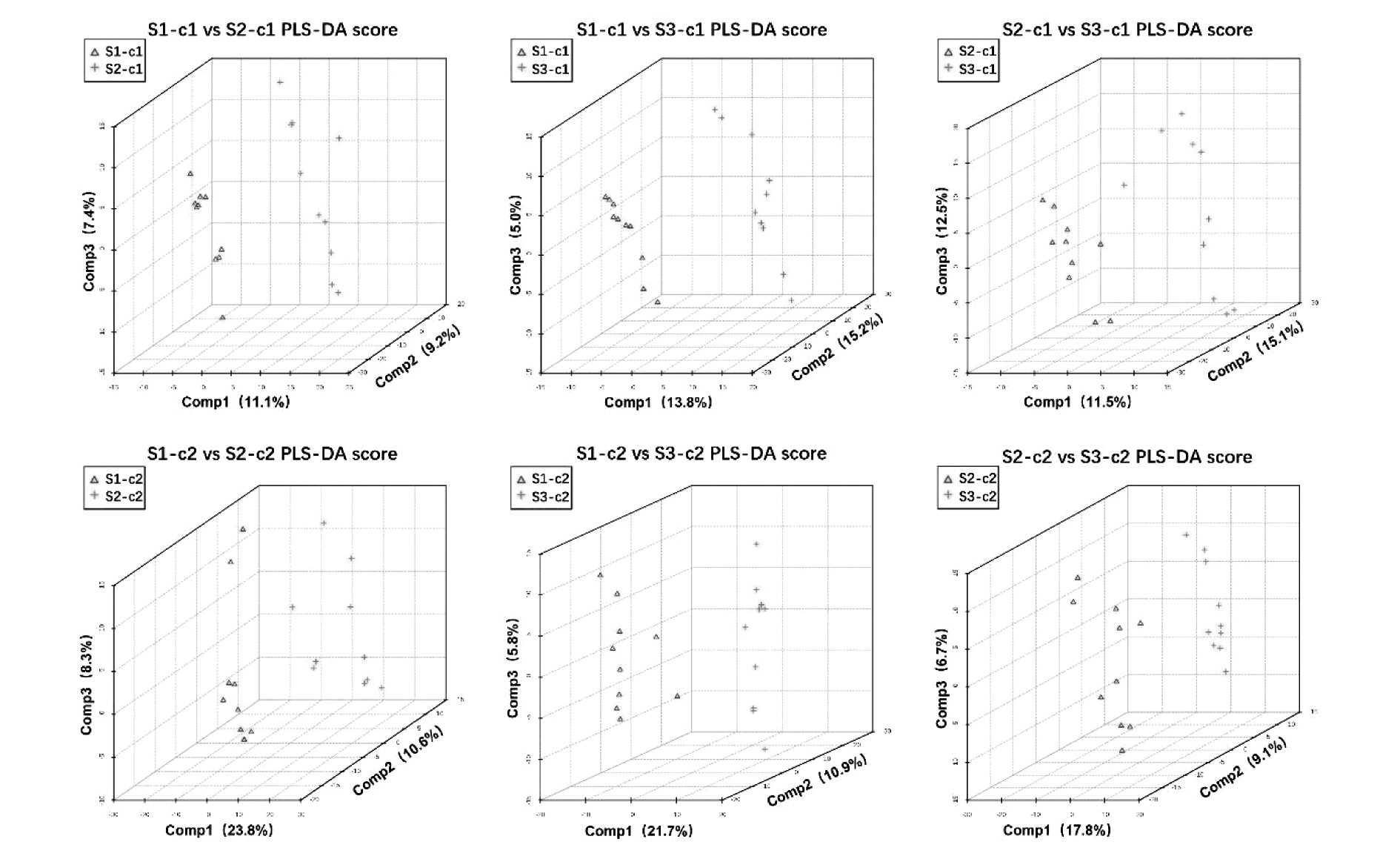
图2 各组样本间PLS-DA得分图 c1:胎鼠小脑,c2:仔鼠小脑,n=10
Figure 2 PLS-DA scores between samples in each group c1:fetal rat cerebellum, c2:offspring rat cerebellum, n=10
进行PLS-DA分析后,两组血浆及小脑样本均得到完全分离。置换检验中,模型的R2及Q2越接近于1,过拟合现象越轻微。一般认为小样本时若R2及Q2均大于0.2,则模型的过拟合程度可以接受。置换检验结果表明,在针对胎鼠小脑及仔鼠小脑进行分析的过程中,S2与S3组间的PLS-DA模型均存在一定过拟合现象,不再适宜进行后续差异代谢物的筛选。
表2 PLS-DA模型的置换检验结果a
Table 2 Permutation test results of PLS-DA
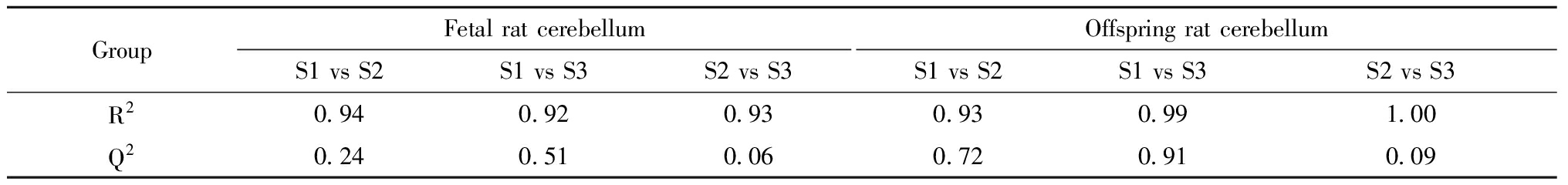
GroupFetal rat cerebellumS1 vs S2S1 vs S3S2 vs S3Offspring rat cerebellumS1 vs S2S1 vs S3S2 vs S3R20.940.920.930.930.991.00Q20.240.510.060.720.910.09
综合PLS-DA分析结果,以及FC和t检验结果,筛选出两组间相对含量存在显著性差异的代谢物。依据质谱数据库信息,对所鉴定的差异代谢物进行初步分类,排除其中来源于植物的活性物质及确证的外源性药物成分,各组胎鼠小脑及仔鼠小脑样本间潜在内源性差异代谢物如表3及表4所示。两组小脑间内源性差异代谢物包括多种氨基酸及衍生物、维生素及衍生物、多种其它活性物质。
表3 各组胎鼠小脑间内源性差异代谢物
Table 3 Endogenous differential metabolites between fetal rat cerebellum in each group
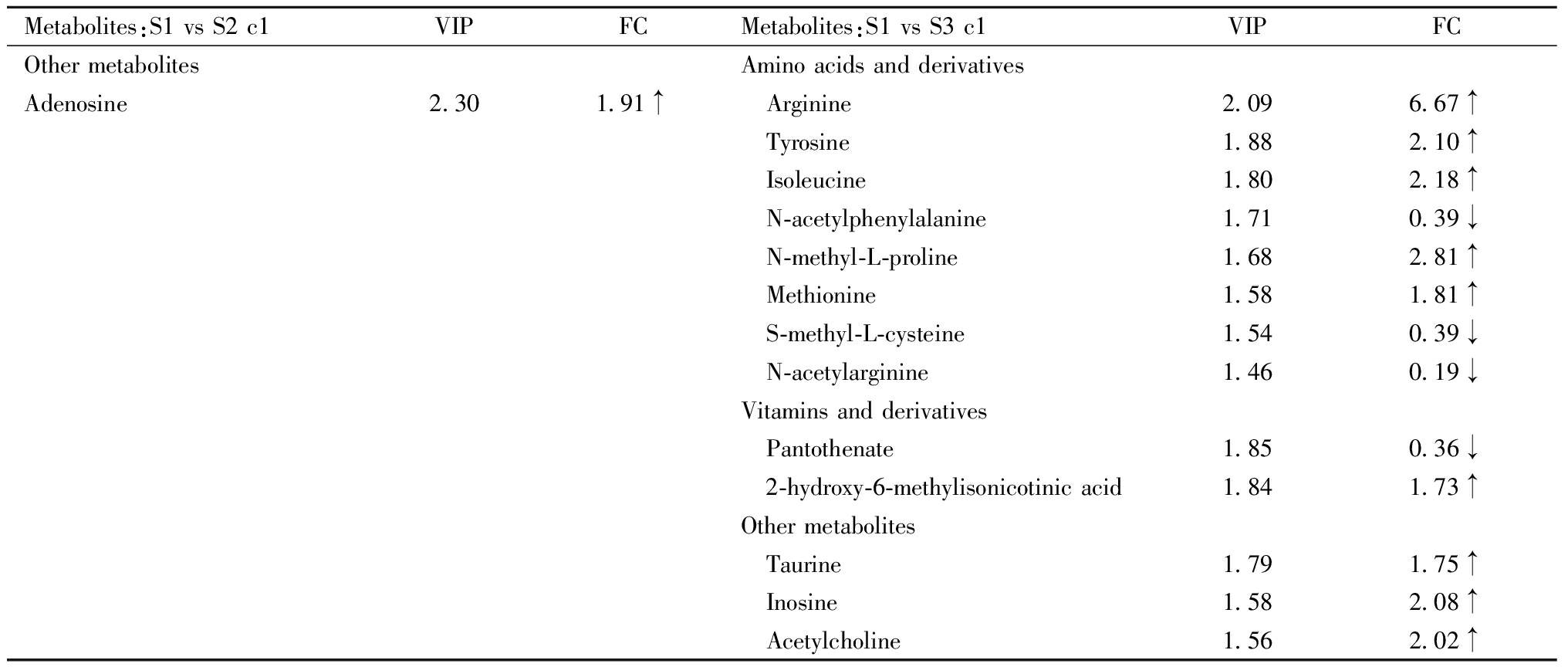
Metabolites:S1 vs S2 c1VIPFCMetabolites:S1 vs S3 c1VIPFCOther metabolitesAmino acids and derivativesAdenosine2.301.91↑ Arginine2.096.67↑ Tyrosine1.882.10↑ Isoleucine1.802.18↑ N-acetylphenylalanine1.710.39↓ N-methyl-L-proline1.682.81↑ Methionine1.581.81↑ S-methyl-L-cysteine1.540.39↓ N-acetylarginine1.460.19↓Vitamins and derivatives Pantothenate1.850.36↓ 2-hydroxy-6-methylisonicotinic acid1.841.73↑Other metabolites Taurine1.791.75↑ Inosine1.582.08↑ Acetylcholine1.562.02↑
表4 各组仔鼠小脑间内源性差异代谢物
Table 4 Endogenous differential metabolites between offspring rat cerebellum in each group
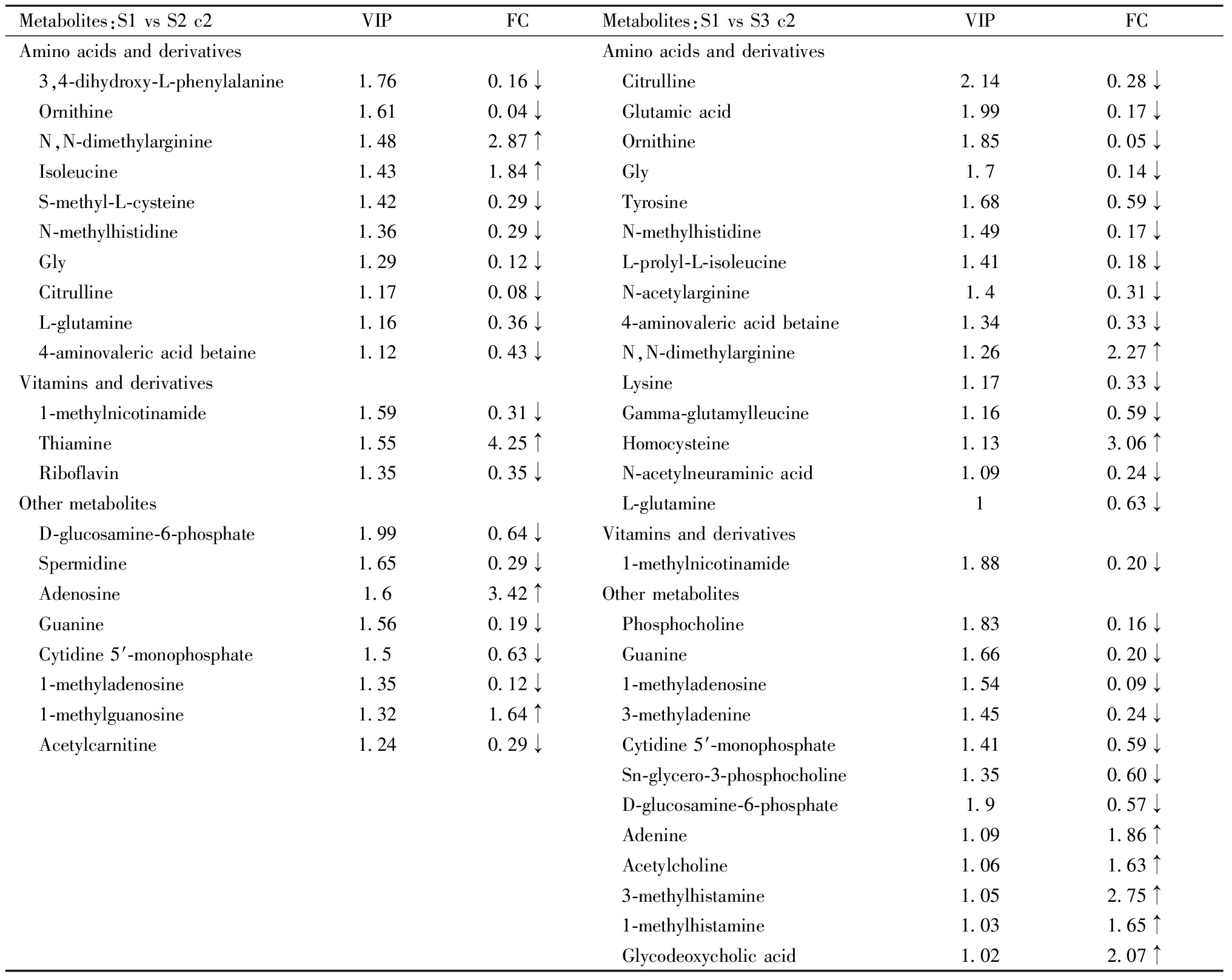
Metabolites:S1 vs S2 c2VIPFCMetabolites:S1 vs S3 c2VIPFCAmino acids and derivativesAmino acids and derivatives 3,4-dihydroxy-L-phenylalanine1.760.16↓ Citrulline2.140.28↓ Ornithine1.610.04↓ Glutamic acid1.990.17↓ N,N-dimethylarginine1.482.87↑ Ornithine1.850.05↓ Isoleucine1.431.84↑ Gly1.70.14↓ S-methyl-L-cysteine1.420.29↓ Tyrosine1.680.59↓ N-methylhistidine1.360.29↓ N-methylhistidine1.490.17↓ Gly1.290.12↓ L-prolyl-L-isoleucine1.410.18↓ Citrulline1.170.08↓ N-acetylarginine1.40.31↓ L-glutamine1.160.36↓ 4-aminovaleric acid betaine1.340.33↓ 4-aminovaleric acid betaine1.120.43↓ N,N-dimethylarginine1.262.27↑Vitamins and derivatives Lysine1.170.33↓ 1-methylnicotinamide1.590.31↓ Gamma-glutamylleucine1.160.59↓ Thiamine1.554.25↑ Homocysteine1.133.06↑ Riboflavin1.350.35↓ N-acetylneuraminic acid1.090.24↓Other metabolites L-glutamine10.63↓ D-glucosamine-6-phosphate1.990.64↓Vitamins and derivatives Spermidine1.650.29↓ 1-methylnicotinamide1.880.20↓ Adenosine1.63.42↑Other metabolites Guanine1.560.19↓ Phosphocholine1.830.16↓ Cytidine 5′-monophosphate1.50.63↓ Guanine1.660.20↓ 1-methyladenosine1.350.12↓ 1-methyladenosine1.540.09↓ 1-methylguanosine1.321.64↑ 3-methyladenine1.450.24↓ Acetylcarnitine1.240.29↓ Cytidine 5′-monophosphate1.410.59↓ Sn-glycero-3-phosphocholine1.350.60↓ D-glucosamine-6-phosphate1.90.57↓ Adenine1.091.86↑ Acetylcholine1.061.63↑ 3-methylhistamine1.052.75↑ 1-methylhistamine1.031.65↑ Glycodeoxycholic acid1.022.07↑
三、共有差异代谢物的进一步分析
进一步分析不同组间共有的差异代谢物。其中胎鼠小脑间未见共有的差异代谢物,仔鼠小脑间共有差异代谢物的特征离子平均相对相应强度、趋势检验结果如表5所示,趋势检验结果进行了多重校正检验。
表5 仔鼠小脑间共有差异代谢物的质谱响应强度及趋势检验结果a
Table 5 The mass spectral response intensity and trend test results of common differential metabolites in the cerebellum of offspring rata
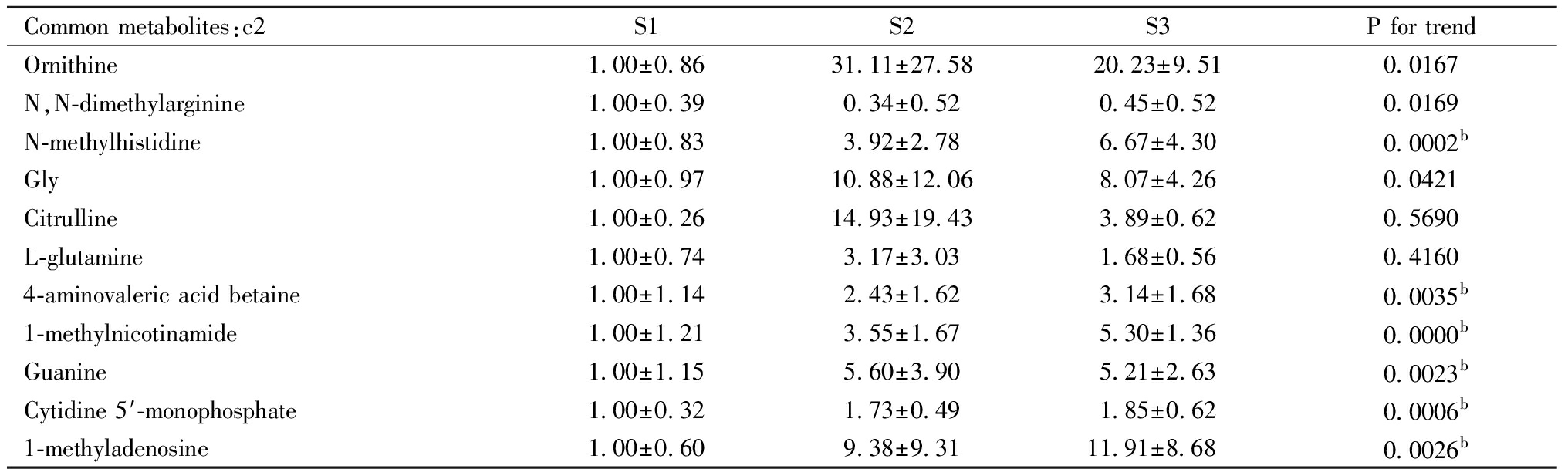
Common metabolites:c2S1S2S3P for trendOrnithine1.00±0.8631.11±27.5820.23±9.510.0167N,N-dimethylarginine1.00±0.390.34±0.520.45±0.520.0169N-methylhistidine1.00±0.833.92±2.786.67±4.300.0002bGly1.00±0.9710.88±12.068.07±4.260.0421Citrulline1.00±0.2614.93±19.433.89±0.620.5690L-glutamine1.00±0.743.17±3.031.68±0.560.41604-aminovaleric acid betaine1.00±1.142.43±1.623.14±1.680.0035b1-methylnicotinamide1.00±1.213.55±1.675.30±1.360.0000bGuanine1.00±1.155.60±3.905.21±2.630.0023bCytidine 5′-monophosphate1.00±0.321.73±0.491.85±0.620.0006b1-methyladenosine1.00±0.609.38±9.3111.91±8.68 0.0026b
a. The response intensity is described by mean ± standard deviation, and the average response intensity of the corresponding characteristic ions in S1 is used as the benchmark, n=10; b. Bonferroni correction, P<0.050/11=0.0045
趋势检验结果表明,N-甲基组氨酸(N-methylhistidine)、4-氨基戊酸甜菜碱(4-aminovaleric acid betaine)、1-甲基烟酰胺(1-methylnicotinamide)、鸟嘌呤(Guanine)、5-一磷酸胞苷(Cytidine 5′-monophosphate)、1-甲基腺苷(1-methyladenosine)等物质在仔鼠小脑中水平随大豆分离蛋白干预比例增加呈增加趋势。
讨 论
本研究使用不同比例浓缩牛乳蛋白及大豆分离蛋白的饲料对大鼠妊娠期及哺乳期进行了干预,并通过代谢组学方法探索GD19.5胎鼠小脑及PD21仔鼠小脑中的物质水平变化。结果表明胎鼠及仔鼠小脑中多种潜在活性物质水平发生了明显改变,且在仔鼠小脑中,随饲料中大豆分离蛋白的含量增加,N-甲基组氨酸、4-氨基戊酸甜菜碱、1-甲基烟酰胺、鸟嘌呤、5-一磷酸胞苷、1-甲基腺苷水平亦增加,并存在剂量反应关系。
既往探讨不同蛋白来源或其肽对神经系统影响的有关研究相对较少。有研究者曾探讨高蛋白饮食中,牛乳酪蛋白或大豆分离蛋白对成年小鼠血脑屏障的影响,结果发现高酪蛋白饮食对小鼠血脑屏障功能造成损害,但高大豆蛋白饮食则未发现此种现象[13];也有日本学者曾探讨大豆和酪蛋白衍生肽对成年小鼠大脑皮层、脑干、海马中酪氨酸和单胺神经递质代谢的影响,结果发现大豆蛋白和酪蛋白肽摄入对小鼠上述脑区中相关神经递质的代谢影响有所不同[14]。此外,稍早有国内研究发现对缺碘小鼠补充大豆蛋白可以降低脑组织受自由基损伤的程度[15];细胞实验中也发现大豆蛋白肽可以减轻β-淀粉样蛋白肽诱导的小鼠原代海马神经元损伤[16]。在针对牛乳蛋白及其肽的研究中,则发现酪蛋白及其肽具有预防压力引起的应激行为及抗焦虑作用[7, 17];针对衰老、阿尔茨海默模型的小鼠的研究中,则发现了乳清蛋白肽的有利影响[18, 19]。综上,既往研究揭示了不同来源蛋白或其肽对神经系统功能的作用差异,功能差异往往与物质基础改变有关,尤其是发育阶段形成的物质结构变化,但目前尚无研究探讨不同来源蛋白对发育中的神经系统的代谢组学影响。
本研究中发现,蛋白来源中大豆蛋白比例增加使得仔鼠小脑中N-甲基组氨酸、4-氨基戊酸甜菜碱、1-甲基烟酰胺、鸟嘌呤、5-一磷酸胞苷、1-甲基腺苷等物质水平增加,且存在剂量反应关系。上述物质中,N-甲基组氨酸是组氨酸甲基化后的产物,然而目前罕有研究探讨组氨酸甲基化在蛋白质功能和细胞生理学中的作用,其对神经系统的可能影响也并不清楚[20]。4-氨基戊酸甜菜碱则是甜菜碱类化合物中的一种,甜菜碱又称为三甲基甘氨酸,被认为具有对抗氧化应激、调节能量代谢等多种功能[21]。近期研究中还发现甜菜碱可以预防阿尔茨海默模型小鼠中认知障碍的发展,并降低脑中的氧化应激水平及相关基因的表达[22-23]。1-甲基烟酰胺则是另一种可能对神经系统产生有利影响的物质,目前已经发现其可以拮抗外源性物质带来的神经炎症、凋亡以及伴随而来的认知能力下降[24-25]。鸟嘌呤、5-一磷酸胞苷、1-甲基腺苷则均属于嘌呤或嘧啶及其衍生物,很早人们就已意识到嘌呤能系统在哺乳动物中枢神经系统中可能具有重要功能[26]。目前研究发现鸟嘌呤及其核苷酸同样对神经系统具有有益作用,鸟苷被认为可以减少脑中的神经炎症、氧化应激和兴奋性毒性,并在神经元和神经胶质细胞中发挥营养作用[27]。近期研究同样发现鸟苷可以对抗抑郁作用,并在缺血性中风中起到保护作用[28-29]。腺嘌呤及其衍生物对神经系统的有关影响也有一些研究[28],但胞嘧啶及其衍生物的相关研究则相对很少。
在神经系统中,与具有更复杂的脑区分布和更复杂功能的大脑相比,小脑主要负责对运动功能进行调节,其结构功能均较为独立,在代谢组学研究中,有利于集中发现重要的线索。然而由于中枢神经系统各部分结构和功能存在差异,其代谢组也可能存在差别,故而本研究中发现的差异代谢物可能仅能表征胎鼠及仔鼠小脑的代谢组改变,而不能直接反应中枢其它部分的代谢组改变,需要进一步的研究来阐明。除此之外,本研究中采用非靶向代谢组学方法进行研究,无法获得对应物质的绝对定量水平,故而无法对胎鼠及仔鼠小脑中相应代谢物水平是否超出生理限度做出判断,也是本研究的不足之处之一。
综上所述,本研究通过代谢组学方法揭示了不同比例浓缩牛乳蛋白及大豆分离蛋白干预会对胎鼠及仔鼠小脑的代谢组产生影响,但其具体作用机制及这种差异的功能性影响还需要进一步的研究来阐明。
1 Chakrabarti S,Guha S,Majumder K.Food-derived bioactive peptides in human health:Challenges and opportunities.Nutrients,2018,10:1738.
2 Neinast M,Murashige D,Arany Z.Branched chain amino acids.Annu Rev Physiol,2019,81:139-164.
3 Xiao F,Guo F.Impacts of essential amino acids on energy balance.Mol Metab,2022,57:101393.
4 Choi S,Disilvio B,Fernstrom M H,et al.Meal ingestion,amino acids and brain neurotransmitters:effects of dietary protein source on serotonin and catecholamine synthesis rates.Physiol Behav,2009,98:156-162.
5 Snelson M,Mamo J C L,Lam V,et al.Differential effects of high-protein diets derived from soy and casein on blood-brain barrier integrity in wild-type mice.Front Nutr,2017,4:35.
6 Hino Y,Koyanagi A,Maebuchi M,et al.Comparison of the effect of soy and casein-derived peptide administration on tyrosine and catecholamine metabolism in the mouse brain.J Nutr Sci Vitaminol(Tokyo),2018,64:329-334.
7 Tang C H.Assembled milk protein nano-architectures as potential nanovehicles for nutraceuticals.Adv Colloid Interface Sci,2021,292:102432.
8 Xue H,Han J,He B,et al.Bioactive peptide release and the absorption tracking of casein in the gastrointestinal digestion of rats.Food Funct,2021,12:5157-5170.
9 Ma Y,Liu J,Shi H,et al.Isolation and characterization of anti-inflammatory peptides derived from whey protein.J Dairy Sci,2016,99:6902-6912.
10 Benoit S,Chaumontet C,Schwarz J,et al.Anxiolytic activity and brain modulation pattern of the alpha-casozepine-derived pentapeptide YLGYL in mice.Nutrients,2020,12:1497.
11 Chatterjee C,Gleddie S,Xiao C W.Soybean Bioactive Peptides and Their Functional Properties.Nutrients,2018,10:1211.
12 Yamada Y,Muraki A,Oie M,et al.Soymorphin-5,a soy-derived mu-opioid peptide,decreases glucose and triglyceride levels through activating adiponectin and PPARalpha systems in diabetic KKAy mice.Am J Physiol Endocrinol Metab,2012,302:E433-440.
13 Pak V V,Koo M,Kwon D Y,et al.Design of a highly potent inhibitory peptide acting as a competitive inhibitor of HMG-CoA reductase.Amino Acids,2012,43:2015-2025.
14 Mehdad A,Brumana G,Souza A A,et al.A Bowman-Birk inhibitor induces apoptosis in human breast adenocarcinoma through mitochondrial impairment and oxidative damage following proteasome 20S inhibition.Cell Death Discov,2016,2:15067.
15 孟献亚,张秀丽,蔡生花,等.大豆蛋白对缺碘小鼠脑组织抗氧化能力及甲状腺重量的影响.青海医药杂志,2007:3.
16 马永超,范文娟,饶淑梅,等.大豆肽减轻β-淀粉样蛋白肽诱导的小鼠原代海马神经元损伤.解剖学杂志,2020,43:7.
17 Joung J Y,Song J G,Kim H W,et al.Protective effects of milk casein on the brain function and behavior in a mouse model of chronic stress.J Agric Food Chem,2021,69:1936-1941.
18 Ano Y,Ohya R,Takaichi Y,et al.beta-Lactolin,a Whey-derived lacto-tetrapeptide,prevents Alzheimer′s disease pathologies and cognitive decline.J Alzheimers Dis,2020,73:1331-1342.
19 Yu X C,Li Z,Liu X R,et al.The Antioxidant effects of whey protein peptide on learning and memory improvement in aging mice models.Nutrients,2021,13:2100.
20 Kwiatkowski S,Drozak J.Protein Histidine Methylation.Curr Protein Pept Sci,2020,21:675-689.
21 Figueroa-Soto C G,Valenzuela-Soto E M.Glycine betaine rather than acting only as an osmolyte also plays a role as regulator in cellular metabolism.Biochimie,2018,147:89-97.
22 Ibi D,Tsuchihashi A,Nomura T,et al.Involvement of GAT2/BGT-1 in the preventive effects of betaine on cognitive impairment and brain oxidative stress in amyloid beta peptide-injected mice.Eur J Pharmacol,2019,842:57-63.
23 Ibi D,Hirashima K,Kojima Y,et al.Preventive effects of continuous betaine intake on cognitive impairment and aberrant gene expression in hippocampus of 3xTg mouse model of Alzheimer′s disease.J Alzheimers Dis,2021,79:639-652.
24 Fu L,Liu C,Chen L,et al.Protective effects of 1-methylnicotinamide on abeta1-42-induced cognitive deficits,neuroinflammation and apoptosis in mice.J Neuroimmune Pharmacol,2019,14:401-412.
25 Mu R H,Tan Y Z,Fu L L,et al.1-Methylnicotinamide attenuates lipopolysaccharide-induced cognitive deficits via targeting neuroinflammation and neuronal apoptosis.Int Immunopharmacol,2019,77:105918.
26 Schmidt A P,Lara D R,Souza D O.Proposal of a guanine-based purinergic system in the mammalian central nervous system.Pharmacol Ther,2007,116:401-416.
27 Bettio L E,Gil-Mohapel J,Rodrigues A L.Guanosine and its role in neuropathologies.Purinergic Signal,2016,12:411-426.
28 Almeida R F,Ferreira T P,David C V C,et al.Guanine-based purines as an innovative target to treat major depressive disorder.Front Pharmacol,2021,12:652130.
29 Chojnowski K,Opielka M,Nazar W,et al.Neuroprotective effects of guanosine in ischemic stroke-small steps towards effective therapy.Int J Mol Sci,2021,22:6898.