著名的“胎源假说”提出,儿童及成人期多种疾病与生命早期不良暴露有关[1]。近年来,育龄女性肥胖率和孕期过度增重率逐年上升至较高水平[2-3],孕前肥胖和孕期过度增重不仅增加母体妊娠期糖尿病、妊娠期高血压和产后出血等风险[4-5],而且对子代健康产生不良影响[6]。研究表明,孕产妇肥胖可影响脐带血中铁相关指标水平,如降低脐带血血清铁、铁蛋白等的水平,肥胖与铁相关指标的关联可能通过炎症途径介导[7-9]。然而,上述研究仅检测了脐带血中相关指标水平,未继续探究孕前肥胖和孕期过度增重对子代出生后炎性指标和铁相关指标的影响,且相关结果是否受到混杂因素影响尚未可知。本动物实验研究拟采用高脂饮食诱导母鼠孕前肥胖和孕期过度增重,探究母鼠孕前肥胖和孕期过度增重对子鼠铁相关指标的影响以及炎症反应的可能机制,为母体肥胖对子代健康影响提供依据。
对象与方法
一、实验动物与饲料
6周龄健康的SPF级Wistar雌性大鼠18只,购自北京维通利华实验动物技术有限公司[实验动物生产许可证:SCXK(京)2016-0006],饲养于北京大学医学部实验动物科学部[实验动物使用许可证号:SYXK(京)2016-0041],饲养环境安静,温度(22±2)℃,相对湿度50%~60%。交配用的SPF级Wistar雄性大鼠订购来源和饲养环境同上,共18只,13周龄,体重(380±20)g。
实验饲料分为标准饲料和高脂饲料。标准饲料为大小鼠生长繁殖饲料,购自北京科澳协力饲料有限公司,平均每克饲料供能3.44 kcal,63%能量由碳水化合物提供;高脂饲料为Research Diets D12492,即60%脂供能高脂饲料,购自北京凯国科技有限公司,平均每克饲料供能5.24 kcal,60%能量由脂质提供。所有实验动物均自由采食饲料和饮水。
二、方法
1.实验设计:18只SPF级Wistar雌性大鼠适应性饲喂1周后,采用随机数字表法以1∶1∶1的比例随机分为对照组(Con,n=6)、孕前肥胖组(Pre-obese,n=6)和孕期过度增重组(GWG,n=6),对照组全程饲喂标准饲料,孕前肥胖组于孕前6周起饲喂高脂饲料,孕期过度增重组仅于孕前10 d起饲喂高脂饲料、其余时期饲喂标准饲料(考虑大鼠孕期较短,故将孕期过度增重组的高脂饮食干预时间适当提前至受孕前10 d,以确保其孕前体重与对照组相当而孕期增重较之明显增加)。为控制哺乳期子鼠数量及性别比,在子鼠出生后第5天,将每窝别子鼠数量调整为6只,雌雄各半(性别根据子鼠肛门与生殖突的间距判断)。哺乳3周后母鼠乙醚麻醉处死,从每窝别子鼠中随机抽取2~3只子鼠纳入离乳后研究,每组12只(雌雄各半),共计36只。离乳后,所有子鼠均自由采食标准饲料和饮水,离乳21 d后子鼠乙醚麻醉处死(图1)。本实验方案通过了北京大学生物医学伦理委员会实验动物福利伦理分委会的审查。
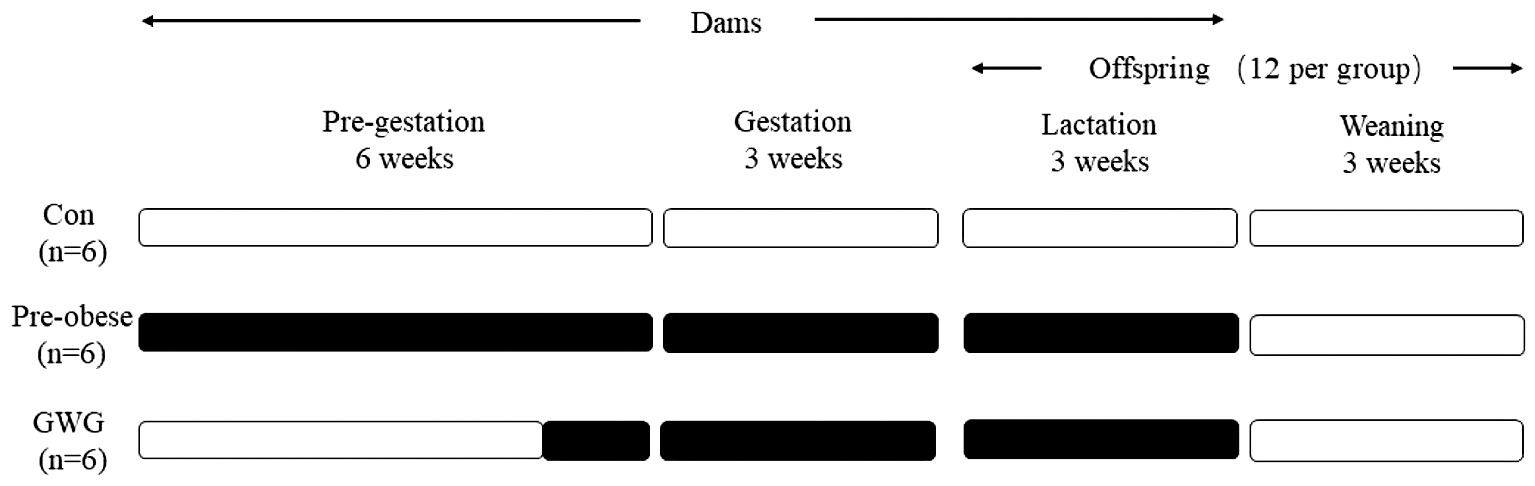
图1 实验设计(■高脂饲料;□标准饲料)
Figure 1 Experiment Design (■high-fat diet, □standard chow diet)
2.体重测量与血液采集:实验期间记录母鼠体重,母鼠孕前体重定义为与雄鼠第一次交配前的体重,孕期增重定义为孕期第19天与孕期第1天体重之差。子鼠出生后每周测量体重,离乳后第7天、14天和21天对子鼠进行眼眶内眦静脉血采集,每次采血量约1.0~1.2 mL,全血标本室温放置30 min后,1 500 g离心20 min,取上层血清,置于-80℃保存。
3.主要仪器与试剂:实验仪器主要包括电子天平(上海越平科学仪器有限公司)、高速离心机(Eppendorf Centrifuge 5424R)、酶标仪(Rayto RT-6100,450nm)和全自动血细胞分析仪(Nihon MEK-6400);全自动血细胞分析仪配套试剂主要包括稀释液MEK-640、溶血剂MEK-680、清洗液MEK-520和强力清洗液MEK-620;酶联免疫吸附试验(ELISA)试剂盒包括大鼠白细胞介素-6(interleukin-6,IL-6)、铁调素(hepcidin)和铁蛋白(ferritin)试剂盒,均购自北京冬歌博业有限公司。
4.实验室检测:采用ELISA试剂盒检测子鼠离乳后第7天、14天和21天血清中IL-6、铁调素和铁蛋白的水平,所有样本均重复测量。采用全自动血细胞分析仪检测子鼠离乳后第7天、14天和21天全血中血红蛋白(hemoglobin,Hgb)、平均血红蛋白量(mean corpuscular hemoglobin,Mch)和平均红细胞体积(mean corpuscular volume,Mcv)。
5.统计学处理:连续型变量以均值±标准差表示,采用单因素方差分析/Kruskal-Wallis H 检验探究大鼠体重与铁相关指标的组间差异,事后两两比较采用Bonferroni或LSD法;进一步采用最小二乘均值分析,探究在调整炎性指标后,子鼠离乳后铁相关指标的组间差异情况。数据分析采用R 4.0.0统计分析软件完成,检验水平为双侧α=0.05。
结 果
一、母鼠体重
孕前肥胖组母鼠孕前体重显著高于对照组[(327.7±27.0) g vs. (279.3±14.2)g,P<0.01](表1),提示高脂饮食诱导母鼠孕前肥胖效果良好。孕期过度增重组与对照组母鼠孕前体重差异无统计学意义,孕期过度增重组母鼠孕中后期体重增速快于对照组母鼠(图2),其孕期增重均值高于对照组的24.4%[(108.2±17.9 )g vs. (87.0±12.0) g]。
表1 母鼠孕前体重和孕期增重(Mean±SD,g)
Table 1 Maternal prepregnancy weight and gestational weight gain (Mean±SD, g)

GroupNPrepregnancy weightGestational weight gainCon6279.3±14.287.0±12.0Pre-obese6327.7±27.0∗∗#128.5±30.3∗GWG6291.8±29.3108.2±17.9
Compared with Con group, *P<0.05, **P<0.01; Compared with GWG group, #P<0.05; The dams with miscarriage or premature birth were excluded.
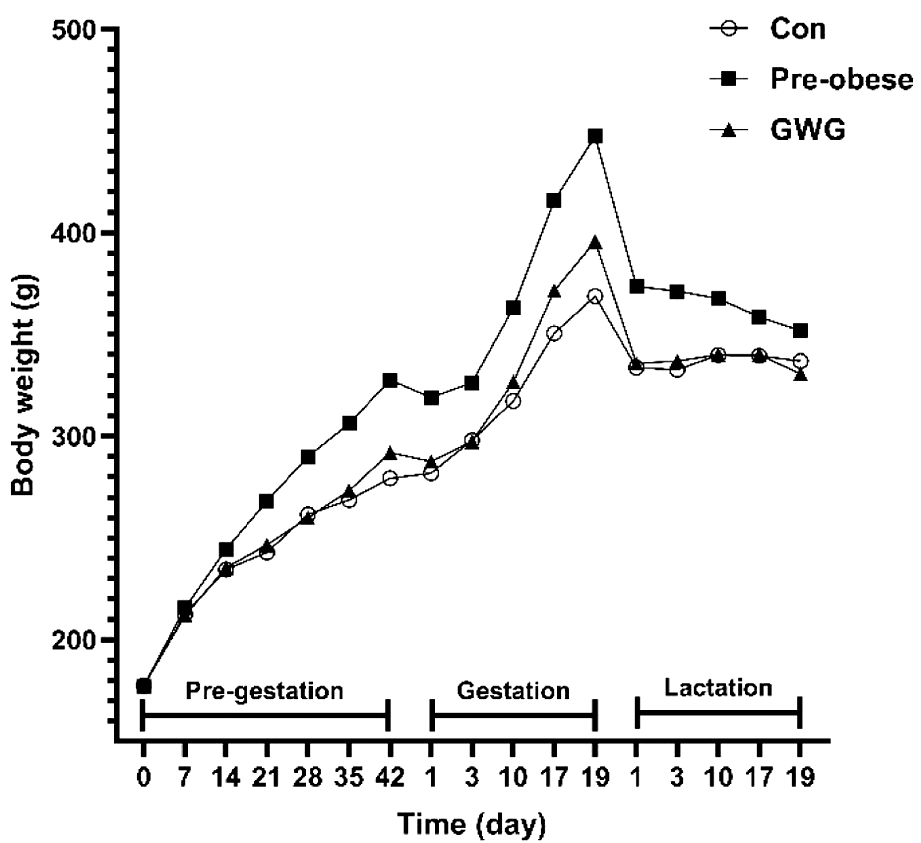
图2 母鼠孕前、孕期与哺乳期体重(Mean,g)
Figure 2 Maternal body weight during prepregnancy, pregnancy and lactation (Mean, g)
二、子鼠体重
孕前肥胖组和孕期过度增重组子鼠出生体重低于对照组子鼠,但组间差异无统计学意义;孕前肥胖组和孕期过度增重组子鼠哺乳期体重增长显著快于对照组(P<0.001),三组子鼠离乳后体重变化未见显著差异(表2)。
表2 子鼠出生后42 d内体重(Mean±SD,g)
Table 2 Body weight within 42 days after birth in offspring (Mean±SD, g)
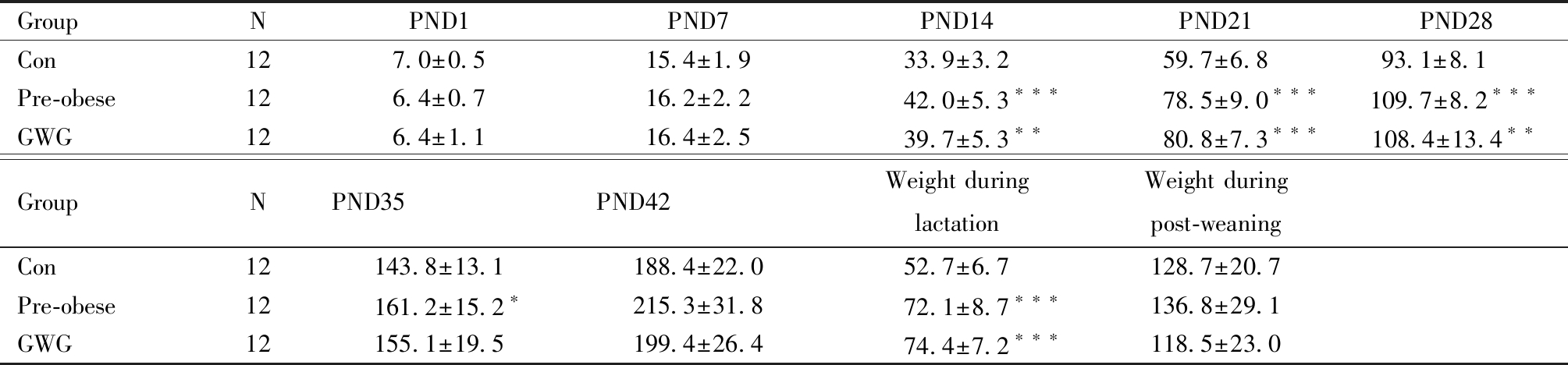
GroupNPND1PND7PND14PND21PND28Con127.0±0.515.4±1.933.9±3.259.7±6.893.1±8.1 Pre-obese126.4±0.716.2±2.242.0±5.3∗∗∗78.5±9.0∗∗∗109.7±8.2∗∗∗GWG126.4±1.116.4±2.539.7±5.3∗∗80.8±7.3∗∗∗108.4±13.4∗∗GroupNPND35PND42Weight duringlactationWeight duringpost-weaningCon12143.8±13.1188.4±22.052.7±6.7128.7±20.7Pre-obese12161.2±15.2∗215.3±31.872.1±8.7∗∗∗136.8±29.1GWG12155.1±19.5199.4±26.474.4±7.2∗∗∗118.5±23.0
Abbreviation:PND, postnatal day; Compared with Con group, *P<0.05, **P<0.01, ***P<0.001
三、子鼠离乳后炎性指标及铁相关指标
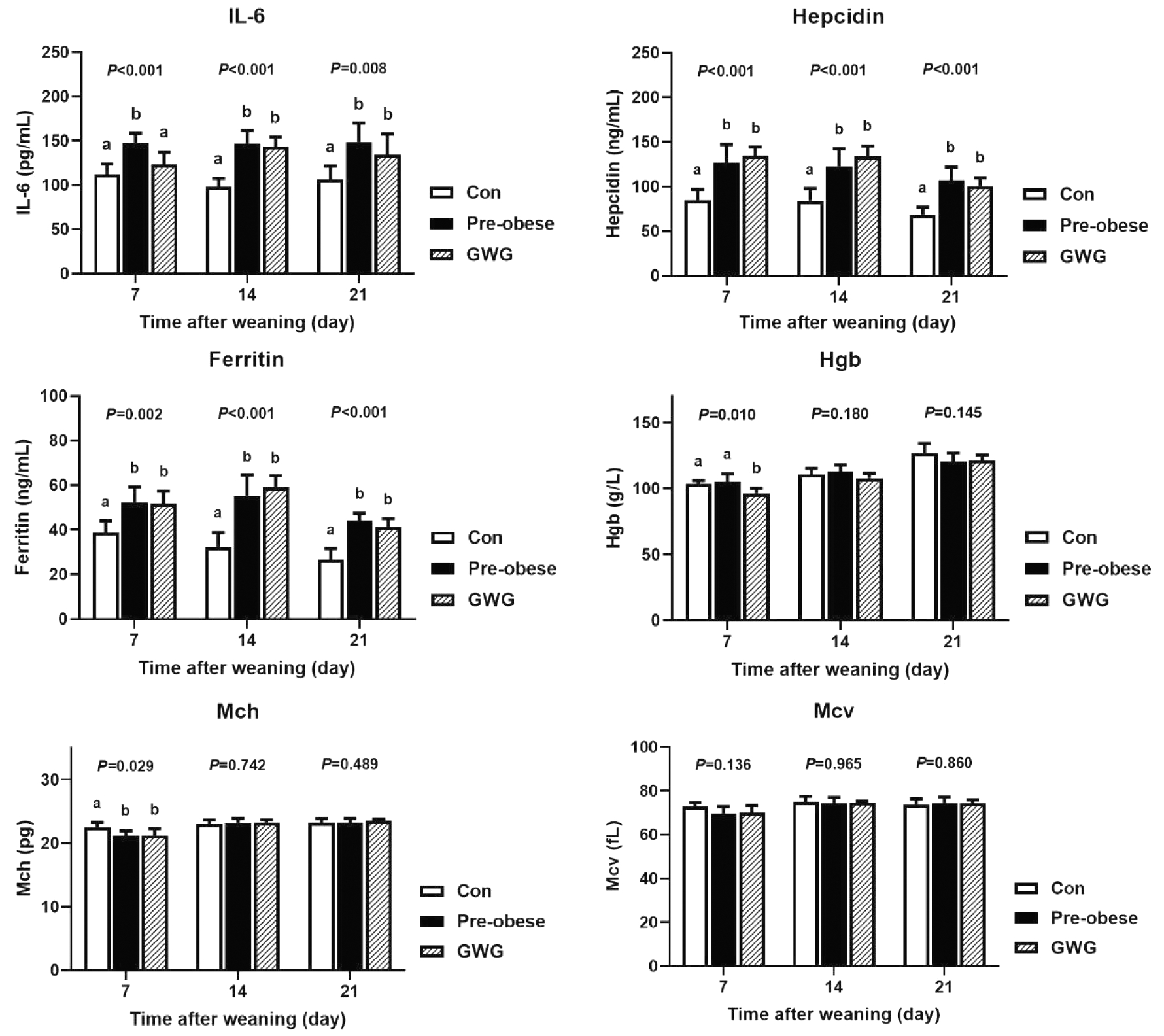
对于子鼠离乳后炎性指标,孕前肥胖组和孕期过度增重组子鼠离乳后第7天、14天和21天血清IL-6和铁调素水平较对照组均升高,且孕前肥胖组子鼠IL-6水平高于孕期过度增重组子鼠(图3和图4)。

abcSignificantly different by one-way ANOVA followed by Bonferroni or LSD post-hoc test (P<0.05).
图3 雄性子鼠离乳后21 d内铁相关指标水平(Mean±SD,n=6/组)
Figure 3 Iron-related indicators of male offspring within 21 days after weaning (Mean±SD, n=6/group)
abSignificantly different by one-way ANOVA followed by Bonferroni or LSD post-hoc test (P<0.05)
图4 雌性子鼠离乳后21 d内铁相关指标水平(Mean±SD,n=6/组)
Figure 4 Iron-related indicators of female offspring within 21 days after weaning (Mean±SD, n=6/group)
与对照组子鼠相比,孕前肥胖组和孕期过度增重组子鼠离乳后第7天、14天和21天血清铁蛋白水平均显著升高(P<0.05,图3和图4)。孕前肥胖组和孕期过度增重组雌性子鼠离乳后第7天全血铁相关指标有下降趋势,表现为孕前肥胖组雌性子鼠Mch水平偏低于对照组[(21.2±0.7) pg vs. (22.5±0.7)pg,P<0.05],孕期过度增重组雌性子鼠Hgb[(96.3±3.9 )g/L vs. (103.3±2.7)g/L]和Mch水平[(21.2±1.1) pg vs. (22.5±0.7)pg]偏低于对照组(P<0.05),两组雌性子鼠的Mcv水平略低于对照组,但差异不具有统计学意义(图4)。孕前肥胖组和孕期过度增重组雄性子鼠离乳后第7天、14天和21天全血Mch和Mcv水平略低于对照组,但差异均不具有统计学意义(图3)。
调整炎性指标IL-6和铁调素后,孕前肥胖组和孕期过度增重组雌性子鼠离乳后第7天铁蛋白和Hgb水平较对照组差异不再具有显著性,其他结果较调整前未见显著改变(表3)。
表3 雌性子鼠离乳后第7天铁相关指标最小二乘均值分析
Table 3 Least square mean analysis of iron-related indicators in female offspring on the 7th day after weaning
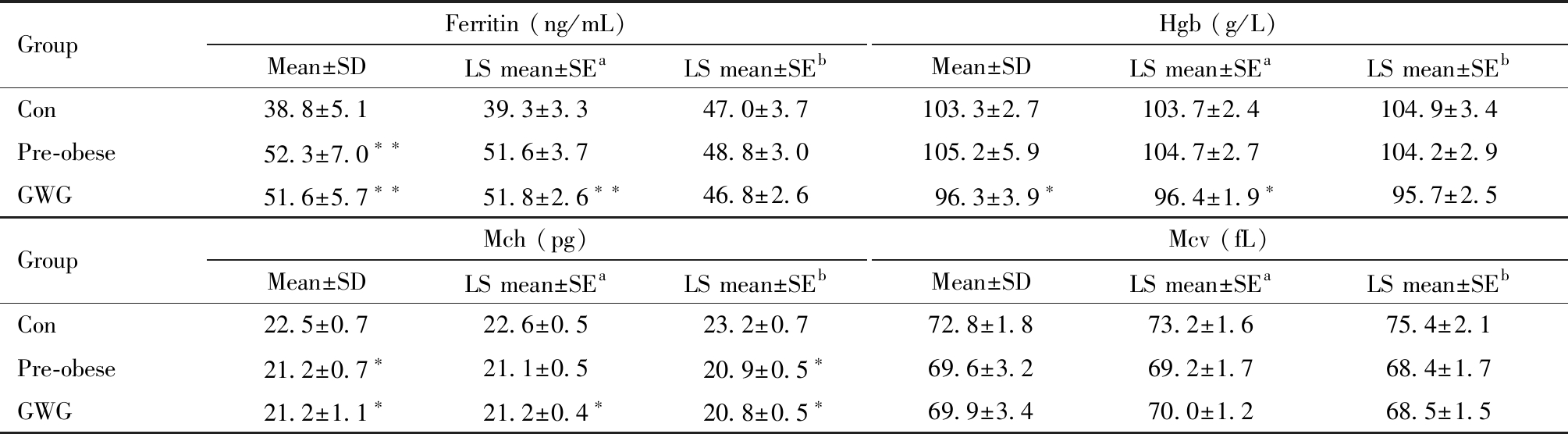
GroupFerritin (ng/mL)Mean±SDLS mean±SEaLS mean±SEbHgb (g/L)Mean±SDLS mean±SEaLS mean±SEbCon38.8±5.139.3±3.347.0±3.7103.3±2.7103.7±2.4104.9±3.4Pre-obese52.3±7.0∗∗51.6±3.748.8±3.0105.2±5.9104.7±2.7104.2±2.9GWG51.6±5.7∗∗51.8±2.6∗∗46.8±2.696.3±3.9∗96.4±1.9∗95.7±2.5GroupMch (pg)Mean±SDLS mean±SEaLS mean±SEbMcv (fL)Mean±SDLS mean±SEaLS mean±SEbCon22.5±0.722.6±0.523.2±0.772.8±1.873.2±1.675.4±2.1Pre-obese21.2±0.7∗21.1±0.520.9±0.5∗69.6±3.269.2±1.768.4±1.7GWG21.2±1.1∗21.2±0.4∗20.8±0.5∗69.9±3.470.0±1.268.5±1.5
a Adjusted for IL-6;b Adjusted for IL-6 and Hepcidin; LS: Least square; SE: standard error; Compared with Con group, * P<0.05, ** P<0.01
讨 论
动物模型已被广泛运用于饮食诱导肥胖的实验研究中,研究者常运用30%~60%脂供能高脂饲料诱导肥胖[10]。本研究采用60%脂供能高脂饲料诱导Wistar雌性大鼠孕前肥胖和孕期过度增重,孕前肥胖组孕前体重显著高于对照组,高脂饮食诱导母鼠孕前肥胖的效果良好;孕期过度增重组孕前体重与对照组相当而孕期增重较之明显增加,孕期增重均值超过对照组的24.4%。
本研究发现,孕前肥胖组和孕期过度增重组子鼠离乳后第7天、14天和21天IL-6水平高于对照组,提示肥胖子代血清炎症因子水平升高。谢润祥[11]、陈雪[12]等的研究提示,生命早期母体高脂饮食可诱导子代小鼠肠道低度炎症,血清炎症因子TNF-α和IL-12的水平升高,与本研究的结论一致。肥胖是一种慢性炎症状态,表现为脂肪细胞被巨噬细胞浸润,后者释放TNF-α、IL-6和IL-1β等促炎因子,而妊娠也被认为是一种低度慢性炎症状态,表现为母体白细胞活化、急性期反应物和细胞因子水平升高[13]。研究表明,孕期肥胖会增加妊娠的基础炎症状态,可能造成子代生命早期炎症环境[14]。
本研究发现,孕前肥胖与孕前过度增重组子鼠离乳后第7天、14天和21天血清铁调素水平升高。铁调素是近年来发现的一种主要由肝细胞分泌、含有25个氨基酸的抗菌多肽,可抑制铁释放到血液循环,在铁平衡中发挥负性调节作用[15]。有研究报道,JAK/STAT是人体炎症状态刺激铁调素表达升高的重要信号通路,IL-6通过JAK/STAT信号通路介导,升高人体铁调素水平[16]。铁调素升高不仅阻碍了十二指肠对膳食铁的吸收,而且阻碍巨噬细胞对铁的释放,使得体内循环铁的水平降低,进而降低了铁相关指标水平[17]。
然而,本研究中孕前肥胖组和孕期过度增重组子鼠离乳后血清铁蛋白水平不降反升。血清铁蛋白被视为评估人体内铁储存的常用指标,高血清铁蛋白水平代表人体铁储存水平高[18],但血清铁蛋白也是一种急性期反应物,受炎症等因素的影响,其高水平也在一定程度上反映慢性炎症和氧化应激的水平[19]。本研究发现,在调整炎性指标IL-6和铁调素后,子鼠血清铁蛋白水平组间差异未有统计学差异,提示孕前肥胖和孕期过度增重组子鼠血清铁蛋白水平的升高受炎症因子和铁调素影响,因此,在以血清铁蛋白评价机体铁储存时要考虑炎性指标。此外,Graf等[20]研究同样发现,母鼠高脂饮食可诱导子鼠急性神经炎症反应,子鼠出生时全脑组织IL-1β和TNF-α水平升高、铁调素和铁蛋白的水平也升高,与本研究结果相似,但Graf等[20]研究并未进一步评估子鼠出生后一段时期铁相关指标水平的变化。人群研究也显示,罹患Ⅱ型糖尿病等代谢综合征的肥胖人群铁蛋白水平升高[19]。
本研究还发现,孕前肥胖组雌性子鼠离乳后第7天Mch水平低于对照组,孕期过度增重组雌性子鼠离乳后第7天Hgb水平和Mch水平低于对照组。目前少数几项关于孕期肥胖与子代贫血的研究均为人群队列研究且结果不尽一致,尹韶华等[21-22] 的研究表明,肥胖/孕期过度增重孕妇的子代6/12月龄Hgb水平下降、贫血风险增加;而Cao等[23]的研究显示,孕前BMI和孕期增重不影响子代Hgb水平;也有研究发现[8, 24],肥胖孕妇分娩新生儿脐带血Hgb水平升高、而组织铁贮存下降。上述人群队列研究的结果差异很可能是因为人群不同及混杂因素的影响,本动物实验结果为孕期肥胖可能增加子代贫血风险提供了因果关联证据。本研究还发现,调整炎症相关指标后,母鼠肥胖对子代铁蛋白和Hgb的影响不再显著,提示炎症反应可能是孕期肥胖增加子代贫血风险的机制之一。
本研究提示,母鼠孕期肥胖对子鼠铁相关指标的影响具有性别差异,铁相关指标水平降低在雌性子鼠中尤为明显。既往研究表明,雌性子代可能更易受饮食因素的影响而出现肥胖[25],且母鼠哺乳期肥胖对雌性子鼠性腺肥胖产生不良影响[26]。胎盘对孕期营养的反应、性激素与代谢激素的作用、表观基因组均可能对性别特异性编程产生影响[27]。
综上所述,母鼠孕前肥胖和孕期过度增重影响雌性子鼠离乳后铁相关指标,炎症反应是可能机制之一。本动物实验也存在一定局限性,本研究中孕期过度增重组孕期增重均值超过对照组的24.4%,但组间差异无统计学意义,可能原因为样本量不充足(n=6/组)导致检验效能下降,进而可能低估母鼠孕期过度增重对子代铁相关指标的影响效应;此外,本研究也未能评估母鼠饲料摄入量与铁元素摄入量对研究结果的影响。
1 Fleming TP,Velazquez MA,Eckert JJ.Embryos,DOHaD and David Barker.J Dev Orig Health Dis,2015,6:377-383.
2 NCD Risk Factor Collaboration (NCD-RisC).Trends in adult body-mass index in 200 countries from 1975 to 2014:a pooled analysis of 1698 population-based measurement studies with 19·2 million participants.Lancet,2016,387:1377-1396.
3 Goldstein RF,Abell SK,Ranasinha S,et al.Gestational weight gain across continents and ethnicity:systematic review and meta-analysis of maternal and infant outcomes in more than one million women.BMC Med,2018,16:153.
4 Scott-Pillai R,Spence D,Cardwell CR,et al.The impact of body mass index on maternal and neonatal outcomes:a retrospective study in a UK obstetric population,2004-2011.BJOG,2013,120:932-939.
5 Gilmore LA,Klempel-Donchenko M,Redman LM.Pregnancy as a window to future health:Excessive gestational weight gain and obesity.Semin Perinatol,2015,39:296-303.
6 Catalano PM,Shankar K.Obesity and pregnancy:mechanisms of short term and long term adverse consequences for mother and child.BMJ,2017,356:j1.
7 Dosch NC,Guslits EF,Weber MB,et al.Maternal Obesity Affects Inflammatory and Iron Indices in Umbilical Cord Blood.J Pediatr,2016,172:20-28.
8 Korlesky C,Kling PJ,Pham D,et al.Cord Blood Erythropoietin and Hepcidin Reflect Lower Newborn Iron Stores due to Maternal Obesity during Pregnancy.Am J Perinatol,2019,36:511-516.
9 张增秀,彭俊铮,李少霞.孕期肥胖与新生儿缺铁性贫血的关系.现代医院,2017,17:206-210.
10 Buettner R,Schölmerich J,Bollheimer LC.High-fat diets:modeling the metabolic disorders of human obesity in rodents.Obesity (Silver Spring),2007,15:798-808.
11 谢润祥,曹海龙,黄欣远,等.生命早期母体高脂饮食诱导子代小鼠肠道低度炎症对肠黏膜屏障的影响.中华临床营养杂志,2018,26:361-365.
12 陈雪,张玉媛,王允,等.孕期和/或哺乳期高脂饮食暴露对仔鼠糖脂代谢和炎性因子的影响.营养学报,2020,42:350-355.
13 Sacks GP,Seyani L,Lavery S,et al.Maternal C-reactive protein levels are raised at 4 weeks gestation.Hum Reprod,2004,19:1025-1030.
14 Challier JC,Basu S,Bintein T,et al.Obesity in pregnancy stimulates macrophage accumulation and inflammation in the placenta.Placenta,2008,29:274-281.
15 Ganz T,Nemeth E.Hepcidin and iron homeostasis.Biochim Biophys Acta,2012,1823:1434-1443.
16 Wrighting DM,Andrews NC.Interleukin-6 induces hepcidin expression through STAT3.Blood,2006,108:3204-3209.
17 Koenig MD,Tussing-Humphreys L,Day J,et al.Hepcidin and iron homeostasis during pregnancy.Nutrients,2014,6:3062-3083.
18 Walters GO,Miller FM,Worwood M.Serum ferritin concentration and iron stores in normal subjects.J Clin Pathol,1973,26:770-772.
19 Aigner E,Feldman A,Datz C.Obesity as an emerging risk factor for iron deficiency.Nutrients,2014,6:3587-3600.
20 Graf AE,Lallier SW,Waidyaratne G,et al.Maternal high fat diet exposure is associated with increased hepcidin levels,decreased myelination,and neurobehavioral changes in male offspring.Brain Behav Immun,2016,58:369-378.
21 Yin S,Zhou Y,Li H,et al.Association of maternal BMI during early pregnancy with infant anemia:a large Chinese birth cohort.Nutr Metab (Lond),2020,17:32.
22 Yin S,Zhou Y,Li H,et al.Association of gestational weight gain rate with infant anaemia in China:a birth cohort study.Br J Nutr,2020,124:1285-1292.
23 Cao C,Pressman EK,Cooper EM,et al.Prepregnancy Body Mass Index and Gestational Weight Gain Have No Negative Impact on Maternal or Neonatal Iron Status.Reprod Sci,2016,23:613-622.
24 Phillips AK,Roy SC,Lundberg R,et al.Neonatal iron status is impaired by maternal obesity and excessive weight gain during pregnancy.J Perinatol,2014,34:513-518.
25 Bayol SA,Simbi BH,Bertrand JA,et al.Offspring from mothers fed a 'junk food' diet in pregnancy and lactation exhibit exacerbated adiposity that is more pronounced in females.J Physiol,2008,586:3219-3230.
26 George G,Draycott S,Muir R,et al.Exposure to maternal obesity during suckling outweighs in utero exposure in programming for post-weaning adiposity and insulin resistance in rats.Sci Rep,2019,9:10134.
27 Dearden L,Bouret SG,Ozanne SE.Sex and gender differences in developmental programming of metabolism.Mol Metab,2018,15:8-19.