产前皮质类固醇治疗在降低34周之内早产儿呼吸和神经系统疾病发病率及围产期死亡率方面的益处已得到充分证实[1]。最近的研究证据支持将产前糖皮质激素的应用范围扩展至晚期早产儿[2]。然而,由于缺乏应用产前糖皮质激素的晚期早产儿长期随访的数据,阻碍了该策略的广泛实施。
糖尿病母亲的婴儿发生呼吸系统疾病和低血糖的风险更高,但在晚期早产儿产前类固醇试验中,妊娠前糖尿病患者被排除在外,而妊娠期糖尿病患者也仅占该试验总样本的10.8%左右[3]。因此,产前皮质类固醇对糖尿病母亲的晚期早产儿风险和益处证据有限[4]。但数据显示,在临床实践中,超过一半(55%~80%)的产科医生在管理患有妊娠前或妊娠期糖尿病有晚期早产风险的孕妇时会给予皮质类固醇治疗[5]。国内指南也推荐对妊娠期血糖控制未达到理想水平的糖尿病患者,建议在产前给予1个疗程的糖皮质激素治疗[6]。到目前为止,关于糖尿病母亲使用皮质类固醇后对晚期早产儿的新生儿结局的影响,现有研究数据仍然很少。
本研究的目的是回顾性分析本院糖尿病母亲的晚期早产儿产前糖皮质激素应用情况,探讨其使用模式与非糖尿病母亲早产儿之间的差异及产前糖皮质激素对糖尿病母亲的晚期早产儿呼吸系统疾病及低血糖等短期结局的影响。
对象与方法
1.研究对象:2016年1月至2021年12月本院产科分娩的631例晚期早产儿作为研究对象。纳入标准包括(1)出生胎龄34~36 + 6周;(2)单胎妊娠。排除标准包括(1)胎儿先天畸形及染色体异常;(2)母亲绒毛膜羊膜炎的妊娠;(3)因母亲并发症或合并症孕期使用糖皮质激素治疗者;(4)出生后因各种原因转至其他医院治疗,不能获得详细病历资料者。根据母亲是否合并妊娠前或妊娠期糖尿病分为糖尿病母亲组和非糖尿病母亲组,糖尿病母亲组183例,非糖尿病母亲组448例。根据是否使用产前糖皮质激素将两组进一步分为激素组和对照组,糖尿病母亲激素组68例,糖尿病母亲对照组115例,非糖尿病母亲激素组121例,非糖尿病母亲对照组327例。
2.资料的收集:从本院电子病历系统中提取出孕产妇人口学特征及其妊娠结局,包括年龄、产次、分娩时的胎龄、分娩方式、孕期并发症及是否胎膜早破、产前地塞米松的使用情况、生后72 h内血糖值、是否发生呼吸系统疾病、是否使用呼吸支持。产前糖皮质激素给药方案是地塞米松每次6 mg,肌肉注射,每12 h1次,共4次[7]。呼吸系统疾病主要包括湿肺、羊水吸入、呼吸暂停、新生儿呼吸窘迫综合征等。诊断标准参照《实用新生儿学》(第5版)[8]。低血糖症的定义为血糖水平低于40 mg/dL(2.2 mmol/L)[8]。呼吸支持定义为新生儿出生后需要使用以下一项或多项辅助通气,如鼻导管吸氧、无创通气(经鼻持续气道正压通气、经鼻双水平气道正压通气、经鼻间歇正压通气)、气管插管有创机械通气。
3.统计学处理:应用SPSS 23.0软件进行数据分析。符合正态分布的计量资料以均数±标准差![]() 表示,组间比较采用独立样本t检验;非正态分布的计量资料采用中位数及四分位数间距[P50(P25,P75)]表示,组间比较采用Mann-Whitne U检验;计数资料以例数和百分率(%)表示,组间比较采用卡方检验或Fisher精确概率检验。P<0.05为差异有统计学意义。
表示,组间比较采用独立样本t检验;非正态分布的计量资料采用中位数及四分位数间距[P50(P25,P75)]表示,组间比较采用Mann-Whitne U检验;计数资料以例数和百分率(%)表示,组间比较采用卡方检验或Fisher精确概率检验。P<0.05为差异有统计学意义。
结果
1.晚期早产儿糖尿病母亲与非糖尿病母亲产前糖皮质激素应用情况:共有631例晚期早产儿纳入研究,其中糖尿病母亲183例(29.0%),非糖尿病母亲448例(71.0%)。糖尿病母亲的晚期早产儿产前激素使用率为37.2%(68/183),非糖尿病母亲的晚期早产儿产前糖皮质激素使用率27.0%(121/448),两者间差异有统计学意义。进一步按胎龄进行分层发现,胎龄34周和35周的糖尿病母亲产前使用糖皮质激素的使用率显著高于非糖尿病母亲,差异有统计学意义;而对于胎龄36周的糖尿病母亲与非糖尿病母亲产前糖皮质激素的使用率比较,差异无统计学意义。见表1。
表1 不同胎龄晚期早产儿产前糖皮质激素应用情况 [例(%)]
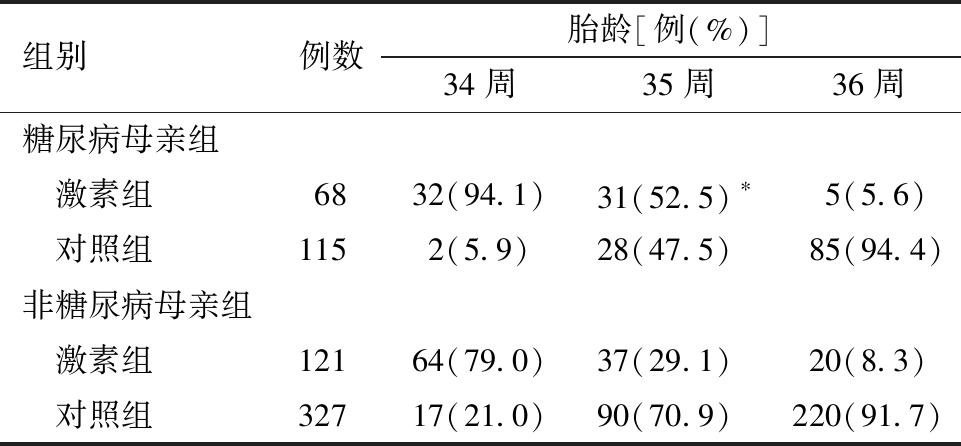
组别例数胎龄[例(%)]34周35周36周糖尿病母亲组 激素组6832(94.1)31(52.5) ∗5(5.6) 对照组1152(5.9)28(47.5)85(94.4)非糖尿病母亲组 激素组12164(79.0)37(29.1)20(8.3) 对照组32717(21.0)90(70.9)220(91.7)
与非糖尿病母亲组产前使用激素组对比,*P<0.05
2.糖尿病母亲的晚期早产儿激素组与对照组特征比较:不同胎龄激素组与对照组的母亲人口统计学特征,见表2。
表2 糖尿病母亲晚期早产儿激素组和对照组资料的比较
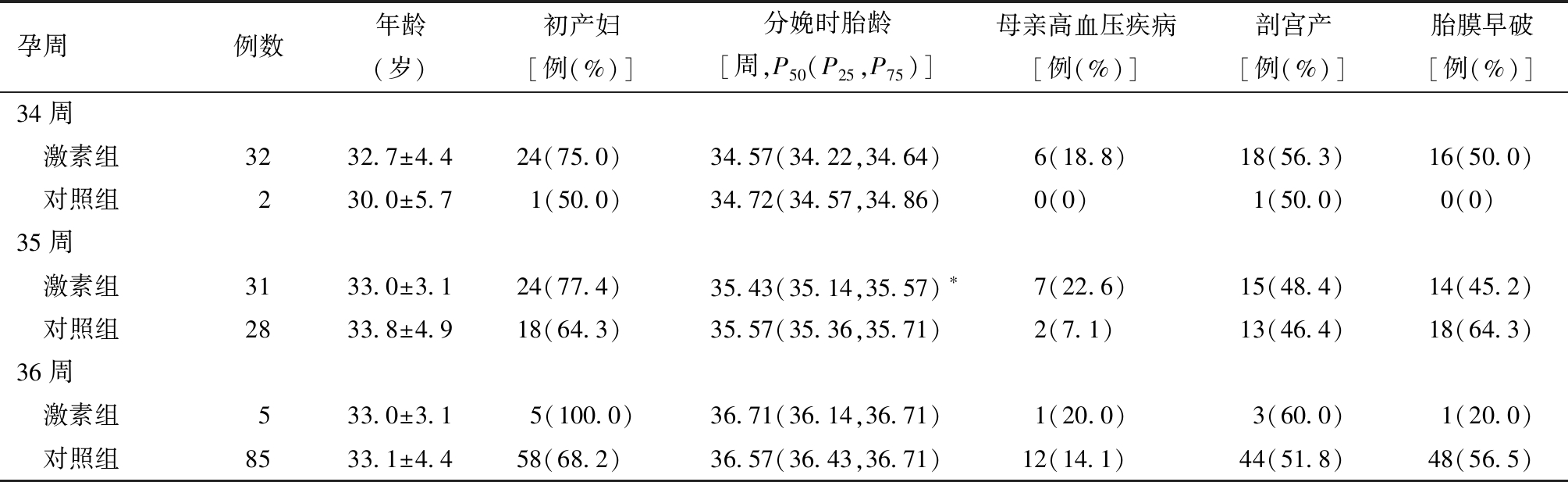
孕周例数年龄(岁)初产妇[例(%)]分娩时胎龄[周,P50(P25,P75)]母亲高血压疾病[例(%)]剖宫产[例(%)]胎膜早破[例(%)]34周 激素组3232.7±4.424(75.0)34.57(34.22,34.64)6(18.8)18(56.3)16(50.0) 对照组230.0±5.71(50.0)34.72(34.57,34.86)0(0)1(50.0)0(0) 35周 激素组3133.0±3.124(77.4)35.43(35.14,35.57)∗7(22.6)15(48.4)14(45.2) 对照组2833.8±4.918(64.3)35.57(35.36,35.71)2(7.1)13(46.4)18(64.3)36周 激素组533.0±3.15(100.0)36.71(36.14,36.71)1(20.0)3(60.0)1(20.0) 对照组8533.1±4.458(68.2)36.57(36.43,36.71)12(14.1)44(51.8)48(56.5)
与35周对照组比较,*P<0.05
对于糖尿病母亲的晚期早产儿,各胎龄激素组和对照组在母亲年龄、产次、是否合并高血压疾病、胎膜早破及剖宫产率差异均无统计学意义。在胎龄35周早产儿中,激素组早产儿胎龄低于对照组,差异有统计学意义;但在胎龄34周和36周早产儿中,两组间胎龄差异无统计学意义。
3.糖尿病母亲的晚期早产儿短期结局的比较:如表3所示,无论胎龄大小,激素组和对照组早产儿生后呼吸系统疾病发生率及呼吸支持使用率比较,差异均无统计学意义。与对照组相比,各胎龄激素组早产儿低血糖的发生率高于对照组,但组间差异无统计学意义。
表3 糖尿病母亲晚期早产儿激素组和对照组呼吸系统结局比较
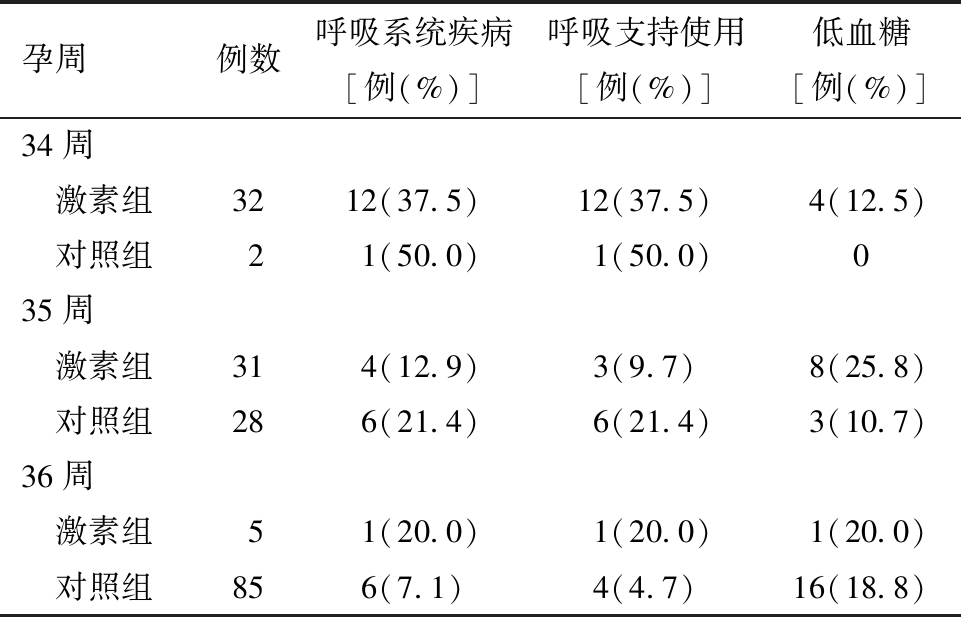
孕周例数呼吸系统疾病[例(%)]呼吸支持使用[例(%)]低血糖[例(%)]34周 激素组3212(37.5)12(37.5)4(12.5) 对照组21(50.0)1(50.0)035周 激素组314(12.9)3(9.7)8(25.8) 对照组286(21.4)6(21.4)3(10.7)36周 激素组51(20.0)1(20.0)1(20.0) 对照组856(7.1)4(4.7)16(18.8)
讨论
母亲患有糖尿病与胎儿肺成熟延迟有关,因此,糖尿病母亲的婴儿发生呼吸系统疾病的风险更高[9]。产前糖皮质激素可促进胎儿肺成熟,增加肺表面活性物质的合成,这是产前皮质类固醇用于早产儿的理论基础[1,10]。基于这一理论,糖尿病母亲的早产儿可能会因产前皮质类固醇暴露而获得更大的呼吸益处。但由于大多数关于应用产前糖皮质激素对新生儿结局影响的研究都排除了患有糖尿病的孕妇,或仅包含了极少数患者,导致相关研究不足以确定糖尿病母亲婴儿应用产前糖皮质激素的利弊[3-4]。Gyamfi-Bannerman等[3]在研究产前糖皮质激素对晚期早产儿结局的影响时,发现产前糖皮质激素的使用减少了晚期早产儿呼吸系统疾病的发生,但却增加了发生低血糖的风险。妊娠期糖尿病孕妇血糖水平升高,从而引起胎儿高胰岛素血症和低血糖,加之母亲应用糖皮质激素,可能使胎儿出生后低血糖发生风险进一步增加,这可能损害新生儿短期和长期的神经发育[11-12]。因此,迫切需要更多的研究评估糖尿病母亲的晚期早产儿使用产前糖皮质激素的安全性和有效性。
本研究中,妊娠前和妊娠期糖尿病的发病率高达29.0%,该人群晚期早产儿产前糖皮质激素的使用率为37.2%,显著高于非糖尿病母亲的晚期早产儿。原因可能与国内现行的早产儿产前激素使用指南推荐的人群有关,即对于妊娠期血糖控制未达到理想水平的糖尿病患者建议在产前给予1个疗程的糖皮质激素治疗。但在一项<34周的研究中,糖尿病母亲与非糖尿病母亲产前糖皮质激素的使用率并没有显著差异[13]。本研究对胎龄进行分层研究,发现在胎龄35周的糖尿病母亲,激素组早产儿胎龄小于对照组,这可能与产科医生在处理有早产风险的人群时,对胎龄较小的给予产前糖皮质激素更积极有关;对于胎龄34周糖尿病母亲的早产儿,无论母亲是否合并有糖尿病,国内指南[7]是推荐常规应用1个疗程的糖皮质激素,所以激素组与对照组胎龄无差异;而对于36周糖尿病母亲的早产儿,由于近足月、并发症少,因此该胎龄组产前糖皮质激素给药率低,且激素组与对照组胎龄无显著差异。
本研究中,产前糖皮质激素的使用并没有减少糖尿病母亲的晚期早产儿呼吸系统疾病发生率及呼吸支持的使用。Gyamfi-Bannerman等研究也发现,在晚期早产儿中,产前糖皮质激素的使用与呼吸预后之间没有关联[14]。然而,在同一随机对照研究中,对其他围产期因素进行调整后,显示了产前糖皮质激素与新生儿呼吸结局之间的有益关联[3]。研究表明,产前糖皮质激素给药距分娩的间隔影响产前糖皮质激素的疗效[15],但在本研究及上述两项研究中均未考虑该因素,可能导致结论不一致。最近,一项Meta分析纳入了7项随机对照试验,结果显示产前暴露于糖皮质激素减少了晚期早产儿对呼吸支持的需求,但增加了低血糖的风险[16]。低血糖是糖尿病患者所生新生儿的一个众所周知的并发症,晚期早产儿使用产前糖皮质激素可能会使低血糖症状加重。有研究发现产前糖皮质激素给药与使新生儿因低血糖转入NICU的风险增加3倍[17]。最近,也有质疑产前糖皮质激素是否能产生纯粹的好处,Räikkönen等[18]最近报道,与未接受产前糖皮质激素的兄弟姐妹相比,接受产前糖皮质激素(任何胎龄)的儿童患行为障碍的风险增加。当然,新生儿低血糖可引起短期和长期的神经系统并发症[19]。应该注意的是,在Gyamfi-Bannerman等[3]的试验中,即使在那些出现低血糖的新生儿中,低血糖也是短暂的(24 h内纠正),大多数不需要治疗。笔者先前的研究发现,产前糖皮质激素不是晚期早产儿发生低血糖的独立危险因素,而生后的新生儿照护及喂养措施更可能是低血糖的危险因素[20]。
本研究的局限性是整个队列中产前糖皮质激素的暴露率较低,因此,不可能进行妊娠前和妊娠期糖尿病的亚组分析。因此,很难描述产前早产糖皮质激素对新生儿的后果是否因母亲的糖尿病类型而异。其次,本研究没能得到孕妇分娩期间的血糖值,这与新生儿低血糖的风险有关。
综上所述,本研究显示,糖尿病母亲与非糖尿病母亲产前糖皮质激素给药模式是不同的。对于糖尿病母亲的晚期早产儿,产前糖皮质激素的使用并没有降低呼吸系统发病率及呼吸支持的使用,也未增加新生儿低血糖的发生。但仍需要在随机对照试验中进一步评估糖尿病母亲使用产前糖皮质激素的安全性和有效性。
1 Roberts D,Brown J,Medley N,et al.Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth.Cochrane Database Syst Rev,2017,3:CD004454.
2 Reddy UM,Deshmukh U,Dude A,et al.Society for Maternal-Fetal Medicine Consult Series #58:Use of antenatal corticosteroids for individuals at risk for late preterm delivery:Replaces SMFM Statement #4,Implementation of the use of antenatal corticosteroids in the late preterm birth period in women at risk for preterm delivery.Am J Obstet Gynecol,2021 225:B36-B42.
3 Gyamfi-Bannerman C,Thom EA,Blackwell SC,et al.Antenatal Betamethasone for Women at Risk for Late Preterm Delivery.N Engl J Med,2016,374:1311-1320.
4 Amiya RM,Mlunde LB,Ota E,et al.Antenatal Corticosteroids for Reducing Adverse Maternal and Child Outcomes in Special Populations of Women at Risk of Imminent Preterm Birth:A Systematic Review and Meta-Analysis.PLoS One,2016,11:e0147604.
5 Battarbee AN,Clapp MA,Boggess KA,et al.Practice Variation in Antenatal Steroid Administration for Anticipated Late Preterm Birth:A Physician Survey.Am J Perinatol,2019,36:200-204.
6 中国医师协会新生儿科医师分会,《中华围产医学杂志》编辑委员会.早产儿呼吸窘迫综合征早期防治专家共识.中华围产医学杂志,2017,20:557-559.
7 中华医学会妇产科学分会产科学组.早产临床诊断与治疗指南.中华妇产科杂志,2014,49:481-484.
8 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学.第5版.北京:人民卫生出版社,2018.
9 Fung GP,Chan LM,Ho YC,et al.Does gestational diabetes mellitus affect respiratory outcome in late-preterm infants.Early Hum Dev,2014,90:527-530.
10 Azad MB,Moyce BL,Guillemette L,et al.Diabetes in pregnancy and lung health in offspring:developmental origins of respiratory disease.Paediatr Respir Rev,2017,21:19-26.
11 Metzger BE,Persson B,Lowe LP,et al.Hyperglycemia and adverse pregnancy outcome study:neonatal glycemia.Pediatrics,2010,126:e1545-1552.
12 Dude AM,Yee LM,Henricks A,et al.Neonatal hypoglycemia after antenatal late preterm steroids in individuals with diabetes.J Perinatol,2021,41:2749-2753.
13 Battarbee AN,Sandoval G,Grobman WA,et al.Antenatal Corticosteroids and Preterm Neonatal Morbidity and Mortality among Women with and without Diabetes in Pregnancy.Am J Perinatol,2022,39:67-74.
14 Gyamfi-Bannerman C,Gilbert S,Landon MB,et al.Effect of antenatal corticosteroids on respiratory morbidity in singletons after late-preterm birth.Obstet Gynecol,2012,119:555-559.
15 Committee Opinion No.713:Antenatal Corticosteroid Therapy for Fetal Maturation.Obstet Gynecol,2017,130:e102-e109.
16 Deshmukh M,Patole S.Antenatal corticosteroids for impending late preterm (34-36+6 weeks) deliveries-A systematic review and meta-analysis of RCTs.PLoS One,2021,16:e0248774.
17 Ali H,Salama H,Robertson N,et al.Antenatal corticosteroids and short-term neonatal outcomes in term and near-term infants of diabetic mothers.Analysis of the Qatar PEARL-peristat registry.J Perinat Med,2021,49:377-382.
18 Räikkönen K,Gissler M,Kajantie E.Associations Between Maternal Antenatal Corticosteroid Treatment and Mental and Behavioral Disorders in Children.JAMA,2020,323:1924-1933.
19 Shah R,Harding J,Brown J,et al.Neonatal Glycaemia and Neurodevelopmental Outcomes:A Systematic Review and Meta-Analysis.Neonatology,2019,115:116-126.
20 王慧,付佳慧,曹丽芳,等.晚期早产儿低血糖与产前糖皮质激素的相关性研究.中国生育健康杂志,2022,33:166-168,171.