妊娠期高血压疾病(hypertensive disorders of pregnancy,HDP)是一类临床常见的妊娠并发症,以妇女怀孕20周后首次出现高血压、蛋白尿等症状为主要临床表现,包括妊娠期高血压、子痫前期、妊娠合并慢性高血压和慢性高血压并发子痫前期等4种临床表型[1],其中妊娠期高血压(gestational hypertension,GH)和子痫前期(preeclampsia,PE)是最常见的两类。全球HDP发病率约为10%[2],中国患病率约为7.6%[3]。研究发现,HDP是导致不良妊娠结局和母婴死亡的重要原因之一[4]。GH患者仅出现高血压症状,PE患者除高血压外,往往还伴发尿蛋白甚至全身多器官损伤[5]。孕妇进入怀孕阶段体内发生一系列生理变化,相对于一般女性人群更容易受体内异常环境影响,进而血压水平升高诱发HDP发生。
8-羟基脱氧鸟苷(8-hydroxy-2′-deoxyguanosine,8-OHdG)是氧自由基攻击人DNA中鸟嘌呤碱基第8位碳原子后,由DNA内切酶切除损伤的碱基后所产生。8-OHdG形成后在人体内不易被代谢,并能在血液和尿液中被检测到,是机体氧化应激及DNA损伤的重要标志物。目前8-OHdG在职业暴露、肿瘤、心血管疾病、神经退行性疾病中已被用于评估氧化应激状态和预后水平[6]。氧化应激是HDP典型的病理改变之一,且PE发生与胎盘氧化应激密切相关。Anto等[7]在非洲人群中利用前瞻性队列研究发现孕妇尿液中8-OHdG浓度升高显著增加HPD发生风险(RR=2.8,95% CI=1.10~7.10),Ferguson等[8]则在美国的队列研究中发现孕期8-OHdG和HPD发病率呈显著负相关(HR=0.47,95% CI =0.33~0.66),提示8-OHdG和HPD发病关系尚无定论。开展孕期孕妇体内8-OHdG暴露水平与HPD的荟萃分析可为二者关系提供较客观系统的认识,全面探索8-OHdG与HDP发病的关联还可为氧化应激在HDP发生发展中的作用提供较为直接的依据,有助于更深入地了解HDP的发病机制,为进一步预防和控制HDP发生提供理论依据。
一、文献纳入、排除标准及检索策略
1.纳入标准:研究需符合以下全部标准可被纳入。即(1)研究内容为孕期8-OHdG暴露与HDP相关性的观察性流行病学研究;(2)使用了合理的生物样本及检测方法测定孕妇8-OHdG暴露量;(3)对结局变量HDP有明确的定义和诊断方法。
2.排除标准:研究符合以下任意一项即排除,即(1)非原始研究,类型为综述、Meta分析、讲座等;(2)动物实验或体外模型研究;(3)未报告OR值(RR值)及95% CI等效应指标;(4)重复发表的文献;(5)非中英文文献。
3.文献检索策略:通过检索PubMed、Embase、Web of science、中国知网和万方数据库,系统性回顾截至2021年12月31日有关孕期8-OHdG暴露与HDP相关性的研究。中文检索词包括8-羟基脱氧鸟苷、8-羟基脱氧鸟苷酸、8-羟基-2′-脱氧鸟苷、8-OHdG、妊娠期高血压疾病、妊娠高血压、妊娠合并高血压、妊娠期高血压综合症、子痫、妊高症、妊娠期高血压、GH、HDP。以中国知网为例,采用专业检索,中英文扩展,检索式为TKA=′8-羟基脱氧鸟苷′+′ 8-羟基脱氧鸟苷酸′+′8-羟基-2′-脱氧鸟苷′+′8-OHdG′AND TKA=′妊娠期高血压′+′妊高症′+′子痫′+′妊娠期高血压疾病′+′妊娠高血压′+′妊娠合并高血压′+′妊娠期高血压综合症′+′GH′+′HDP′。英文检索词包括8-OHdG、8-hydroxy-2′-deoxyguanosine、8-hydroxydeoxyguanosine、8OHdG、8-hydroxy-2′-deoxy guanosine、8-oxoguanine、8-oxo-dG、8-oxo-G、8-oxo-2-deoxyguanosine、8-hydroxyguanine、8-oxo-7,8-dihydro-2-deoxyguanosine、hypertension during pregnancy、hypertensive disorders of pregnancy、pregnancy induced hypertension、gestational hypertension、gestational hypertensive disorders、preeclampsia。
二、文献筛选及质量评价
文献检索过程由两位研究人员独立完成后交叉核对,若产生分歧则通过讨论或咨询第三方研究员解决,直至各数据库检索结果均完全相同。排除各个数据库的重复文献后,根据纳入标准与排除标准对剩余文献进行筛选,筛选完成后对符合纳入和排除标准的文献进行全文审核,最终确认纳入Meta分析的文献。提取各项纳入研究文献的第一作者、发表年限、研究设计类型、研究人群特征、暴露指标、样本量、结局指标、调整的混杂因素、检测的生物样本及效应估计值(OR值、RR值或HR值及95% CI)等数据。两位研究员对纳入的研究文献独立进行质量评价,然后进行交叉核对。针对病例对照研究及队列研究,采用Newcastle-Ottawa Scale(NOS)质量评价标准进行质量评价[9]。每个NOS量表共9个得分点,4个得分点用于评价研究对象的选择,2个得分点用于评价组间可比性,3个得分点用于评价病例对照研究的暴露评估或队列研究的结局评估方法。总分7分及以上的研究定为高质量,4~6分定为中等质量,3分及以下定为低质量。
三、结果
1.文献筛选结果及纳入文献基本特征:本研究初检文献共183篇,其中PubMed、Embase、Web of science、中国知网、万方数据库分别36篇、40篇、57篇、15篇、35篇。去除重复记录后剩余98篇,根据纳入排除标准筛选并审核全文后共4篇英文文献纳入Meta分析,具体筛选流程见图1。纳入文献的发表年限为2014—2021年,国家和地区包括加纳[7](1/4)、美国[8](1/4)、意大利和德国[10](1/4)、印度[11](1/4)。其中2项为队列研究,2项为病例对照研究。样本量总计807例。
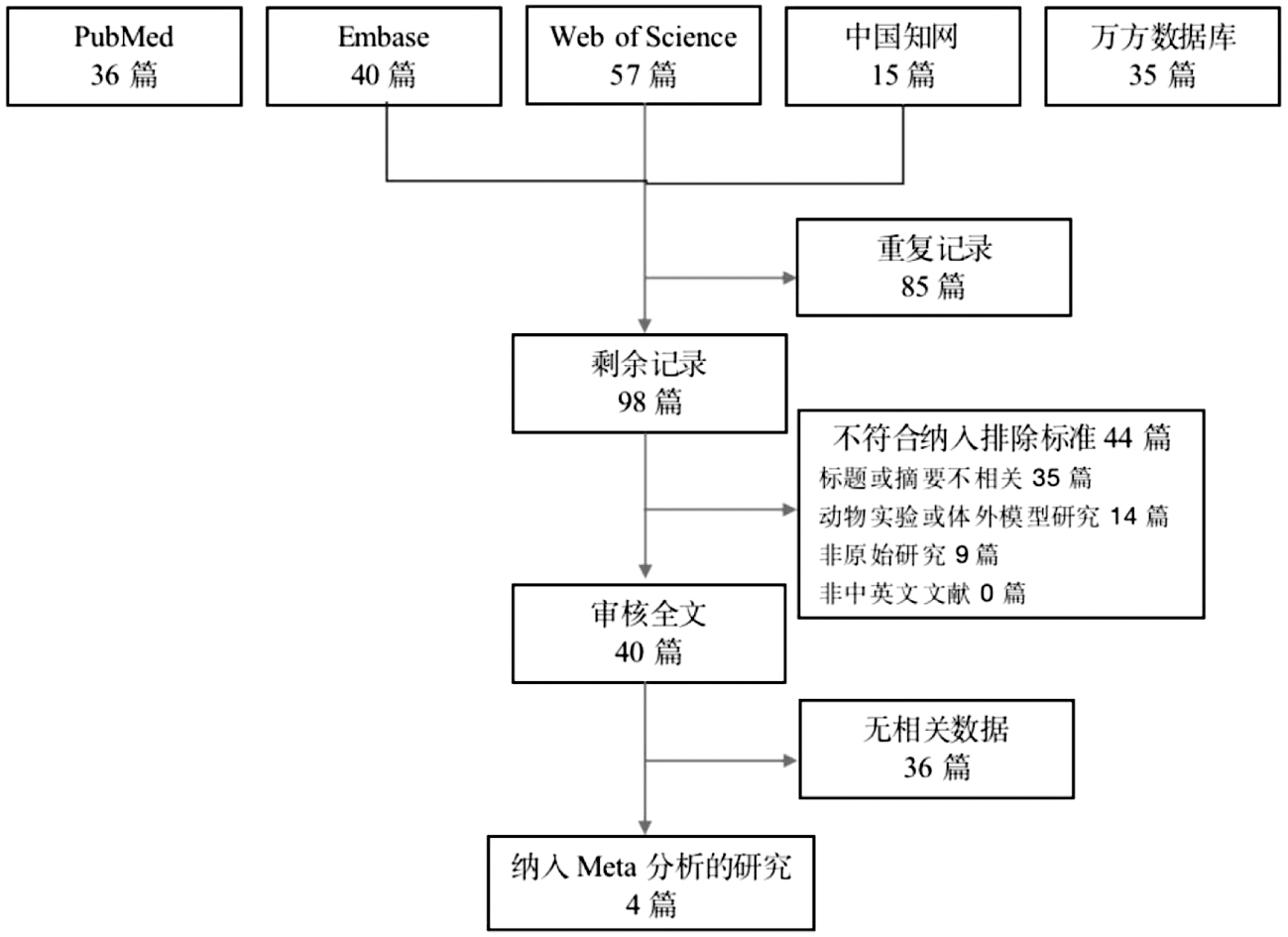
图1 筛选流程示意图
各研究的结局均为二分类变量,报告的效应指标为OR值、RR值和风险比(Hazard Ratio)。4项研究均以PE为病例组或观察结局。各研究检测的生物样本分别为母体尿液、胎盘和脐带血血清。各项研究的基本特征、质量评价结果及报告的效应指标见表1,偏倚风险评价结果见图2。
表1 纳入研究的基本特征和结果
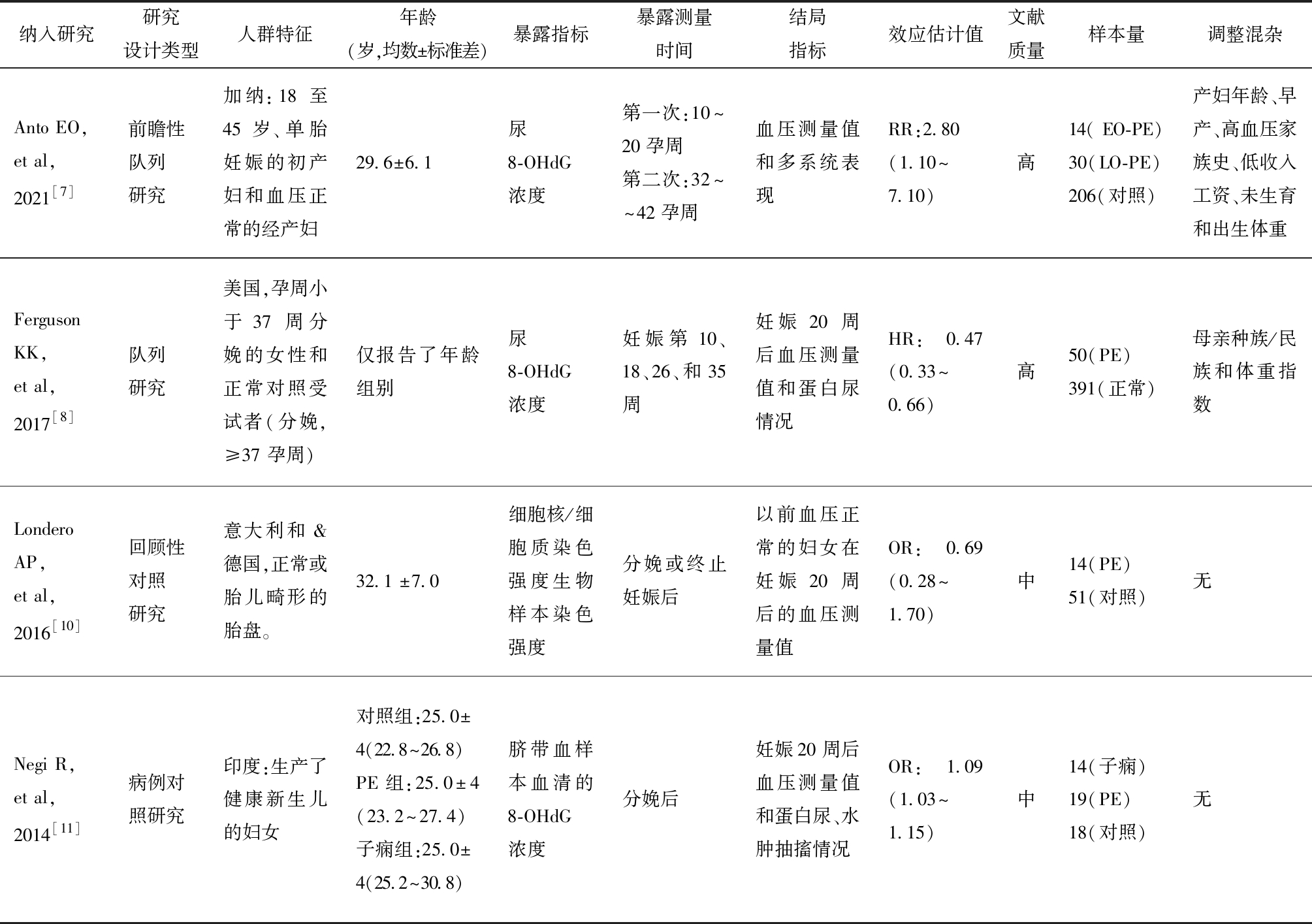
纳入研究研究设计类型人群特征年龄(岁,均数±标准差)暴露指标暴露测量时间结局指标效应估计值文献质量样本量调整混杂Anto EO,et al,2021[7]前瞻性队列研究加纳:18 至 45 岁、单胎妊娠的初产妇和血压正常的经产妇 29.6±6.1尿8-OHdG浓度 第一次:10~20孕周第二次:32~~42孕周血压测量值和多系统表现RR:2.80(1.10~7.10)高14( EO-PE)30(LO-PE)206(对照)产妇年龄、早产、高血压家族史、低收入工资、未生育和出生体重FergusonKK,et al,2017[8]队列研究美国,孕周小于 37 周分娩的女性和正常对照受试者(分娩,≥37 孕周)仅报告了年龄组别尿8-OHdG浓度妊娠第10、18、26、和35周妊娠 20 周后血压测量值和蛋白尿情况HR:0.47 (0.33~0.66)高50(PE)391(正常)母亲种族/民族和体重指数LonderoAP,et al,2016[10]回顾性对照研究意大利和&德国,正常或胎儿畸形的胎盘。32.1 ±7.0细胞核/细胞质染色强度生物样本染色强度分娩或终止妊娠后以前血压正常的妇女在妊娠 20 周后的血压测量值OR:0.69(0.28~1.70) 中14(PE)51(对照)无Negi R,et al,2014[11]病例对照研究印度:生产了健康新生儿的妇女 对照组:25.0±4(22.8~26.8)PE组:25.0±4(23.2~27.4)子痫组:25.0±4(25.2~30.8)脐带血样本血清的8-OHdG浓度分娩后妊娠20 周后血压测量值和蛋白尿、水肿抽搐情况OR:1.09(1.03~1.15)中14(子痫)19(PE)18(对照)无
效应估计值为:OR或RR或HR(95% CI) ;OR:odds ratio优势比;RR:risk ratio相对危险度;HR:hazard radio风险比;PE:preeclampsia子痫前期;EO-PE:早发性子痫前期;LO-PE:晚发性子痫前期
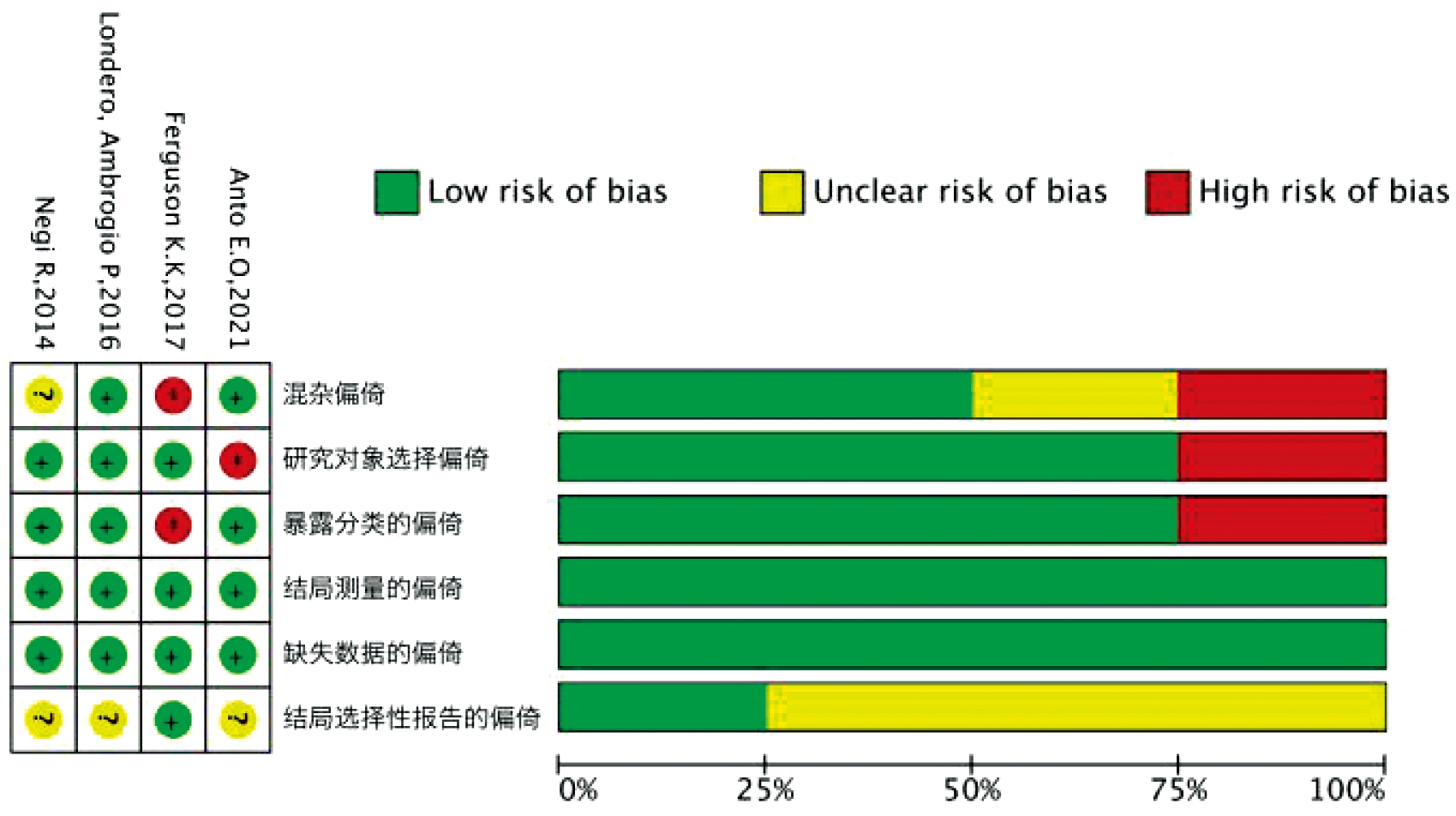
左:单个研究偏倚风险;右:总体偏倚风险
图2 纳入研究的偏倚风险评价结果
2.Meta分析结果:该研究通过RevMan软件进行Meta分析得出结果,并绘制偏倚风险图,采用Stata/SE 16.0软件绘制漏斗图。纳入的4项研究异质性较大(P<0.001,I2 = 89.0%),故采用随机效应模型进行Meta分析。结果显示,8-OHdG与HDP发病的关联无统计学意义(OR=0.93,95% CI =0.50~1.71)。Meta具体分析结果见图3。以加纳[7]和印度[11]人群为研究对象的文献间异质性较大(P<0.05,I2 = 75.0%),以美国[8],意大利和德国[10]人群为研究对象的文献间异质性较小(P=0.44,I2 = 0%),提示研究人群差异可能是本研究异质性的重要来源。4项研究分别检测尿液、胎盘和脐带血血清中的8-OHdG作为暴露指标,因此,检测的生物样本不同也可能导致文献间较大的异质性。

图3 8-OHdG与妊娠期高血压疾病的Meta分析结果
3.发表偏倚分析:本文仅纳入4项小样本研究,图4漏斗图展示了如上研究发表的偏倚情况。利用Egger线性回归法进一步判断发表偏倚,Egger检验P值及95% CI为(P=0.64,95% CI =-10.51~8.16),提示存在发表偏倚的可能性较低。
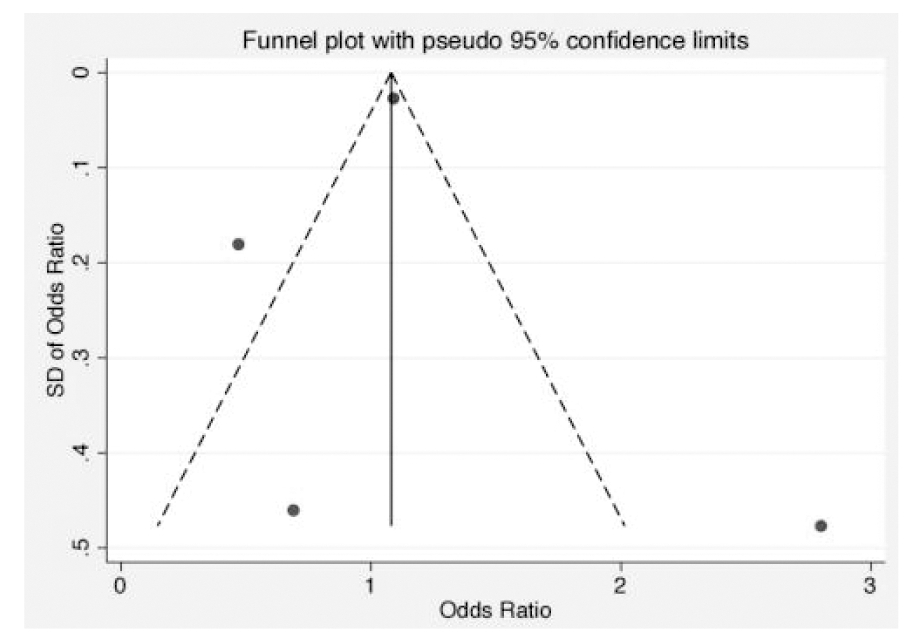
图4 漏斗图
四、讨论
1.HDP是指妇女怀孕20周后首次出现以血压异常增高、蛋白尿等为主要临床特征的一组疾病,可显著增加胎儿生长受限、胎盘早剥、弥漫性血管内凝血、脑水肿、急性心力衰竭,以及急性肾衰竭的风险,是孕产妇和胎儿死亡的重要原因[12]。8-OHdG是表征体内氧化应激和DNA 损伤的重要生物标志物。大量证据表明,尿8-OHdG可能是癌症、动脉粥样硬化和糖尿病等多种疾病的危险因素[13]。考虑到孕妇群体的特殊性,本文进行Meta分析探究孕期8-OHdG暴露与HDP是否相关,分析结果未显示出8-OHdG暴露与HDP发病风险的显著关联(OR=0.93,95% CI=0.50~1.71)。
2.HDP的病因和发病机制仍未能完全明确。目前的研究普遍认为,HDP发生可以分为胎盘形成不良和胎盘氧化应激两个阶段[14],胎盘滋养细胞对子宫内膜侵袭不足,螺旋动脉重塑缺陷,导致胎盘缺血和氧化应激水平升高,释放一系列促炎细胞因子进入母体循环,从而引发广泛的内皮功能障碍,并可能会在细胞水平对母体肾脏、肝脏和大脑造成损伤。GH则可能是孕妇先前存在亚临床的血管功能障碍,对妊娠期生理变化适应不良的结果[15]。8-OHdG是氧化应激反应的重要生物标志物之一,本文通过检索发现共有4项研究关注8-OHdG与HDP的发生关系,但这4项研究的结果差异较大。
3.本文纳入的4项研究同质性较差,其中来自加纳[7]和印度[11]的两项研究认为8-OHdG是子痫前期的危险因素。加纳[7]的研究采用前瞻性队列研究设计方案,先把纳入的孕妇根据尿液8-OHdG浓度分为EO-PE、LO-PE和对照组3个组,再观察随访获得结局。印度[11]的研究在病例对照设计中回溯病例组和未患病的对照组脐带血样本血清的8-OHdG浓度获得结果。然而意大利[10]的回顾性对照研究并未发现8-OHdG与子痫前期发病有显著关联。美国[8]一个队列研究发现尿液8-OHdG较高水平暴露甚至是子痫前期的保护因素。如上研究结果不尽一致的可能原因是纳入研究的人群特征和检测的生物样本不同。4项纳入分析的研究人群分别来自加纳[7]、美国[8]、印度[10]、意大利和德国[11],研究对象遗传背景的差异较大,并且纳入与排除的标准不一。4项研究检测的生物样本分别为尿液、母体血清、脐带血血清和胎盘,重要标志物在不同组织器官中的分布具有较大差异,部分样本来源不能反映机体真实的暴露情况,可能造成对真实效应的误判。另外,4项研究的采样时间差异较大,最早为妊娠第10周,最晚为分娩后,采样时间不同会影响体内8-OHdG的真实水平。
4.本研究对8-OHdG-HDP关系进行了系统全面的文献检索,使用严格的文献纳入排除标准,根据NOS量表对文献质量进行了客观评价,采用ROBIN-S工具进行了偏倚风险评价,最终筛选出4篇有参考价值的文献,质量均为中等及以上,汇总结果未观察到明显的发表偏倚。但由于本次研究样本量较小,Egger线性回归仅纳入4个数据点,结果波动较大,即使回归结果不显著,也不能完全排除发表偏倚的存在。4项研究均采用生物样本检测进行体内暴露测量,可以比较客观反映孕妇体内8-OHdG的实际水平,如上4项研究均由专业调查人员检测血压或通过医院诊断记录确定疾病结局,基本避免了回忆及报告偏倚。综上所述,本研究结果比较可信。
目前,关于此方面的研究数量较少,纳入分析的研究数量还不够多,无法进行亚组分析。将不同样本组织来源和8-OHdG不同灵敏度的文献进行合并分析,可能会导致对真实效应的误判。研究表明,尿液和血清标本的水平均可以代表孕妇的短期暴露情况,而尿液的8-OHdG是孕妇代谢后排泄出的状态[16]。本研究分别采用两种不同的8-OHdG短期暴露基质,两类结果揭示的机体内部反应机制略有差异,未来的研究需要结合其他不良环境暴露诱发HDP的发生机制进一步选取恰当的8-OHdG暴露基质来探索8-OHdG-HDP关联。HDP的各临床亚型发病过程不尽一致,本研究由于纳入的结果尚未对HDP亚型进一步区分,故该结论的前提假设是HDP的各种临床亚型的氧化应激发生过程相同,未来的8-OHdG-HDP相关研究需要对HDP的亚型进一步准确定义,有助于较全面地解释HDP的氧化应激反应过程。
五、结论
本文对4篇涉及孕期8-OHdG暴露与HDP发病风险的关联进行了Meta分析。荟萃的结果未显示8-OHdG与HDP发病的显著相关性,各项研究存在较大的异质性。目前相关研究数量较少,后续需要更多高质量大样本的研究,并结合精确的量化程度和统一的标本采样方法来深入明确二者关系。
1 金铭,刘晓静,张子怡,等.妊娠期高血压疾病的代谢组学研究进展.中国生育健康杂志,2022,33:62-67.
2 Sutton A,Harper LM,Tita A.Hypertensive Disorders in Pregnancy.Obstet Gynecol Clin North Am,2018,45:333-347.
3 李丽,付强强.中国妊娠期高血压疾病患病率的Meta分析.中国妇幼保健,2019,34:3378-3381.
4 宋美娟.妊娠期高血压动态心电图监测的运用研究.当代医学,2022,28:122-125.
5 杨锐,黄仁瑛,谌伦华.阿司匹林对子痫前期及早产影响的Meta分析.重庆医学,2022,51:479-484,490.
6 陈潇荣,蒋丹蔚,唐亚慧,等.血清8-羟基脱氧鸟苷对脓毒症患者病情进展及预后的预测价值.中华烧伤与创面修复杂志,2022,38:207-214.
7 Anto EO,Coall DA,Addai-Mensah O,et al.Early gestational profiling of oxidative stress and angiogenic growth mediators as predictive,preventive and personalised (3P) medical approach to identify suboptimal health pregnant mothers likely to develop preeclampsia.EPMA J,2021,12:517-534.
8 Ferguson KK,Meeker JD,McElrath TF,et al.Repeated measures of inflammation and oxidative stress biomarkers in preeclamptic and normotensive pregnancies.Am J Obstet Gynecol,2017,216:527.e1-527.e9.
9 Peterson J,Welch V,Losos M,et al.The Newcastle-Ottawa scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses.Ottawa:Ottawa Hospital Research Institute,2011,2:1-12.
10 Londero AP,Orsaria M,Marzinotto S,et al.Placental aging and oxidation damage in a tissue micro-array model:an immunohistochemistry study.Histochem Cell Biol,2016,146:191-204.
11 Negi R,Pande D,Karki K,et al.Association of oxidative DNA damage,protein oxidation and antioxidant function with oxidative stress induced cellular injury in pre-eclamptic/eclamptic mothers during fetal circulation.Chem Biol Interact,2014,208:77-83.
12 李玉明,杨宁.《妊娠期高血压疾病血压管理专家共识(2019)》解读.中华高血压杂志,2020,28:714-716.
13 Wu LL,Chiou CC,Chang PY,et al.Urinary 8-OHdG:a marker of oxidative stress to DNA and a risk factor for cancer,atherosclerosis and diabetics.Clin Chim Acta,2004,339:1-9.
14 殷为,钟梅.妊娠期高血压疾病的病因、预测及诊疗进展.实用医学杂志,2016,32:1887-1890.
15 Sircar M,Thadhani R,Karumanchi SA.Pathogenesis of preeclampsia.Curr Opin Nephrol Hypertens,2015,24:131-138.
16 Hu CW,Huang YJ,Li YJ,et al.Correlation between concentrations of 8-oxo-7,8-dihydro-2′-deoxyguanosine in urine,plasma and saliva measured by on-line solid-phase extraction LC-MS/MS.Clinica Chimica Acta,2010,411:1218-1222.