在辅助生育技术(assisted reproductive technology, ART)中,体外受精-胚胎移植(in vitro fertilization-embyro transfe,IVF-ET)是治疗不孕症患者的重要技术和手段。其中运用促性腺激素释放激素受体拮抗剂(gonadotropin releasing hormone antagonist, GnRH-ant)的方案(以下简称拮抗剂方案)是经典的传统方案。GnRH拮抗剂主要是在GnRH十肽的第6号和第8号氨基酸位点上进行了修改,与垂体的GnRH受体结合但不发挥生物学活性,完全阻断内源性GnRH的作用,使血清中的促卵泡激素(follicle stimulating hormone, FSH)、促黄体生成素(luteinizing hormone, LH)水平迅速下降,自发LH峰不能出现[1]。同时,拮抗剂方案中,GnRH激动剂(gonadotropin releasing hormone agonist, GnRH-a)可以替代人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)诱发排卵,可以减少卵巢过度刺激综合症(ovarian hyperstimulation syndrome, OHSS)的发生[2]。近年来,拮抗剂方案在辅助生育治疗的临床应用的需求逐渐增加,国际上对于拮抗剂方案的运用也已经成为主流,拮抗剂方案新鲜周期胚胎移植(鲜胚移植)妊娠率和活产率也不断提高。早有文献报道拮抗剂方案的鲜胚移植临床妊娠率和激动剂长方案没有显著性差异[3]。但是,拮抗剂方案在国内的运用还方兴未艾。对于辅助生育技术而言,临床上越来越多地关注其并发症、合并症的出现和风险,并且想办法防止其发生;常见的并发症除了OHSS以外,多胎妊娠的风险也是非常高,甚至被视为不孕症治疗方法中最重要的不良后果之一。与多胎妊娠相关的产科并发症,包括产前筛查问题和妊娠高血压综合征、产前出血、早产以及辅助分娩或手术分娩的风险显著增加。新生儿问题包括低出生体重和先天畸形患病率等也显著增加[4]。为了减少医源性多胎妊娠,降低围产期风险,体外受精后单胚胎移植被认为是避免多胎妊娠的有效手段[5]。很多不孕患者以及临床医生认为单胚胎移植会大大降低IVF的成功率,对单胚胎移植怀有质疑的态度。有研究显示在新鲜周期中单胚胎移植与双胚胎移植的临床妊娠率和活产率没有显著差异[6]。本研究回顾性分析了以拮抗剂方案鲜胚移植以单胚胎移植为主的IVF-ET治疗策略结局与应用的可行性。
对象与方法
一、研究对象
选取2015年10月至2020年12月于香港大学深圳医院生殖医学中心接受IVF/ICSI-ET(in vitro fertilization/intracytoplasmic sperm injection-embryo transfer,IVF/ICSI-ET)治疗并且行鲜胚移植的共1 096个拮抗剂方案(本院拮抗剂方案占比大于85%)的取卵周期进行回顾性分析,根据其移植胚胎数及第几天胚胎分为A、B、C三组,A组卵裂期第二天胚胎单胚胎移植(n=566),B组卵裂期第二天胚胎双胚胎移植(n=410),C组单囊胚移植(n=120)。入选标准:所有采用拮抗剂方案超促排卵的新鲜治疗周期;取卵后行常规IVF受精或者ICSI授精,取卵后第2天、第3天或第5天行新鲜胚胎移植,临床资料完整且随访信息完整。排除标准:冻胚移植;其他促排卵方案;输卵管积水未处理者;宫腔粘连或子宫畸形者 (纵隔子宫、单角子宫、双子宫、双角子宫)等。
二、方法
1.拮抗剂方案超促排卵方案:月经来的2~3 d检测血清FSH、LH、雌二醇(estradiol, E2)和孕酮(progesterone,P4)并行阴道B超计数窦卵泡数(antral follicle count, AFC)。AFC ≤ 6个,运用重组FSH(recombinant-follicle stimulating hormone, r-FSH)300 IU启动促排卵;6 2.黄体支持方案:黄体支持均从取卵后第二天开始。每天运用阴道黄体酮凝胶90 mg或口服地屈孕酮片进行黄体支持。 3.妊娠结局:卵裂期胚胎移植术后14 d,囊胚移植术后 12 d,β-hCG 阳性确定生化妊娠;在血hCG测定阳性后2周及4周后超声下见妊娠囊为临床妊娠。临床妊娠及活产为主要观察结果。 4.统计学处理:应用SPSS 27.0统计学软件, 计量资料组间比较采用单因素方差分析,以均数±标准差 A组与B组比较,女性年龄、体重指数、获卵总数、总窦卵泡数、睾酮(T)差异均有统计学意义,Gn总量、FSH、LH、泌乳素(prolactin,PRL)、E2、P4差异均无统计学意义。A组与B组的临床妊娠率(30.0%,33.1%)、OHSS率(0.8%,0.2%)、异位妊娠率(1.2%,0.7%)以及活产率(23.6%,23.6%)差异均无统计学意义。A组与B组的流产率(1.7%,5.6%)及多胎妊娠率(0%,5.6%)差异均有统计学意义差异,A组的早产率及多胎妊娠率显著低于B组,无三胎妊娠。见表1。 表1 A组与B组的基本情况和妊娠结局 GroupNAge(year)BMI(kg/m2)Eggs(n)AFC(n)FSH(U/L)LH(U/L)E2(pg/mL)P4(ng/mL)PRL(ng/mL)T(ng/mL)Total Gn(IU)A56632.6±4.0∗21.3±3.0∗7.5±4.39.5±5.4∗9.5±36.14.8±5.056.2±70.00.9±2.315.0±22.60.6±2.7∗2 602.9±960.3B41036.9±3.521.6±2.68.1±4.18.4±4.87.7±3.04.4±2.153.8±35.90.9±2.013.6±8.80.4±0.22 665.8±797.7GroupNOHSSNumber of OHSS casesn Rate(%)Ectopic pregnancyNumber ofectopic pregnancy casesnRate(%)Clinical pregnancyNumber ofclinical pregnancy casesnRate(%)AbortionNumber ofabortion casesnRate(%)DeliveryNumber ofdelivery casesnRate(%)Multiple pregnancyNumber of multiple pregnancy casesnRate(%)A56655660.875661.217056630.0105661.7∗13456623.605660∗B41014100.234100.713641033.1234105.69741023.6234105.6 Compared with group B, *P<0.05 C组与B组相比,女性年龄、体重指数、获卵总数、总窦卵泡数、FSH、LH及Gn总量差异有统计学意义,泌乳素(PRL)、E2、P4及T差异无统计学意义。C组与B组的临床妊娠率(40.0%,33.1%)、OHSS率(0.8%,0.2%)、异位妊娠率(0.8%,0.7%)以及早产率(3.3%,5.6%)差异无统计学意义。C组与B组的活产率(33.3%,23.6%)及多胎妊娠率(0.8%,5.6%)差异有统计学意义,C组的活产率及多胎妊娠率均显著高于B组,无三胎妊娠。见表2。 表2 C组与B组的基本情况和妊娠结局 Table 2 The basic characteristics and pregnancy outcomes of Groups C and B GroupNAge(year)BMI(kg/m2)Eggs(n)AFC(n)FSH(U/L)LH(U/L)E2(pg/mL)P4(ng/mL)PRL(ng/mL)T(ng/mL)Total Gn(IU)C12032.3±4.2∗21.0±2.3∗13.5±3.3∗13.8±6.0∗7.1±1.8∗5.1±4.0∗48.4±33.30.7±1.213.7±6.80.4±0.12 146.6±815.6∗B41036.9±3.521.6±2.68.1±4.18.4±4.87.7±3.04.4±2.153.8±35.90.9±2.013.6±8.80.4±0.22 665.8±797.7GroupNOHSSNumber of OHSS casesn RateEctopic pregnancyNumber ofectopic pregnancycasesnRateClinical pregnancyNumber ofclinicalpregnancycasesnRateAbortionNumber ofabortioncasesnRateDeliveryNumber ofdeliverycasesnRateMultiple pregnancyNumber ofmultiplepregnancycasesnRateC12011200.811200.841204041203.34012033.3∗11200.8∗B41014100.234100.713641033.1234105.69741023.6 234105.6 Compared with group B, *P<0.05 A组与C组相比,获卵总数、总窦卵泡数及Gn总量差异有统计学意义,女性年龄、体重指数、泌乳素(PRL)、FSH、LH,E2、P4及T差异无统计学意义。A组与C组的OHSS率(0.8%,0.8%)、异位妊娠率(1.2%,0.8%)以及早产率(1.7%,3.3%)差异无统计学意义。A组与C组的临床妊娠率(30.0%,40.0%)、活产率(23.6%,33.3%)及多胎妊娠率(0%,0.8%)差异有统计学意义,A组的临床妊娠率、活产率及多胎妊娠率均显著低于C组,无三胎妊娠。见表3。 表3 A组与C组的基本情况和妊娠结局 GroupNAge(year)BMI(kg/m2)Eggs(n)AFC(n)FSH(U/L)LH(U/L)E2(pg/mL)P4(ng/mL)PRL(ng/mL)T(ng/mL)Total Gn(IU)A56632.6±4.021.3±3.07.5±4.3∗9.5±5.4∗9.5±36.14.8±5.056.2±70.00.9±2.315.0±22.60.6±2.72 602.9±960.3∗C12032.3±4.221.0±2.313.5±3.313.8±6.07.1±1.85.1±4.048.4±33.30.7±1.213.7±6.80.4±0.12 146.6±815.6GroupNOHSSNumber of OHSS casesn Rate(%)Ectopic pregnancyNumber ofectopicpregnancycasesnRate(%)Clinical pregnancyNumber ofclinicalpregnancycasesnRate(%)AbortionNumber ofabortioncasesnRate(%)DeliveryNumber ofdeliverycasesnRate(%)Multiple pregnancyNumber ofmultiplepregnancycasesnRate(%)A56655660.875661.217056630.0∗105661.713456623.6∗05660∗C12011200.811200.841204041203.34012033.311200.8 Compared with group C, *P<0.05 超促排卵方案作为ART中的关键步骤,方案的选择是临床医生关注的焦点。拮抗剂方案因为其用药时间短,没有GnRH-a激动剂的“点火”效应,避免了卵巢囊肿的形成,并且能有效降低OHSS发生率,其发生率远远低于激动剂方案[7],而且拮抗剂方案使用时无需在早卵泡期进行垂体降调节,不影响垂体Gn的分泌,更接近正常状态下促使卵泡的发育,并且可减少Gn用量和缩短Gn用药时间,能迅速抑制早发LH峰,防止卵泡提早黄素化或排卵,可获得较多的高质量卵子[8],因为这些优点拮抗剂方案目前已逐渐成为国际上的主流超促排卵方案。 随着辅助生育技术的发展,每次移植胚胎的数量都在不断减少,然而许多生殖中心为了提高单次移植的临床妊娠率,移植选择双胚胎或者多胚胎,虽然多胚胎移植直接提高妊娠率,随之而来的多胎妊娠率却显著增加。多胎妊娠是多胚胎移植最常见的并发症,多胎妊娠的孕产妇与单胎的孕产妇相比,各种合并症及不良妊娠结局的发生率均上升,多胎妊娠母体全身各个系统的负担都加重[9],常常与妊娠期高血压疾病、子痫前期、前置胎盘、择期剖宫产、产后出血等产科并发症息息相关,孕期各种合并症较单胎母儿发生率早、发生率高、进展快、程度重等,多胎妊娠会使早产、极早产、低出生体重、脑瘫儿等发生率大大增加,给母婴、家庭、社会带来了巨大的负担和伤害[10]。一项大型多中心随机试验比较了选择性单胚胎移植与双胎移植两组患者的疗效,结果表明,两组的累积活产率无显著差异,并且单胎移植会显著降低多胎妊娠率[11]。移植第二天胚胎单胚胎移植的临床妊娠率和活产率与移植第二天双胚胎移植差异无统计学意义,移植两个第二天胚胎的多胎妊娠率显著高于移植一个第二天胚胎移植,但是移植两枚第二天胚胎的多胎妊娠率也仅为5.6%。单胚胎移植被认为是避免IVF周期中多胎妊娠的唯一有效方法[12],国际上越来越多的国家提倡单胚胎移植,本中心自运行以来,对于年龄小于35岁的患者的第一个移植周期均只移植一个第二天胚胎,年龄大于35岁、以及第一次移植失败的患者可以选择移植两个第二天胚胎,囊胚一律采取每个移植周期单个移植,这样的策略大大降低了多胎妊娠率。一项回顾性研究显示,在新鲜周期胚胎移植中,单囊胚移植有着与双卵裂期胚胎移植相当的妊娠率和活产率,并且有效地降低了多胎妊娠率、早产率、新生儿的不良结局率[13]。本次研究新鲜周期单囊胚移植临床妊娠率达到了40%,活产率达到了33.3%,多胎妊娠率显著低于双卵裂期的胚胎移植。ART治疗的目的是单胎、足月、健康的婴儿出生,选择性单胚胎移植是减少多胎妊娠最有效的方法。 本中心从2015年10月运行开始就以拮抗剂方案为主导方案进行超促排卵治疗,在本中心所有的取卵周期超促排卵方案中,拮抗剂方案占比大于85%,在卵裂期胚胎的选择上也是一律选择取卵后第二天的卵裂期胚胎进行移植,这与国内外大部分中心采取移植第三天胚胎有所不同。一项前瞻性、随机对照研究发现,在至少有七个正常受精胚胎的女性中,D2和D3胚胎移植的植入率和妊娠率相似,但是当胚胎保持培养至第3天时,总体胚胎质量评分降低[14]。根据Glujovsky等[15]对囊胚期与卵裂期胚胎移植比较的综述结果分析,其中有12个随机对照试验报告了活产率,表明在移植不同阶段的胚胎时,每对夫妇的活产率存在明显的差异;而在该研究23个随机对照试验中表明了早期卵裂期和囊胚期胚胎移植的临床妊娠率没有显著差异,流产率也没有显著差异,但是在其中4项随机对照试验报告了累积妊娠率,明确支持早期卵裂期胚胎移植。囊胚移植缺点包括培养条件要求高,每对夫妇可供冷冻的多余胚胎率较低,以及没有存活到移植阶段的胚胎较高,胚胎损失率高,单卵双胎率更高[16]。 总之,拮抗剂方案鲜胚移植结合选择性单胚胎移植可以有效降低OHSS发生率,并且降低了多胎妊娠率,明显减少了并发症的发生,获得了稳定的妊娠结局及新生儿结局。因此,拮抗剂方案新鲜周期鲜胚移植结合选择性单胚胎移植可以成为一种非常安全的治疗策略。 1 Al-Inany HG,Youssef MA,Ayeleke RO,et al.Gonadotrophin-releasing hormone antagonists for assisted reproductive technology.Cochrane Database Syst Rev,2016,4:CD001750. 2 Xu Y,Zhang YS,Zhu DY,et al.Influence of GnRH antagonist in reproductive women on in vitro fertilization and embryo transfer in fresh cycles.Biomed Rep,2019,10:113-118. 3 Jing M,Lin C,Zhu W,et al.Cost-effectiveness analysis of GnRH-agonist long-protocol and GnRH-antagonist protocol for in vitro fertilization.Sci Rep,2020,10:8732. 4 Jahan R,Jahan K,Afrose R,et al.Obstetric Outcome of Multiple Pregnancy in a Medical College Hospital.Mymensingh Med J,2021,30:633-637. 5 Cutting R.Single embryo transfer for all.Best Pract Res Clin Obstet Gynaecol,2018,53:30-37. 6 Huang X,Liu R,Shen W,et al.An elective single cleavage embryo transfer strategy to minimize twin live birth rate based on a prediction model from double cleavage embryos transfer patients.J Matern Fetal Neonatal Med,2022,35:1775-1782. 7 Xu Y,Zhang YS,Zhu DY,et al.Influence of GnRH antagonist in reproductive women on in vitro fertilization and embryo transfer in fresh cycles.Biomed Rep,2019,10:113-118. 8 Depalo R,Jayakrishan K,Garruti G,et al.GnRH agonist versus GnRH antagonist in in vitro fertilization and embryo transfer (IVF/ET).Reprod Biol Endocrinol,2012,10:26. 9 Multifetal Gestations:Twin,Triplet,and Higher-Order Multifetal Pregnancies:ACOG Practice Bulletin,Number 231.Obstet Gynecol,2021,137:e145-e162. 10 Narang K,Szymanski LM.Multiple Gestations and Hypertensive Disorders of Pregnancy:What Do We Know.Curr Hypertens Rep,2020,23:1. 11 Thurin A,Hausken J,Hillensjö T,et al.Elective single-embryo transfer versus double-embryo transfer in in vitro fertilization.N Engl J Med,2004,351:2392-2402. 12 Wei D,Liu JY,Sun Y,et al.Frozen versus fresh single blastocyst transfer in ovulatory women:a multicentre,randomised controlled trial.Lancet,2019,393:1310-1318. 13 Kwek LK,Saffari SE,Tan HH,et al.Comparison between Single and Double Cleavage-Stage Embryo Transfers,Single and Double Blastocyst Transfers in a South East Asian In Vitro Fertilisation Centre.Ann Acad Med Singap,2018,47:451-454. 14 Laverge H,De Sutter P,Van der Elst J,et al.A prospective,randomized study comparing day 2 and day 3 embryo transfer in human IVF.Hum Reprod,2001,16:476-480. 15 Glujovsky D,Blake D,Farquhar C,et al.Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology.Cochrane Database Syst Rev,2012,7:CD002118. 16 Glujovsky D,Farquhar C.Cleavage-stage or blastocyst transfer:what are the benefits and harms.Fertil Steril,2016,106:244-250.![]() 表示,采用t检验;计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
表示,采用t检验;计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。结 果
一、A组与B组的基本临床情况和临床结局及并发症
Table 1 The basic characteristics and pregnancy outcomes of Groups A and B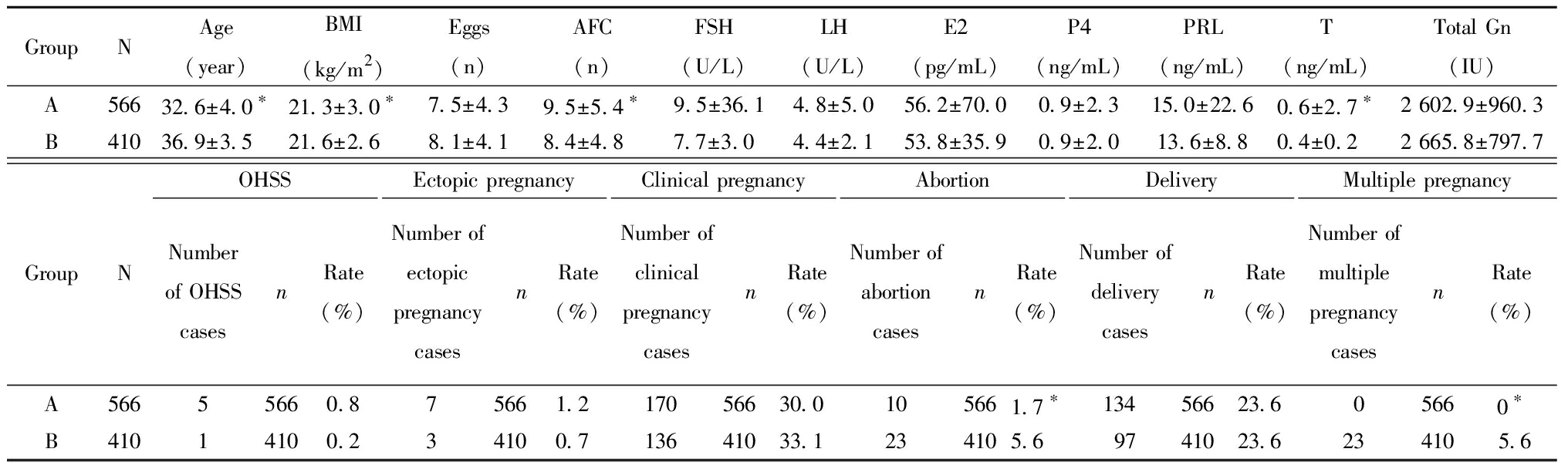
二、C 组与B组的基本临床情况和临床结局
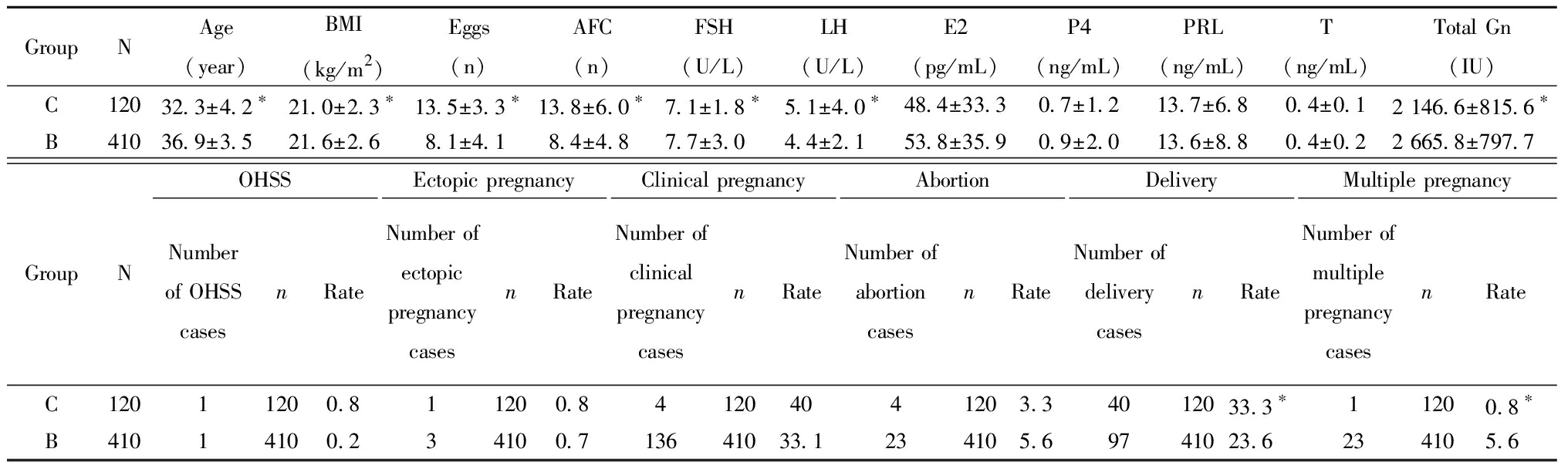
三、A组与C组的基本情况和妊娠结局
Table 3 The basic characteristics and pregnancy outcomes of Groups A and C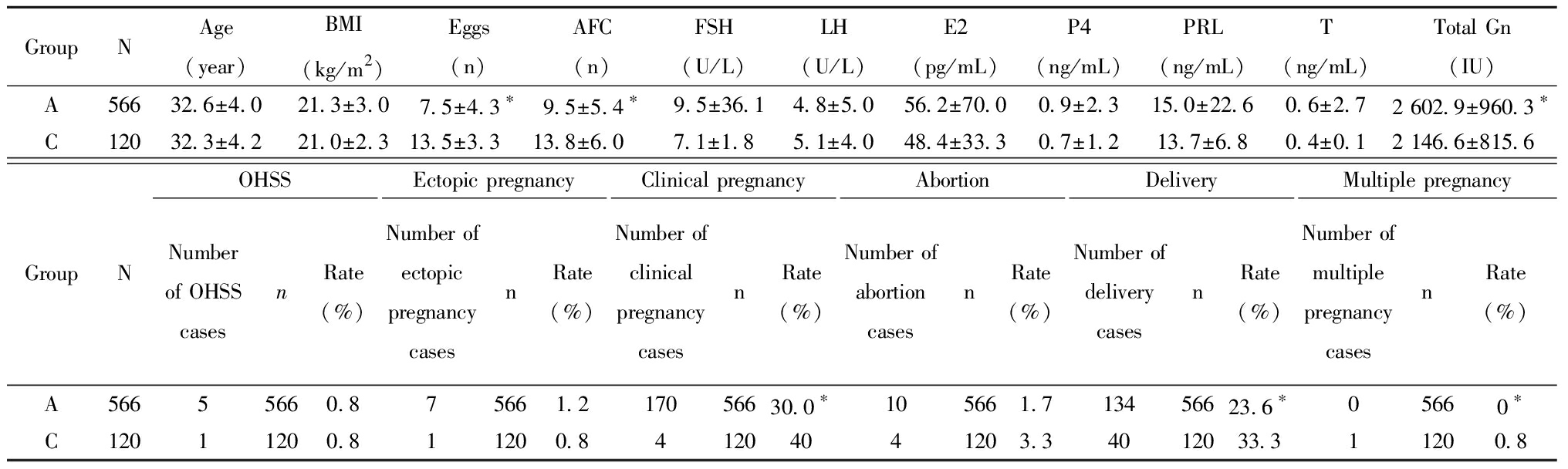
讨 论