男性生殖健康已成为全球性问题。世界卫生组织调查报告显示,全球约有10%~15%的不孕不育夫妇,其中男性因素占50%左右[1]。在过去的40年里,全球成年男性精子质量呈下降趋势,且这一趋势仍在继续[2]。
目前临床评估男性生殖能力的主要依据是精液常规参数,包括精液体积、精子浓度、数量、活力和形态等,但是精液常规参数检测结果很容易受各种因素如睡眠、喝酒、精神压力等的影响而波动[3],且实验室精液常规分析方法目前普遍存在的问题是缺乏良好的室内质量控制和室间质量评价,手工法精子形态检查受技师经验影响大,检查结果不稳定,变异系数大。有研究显示,精液常规检验结果正常的男性中仍有15%不育[4],因此精液常规检查已不能完全满足临床诊断的需求,急需寻找新的检测指标,对男性生育力进行更全面、准确的评估。
精子DNA碎片指数(DNA fragmentation index,DFI)是指发生DNA链断裂的精子数占总精子数的百分比,可从分子水平评估精子细胞内DNA结构完整性。精子DNA是父方遗传信息的重要载体,精子DFI过高可影响胚胎质量和妊娠结局,还可能导致先天畸形和某些儿童疾病[5]。近几年精子DFI的检测方法逐渐成熟,主要有精子染色质结构分析(sperm chromatin structure assay,SCSA)、精子染色质扩散实验、单细胞凝胶电泳或彗星测定、吖啶橙染色法等[6-7]。与精液常规参数检测相比,精子DFI检测结果稳定、变异系数小、检查方法快,可为临床提供更全面客观的诊断评估依据。
维生素D(vitamin D,VD)是人体必需的营养素,其生理功能主要是调节机体钙、磷代谢和促进骨骼生长,对细胞生长分化及免疫功能也有一定调节作用。VD缺乏在全球范围内普遍存在[8]。近年来有研究表明VD缺乏可以影响精子质量,从而导致男性不育[9]。维生素D在血清中主要以25-羟基维生素D[25-hydroxy-vitamin D,25(OH)VD]形式存在,占其总量的95%以上,因此25(OH)VD是公认的衡量维生素D营养状态的最佳指标[8]。
本研究旨在衡量精子DFI与传统的精液常规参数结果的一致性和相关性,并进一步研究血清中25(OH)VD水平对精子常规参数和精子DFI的影响,为男性生育能力的评估提供临床参考。
对象与方法
一、研究对象
选取2021年11月至2022年7月在空军军医大学第一附属医院生殖医学中心就诊的627例男性不育患者,平均年龄(32.3±4.8)岁。研究对象纳入标准:(1)婚后同居≥1年,有规律性生活,未采取任何避孕措施且已排除女方因素的男性患者;(2)患者身体状况良好,体格检查有男性性征,生殖器、睾丸、附睾及附属性腺未见明显异常,无睾丸外伤、家族遗传性疾病史和性功能障碍病史;(3)近1年内无不良生活嗜好(吸烟、酗酒、吸毒等)。排除标准:(1)近期有泌尿生殖系统疾病或其他严重急慢性疾病,有生殖毒性物质、放化疗药物接触史的患者;(2)无精子症或重度少精子症患者;(3)患有或服用影响血清维生素D水平的疾病或药物者。本研究严格遵守涉及人体受试者的《赫尔辛基医学研究宣言》,并在研究前获得了每个研究对象的知情同意。
二、研究方法
1.精液样本采集:患者禁欲3~7 d,采用手淫法将全部精液留取在无菌、干燥的一次性塑料标本杯中,置于37 ℃恒温箱,待标本完全液化后,在1 h内完成精液质量分析。另外将精液样本分装到EP管中置于-20 ℃冰箱冷冻保存,在一周内完成精子DFI测定。
2.精液质量分析:按照《世界卫生组织人类精液检验与处理实验室手册》第5版[10]的操作要求,精液完全液化后,由实验室技术人员检测精液外观、体积、粘稠度、液化时间和pH值,取3 μL混匀的精液样本滴于一次性精子计数板(赛斯医疗,SAS)上,用计算机辅助精子分析系统(SAS)和SASII®2.3版本软件分析精子总数、浓度、总活动率[包括前向运动率(progressive motility,PR)和非前向运动率(non-progressive motility,NP)]。精子形态学分析采用手工法,吸取完全液化后的精液标本5 μL滴于载玻片上,用拉薄技术制作精液涂片,待其风干固定后,用Diff-Quick染色试剂(珠海贝索公司)对精子染色,于光学显微镜下分析精子形态,每份精液标本计数分析200个以上精子,计算正常形态精子百分率。对于精子浓度过高的标本应稀释、离心后再进行分析,以防止精子因高频碰撞而产生检测误差。
3.精子DFI检测:采用吖啶橙染色法配合流式细胞术检测精子DNA完整性,并计算精子DFI。将冷冻的精液样本于37 ℃水浴解冻,然后将其稀释或浓缩至精子浓度为1~2×106个/mL,用吖啶橙染色试剂(国为生物科技有限公司)进行精子染色。染好色的精液用流式细胞分析仪(美国BD,FACSCantoⅡ)检测精子DNA完整性,分析5 000条以上的精子细胞,每个样本至少连续测定两次。由于吖啶橙染料的异染性质,异常精子核染色质成单链与染料吖啶橙结合发橙黄色或红色荧光;正常精子核染色质为双链与吖啶橙结合发绿色荧光,若红光(值)比例增高,说明精子核完整性程度降低。
4.血清25(OH)VD总量测定:患者空腹状态下抽取静脉血,用样本萃取液(浙江迪赛思诊断技术有限公司)提取血清样本中的25(OH)VD,采用液相色谱-串联质谱检测系统(AB SCIEX Triple QuadTM 4500MD,浙江迪赛思诊断技术有限公司)对经有机试剂提取后的样本中25(OH)VD2和25(OH)VD3进行检测,并通过液相保留时间和质谱离子对的不同实现其与干扰物的分离。利用校准品25(OH)VD2、25(OH)VD3标示浓度和测得的峰面积比值拟合标准曲线方程,再将样本25(OH)VD2、25(OH)VD3测定的峰面积与对应内标峰面积的比值代入标准曲线方程,即可计算出样本中25(OH)VD2和 25(OH)VD3的浓度,25(OH)VD的浓度即25(OH)VD2和25(OH)VD3的浓度之和。
5.统计学方法:采用SPSS 25.0软件进行统计学分析。计量资料以均数±标准差![]() 表示,两组计量资料的相关性采用Pearson相关分析,P<0.05为差异有统计学意义。
表示,两组计量资料的相关性采用Pearson相关分析,P<0.05为差异有统计学意义。
结 果
一、精子DFI和精液质量参数的相关性结果
627例不育男性患者精子DFI和精液质量参数检测结果见表1,精子DFI和精液质量参数的相关性见表2。627例不育症患者精子DFI与精子总数、精子浓度呈负相关,但其相关系数绝对值均<0.1,临床价值较小,与PR、精子总活动率、正常形态精子百分率呈负相关(P<0.001)。见表2。
表1 精子DFI和精液质量参数测定结果(n=627)
Table 1 Determination results of sperm DFI and sperm quality parameters

ParameterDetection value( x±s)Sperm DFI(%)22.7±13.4Total sperm count(million)520.6±337.9Sperm concentration(million/mL)63.4±59.0Sperm PR(%)41.6±20.2Total sperm motility(%)52.2±23.6Percentage of normal sperm(%)3.8±1.3
表2 精子DFI和精液质量参数相关性分析(n=627)
Table 2 Correlation analysis of sperm DFI and sperm quality parameters
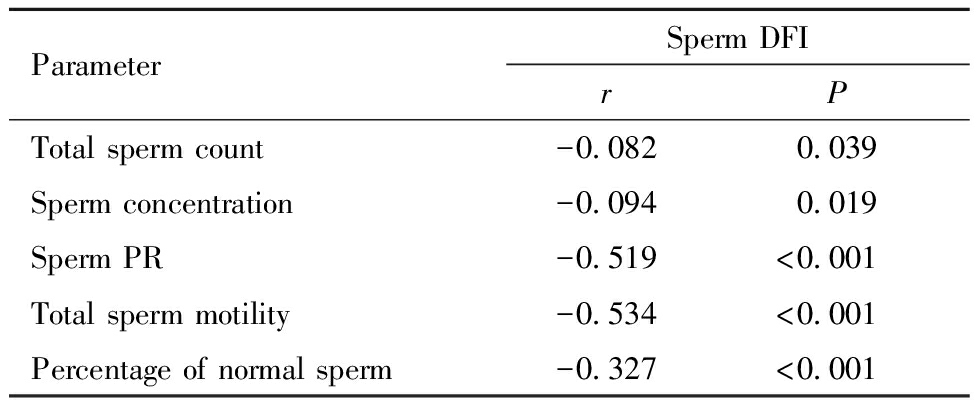
ParameterSperm DFIrPTotal sperm count-0.0820.039Sperm concentration-0.0940.019Sperm PR-0.519<0.001Total sperm motility-0.534<0.001Percentage of normal sperm-0.327<0.001
二、血清25(OH)VD总量和精液质量参数的相关性结果
627例不育男性患者血清25(OH)VD总量和精液质量参数的相关性见表3。627例不育症患者血清25(OH)VD总量(20.0±9.3)μg/L与精子总数、浓度、PR、总活动率无相关性(P>0.05),与正常形态精子百分率呈正相关(P<0.001),与精子DFI呈负相关(P<0.001)。
表3 血清25(OH)VD总量和精液质量参数相关性分析(n=627)
Table 3 Correlation analysis of serum 25(OH)VD content and sperm quality parameters
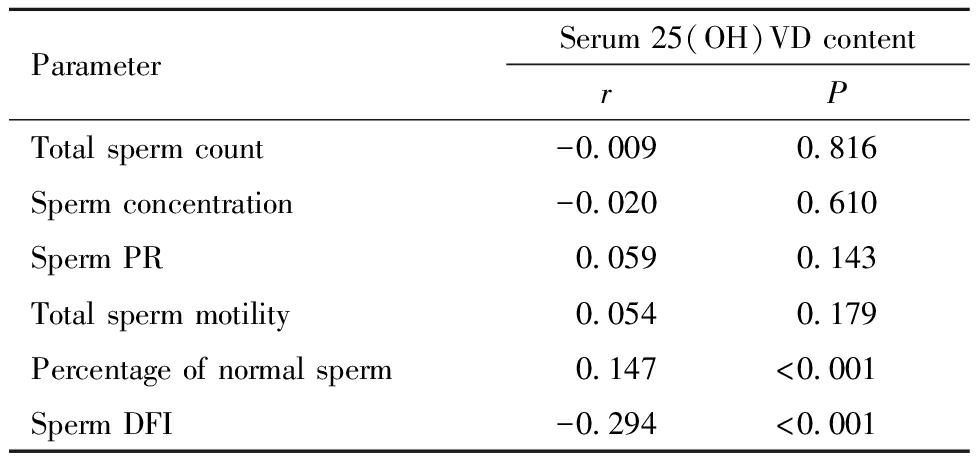
ParameterSerum 25(OH)VD contentrPTotal sperm count-0.0090.816Sperm concentration-0.0200.610Sperm PR0.0590.143Total sperm motility0.0540.179Percentage of normal sperm0.147<0.001Sperm DFI-0.294<0.001
讨 论
精子DFI是反映精子染色质结构完整性的指标,精子DNA结构的完整性是卵子受精和胚胎发育正常的前提。有研究表明,当精子DFI测定值大于30%,精液质量、胚胎质量、自然受孕率和辅助生殖成功率都明显降低,而不明原因流产率相对增高[11]。精子DFI从分子学角度评估男性的生育力,弥补了传统精液常规检查(包括精子数量、活力和形态)的不足。目前认为,精子DNA损伤的机制有三种:(1)精子发育过程中染色质组装期间DNA链断裂;(2)精子的正常凋亡程序受到异常激活或抑制(如放化疗、空气污染、吸烟、环境毒物等),停止凋亡的精子又分化为成熟精子;(3)机体过剩的生物活性氧类物质会导致精子DNA质膜完整性损伤以及DNA链的断裂[12]。
本文用SCSA法检测精子DFI,将吖啶橙染色法和流式细胞术结合对精子DNA完整性进行评估。该方法准确度和精确度高、重复性好、变异系数低,且操作方便,适合大量精子(>5 000)快速评估,可对冷冻标本批量检测[6]。本研究显示,精子DFI与PR、精子总活动率、正常形态精子百分率呈显著负相关,这在一定程度上说明精子活力和形态与精子DNA结构完整性有一定关系,精子DFI越高,精子DNA结构完整性越差,精子活力减弱,畸形率增加。精子活力受多种因素影响,线粒体是精子运动的主要功能装置,其功能缺陷将导致精子运动力降低,若精子DNA完整性受损,可导致精子运动装置异常,线粒体异常率显著增高,精子活力减弱[13]。精子发生和成熟的过程中,生精细胞核内染色体通过减数分裂发生了局部重排,与精子核DNA结合的核蛋白也发生了从组蛋白到鱼精蛋白的转化过程,这一过程中伴随着精子形态学变化。各种原因导致的精子鱼精蛋白含量减低,二硫键形成障碍,均可导致染色质缩合异常,进而引发的核内空泡、顶体异常等精子头部形态异常[14]。畸形精子由于细胞核内鱼精蛋白-DNA复合体减少,不能压缩精子核,导致精子核内存在大量体积较大的组蛋白,精子染色质结构疏松,精子DNA易发生损伤,且畸形精子产生的氧自由基(ROS)也可导致精子DNA损伤,最终使精子DNA碎片增多,精子DFI升高[15]。
本文研究还显示血清25(OH)D水平与PR、精子总活动率、精子浓度和数量无相关性,而与正常形态精子百分率呈正相关,与精子DFI呈负相关。目前维生素D与精液质量参数间的关系以及作用机制尚无定论,有研究者提出VD通过与VD受体结合启动基因组途径,诱导细胞周期停滞、增强阻滞、刺激分化、提高细胞凋亡率,从而保护细胞免受 DNA 损伤[16]。VD受体及代谢酶在男性前列腺、睾丸、精子和支持细胞中均有表达,动物实验证实VD在减少ROS和避免DNA损伤方面有一定作用[17]。此外还有研究发现,血清VD缺乏会损害小鼠睾丸发育和精子发生[18]。多项研究也表明,VD在多个水平参与了男性生殖功能,包括基因、精子代谢和功能、睾丸组织形态学等[19]。但也有研究认为正常人体中血清25(OH)D水平与精子总数、精子浓度无相关性[20]。
本研究作为一个初步的相关性分析,研究因素与结论的关系是探索性的,其因果关系需要通过进一步的前瞻性研究予以确认。研究还存在一定不足,如未对不同程度精子DNA损伤和不同程度维生素D缺乏的患者分等级进行比较。深层次的发生机制和联系,还有待进一步深入研究和探索。
综上所述,精子DFI不仅可以反映精子细胞核 DNA受损情况,它还与精子活力、形态相关,可以作为一项重要的精子质量评估指标,为全面、客观评估男性生育力提供有效信息,并指导治疗。男性不育患者血清25(OH)VD水平一定程度上可能影响精子质量,可为临床医生评估男性生育力和治疗提供参考。
1 陈涓涓,雷婷,李欣,等.4479例不孕夫妻男性患者精液检测结果分析.标记免疫分析与临床,2019,26:737-740,780.
2 Cho CL,Agarwal A.Role of sperm DNA fragmentation in male factor infertility:A systematic review.Arab J Urol,2018,16:21-34.
3 Zhang J,Cai Z,Ma C,et al.Impacts of outdoor air pollution on human semen quality:a meta-analysis and systematic review.Biomed Res Int,2020,2020:1-9.
4 Yang H,Li G,Jin H,et al.The effect of sperm DNA fragmentation index on assisted reproductive technology outcomes and its relationship with semen parameters and lifestyle.Transl Androl Urol,2019,8:356-365.
5 Tang L,Rao M,Yang W,et al.Predictive value of the sperm DNA fragmentation index for low or failed IVF fertilization in men with mild-to-moderate asthenozoospermia.J Gynecol Obstet Hum Reprod,2021,50:101868.
6 徐奎,王灵敏,杨昊,等.SCSA与SCD检测精子DNA碎片指数的比较分析.中国男科学杂志,2018,32:14-18.
7 杨宜英,曾泓杰,王征.吖啶橙染色结合流式细胞仪的方法检测精子DNA碎片率及与临床特征参数的相关性分析.广州医科大学学报,2021,49:37-41.
8 Anandabaskar N,Selvarajan S,Kamalanathan S.Vitamin D in health and disease-an update.J Young Pharm,2018,10:381-387.
9 Hussein TM,Eldabah N,Zayed HA,et al.Assessment of serum vitamin D level and seminal vitamin D receptor gene methylation in a sample of Egyptian men with idiopathic infertility.Andrologia,2021,53:e14172.
10 WHO.WHO laboratory manual for the examination and processing of human semen.5th ed.Geneva:WHO Press,2010.
11 Rex AS,Wu C,Aagaard J,et al.DNA fragmentation in human spermatozoa and pregnancy rates after intrauterine insemination.Should the DFI threshold be lowered.J Clin Med,2021,10.
12 刘焙,耿天.多溴联苯醚男性生殖毒性研究进展.中华男科学杂志,2019,25:1131-1134.
13 Shamsi MB,Kumar R,Bhatt A,et al.Mitochondrial DNA mutations in etiopathogenesis of male infertility.Indian J Urol,2008,24:150-154.
14 查晓敏,朱复希,张静静,等.精子DFI与精液常规、精子形态学的相关性及其对IVF-ET/ICSI结局的影响.天津医药,2021,49:45-49.
15 徐立奇,任胜强,梁宇,等.部分型圆头精子症患者精子形态、DNA碎片指数和精液常规参数分析.中国性科学,2018,27:26-29.
16 Haussler MR,Jurutka PW,Mizwicki M,et al.Vitamin D receptor (VDR)-mediated actions of 1α,25(OH)2 vitamin D3:genomic and non-genomic mechanisms.Best Pract Res Clin Endocrinol Metab,2011,25:543-559.
17 Nair-Shalliker V,Armstrong BK,Fenech M.Does vitamin D protect against DNA damage.Mutat Res,2012,733:50-57.
18 Fu L,Chen YH,Xu S,et al.Vitamin D deficiency impairs testicular development and spermatogenesis in mice.Reprod Toxicol,2017,73:241-249.
19 于霞,董来慧,赵君利.维生素D干预对不育男性精液质量的影响.宁夏医科大学学报,2020,42:782-786.
20 黎靖宇,黄品秀,谢伟,等.血清25-羟维生素D与精液质量相关性研究.现代中西医结合杂志,2019,28:579-581,605.